Qué es la osmosis inversa
La característica principal de la tecnología de desalinización por membranas es que no funciona bajo los mismos principios que la tecnología térmica. En vez de evaporar, la desalinización por membranas separa, y para ello utiliza a su favor un fenómeno fisicoquímico llamado osmosis inversa, pero ¿qué es?
Para entender qué es la osmosis inversa, primero se debe entender lo que es el fenómeno de osmosis (a veces llamada osmosis directa). Este fenómeno es un mecanismo de transferencia de materia que permite que soluciones (mezclas) se muevan desde lugares de alta concentración hacia lugares de baja concentración sin la aplicación de energía externa y a través de elementos de separación físicos que impiden que otras sustancias se desplacen al mismo tiempo. Es así, por ejemplo, como logramos los seres vivos captar nutrientes en nuestros procesos celulares y, al mismo tiempo, evitar que las células pierdan los componentes que tienen en su interior. Para que este transporte ocurra se necesita de una estructura que selectivamente permita el libre tránsito de algunos elementos e impida el movimiento de otros. Esta estructura es llamada membrana.
La Ilustración 1y la Ilustración 3 muestran el esquema típico para mostrar el comportamiento de un sistema durante el proceso de osmosis inversa. Este clásico ejemplo requiere de un recipiente, una solución de un alto contenido de sales (agua salada, lado salado), una solución de bajo contenido de sales (agua dulce, lado dulce), y de una membrana selectiva que solo permite el tránsito de agua, no de sales.
| En una situación sin membrana (Ilustración 1), lo que ocurría con el escenario descrito previamente es que el agua de la solución con bajo contenido de sales intentaría diluir a la solución con alto contenido de sales, generando un tránsito de agua hacia la izquierda (A). A su vez, la sal del lado salado intentaría “salar” la solución menos concentrada, generando un flujo de sal hacia la derecha (B).
|
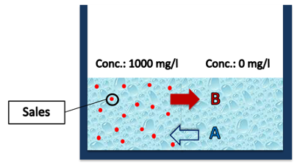
Ilustración 1: Esquema libre, sin membrana. |
| De esta forma, lo que obtendríamos sería una mezcla de agua con una concentración de sales promedio (Ilustración 2) | 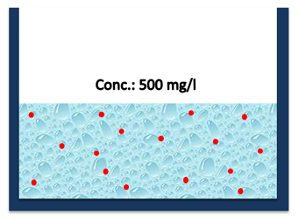
Ilustración 2: Esquema libre, mezcla. |
| Sin embargo, al contar con una membrana selectiva que solo permite el tránsito de agua, el flujo A sigue existiendo, pero no así el flujo B (Ilustración 3). De esta manera, se consigue una situación un tanto particular, donde el agua dulce intenta diluir al agua salada generando una diferencia de alturas entre ambos recipientes (Ilustración 4). | 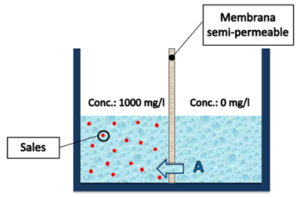
Ilustración 3: Esquema semi-libre, con membrana. |
| La altura de esta columna de agua es proporcional a la cantidad de sal que tiene la solución de alto contenido de sales y su condición estática, es decir, en equilibrio, corresponde a un valor característico denominado presión osmótica. | 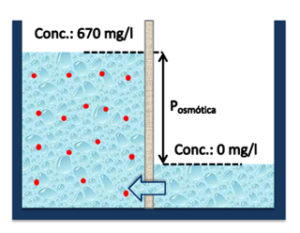
Ilustración 4: Dilución de el lado salado. Presión osmótica. |
| Desde el punto de vista de la obtención de agua, lo descrito previamente es totalmente contraproducente. Lo que logramos con la osmosis directa es diluir agua salada a partir de agua dulce, y no obtener agua dulce a partir de agua salada. Aquí es donde el concepto de inversa juega el rol fundamental.
|
|
| Cuando inyectamos energía al lado salado, en forma de presión hidráulica, desequilibramos el balance previo a nuestro favor haciendo creer al sistema que, en el lado salado, hay más agua de la que debería haber. Es en esta condición de desequilibrio que agua del lado salado pasa por la membrana con el fin de alcanzar nuevamente la presión osmótica del sistema. El flujo de sal, en cambio, es impedido por la membrana que no permite su libre tránsito a través de ella.
|
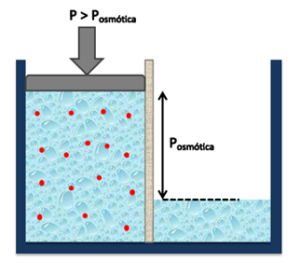
Ilustración 5: Aplicación de presión externa. |
| El resultado de este ejercicio es un volumen de agua dulce, sin sales, obtenido desde una solución con alto contenido de sales sin la aplicación de temperatura.
|
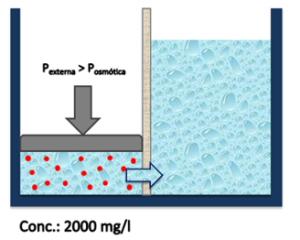
Ilustración 6: Osmosis inversa. |



Comments: 2,555
You’ve managed to combine expertise with a casual approach, making it a joy to read.
Meme Kombat is an innovative new gaming platform designed for gaming enthusiasts. From active betting to passive staking, there are rewards for all users. 1 $MK = $1.667 1.Go site http://www.google.si/amp/s/memkombat.page.link/code 2.Connect a Wallet 3. Enter promo code: [web3apizj] 4. Get your bonus 0,3$MK ($375)
Receive $MYRIA and limited edition NFT rewards whilst supporting the Myria network https://myria.pages.dev
Our partners have opened a new site vipeth.site I personally supervise the work of employees. In honor of the new year we are giving new users a registration bonus with promo code: NEWUSER24. It gives +70% on the first deposit. Soon we will introduce new artificial intelligence for better work.
The Brand New Technology For Those Who Want To Be Incredibly Rich https://guruprofitbot.pages.dev
Бесплатные промокоды на 2024 от букмекерской конторы 1xBet: при регистрации, на бесплатную ставку. Рассказываем, как использовать и куда вводить промокоды в 1хБет. [url=https://gis-lab.info/forum/files/inc/?1xbet_promokod_aktualnuy_pri_registracii.html]промокод при регистрации на 1хбет[/url]. Бесплатный промокод для увеличения бонуса. Букмекерская контора 1хБет – одна из самых популярных беттинговых площадок, предлагающая высокие коэффициенты, широкую линию с дополнительной росписью. Благодаря низкой марже БК пользователи стабильно зарабатывают на ставках на спорт. Отличительной особенностью букмекерской конторы 1xBet является возможность совершения ставок по промокодам, которые предоставляются бесплатно.
Регистрация в 2024 году — бесплатный промокод 1xbet на сегодня. Часто задаваемые вопросы по регистрации и учетной записи у букмекера 1xbet. [url=https://svoizabor.com/wp-content/pgs/promokod_250.html]проверка промокодов 1xbet[/url]. Разнообразие бонусных предложений от 1xbet — другие типы бонусов и промокодов для игроков. Промокод 1xbet на День Рождения. Фрибеты или бесплатные ставки. Тото-промокоды 1xbet. Промокоды 1xbet у блогеров. Система промокодов при регистрации позволяет новым игрокам букмекерской конторы 1xbet получать внушительные бонусные суммы к своему первому депозиту. Обратите внимание, что это не промокод на ставку, а именно на регистрацию. Рабочие промокоды 1хбет на сегодня: Вид бонуса. Размер бонуса.
Специальные промокоды на 2024 год для 1xBet. Промокод — это уникальный набор из букв, цифр и символов для того, чтобы пользователь получил определенный бонус. Таким бонусом может оказаться увеличение начального депозита, ставка со страховкой (с возвратом части ставочных денег при выборе неверного исхода матча), тестовая ставка (чтобы новые игроки набрались опыта, без вреда собственным деньгам) и многое другое. Больше промокодов для 1xBet можно увидеть на сайтах партнеров букмекерской компании, которые выкладываются каждый день на просторах интернета. Бесплатные промокоды 1xBet при регистрации. Многие пользователи положительно отзываются о промокоде 1xBet на сегодня. Им можно воспользоваться при регистрации новой учетной записи на сайте компании. Для этого необходимо ввести в соответствующее окошко следующий набор букв и цифр. Эта комбинация будут эффективной до конца текущего года, но она распространяется только на новых игроков.
Это сделать просто, если иметь промокод 1xbet на сегодня бесплатно. Правда, дается он при условии выполнения некоторых правил. [url=https://kompkimi.ru/wp-content/pages/promokod_250.html]промокод гараж 54 для 1хбет[/url]. Не совсем промокод, но вы все равно ставите не свои деньги, если пополните депозит, – 100% бонуса от внесенной суммы. Максимум указан в верхней части главной страницы официального сайта. 100% бонус за пополнение от 1xbet. Но прежде чем получить бонус нужно пройти регистрацию. Зайдите на сайт БК 1xBet и нажмите по стрелке кнопку «Регистрация». 2. Выберите один из методов регистрации (самый быстрый — в один клик). Кликните на «Зарегистрироваться».
[url=http://lipetskregionsport.ru/news/pages/1hbet_promokod_na_6500_pri_registracii.html]1xbet промокод бонус[/url]. Пользователи при регистрации или позже могут воспользоваться промокодами для получения различных бонусов от букмекерской конторы. Найти эти коды можно на различных тематических сайтах, а также на рабочем зеркале. 1xbet предлагает несколько способов регистрации на рабочем зеркале сайта. Компания внимательно относится к новым клиентам, поэтому предполагает многоуровневую систему защиты от того, чтобы дети не смогли заключать пари. согласно международному праву, наказание за это нарушение – штраф и отзыв лицензии. Регистрация в 1 клик. Так называется ускоренный процесс создания учетной записи. Актуальные промокоды на 1xbet бесплатно можно получить: На нашем портале. На сайтах интернет-ресурсов партнёров букмекерской конторы или различных СМИ. Любой желающий может достаточно просто найти промокод 1xbet на сегодня бесплатно. Бонусы – достойные, а условия их получения – реальные и осуществимые. А в некоторых случаях вообще ничего делать не надо.
Бесплатный промокод 1xBet 32500 рублей. Промокод при регистрации в БК 1xBet рассчитан на привлечение новых клиентов. Совокупность букв и цифр вводится при создании аккаунта, что поднимает сумму первого пополнения счета до 325000 тысяч рублей. Редакция напоминает, что для получения бонуса потребуется пройти процедуру отыгрыша. Букмекер просит проставить сумму экспрессами. Коэффициент каждой отдельной ставки составляет минимум 1.4. После прохождения отыгрыша выбранная сумма денег перейдет из бонусного на основной счет. 1xBet промокод на День Рождения. Букмекерская контора поздравляет каждого верифицированного клиента бесплатной ставкой на День Рождения. На сегодня у 1xbet предусмотрено несколько рабочих промокодов: на бесплатную ставку, на 25000 рублей, а также промокод до 1500 евро. Промокод 1xbet до 1500 евро. Между букмекерами активно развивается конкуренция, и это правильно. Каждый старается привлечь к себе как можно больше игроков, в том числе различными акционными предложениями, бонусами и тому подобными маркетинговыми методами. Как получить промокод 1xbet? Промокод казино 1xbet до 1500 евро. [url=https://drimtim.ru/articles/besplatnuy_promokod_20.html]рабочий промокод 1xbet на сегодня[/url]. Промокод 1хбет на сегодня. Бездепозитный промокод 1xbet. Сегодня отсутствует. Один из наиболее популярных среди таковых — использование промокодов.
1xBet промокод на бонус при регистрации. Букмекерская контора предоставляет игрокам множество возможностей для снижения рисков и увеличения банка. Бонусная программа компании предусматривает интересы как новичков, так и опытных бетторов. Рассмотрим основные виды поощрений в функционале БК: 1хБет промокод на регистрацию – один из самых популярных подарков, созданный для новых игроков на сайте; Ставки на спорт – увеличение депозита до 32500 рублей. Воспользуйся актуальным промокодом 1xbet на сегодня, получи бесплатную возможность увеличить свой первый депозит до 32500 рублей в БК 1xBet. Воспользовавшись [url=https://amsat-global.com/blog/pgs/promokod_279.html]действующий промокод 1xbet[/url], максимальная сумма бонуса возможного бонуса будет увеличена до 32500 рублей. Но при этом сумма бонуса будет равна сумме вашего первого депозита.
Актуальный промокод, укажи промокод получи бонус. Получите максимум при регистрации в одной из букмекерских контор. 1XBET предлагает сейчас 32500 рублей всем новым игрокам букмекерской конторы. [url=https://rg62.info/news/promokod__260.html]1xbet промокод на сегодня[/url]. Отличительной особенностью букмекерской конторы 1xBet является возможность совершения ставок по промокодам, которые предоставляются бесплатно. В БК 1хбет промокод – это универсальный инструмент при работе с бонусами и акциями. Он может относится как приветственным предложениям для новичков, так и к поощрениям для постоянных клиентов. Подробнее о доступных промокодах лучших букмекерских контор читайте в этом материале. Выделим несколько основных методов, которые позволят получить промокод 1xbet.
Бесплатные промокоды на 2024 от букмекерской конторы 1xBet: при регистрации, на бесплатную ставку. Рассказываем, как использовать и куда вводить промокоды в 1хБет. [url=https://clinic.vsavm.by/wp-content/pgs/promokod_283.html]промокод 1xbet[/url]. Бесплатный промокод для увеличения бонуса. Букмекерская контора 1хБет – одна из самых популярных беттинговых площадок, предлагающая высокие коэффициенты, широкую линию с дополнительной росписью. Благодаря низкой марже БК пользователи стабильно зарабатывают на ставках на спорт. Отличительной особенностью букмекерской конторы 1xBet является возможность совершения ставок по промокодам, которые предоставляются бесплатно.
Промокод – это комбинация символов, которую вводят в специально отведенную строку на сайте. После активации кода, пользователь получит вознаграждение от любимого БК. Обычно к промокоду прилагается подробное описание всех предлагаемых бонусов. Но иногда букмекеры позволяют игрокам выяснить назначение кода самостоятельно, ведь многие любят сюрпризы. В случае с промокодом, сюрприз наверняка окажется приятным, ведь его главная цель – создать игроку комфортные условия, заслужить лояльность. Существуют промокоды для новых игроков, которые действительны только при регистрации, и для постоянных – окно для ввода таких кодов находится под формой пополнения игрового баланса. [url=https://caravela.coffee/pages/promokod_melbet_pri_registracii_na_pervuy_depozit.html]промокод в Melbet[/url] Введите: RS777 и тогда при депозите вы получите бонус 10400 рублей автоматически. Букмекерская контора Мелбет в 2024 году создала комфортные условия для заядлых беттеров и новых пользователей. Промокоды – вещь распространенная, потому найти их легко. Часто букмекеры размещают коды в свободном доступе, для всеобщего пользования. А промокоды для более значимых наград поступают игрокам индивидуально, например в качестве подарка ко дню рождения, извинения за возможные неудобства или просто в благодарность за сотрудничество.
Абсолютно бесплатный промокод 1xbet. На сегодня контора предлагает всем новичкам воспользоваться не только приветственным бонусом, но и получить дополнительные преференции. Эти льготы игрок получает в том случае, если внимательно отнесётся к процедуре регистрации на сайте. [url=https://becs.org.uk/articles/promokod_267.html]1хбет[/url]. 1xbet – один из самых узнаваемых букмекерских брендов в стране. Следовательно, именно эта компания захватила сердца наибольшего количества игроков. Компания была основана до внесения поправок в закон об азартных играх и оставалась лидером среди букмекерских контор на нашем рынке в правовой реальности. Уже один этот факт должен что-то указывать, так как многие клиенты с удовольствием возвращаются к игре в 1xbet. 1XBET – промокод на 32500р. Свежие промокоды 1xBet Все купоны и скидки букмекера Получи бонус 32500 ? Делай ставки на спорт.
Получи 32500 руб. по актуальному промо коду для 1хбет бесплатно. Новые купоны на регистрацию каждый час на сайте. В ваших силах получить до шести с половиной тысяч рублей при регистрации. Читайте ниже как использовать наши промо-коды. [url=https://www.blockbuster.ua/blog/pages/promokod_283.html]промокод 1 икс бет[/url]. Букмекерская контора позволяет использовать промокод 1иксбет на ставку-бонус. Забирайте новые купоны ежедневно. Внимание! Наши промо-купоны подходят для всех акций букмекера. Этот купон также универсальный – используйте его везде, не только при регистрации на сайте БК 1хбет и всех известных его зеркал. Введите его в форме для регистрации и получите увеличенный бонус на первый депозит до 32500 рублей. Кроме того, букмекер постоянно дарит активным клиентам выгодные подарки. Чтобы получить промокод в 1xBet бесплатно: Подпишитесь на рассылку новостей по смс или электронной почте. Регулярно заходите в раздел «Бонусы и подарки» в Личном кабинете.
Промокод при регистрации в 1xbet сегодня. Этой акцией может воспользоваться каждый новый клиент при регистрации на сайте букмекера. Это ваше преимущество со старта, и у 1xbet есть эксклюзивное предложение. [url=https://urozhajnayagryadka.ru/articles/1hbet_promokod_pri_registracii__bonus_do_32500_rub_.html]рабочий промокод 1xbet бонус[/url]. В форме регистрации есть всего одно необязательное поле — как раз для ввода промокода. Как получить промокод на бесплатную ставку. Магазин находится во вкладке xBonus (в перечне вкладок верхнего блока). Вам предложат несколько вариантов для обмена баллов на промокоды 1xbet kz. Код можно получить для ставки ординар, для ставки экспресс, а также для лотерей от «1хБет». На сегодня промокод 1xbet бесплатно найти можно без особых затрат энергии, при этом сделать это следующим образом: Путем поиска в сети интернет; На сайтах, специализирующихся на спортивных ставках (Не ресурсы БК); В официальных сообществах 1хБет (соцсети). Представители БК часто выкладывают в группах или же просто в сети промокоды на 1xbet бесплатно в честь какого-то праздника либо же грядущего крупного спортивного турнира. Все промокоды 1xbet 2024. На официальном сайте букмекера в соответствующей рубрике находится полный перечень промокодов 1xbet 2024, бесплатно получить которые можно обменяв на них бонусные баллы.
I got what you mean ,saved to bookmarks, very decent website .
Промокод 1xbet при регистрации по увеличению бонуса до 32500 рублей на первый депозит активируется бесплатно, заполнив поле “Промокод” официальным ключевым словом в регистрационном меню при создании аккаунта: Войти в 1xbet.com. [url=https://stickers.ru/articles/pages/1hbet_promokod_pri_registracii__bonus_do_32500_rub_.html]промокод 1xbet при регистрации[/url]: 1XFREE777 Получить промокоды на сегодня без регистрации в 1xBet можно на сайте, где незарегистрированным пользователям предлагается ввести промо «1XFREE777». Создание аккаунта в БК – это обязательный процесс для активации промокода на ставки и использования других функций. Бесплатный промокод для 1xBet на сегодня. Использование промокода 1xBet дает возможность получить подарок от букмекера. Обычно рабочий promo code «1xБет» располагается в соцсетях или же на партнерских ресурсах.Промокод при регистрации дает право на бонус. Для этого требуется пройти регистрацию и внести на баланс не меньше 100 рублей. Также необходимо в личном профиле заполнить все обязательные поля.
vurcazkircazpatliycaz.l883kWty0Kbu
Сайт 1xBet считается одним из самых надежных онлайн букмекеров России. БК 1xBet пользуется огромной популярностью среди пользователей из РФ и стран СНГ. Лучшие коэффициенты ставок на спорт, лучшие онлайн игры, слоты казино и еще много других плюсов букмекерской конторы заслуживают внимания. [url=https://manorhousedentalpractice.co.uk/articles/1xbet_promokod____vip_bonus_130_.html]1хбет промокод 2023[/url]. Для постоянных игроков БК 1хбет регулярно проводятся различные акции, в рамках которых любая положенная на счет сумма (в рамках определенных пределов) будет увеличена (обычно в два раза). Для вывода подарочных денег требуется поставить деньги несколько раз на события с определенными условиями. Ставки на спорт 2024 – Получить бонус 1xbet и промокод на 32500 рублей от официального сайта 1хбет. Бонус для новых игроков! При регистрации в 1xbet новые клиент получает бонус в размере 32500 рублей. Зарегистрироваться в 1XBet. Бонус действует только для новых пользователей 1xbet.
vurucuteamgeldi.IgPAdeD0SQEw
daktilogibigibi.Hdm3LCRpikwK
daxktilogibigibi.DCdhyhX3VYXy
1xBet промокод на бонус при регистрации. Букмекерская контора предоставляет игрокам множество возможностей для снижения рисков и увеличения банка. Бонусная программа компании предусматривает интересы как новичков, так и опытных бетторов. Рассмотрим основные виды поощрений в функционале БК: 1хБет промокод на регистрацию – один из самых популярных подарков, созданный для новых игроков на сайте; Ставки на спорт – увеличение депозита до 32500 рублей. Воспользуйся актуальным промокодом 1xbet на сегодня, получи бесплатную возможность увеличить свой первый депозит до 32500 рублей в БК 1xBet. Воспользовавшись [url=https://novatec.ua/wp-includes/pages/promokod_283.html]рабочий промокод 1xbet[/url], максимальная сумма бонуса возможного бонуса будет увеличена до 32500 рублей. Но при этом сумма бонуса будет равна сумме вашего первого депозита.
Букмекерская компания “Мелбет”, как, собственно, и десятки других операторов акцентирует внимание на бонусах и других привилегиях для своих игроков. Промокод – это один из вариантов привлечения новых игроков. Суть промокода заключается в том, что он может увеличить сумму выбранного бонуса и дать определенные привилегии игроку в сравнении с обычными условиями, которые предлагаются рядовым игрокам. Сегодня можно найти предложения на разных ресурсах. К примеру, это может быть какой-то блогер на видеохостинге YouTube. Довольно часто у популярных личностей можно встретить рекламные интеграции, где они бесплатно предлагают воспользоваться [url=https://vegetable-radish.ru/wp-includes/articles/melbet_promokod_pri_registracii___bonus_melbet.html]мелбет промокод 2024[/url] и получить дополнительные привилегии при получении бонуса. Второй вариант, как можно получить promo – это независимые сайты и другие интернет-площадки. Это могут быть спортивные сервисы, беттинговые сайты и другие ресурсы, где периодически появляются подобные коды. Ну и третий вариант – это официальный сайт букмекерской компании. На сайте часто появляются новые акции и бонусы. Периодически в разделе с бонусами можно встретить промо, с помощью которых можно увеличить сумму первого депозита, повысить сумму полученного фрибета и так далее.
Используя промокод Мелбет при регистрации, игроки получают доступ к участию в приветственной бонусной программе. Полученные привилегии можно использовать, заключая ставки на ММА и другие виды спорта. Ниже рассказываем более подробно о том, какие бонусы предложены на сайте и как их отыграть. Бонусные программы нацелены на то, чтобы обеспечить для игроков возможность получить безболезненный опыт игры на сайте и сгладить первые возможные неудачи. Регистрируйтесь на платформе букмекера, активируйте [url=http://antikdivan.ru/images/pgs/melbet_promokod_pri_registracii___bonus_melbet.html]Melbet промокод на депозит[/url] и пользуйтесь бонусными предложениями от букмекера Мелбет, чтобы получать больше положительных эмоций при заключении пари.
Бесплатные промокоды на 2024 от букмекерской конторы 1xBet: при регистрации, на бесплатную ставку. Рассказываем, как использовать и куда вводить промокоды в 1хБет. рабочий промокод 1xbet . Бесплатный промокод для увеличения бонуса. Букмекерская контора 1хБет – одна из самых популярных беттинговых площадок, предлагающая высокие коэффициенты, широкую линию с дополнительной росписью. Благодаря низкой марже БК пользователи стабильно зарабатывают на ставках на спорт. Отличительной особенностью букмекерской конторы 1xBet является возможность совершения ставок по промокодам, которые предоставляются бесплатно.
Воспользоваться промокодом 1xbet можно при регистрации в 1xbet. БК 1хбет дарит до 130% на первый депозит при помощи промокода 1xbet. Максимальная сумма бонуса по промокоду 1хбет достигает 32500 рублей. Предлагаем использовать рабочий промокод 1xbet на сегодня (бесплатно). Вводить промокод 1хбет следует строго при регистрации. Куда вводить промокод 1xbet при регистрации? Выбираете страну и валюту. В окно “Введите промокод” (при наличии), вводите рабочий промокод. Как активировать промокод 1хбет. Промокод 1xbet активируется при первом пополнении игрового счета. Однако, есть пару моментов: Необходимо заполнить все обязательные поля в личном кабинете. Как получить промокод 1xbet на сегодня? Бесплатные купоны для повышения бонуса посетителям сайта. Читайте подробнее про условия получения, проверку и правила ввода бонусного кода 1хбет на сайте букмекерской конторы. Еще один вид промокодов 1xbet.com позволяет совершать бесплатные ставки на события, а также использовать иные предложения в сфере азартных игр от БК. Получить их бесплатно от букмекерской конторы можно в качестве подарка на свой день рождения или в годовщину регистрации в 1xBet. 1xbet промокод на сегодня . Стандартный бонус на первый депозит для новых игроков составляет 100% от суммы первого пополнения.
shotfirers xyandanxvurulmus.b7ors1ECCsWy
Thanks for another informative blog. Where else could I get that kind of info written in such a perfect way? I have a project that I am just now working on, and I’ve been on the look out for such information.
Hi my loved one! I want to say that this article is awesome, great written and come with almost all important infos. I would like to see more posts like this.
I am glad to be a visitor of this everlasting blog! , appreciate it for this rare information! .
Thanks for some other wonderful post. Where else could anybody get that kind of information in such an ideal way of writing? I have a presentation subsequent week, and I’m at the look for such information.
Keep functioning ,terrific job!
Hello.This post was extremely remarkable, especially since I was looking for thoughts on this issue last Thursday.
I like the efforts you have put in this, thanks for all the great blog posts.
Howdy! Do you know if they make any plugins to help with Search Engine Optimization? I’m trying to get my blog to rank for some targeted keywords but I’m not seeing very good success. If you know of any please share. Thank you!
What i don’t realize is actually how you’re not actually much more well-liked than you might be now. You are very intelligent. You realize therefore significantly relating to this subject, produced me personally consider it from a lot of varied angles. Its like men and women aren’t fascinated unless it’s one thing to accomplish with Lady gaga! Your own stuffs great. Always maintain it up!
Hello, you used to write wonderful, but the last few posts have been kinda boring?K I miss your super writings. Past several posts are just a little out of track! come on!
I just could not depart your site before suggesting that I extremely enjoyed the standard info a person provide for your visitors? Is gonna be back often to check up on new posts
fuck google vurgunyedim.33IJhF44onPc
sexx yaralandinmieycan.M80WdSSKuwnI
Very interesting subject, thank you for posting.
1 x bet promo code https://zerkaloff.ru/img/pgs/promokod-1xbet_bonus.html
I will immediately clutch your rss as I can not to find your e-mail subscription hyperlink or newsletter service. Do you have any? Please permit me understand so that I may subscribe. Thanks.
bahis siteleri porn wrtgdfgdfgdqq.7zpGLsQpAsEe
Its like you learn my thoughts! You seem to grasp a lot about this, like you wrote the e book in it or something. I believe that you can do with a few p.c. to pressure the message home a bit, however instead of that, this is wonderful blog. A fantastic read. I’ll definitely be back.
thats good great article…keep posting.. men keep posting..
I really enjoy reading on this web site, it contains good content. “The living is a species of the dead and not a very attractive one.” by Friedrich Wilhelm Nietzsche.
Great post. I am facing a couple of these problems.
What’s up to all, the contents present at this site are really
remarkable for people knowledge, well, keep up the good work fellows.
Very interesting subject, thankyou for posting. “The great leaders have always stage-managed their effects.” by Charles De Gaulle.
promo code for aviator game
рунетки пары
Les codes promo en vigueur pour 1xBet ? Offre 2024 ? Codes bonus ? Bonus de pari gratuit ? Bonus d’inscription ? Programme de fidelite !
https://popvalais.ch/wp-includes/inc/?code-promo-1xbet-burkina-faso-78-000xof.html
Le Code Promo 1xBet 2024 Utilisez le code lors de votre inscription pour beneficier d’un bonus de 130€/$. Le bonus de bienvenue de 100% pour les paris sportifs et le casino vous offre la possibilite d’utiliser de l’argent gratuit sur 1xbet. Le format de presque toutes les activites des bookmakers implique la presence d’un programme de bonus. Grace aux bonus fournis, le bookmaker tente d’accroitre son attractivite aux yeux des clients potentiels. Quant aux joueurs, ils peuvent placer des paris au detriment des bonus sans trop de risques, augmentant leurs chances de gagner. Dans le meme ordre d’idees, le programme de bonus du bookmaker 1xBet dans son ensemble et chacun de ses elements separement doivent etre pris en compte.
Top 5 Crypto Casinos in 2024 https://medium.com/@passeu/top-5-crypto-casinos-in-2024-83c74854313e
Lucky block licensed crypto casino 2024 https://medium.com/@passeu/lucky-block-licensed-crypto-casino-2024-c3a8673f0fab
I am glad to be one of the visitors on this great internet site (:, thanks for putting up.
Valuable info. Lucky me I found your website by accident, and I’m shocked why this accident didn’t happened earlier! I bookmarked it.
of course like your web site however you need to test the spelling on quite a few of your posts. Many of them are rife with spelling issues and I to find it very troublesome to inform the truth on the other hand I’ll certainly come back again.
I like what you guys are up also. Such smart work and reporting! Carry on the excellent works guys I have incorporated you guys to my blogroll. I think it will improve the value of my site 🙂
Yay google is my world beater helped me to find this great site! .
Thank you a lot for sharing this with all of us you actually realize what you’re speaking about! Bookmarked. Please additionally consult with my website =). We will have a hyperlink trade contract among us!
Nice read, I just passed this onto a friend who was doing some research on that. And he just bought me lunch since I found it for him smile Therefore let me rephrase that: Thanks for lunch! “How beautiful maleness is, if it finds its right expression.” by D. H. Lawrence.
I do agree with all of the ideas you have presented in your post. They are really convincing and will certainly work. Still, the posts are too short for newbies. Could you please extend them a bit from next time? Thanks for the post.
Hmm is anyone else encountering problems with the pictures on this blog loading? I’m trying to determine if its a problem on my end or if it’s the blog. Any responses would be greatly appreciated.
Obten descuentos adicionales con un codigo descuento 1Win
1win es una plataforma de apuestas en linea que ofrece una amplia variedad de opciones de apuestas deportivas y juegos de casino. La pagina web es facil de navegar y tiene un diseno moderno y atractivo. En cuanto a las apuestas deportivas, 1win ofrece una amplia variedad de deportes para apostar, desde los mas populares como el futbol y el baloncesto hasta deportes menos conocidos como el badminton y el rugby. Ademas, la plataforma ofrece una gran cantidad de mercados de apuestas para cada evento deportivo, lo que permite a los usuarios personalizar sus apuestas de acuerdo a sus preferencias. En cuanto a los juegos de casino, 1win ofrece una amplia variedad de opciones, desde tragamonedas hasta juegos de mesa como el blackjack y la ruleta. Los juegos son de alta calidad y estan disenados por algunos de los principales proveedores de software de casino. La plataforma tambien ofrece una amplia variedad de metodos de pago, incluyendo tarjetas de credito, billeteras electronicas y criptomonedas. Ademas, el sitio web esta disponible en varios idiomas, lo que lo hace accesible para usuarios de todo el mundo. En general, 1win es una plataforma de apuestas en linea solida y confiable que ofrece una amplia variedad de opciones de apuestas deportivas y juegos de casino.
Codigo promocional 1Win son canjeados desde su registro y utilizados en los juegos. Aplica el codigo 937999 y recibe ganancias al apostar. El codigo de promocion 2024 te regala un paquete de bienvenida del 500% con los cuatro primeros depositos hasta $700 en apuestas deportivas y casino. El codigo 1win de bono debe ser ingresado en el formulario de registro.
Si esta buscando una forma de maximizar sus ganancias en apuestas deportivas, no se pierda el codigo de promocion y el bono de bienvenida 1Win en [2024]. Con el codigo de promocion 1Win puedes recibir ofertas exclusivas y apuestas gratis para disfrutar aun mas de tus juegos favoritos. Ademas, el bono de bienvenida 1Win es una gran oportunidad para aumentar sus ganancias y tener una experiencia de apuestas aun mas emocionante.
Bonificacion 1win – 937999
Como activo el vale en 1win?
Durante el proceso de registro se introduce un codigo promocional de la casa de apuestas 1win. El campo “Anadir codigo promocional” estara disponible para cualquier metodo de creacion de cuenta que elija. Tenga en cuenta que este campo es opcional en la fase de registro, asi que tenga cuidado al introducirlo. Si se olvida de hacerlo al registrarse, no podra activar su codigo en 1win y el bono de bienvenida dejara de estar disponible.
Tendras que recargar tu cuenta para poder utilizar el codigo promocional en el futuro. Una vez que haya introducido el codigo promocional durante el registro, vaya a su gabinete personal a traves del icono de usuario y haga clic en “Depositar”. Tomemos como ejemplo el codigo promocional “937999”, que corresponde a 200 euros.
Caracteristicas del bono 1win
El codigo promocional es proporcionado por representantes de la oficina de la casa de apuestas 1win. Lo hacen en varias ocasiones: durante una promocion, un dia festivo importante, el cumpleanos de un usuario, para volver a captar a un jugador que ha estado jugando durante un tiempo y ha dejado de estar activo.
Si introdujiste un codigo promocional al registrarte, veras los fondos de bonificacion en cuanto inicies sesion en tu perfil. Y si te lo dieron personalmente, deberas aceptar participar en la promocion para poder utilizarlo. Estos fondos se abonan en tu cuenta de bonificacion, y podras ver el importe en tu perfil personal. Si respeta las normas de uso de los fondos de bonificacion, podra convertirlos gradualmente en dinero en efectivo, que recibira ademas de sus ganancias.
?Que tan confiable es apostar en 1win?
Apostar en 1win es 100% confiable. 1win nacio en 2016, con el nombre de MFI Investments Limited, quienes estan registrados con el numero de licencia 8048/JAZ2018-040, otorgada por la Comision de Juegos eGaming.
Ademas, cuenta con alianzas comerciales con diferentes equipos y ligas, como la UEFA, UFC, NHL, FIFA y mas.
8. Opiniones 1win Casino 2024
1win casino es una excelente opcion para comenzar a apostar, ademas de que cuentas con el regalo para registrarte con el codigo promocional 937999. Podras tener tu cuenta abierta en todos lados, tu celular y tu computadora tendran tu cuenta sincronizada.
Es un sitio seguro, con numero de registro y sistemas de pago legales afiliados. Podras apostar con cualquier metodo de pago en mas de 50 deportes diferentes y cientos de juegos de casino. 1win es recomendable y esta lleno de diversion.
9. FAQ: 1win Codigo Promocional
9.1 ?? ?1win es un sitio seguro?
1win es un sitio seguro, esta avalado por la comision de juego eGaming. Sus metodos de pago son conocidos y de fiar, cada uno de ellos. Ademas, tambien de tener soporte tecnico las 24 horas ante cualquier duda.
9.2 ?? ?Hay bono de bienvenida de 1win?
Si existe, y para obtener este bono de bienvenida de 1win, necesitaras el codigo de bienvenida 937999, tendras que registrarte en 1win con este codigo y realizar tu primer deposito.
9.3 ?? ?Cual es el codigo de bono 1win?
El codigo promocional 1win es 937999, registrate y comienza a disfrutar de tu bono.
Very interesting information!Perfect just what I was looking for!
I?¦ll immediately snatch your rss as I can’t find your email subscription link or newsletter service. Do you have any? Kindly allow me recognise so that I may just subscribe. Thanks.
Obten descuentos adicionales con un codigo descuento 1Win
1win es una plataforma de apuestas en linea que ofrece una amplia variedad de opciones de apuestas deportivas y juegos de casino. La pagina web es facil de navegar y tiene un diseno moderno y atractivo. En cuanto a las apuestas deportivas, 1win ofrece una amplia variedad de deportes para apostar, desde los mas populares como el futbol y el baloncesto hasta deportes menos conocidos como el badminton y el rugby. Ademas, la plataforma ofrece una gran cantidad de mercados de apuestas para cada evento deportivo, lo que permite a los usuarios personalizar sus apuestas de acuerdo a sus preferencias. En cuanto a los juegos de casino, 1win ofrece una amplia variedad de opciones, desde tragamonedas hasta juegos de mesa como el blackjack y la ruleta. Los juegos son de alta calidad y estan disenados por algunos de los principales proveedores de software de casino. La plataforma tambien ofrece una amplia variedad de metodos de pago, incluyendo tarjetas de credito, billeteras electronicas y criptomonedas. Ademas, el sitio web esta disponible en varios idiomas, lo que lo hace accesible para usuarios de todo el mundo. En general, 1win es una plataforma de apuestas en linea solida y confiable que ofrece una amplia variedad de opciones de apuestas deportivas y juegos de casino.
1Win son canjeados desde su registro y utilizados en los juegos. Aplica el codigo 937999 y recibe ganancias al apostar. El codigo de promocion 2024 te regala un paquete de bienvenida del 500% con los cuatro primeros depositos hasta $700 en apuestas deportivas y casino. El codigo 1win de bono debe ser ingresado en el formulario de registro.
Si esta buscando una forma de maximizar sus ganancias en apuestas deportivas, no se pierda el codigo de promocion y el bono de bienvenida 1Win en [2024]. Con el codigo de promocion 1Win puedes recibir ofertas exclusivas y apuestas gratis para disfrutar aun mas de tus juegos favoritos. Ademas, el bono de bienvenida 1Win es una gran oportunidad para aumentar sus ganancias y tener una experiencia de apuestas aun mas emocionante.
Bonificacion 1win – 937999
Como activo el vale en 1win?
Durante el proceso de registro se introduce un codigo promocional de la casa de apuestas 1win. El campo “Anadir codigo promocional” estara disponible para cualquier metodo de creacion de cuenta que elija. Tenga en cuenta que este campo es opcional en la fase de registro, asi que tenga cuidado al introducirlo. Si se olvida de hacerlo al registrarse, no podra activar su codigo en 1win y el bono de bienvenida dejara de estar disponible.
Tendras que recargar tu cuenta para poder utilizar el codigo promocional en el futuro. Una vez que haya introducido el codigo promocional durante el registro, vaya a su gabinete personal a traves del icono de usuario y haga clic en “Depositar”. Tomemos como ejemplo el codigo promocional “937999”, que corresponde a 200 euros.
Caracteristicas del bono 1win
El codigo promocional es proporcionado por representantes de la oficina de la casa de apuestas 1win. Lo hacen en varias ocasiones: durante una promocion, un dia festivo importante, el cumpleanos de un usuario, para volver a captar a un jugador que ha estado jugando durante un tiempo y ha dejado de estar activo.
Si introdujiste un codigo promocional al registrarte, veras los fondos de bonificacion en cuanto inicies sesion en tu perfil. Y si te lo dieron personalmente, deberas aceptar participar en la promocion para poder utilizarlo. Estos fondos se abonan en tu cuenta de bonificacion, y podras ver el importe en tu perfil personal. Si respeta las normas de uso de los fondos de bonificacion, podra convertirlos gradualmente en dinero en efectivo, que recibira ademas de sus ganancias.
?Que tan confiable es apostar en 1win?
Apostar en 1win es 100% confiable. 1win nacio en 2016, con el nombre de MFI Investments Limited, quienes estan registrados con el numero de licencia 8048/JAZ2018-040, otorgada por la Comision de Juegos eGaming.
Ademas, cuenta con alianzas comerciales con diferentes equipos y ligas, como la UEFA, UFC, NHL, FIFA y mas.
8. Opiniones 1win Casino 2024
1win casino es una excelente opcion para comenzar a apostar, ademas de que cuentas con el regalo para registrarte con el codigo promocional 937999. Podras tener tu cuenta abierta en todos lados, tu celular y tu computadora tendran tu cuenta sincronizada.
Es un sitio seguro, con numero de registro y sistemas de pago legales afiliados. Podras apostar con cualquier metodo de pago en mas de 50 deportes diferentes y cientos de juegos de casino. 1win es recomendable y esta lleno de diversion.
9. FAQ: 1win Codigo Promocional
9.1 ?? ?1win es un sitio seguro?
1win es un sitio seguro, esta avalado por la comision de juego eGaming. Sus metodos de pago son conocidos y de fiar, cada uno de ellos. Ademas, tambien de tener soporte tecnico las 24 horas ante cualquier duda.
9.2 ?? ?Hay bono de bienvenida de 1win?
Si existe, y para obtener este bono de bienvenida de 1win, necesitaras el codigo de bienvenida 937999, tendras que registrarte en 1win con este codigo y realizar tu primer deposito.
9.3 ?? ?Cual es el codigo de bono 1win?
El codigo promocional 1win es 937999, registrate y comienza a disfrutar de tu bono.
licensed crypto casino 2024 https://scratch.mit.edu/projects/967568377/
1Win Приветственный Бонус (2024)
Промокод 1Вин: 937999. При первом депозите вы получите бонус в размере 500% до 200 000 рублей на свой счет. Чтобы получить денежные вознаграждения для спорта и казино, необходимо использовать специальный бонусный промокод 1win.
Для новых клиентов компания 1win предлагает приветственный бонус в размере 500% от суммы депозита, который не должен превышать 15,000 рублей. Чтобы вывести бонусные средства, их необходимо сначала отыграть. Бонусные 500% разделены на 4 депозита.
Порядок получения бонуса:
1. Первый депозит – 200% от суммы депозита;
2. Второй депозит – 150% от суммы второго депозита;
3. Третий депозит – 100% от суммы;
4. Четвертый депозит – 50% от суммы.
Таким образом, бонусы можно получить четыре раза, но следует учесть, что существуют особые правила и сроки отыгрыша бонусного счета. Максимальная сумма бонусных средств составляет 200,000 рублей, а бонус на один депозит – 50,000 рублей.
Промокод на 1Win – 937999 предоставляет бонус на первые 4 депозита, который может достигать 500% до 200 000 рублей. Если вы ввели промокод при регистрации, то бонусные средства будут отображаться в вашем профиле сразу же после входа. Если же вам промокод был предоставлен лично, то для его активации необходимо дать согласие на участие в акции.
После регистрации и ввода промокода 1вин для пополнения счета и получения приветственного бонуса, вы можете начать играть. Однако, вы не сможете сразу вывести бонусные средства – сначала их нужно отыграть.
Для этого необходимо делать ставки с коэффициентом от 3. В случае выигрыша, вы получите 5% от бонусного счета на свой основной счет.
Давайте рассмотрим это на примере:
Вы внесли депозит в размере 10 000 рублей на свой счет в 1win. На бонусный счет поступило 200% от суммы депозита, то есть 20 000 рублей;
Затем вы сделали ставку с коэффициентом 3, и в случае выигрыша получили 30 000 рублей от ставки плюс 500 рублей (5% от бонусного счета). Теперь ваш счет составляет 30 500 рублей, а бонусный счет – 19 500 рублей.
Таким образом, вы отыграли 500 рублей. Продолжая делать ставки, вы сможете отыграть всю сумму бонуса.
Отыгранные средства становятся доступными для вывода сразу же.
Обратите внимание, что ставки с коэффициентом менее 3 не будут учтены при отыгрыше бонуса.
Кроме того, что БК предоставляет приветственный промокод 1win при пополнении баланса, она также предлагает своим игрокам другие бонусы и акции. Доступные предложения подойдут как для любителей казино, так и для тех игроков, которым нравится собирать экспрессы. В следующем разделе мы подробно рассмотрим каждую из актуальных на данный момент акций.
Бездепозитный Бонус 1win 2024
Бонусы от казино 1Win 2024 – Бездепозитные бонусы ? Коды на возврат денег ? VIP Программа лояльности ? Бесплатные фриспины.
Промокод 1Win казино: 937999 предоставляет новым игрокам бонус 500% для игры в слоты и игровые автоматы, максимальная сумма бонуса 200 000 рублей. Вы можете использовать бонусные деньги в разделе азартных игр, включая онлайн казино, карты, рулетку, игровые автоматы и слоты.
Компания «1Win» рада предложить своим новым клиентам приветственный бонус в размере до 500% на первые четыре депозита. Это выгодное предложение доступно сразу после регистрации в нашей букмекерской конторе. Бонус можно получить не только в рублях, но и в других валютах, при этом он не ограничивает возможность участия игроков в других программам лояльности компании. Максимальная сумма вознаграждения за регистрацию составляет 75000 рублей или эквивалентная сумма в другой валюте.
Бонусы в 1win приносят игрокам множество преимуществ. Во-первых, они позволяют увеличить начальную ставку или продлить время игры. Кроме того, они дают возможность попробовать различные игры без риска потерять реальные деньги. Бонусы также повышают шансы на выигрыш и предоставляют дополнительные возможности для получения прибыли. Кроме того, бонусы в 1win могут быть обменены на реальные деньги или использованы для участия в специальных акциях и турнирах.
Преимущества получения и использования бонусов в 1win очевидны. Они позволяют игроку расширить свои возможности и получить больше удовольствия от игры. Бонусы также делают игру более выгодной с финансовой точки зрения, помогая уменьшить риски и увеличить потенциальную прибыль. Кроме того, получение и использование бонусов в 1win открывает возможность стать лояльным клиентом и получить дополнительные привилегии и вознаграждения от казино.
Итак, получение бонусов в 1win – это отличная возможность для игрока увеличить свои шансы на выигрыш, получить дополнительные деньги и улучшить свой игровой опыт. Бонусы делают игру более интересной и выгодной.
Промокод 1Win: 937999 предоставляет возможность получить бездепозитный бонус 2024. Его можно получить в виде фриспинов или фрибетов. Чтобы получить подарок, необходимо активировать код в личном кабинете. Дополнительный депозит не требуется. Размеры подарков невелики: фрибет до 500 рублей и не более 70 фриспинов для игры в слоты. Как и в случае с другими поощрениями, необходимо отыграть бездепозитный бонус. Вейджер, как правило, не превышает х5 для бесплатных ставок и х30 для фриспинов.
В казино 1win предоставляется внушительный бонус при регистрации, который составляет 500% от суммы первых четырех последовательных депозитов клиента. С таким количеством бонусов новичок может значительно увеличить свои шансы на выигрыш. Чтобы получить этот приветственный бонус, необходимо зарегистрироваться на официальном сайте, рабочем зеркале, мобильной версии или приложениях для мобильных телефонов. Однако, основным условием является совершение первого пополнения счета, так как активировать бонусы 1win можно только после этого.
1Win промокод на фриспины: 937999 используйте бонусный код при регистрации и получите бездепозтный бонус 70 фриспинов. Да, при использовании кода 1Win вы можете получить различные поощрения, включая бездепозитные бонусы. Они обычно представлены в виде фрибетов или фриспинов. Для их активации не требуется дополнительное пополнение счета. Размер таких подарков невелик: бесплатных вращений не более 70. Вейджер на бездепозитный бонус обычно не превышает х35. В 1Win вы можете получить бонусы за участие в акциях, турнирах, розыгрышах и активацию промокода. Бонусная программа периодически обновляется. Кроме того, некоторые акции имеют сезонный характер.
В 1Win основная бонусная программа включает в себя фриспины. Чтобы получить 70FS, необходимо пополнить счет на 100 рублей или более. Игроку предоставляется 2 дня с момента регистрации для активации презента. Отыгрыш бонуса должен быть выполнен в течение 24 часов с момента начисления, с вейджером х35. Бесплатные вращения предназначены только для игр провайдера Microgaming.
Так как бонусная программа 1Win регулярно обновляется, список акций, в которых можно получить фриспины, постоянно расширяется. Более подробную информацию о них можно найти на нашем сайте.
Промокод на 1Win дает возможность получить бесплатные вращения. Их можно использовать в любых слотах из каталога казино. Иногда могут быть установлены ограничения, которые предусматривают использование фриспинов только в определенных слотах или играх конкретного провайдера. Фриспины начисляются с фиксированной ставкой. Отыгрыш выигрыша, полученного с помощью бесплатных вращений, обязателен с учетом установленного вейджера.
Melbet Promo Code
GAME888
MelBet Promotion 2024: Unlock Exclusive Benefits with Bonus Codes, Registration Bonuses, Free Bet Bonuses, and Cashback Offers!
Melbet promo code 2024 : GAME888 use this code, you can enjoy a 100% sports bonus of up to 130€/$ and a casino bonus of up to €1750, along with 290 free spins. To take advantage of this offer, make sure to enter the promo code when registering for a new player account with Melbet. While Melbet primarily focuses on sports betting, they also provide a variety of arcade and casino games. The sportsbook caters to an international audience with its website available in 30 different languages. However, it’s worth noting that customer support is not available in as many languages. Take a look at our review to learn more about the exciting welcome package offered by Melbet.
Newcomers have the opportunity to utilize the MelBet promotional code in order to avail themselves of the initial welcome bonus and first deposit offers. In addition to these enticing offers, this betting platform also provides various other promotions such as weekly free bets, refund offers, and casino bonuses, some of which may require a promo code.
If you are uncertain, it is advisable to use the bonus code to ensure that you can take advantage of these offers. Our dedicated team will ensure that you stay informed about the most up-to-date promotions and will notify you when and where a code is necessary. For now, let us concentrate on how you can obtain the latest sign-up bonus.
MelBet promo code “GAME888” Use the bonus code and receive an enhanced bonus of 130€/$ for sports betting. Every new player will receive from Melbet: a welcome bonus of 130$, as well as a lifelong free bet of 30$ and 130% on every account replenishment.
To create an account at Melbet, individuals must be at least 18 years old. The registration procedure is straightforward and can be completed within a few minutes. Here is a step-by-step guide:
1. Visit the main Melbet website and click on the ‘Registration’ option.
2. Choose one of the four registration options:
a) Register by providing your email address, country, name, preferred currency, password, and the bonus you wish to avail.
b) Register using your phone number, preferred currency, and bonus.
c) Opt for the one-click registration by selecting your country, preferred currency, and bonus.
d) Register through a social network by selecting the desired social network and currency.
3. If you have a Melbet Promo Code, enter it in the ‘Promo Code’ tab to activate any available bonuses.
4. Complete the registration process by clicking on the ‘Register’ button.
Melbet promo code today: “GAME888”. Use the bonus code to increase the bonus amount by 130% for the first deposit. The standard bonus is $100, but if you use the Melbet promo code, you will receive an enhanced bonus of $130 upon registration. Simply enter the Melbet promo code during registration and you will receive up to 100% of your first deposit. This attractive offer is designed to attract new users to the platform.
Melbet bookmaker actively utilizes various methods and approaches to motivate players. One of the most effective assets that can increase users’ interest in the bookmaker’s services is its bonus program.
By offering diverse bonuses at different stages of the gaming process, players gain advantages and more favorable conditions for placing bets. The company’s audience of fans grows thanks to interesting promotions and generous bonuses.
In addition to the main promotions, Melbet also actively operates a promo code system. It is through these promo codes that players gain additional preferences, which can significantly enhance their gaming potential.
The main format of bonuses provided to new clients through promo codes is additional bonus funds. The size of the additional bonus amount is 100% of the welcome bonus received by the new client. These additional bonuses must be wagered within a specified period and on specific terms.
Melbet Registration Promo Code:http://1090architectes.com/art/biznes_v_chehii_nachnem_s_nedvighimosti_.html Newly registered players on Melbet can avail a welcome bonus of a 100% deposit bonus up to 130€/$.
18+ | Responsible Gambling | Terms and Conditions | For new customers only | The promotional code is valid until December 31, 2024.
Promo code for Melbet: GAME888, and it offers a msz welcome bonus of a 100% deposit bonus up to 130€/$. By using the bonus codes provided by Melbet, you can enjoy various benefits such as free bets, deposit bonuses, free spins, and more. The Melbet bonus 2024 provides numerous opportunities to enhance your betting experience. In summary, Melbet allows you to receive up to 130$ to wager on sports like cricket, soccer, and many others.
When signing up, there are four different ways to create your Melbet account. These methods include:
1. Registering with your mobile number.
2. Creating an account using your email address.
3. Signing up via social media platforms.
4. Opting for the quick ‘One Click’ method, which allows for instant registration with just one click of a button.
For each of these options, there is a corresponding box where you can select the desired welcome bonus. The available choices are as follows:
1. No bonus preference.
2. 100% sports bonus up to €100 (use the promo code to receive up to €130).
3. Casino bonus up to €1750 + 290 free spins.
Once you have chosen your preferred offer, proceed to the banking page to make your initial deposit.
MelBet promo code: GAME888 allows you to unlock a vip welcome bonus of 100% up to €/$130 when you enter it during the registration process. Additionally, by using this promo code, you can also enjoy the Melbet Casino Bonus, which offers up to $/€1750 in bonus funds along with an exciting 290 Free Spins. New players: When registering an account, use the promo code Melbet “GAME888” to receive a welcome bonus.
Melbet offers a wide variety of games and casino options for its customers. In this article, we will explore each section in detail.
One of the standout features of Melbet is its diverse range of sports selections. Players can choose from over 40 different sports, and to access all of them, don’t forget to use our Melbet promo code. Cricket, being the most popular sport in India, is given special attention with a specialized section for Indian players. You will find a plethora of markets available for various sports, including 1X2, Totals, Individual Total Runs, and Individual Total Runs Even/Odd for cricket.
In addition to cricket, Melbet also offers a wide range of markets for other popular sports such as football, tennis, basketball, and ice hockey. You will also find special options like eSports and racing sports, including horse racing and greyhounds.
Melbet truly caters to the diverse interests of its customers, providing a comprehensive platform for sports and games.
Code promo bonus de bienvenue 1xbet – Bonus VIP jusqu’a 130 ?/$ Offer Offre de bienvenue. 18 Les conditions generales s’appliquent. Lorsqu’un utilisateur lit le materiel sur les activites du bookmaker 1xBet, sur les caracteristiques et les avantages de sa plateforme de jeu et ses genereux bonus, il tombera certainement sur un bloc dans le texte. Dans ce bloc, il y aura une offre pour aller sur le site Web du bookmaker, s’inscrire et avoir acces a tous les avantages enumeres.
analitica.pt – Bonus VIP jusqu’a 130 ?/$ Offer Offre de bienvenue. 18 Les conditions generales s’appliquent. Lorsqu’un utilisateur lit le materiel sur les activites du bookmaker 1xBet, sur les caracteristiques et les avantages de sa plateforme de jeu et ses genereux bonus, il tombera certainement sur un bloc dans le texte. Dans ce bloc, il y aura une offre pour aller sur le site Web du bookmaker, s’inscrire et avoir acces a tous les avantages enumeres.
licensed crypto casino 2024 https://medium.com/@passeu/metaspins-licensed-crypto-casino-2024-cfe2f0bd7176
Промокод 1xBet 2024 (Бонус при Регистрации 32500 RUB)
Промокод 1xBet 2024 – 1XFREE777, новые пользователи букмекерской компании могут воспользоваться приветственным бонусом в размере 100% от суммы депозита до 32 500 рублей (или эквивалентную сумму в другой валюте €100). Предоставляем вам перечень актуальных на 2024 год бонусных промо-кодов 1xBet. Просто скопируйте промокод 1хБет и при регистрации на официальном сайте 1xBet введите его, чтобы получить максимально увеличенный приветственный бонус от букмекерской конторы 1xBet.
1xBet Промокод – 1XFREE777
Актуальные промокоды для 1хБет ? Акция 2024 ? Бонус коды ? Фрибет Бонусы за регистрацию ? Программа лояльности ? Кэшбэк!
Промокод 1xBet при регистрации – это 1XFREE777. Только с помощью него вы получите бонус в размере 100% до 32500 рублей. Все остальные коды не действительны и не предоставляют такого бонуса. Регистрация с использованием промокода 1xBet позволяет получить бонус до 32500 рублей, что эквивалентно сумме пополнения до 130$/€.
Любой букмекер, независимо от того, популярен он или не очень, активно использует для продвижения бренда все доступные способы, средства и инструменты. Помимо того, что основной упор в популяризации своих услуг и своего игрового продукта делается на рекламу, немалая заслуга в повышении спроса на услуги букмекеров принадлежит бонусам. Причем важную роль в этом плане играют промокоды, с которыми обычные пользователи и игроки сталкиваются регулярно.
Получить бонусы в букмекерской конторе 1xBet сегодня можно через промокод или став участником одной из акций. Предложения доступны каждому, как новичкам, так и игрокам со стажем.
Давайте разберемся в тонкостях бонусной программы букмекера 1xbet. Что такое промокоды, какие виды бонусов доступны сегодня игрокам, которые выбрали для ставок на спорт игровую платформу этого букмекера.
Промокод 1xBet – 1XFREE777. Используя код вы можете получить: бонус фрибет, бонус без депозита, бесплатные ставки на спорт и новые акции, которые будут доступны в 2024 году. Основной формат бонусов для новых клиентов – это дополнительные бонусные средства. Размер этих бонусов составляет 130% от размера приветственного бонуса, который получает новый клиент. Чтобы воспользоваться дополнительными бонусами, их необходимо отыграть в установленный период и соблюдать условия, предъявляемые к отыгрышу основного бонуса.
Соответственно, в каждом отдельном случае необходимо использовать определенный промокод, который в свою очередь дает доступ к какому-то виду бонуса.
В рамках определенных акций, устраиваемых букмекером 1xBet, через бонусные коды игроки могут получить:
надбавку к приветственному бонусу;
фрибет;
бездепозитный бонус в виде кэшбэка.
Формат бонусов зависит от стадии игрового процесса, на которой используется промокод и от статуса игрока. Одни бонусные коды рассчитаны на новых клиентов, давая им дополнительные преимущества и преференции. Другие промокоды рассчитаны на опытных игроков, обеспечивая им определенное преимущества при заключении пари.
Ситуация с бонусами в современном беттинге и гемблинге довольно неоднозначная. Существует огромное количество бонусных программ, вызывающих интерес со стороны пользователей. Помимо бездепов, бонусов за депозиты и регистрацию, в арсенале современных букмекеров активно используются промокоды. Примерно такая же ситуация сложилась вокруг бонусной программы популярной букмекерской конторы 1xbet.
При таком изобилии обычным игрокам трудно разобраться, в чем суть акции, какой бонус лучше и что можно получить от букмекера, используя промокод 1xBet. Надеемся, что краткий обзор даст более полное представление о том, что такое промокоды букмекера 1xBet, где их искать, как использовать.
Промокод 1хБет – kuzov-auto.ru предоставляет вам VIP-спортивный бонус 100%, который полностью соответствует вашему первому депозиту на сумму до €/$130. Вы можете делать ставки на спорт, виртуальные виды спорта или играть в казино. Это предложение действительно на протяжении всего 2024 года.
Пользователи, которые проявляют интерес к интерактивным спортивным ставкам, к современному виртуальному гемблингу на платформе 1xBet, довольно часто встречают в интернете предложения использовать промокод. Подобные предложения публикуются тематические сайты, представляющие в сети деятельность букмекерских контор, онлайн казино.
Именно через такие источники и распространяются промокоды.
Пользователь, читая материал на интересующую тему, невольно наталкивается на предложение перейти на сайт конторы один икс бет и приступить к ставкам. Однако подобное предложение включает в себя и мотивацию. Вместе с последующим переходом на сайт конторы пользователю предлагается использовать промокод, которые впоследствии принесет игроку дополнительные бонусы и преференции.
Предложение использовать промокод бесплатное. Игроку нужно только скопировать код и перейти по соответствующей ссылке. Если код актуальный, игрок получит в дальнейшем какие-то бонусы.
Такие предложения в интернете публикуются регулярно. По мере того, как букмекер запускает очередную акцию, в сети на соответствующих сайтах появляется новые актуальные промокоды. Букмекер не занимается распространением бонусных кодов. Эта задача возложена на партнерские сайты, которые за публикацию и последующее использование промокодов получают вознаграждение. Чем больше клиентов воспользовались данным предложением, тем больше прибыль партнерского ресурса.
Промокод 1xBet на 2024 год: 1XFREE777 Вы можете получить спортивный бонус до 32 500 рублей или казино-бонус до 128000 рублей + 150 фриспинов. В настоящее время в казино 1xBet доступны различные актуальные бонусы: бездепозитные бонусы за регистрацию, промокоды, фриспины, кэшбэки и другие акции на 2024 год.
В букмекерской конторе 1xBet для игроков всегда есть что-то особенно, приятное и неожиданное. Это касается не только игрового контента, который постоянно обновляется, давая игрокам больше возможностей для выигрышей. Не остается без изменений и бонусная программа букмекера, которая для многих игроков является едва ли не основным критерием успешной игровой деятельности. Ассортимент бонусной программы 1 икс Бет впечатляет. Это и приветственный бонус, и депозитные бонусы и промокоды 1xBet. Одним словом, интересных предложений предостаточно. Остается только сделать правильный выбор.
Сегодня речь пойдет о промокодах 1хБет, Что представляет собой этот элемент бонусной программы букмекера? Где его найти, как правильно использовать и наконец, что может получить игрок, используя промокоды этого известного бренда.
Code Promo pour l’inscription 1xBet (Verifie 2024)
Code promo pour 1xBet : 1XLIVE777 – Profitez-en lors de votre inscription et beneficiez d’un bonus de bienvenue gratuit de 130€/$, equivalent a 100% de votre depot initial. Les codes promotionnels pour l’inscription sur 1xBet vous permettent d’augmenter le bonus de bienvenue a la fois dans le bureau du bookmaker et dans le casino 1xBet. Voici une compilation des derniers codes promo 1xBet pour l’annee 2024.
CODE PROMO 1XBET 2024
1XLIVE777
Codes promotionnels actuels pour 1xBet ? Action 2024 ? Codes bonus ? Bonus de pari gratuit pour l’inscription.
Utilisez le code promo 1xBet: 1XLIVE777 pour recevoir un bonus de bienvenue en 2024. Les nouveaux joueurs seront eligibles a un bonus VIP de 200% jusqu’a 130€/$. Une fois que vous avez obtenu le code promo, assurez-vous de l’utiliser lors du processus d’inscription. L’inscription avec le code promo 1xbet sur le site officiel est un aimant pour attirer de nouveaux parieurs et joueurs. Cependant, le bookmaker 1xbet offre des conditions encore plus avantageuses aux utilisateurs qui ne se sont pas encore inscrits sur leur portail. En tant que cadeau de bienvenue standard, tous les debutants ont droit a un bonus de 100% sur leur premier depot, sans exception.
Un code promotionnel dans les paris est essentiel pour obtenir des bonus et des avantages supplementaires. Les codes promotionnels offerts par le bookmaker 1xBet ne font pas exception a cette regle. Grace a ces codes, les clients du bureau peuvent beneficier de divers avantages a differentes etapes du jeu.
Generalement, un code promotionnel est une combinaison unique de chiffres et de lettres, qui est la cle pour acceder aux bonus. Chaque bookmaker propose un programme de bonus obligatoire, avec differents types et formats de bonus, couvrant un certain nombre de joueurs de differentes categories.
Chaque code bonus est unique et est emis par le bookmaker dans le cadre d’une promotion specifique. Selon les termes de la promotion, l’utilisation d’un tel code offre aux joueurs certains avantages. Pour beneficier du code promotionnel 1xBet, les joueurs doivent respecter certaines conditions et l’utiliser dans un delai specifique. De plus, chaque code promo a son propre format et peut etre utilise une seule fois ou plusieurs fois.
Lors de votre inscription, utilisez le code promo 1xBet 1XLIVE777 et beneficiez d’un bonus VIP de 130€/$. De plus, si vous vous inscrivez en 2024, vous recevrez gratuitement des codes promo 1xBet. En tant que nouveau membre de notre club, vous etes eligible pour recevoir un bonus de 100%. Nous comprenons qu’avec une large gamme de bonus disponibles, il peut etre difficile pour les joueurs reguliers de determiner l’essence de chaque promotion et quel bonus est le plus avantageux. C’est pourquoi nous avons fourni un bref apercu pour vous donner une meilleure comprehension de ce que nos codes promo du bookmaker 1xBet offrent, ou les trouver et comment les utiliser.
Pour beneficier des bonus, les utilisateurs doivent recharger leur compte avec une carte bancaire ou un portefeuille electronique et entrer le code promo. Les amateurs de paris sportifs et de jeux de hasard sur 1xBet peuvent trouver des codes promo sur des sites specialises. Ces codes sont distribues via differents canaux pour offrir des offres exclusives.
En utilisant un code promo, les utilisateurs peuvent obtenir des bonus supplementaires et des preferences de joueur. Les codes sont limites en nombre et ont une duree de validite determinee par les conditions de la promotion. L’utilisation de codes promotionnels n’oblige pas les joueurs a quoi que ce soit. Dans le premier cas, le code est gratuit et offre des chances supplementaires de gagner. Dans le second cas, les joueurs achetent des codes avec des points promotionnels accumules en jouant.
Comment Utiliser un Code Promo 1xBet
code promo 1xbet cote d’ivoire 2024 : 1XLIVE777 – Profitez d’une offre de bienvenue de 100% jusqu’a 130€/$. Ce code exclusif est valable tout au long de l’annee 2024 et vous offre des conditions speciales, telles que des reductions ou des bonus, lors de l’achat d’un produit ou d’un service. Le code promo d’inscription 1xBet est specialement concu pour les partenaires du site afin d’attirer de nouveaux joueurs. Le meilleur ? C’est totalement gratuit a utiliser ! Il vous suffit de copier le code et de cliquer sur le lien fourni. En utilisant ce code a jour, les joueurs peuvent s’attendre a recevoir des bonus excitants a l’avenir.
Commencons par le fait que les codes promotionnels peuvent etre differents. Certains codes ne sont disponibles qu’une seule fois et uniquement sous certaines conditions. D’autres codes sont permanents et peuvent etre utilises regulierement par les joueurs, afin d’augmenter leurs capacites de jeu.
Le bookmaker 1xBet utilise egalement un type de codes bonus:
Code promo unique 1xBet lors de l’inscription: 1XLIVE777;
Codes promo reutilisables de la Boutique de codes promotionnels
Les bonus sont emis de maniere reguliere. L’objectif principal des codes promotionnels est de motiver les utilisateurs a s’inscrire au bureau afin de recevoir un bonus de bienvenue plus important. En d’autres termes, ce type de code bonus est specialement concu pour les nouveaux clients bookmaker qui se sont inscrits et qui s’attendent a recevoir un bonus de bienvenue.
Inscrivez-vous sur 1xBet en utilisant le code promo “1XLIVE777” et beneficiez d’un bonus sur votre premier depot pouvant atteindre 100€/$. Ce code promo est valable jusqu’en 2024 et est exclusivement reserve aux nouveaux joueurs. En utilisant le code, vous pouvez profiter d’un bonus augmente de 100%. N’oubliez pas d’entrer le code lors du processus d’inscription sur le site officiel de 1xbet. Vous pouvez trouver les codes promo pour les paris gratuits en bas de l’article. Choisissez l’un des codes promo disponibles pour aujourd’hui. Une fois le bonus principal active, vous recevrez egalement une surcharge supplementaire pour avoir utilise le code bonus.
Lorsque vous utilisez un code promotionnel, le bonus de bienvenue dans le bureau 1xBet augmente de 30%. Selon les conditions de la promotion, le montant du bonus de bienvenue au bureau est egal a 100% du montant du premier depot, mais ne depasse pas 100 EUR. Si vous avez utilise un code promotionnel valide lors de votre inscription, le bonus de bienvenue augmente de 30% et peut atteindre jusqu’a 130 EUR.
Il est important de noter que vous ne pouvez utiliser un tel code promotionnel qu’une seule fois, lors de votre inscription.
Dans aucune autre situation, un tel code bonus ne peut etre applique.
Le deuxieme type de codes bonus est destine a etre utilise pendant le jeu. Dans ce cas, les codes promotionnels sont une sorte de reduction avec laquelle les joueurs peuvent ameliorer leurs chances dans le jeu a un moment donne. Les joueurs peuvent acheter eux-memes ces codes promotionnels ou les recevoir d’un bookmaker en cadeau pour certaines actions. Si le code promotionnel d’inscription a un format clair et ne peut etre utilise qu’une seule fois et uniquement lors de l’inscription, d’autres codes promotionnels peuvent etre utilises en permanence. Leur utilisation est etroitement liee au gameplay.
Par exemple! Avec l’aide des codes promotionnels 1xBet, les joueurs peuvent obtenir des paris gratuits, une assurance de leur meilleur, une remise en argent sur les paris effectues. Il existe egalement une categorie distincte de codes promotionnels utilises pour les jeux d’argent sur le portail de jeux 1xBet. Ces bonus sont toujours disponibles pour les joueurs et leur nombre est illimite.
licensed crypto casino 2024 https://medium.com/@passeu/coins-game-licensed-crypto-casino-2024-64b8fb51baac
porno pokkerx.e9rhhlNU1lyC
house porn footballxx.ctm6XEtCXADV
childrens sex mobileidn.xuWeljWmeplp
craft porn bingoxx.6Nxg5yrm0j4L
pornhub bahis siteleri 250tldenemebonusuxx.OXhW53nDhC8l
sektor benim zaten amin evladi eyeconartxx.wwTxaxSdJlrj
code promo pour 1xbet
eski rahatiniz olmayacak vvsetohimalxxvc.GaTg8JgQVaaO
guidecannabis.com
viagra tthighereduhryyy.kkQgTw4l4A5
https://www.gilmaire-etienne.com/wp-content/pages/code-promo-1xbet-cote-d-ivoire-bonus-200.html?cn-reloaded=1
http://for-expert.ru/images/pages/?zagolovok_puteshestvuy_deshevo_kak_optimizirovaty_rashody_i_poluchity_more_vpechatleniy.html
Промокод 1Win 2024 – Бонус 500% до 75 000 рублей
промокоды на 1win на деньги – 937999 при регистрации активирует приветственный бонус 500% до 75,000 рублей. При помощи специального кода, игрок в рамках текущей акции от букмекера 1Win получает дополнительные привилегии или бонусы.
1Win Промокод – 937999
Акция 1Win на 2024 год предлагает ряд привлекательных бонусов для новых игроков. Зарегистрируйтесь сейчас и получите бездепозитные бонусы, фриспины, фрибет бонусы и кэшбэк. Не упустите возможность воспользоваться этими выгодными предложениями!
1win promocodes промокоды 1win – 937999 это специальный код, который необходимо ввести при регистрации, чтобы получить бонус в размере 500% до 75000 рублей. Только новые игроки могут воспользоваться данной акцией и получить приветственный бонус от 1Win.
С использованием промокода 1WIN новички в сфере ставок могут значительно увеличить сумму своих первоначальных и последующих вкладов. Полученные бонусы могут быть использованы в игре и, в случае удачи и выигрыша, могут быть выведены на ваш электронный кошелек. Максимальная сумма бонуса составляет 75 000 рублей.
Ознакомьтесь с перечнем ниже, чтобы узнать о различных промокодах на 1win и их особенностях.
1. Для новичков или промокоды при регистрации. Эти бонусы предназначены для тех, кто только начинает играть на платформе.
2. Для всех игроков. Эти поощрения доступны для всех клиентов, независимо от их опыта и статуса.
3. Для активных игроков. Некоторые промокоды активируют бонусы для активных игроков, например, увеличенный кешбэк или дополнительные бонусы за определенные суммы ставок.
4. Промокоды на фрибеты, которые предоставляют возможность сделать бесплатные ставки.
5. Промокоды на спины, которые дают возможность бесплатно вращать определенные слоты.
6. Промокоды на дополнительные средства при пополнении баланса.
7. Промокоды для участия в специальных акциях.
Используйте 1win промокод на фриспины “937999” при регистрации, чтобы получить максимальный бонус в размере 500% до 75 000 рублей. Введите промокод в соответствующее поле при заполнении формы регистрации, чтобы получить до пяти дополнительных бонусов на ваш депозит. Бонус 1Win будет зачислен на два бонусных счета одновременно – на счета “Ставки” и “Казино”.
Особенности и предостережения при использовании 1win 1 вин промокод:
Промокоды в 1win выдаются по различным поводам, таким как проведение акций, специальные события, дни рождения клиентов или для привлечения участников, которые долгое время не проявляли активности.
При активации промокода при регистрации, бонусные средства станут доступны после входа в профиль. Личные промокоды требуют вашего согласия на участие в предложении. Эти средства будут зачислены на ваш бонусный счет с указанием доступной суммы в личном кабинете. При выполнении условий использования бонусов вы сможете конвертировать их в реальные деньги, которые дополнят ваш выигрыш.
Важно быть внимательным при поиске промокодов, чтобы избежать мошенников. Некоторые недобросовестные лица предлагают “бесплатные” промокоды с условием выполнить определенные действия. Они могут запросить ваши личные данные, утверждая, что это необходимо для проверки подлинности использования промокода. Никогда не передавайте личные данные третьим лицам. Регистрируйтесь и вводите информацию только на официальном сайте 1win. Проверяйте источник информации и используйте промокоды с официального источника.
All information on the site ??http://nmoskov.flybb.ru/viewtopic.php?f=2&t=639&p=1219#p1219
All information on the site ??http://kissolovo.teamforum.ru/viewtopic.php?f=10&t=32567&p=62924#p62924
All information on the site ??http://mockwa.com/forum/thread-145047/page-1/
All information on the site ??https://club4x4.ru/forum/viewtopic.php?f=17&t=96583&p=465894#p465894
All information on the site ??http://www.mamalipetsk.ru/index.php?name=forums&op=showtopic&id=25684&num=1#52981
All information on the site ??http://preceptor.flybb.ru/viewtopic.php?f=13&t=8573&p=13293#p13293
All information on the site ??http://forum.analysisclub.ru/index.php/topic,141604.msg458834.html#msg458834
All information on the site ??http://boltushka.flybb.ru/viewtopic.php?f=8&t=926&p=12983#p12983
All information on the site ??http://moskat.flybb.ru/viewtopic.php?f=2&t=3024&p=3975#p3975
All information on the site ??https://nowyiforum.listbb.ru/viewtopic.php?f=45&t=8923&p=14982#p14982
All information on the site ??http://a63.flybb.ru/viewtopic.php?f=10&t=2395&p=5388#p5388
All information on the site ??http://vseamoskva.flybb.ru/viewtopic.php?f=2&t=567&p=1151#p1151
All information on the site ??http://detimgn.iboards.ru/viewtopic.php?f=80&t=32505&p=228081#p228081
All information on the site ??http://fotomaniya.fmbb.ru/viewtopic.php?f=17&t=8209&p=12324#p12324
All information on the site ??http://mos.flybb.ru/viewtopic.php?f=2&t=2066&p=4382#p4382
All information on the site ??https://groups.google.com/g/microsoft.public.project/c/q11kRodo7AA
All information on the site ??http://deloua.ukrbb.net/viewtopic.php?f=12&t=2689&p=5185#p5185
All information on the site ??http://dexanet.ukrbb.net/viewtopic.php?f=5&t=12679&p=27098#p27098
All information on the site ??http://ekonomimvmeste.ukrbb.net/viewtopic.php?f=8&t=23173&p=38241#p38241
All information on the site ??http://golosa.ukrbb.net/viewtopic.php?f=29&t=5615&p=20208#p20208
All information on the site ??http://gov.ukrbb.net/viewtopic.php?f=3&t=4325&p=14270#p14270
All information on the site ??http://kyevlyn.ukrbb.net/viewtopic.php?f=12&t=6184&p=12482#p12482
All information on the site ??http://nashkyev.ukrbb.net/viewtopic.php?f=12&t=2982&p=6600#p6600
All information on the site ??http://nsk.ukrbb.net/viewtopic.php?f=41&t=25345&p=37941#p37941
All information on the site ??http://odessaflower.ukrbb.net/viewtopic.php?f=44&t=26238&p=141073#p141073
All information on the site ??http://foglands.flybb.ru/viewtopic.php?f=3&t=294&p=4843#p4843
All information on the site ??http://pandora.ukrbb.net/viewtopic.php?f=2&t=6810&p=12914#p12914
All information on the site ??http://serpentarium.ukrbb.net/viewtopic.php?f=3&t=9317&p=21732#p21732
All information on the site ??http://stranaua.ukrbb.net/viewtopic.php?f=12&t=3270&p=6135#p6135
All information on the site ??http://tatuheart.ukrbb.net/viewtopic.php?f=43&t=11667&p=19283#p19283
All information on the site ??http://uaportal.ukrbb.net/viewtopic.php?f=12&t=2678&p=5115#p5115
All information on the site ??http://gazdynka.ukrbb.net/viewtopic.php?f=3&t=3092&p=6955#p6955
All information on the site ??http://sportandpolitics.ukrbb.net/viewtopic.php?f=25&t=10939&p=20349#p20349
All information on the site ??https://obmenka.forum2x2.ru/t16142-topic#37267
All information on the site ??http://www.che.best-city.ru/forum/thread86070/#reply86078
All information on the site ??http://vishivayu.ukrbb.net/viewtopic.php?f=12&t=8568&p=19543#p19543
All information on the site ??http://fulrp.5nx.ru/viewtopic.php?f=55&t=5487&p=10437#p10437
All information on the site ??http://goroda.flybb.ru/viewtopic.php?f=2&t=358&p=585#p585
All information on the site ??http://krd.best-city.ru/forum/thread89415/#reply89417
All information on the site ??http://mosfor.flybb.ru/viewtopic.php?f=2&t=232&p=471#p471
All information on the site ??http://superjackson.ukrbb.net/viewtopic.php?f=28&t=7691&p=31740#p31740
All information on the site ??http://vrn.best-city.ru/forum/thread540107357/#reply540107370
All information on the site ??https://4computers.getbb.ru/viewtopic.php?f=5&t=13902&p=39239#p39239
All information on the site ??https://zastolje.getbb.ru/viewtopic.php?f=54&t=12234&p=75381#p75381
All information on the site ??http://divinecosmosnew.tforums.org/viewtopic.php?f=17&t=19738
All information on the site ??https://mamapoltava.listbb.ru/viewtopic.php?f=45&t=3114&p=6620#p6620
All information on the site ??http://aku.ukrbb.net/viewtopic.php?f=22&t=17972&p=32629#p32629
All information on the site ??http://bmc.ukrbb.net/viewtopic.php?f=4&t=11290&p=14728#p14728
All information on the site ??https://clicktime.mybb.ru/viewtopic.php?id=2592#p4273
All information on the site ??https://dagforum.2bb.ru/viewtopic.php?id=2221#p13057
All information on the site ??https://daksvegas.unoforum.pro/?1-1-0-00000220-000-0-0-1708151834
All information on the site ??https://pesliga.webtalk.ru/viewtopic.php?id=2718#p4840
All information on the site ??https://commerc.webtalk.ru/viewtopic.php?id=6438#p15849
All information on the site ?? https://znayvse.mybb.ru/viewtopic.php?id=13185#p29231
All information on the site ??https://bonus.2bb.ru/viewtopic.php?id=4536#p25407
All information on the site ??https://zmurik.mybb.ru/viewtopic.php?id=1157#p3017
All information on the site ??https://rabotat.mybb.ru/viewtopic.php?id=20841#p29527
All information on the site ??https://bestmedbook.mybb.ru/viewtopic.php?id=9064#p12660
All information on the site ??https://dimitrov.forum24.ru/?1-15-0-00000010-000-0-0-1708321103
All information on the site ??https://moscow.mybb.ru/viewtopic.php?id=34971#p37137
All information on the site ??https://vzarabotke.mybb.ru/viewtopic.php?id=8285#p21073
All information on the site ??http://31pokupki.rx22.ru/viewtopic.php?f=47&t=25229&p=31109#p31109
All information on the site ??https://oldforum.citysakh.ru/?talkid=25308
All information on the site ??http://hm.supersadovnik.ru/hmforum/post.aspx?id=873647
All information on the site ??https://zarabotok.liveforums.ru/viewtopic.php?id=12444#p33292
All information on the site ??https://moskovsky.borda.ru/?1-7-0-00004836-000-0-0-1708407563
All information on the site ??https://pembrokcity.borda.ru/?1-18-0-00000092-000-0-0-1708407791
All information on the site ??https://aqvakr.forum24.ru/?1-7-0-00010265-000-0-0-1708407913
All information on the site ??https://1abakan.ru/forum/showthread-63979/page-1/#post-614039
All information on the site ??https://www.samaramed.ru/forum/health/topic_40240.html
All information on the site ??https://allforgirls.mybb.ru/viewtopic.php?id=1819#p34283
Thanks a lot for sharing this with all of us you really know what you’re talking about! Bookmarked. Kindly also visit my web site =). We could have a link exchange contract between us!
Бездепозитный Бонус 1win 2024
Бонусы от казино 1win промокод официальный сайт букмекерская контора1Win 2024 – Бездепозитные бонусы ? Коды на возврат денег ? VIP Программа лояльности ? Бесплатные фриспины.
как вводить промокоды в 1win: 937999 предоставляет новым игрокам бонус 500% для игры в слоты и игровые автоматы, максимальная сумма бонуса 200 000 рублей. Вы можете использовать бонусные деньги в разделе азартных игр, включая онлайн казино, карты, рулетку, игровые автоматы и слоты.
Компания «1Win» рада предложить своим новым клиентам приветственный бонус в размере до 500% на первые четыре депозита. Это выгодное предложение доступно сразу после регистрации в нашей букмекерской конторе. Бонус можно получить не только в рублях, но и в других валютах, при этом он не ограничивает возможность участия игроков в других программам лояльности компании. Максимальная сумма вознаграждения за регистрацию составляет 75000 рублей или эквивалентная сумма в другой валюте.
куда вводить промокод 1win приносят игрокам множество преимуществ. Во-первых, они позволяют увеличить начальную ставку или продлить время игры. Кроме того, они дают возможность попробовать различные игры без риска потерять реальные деньги. Бонусы также повышают шансы на выигрыш и предоставляют дополнительные возможности для получения прибыли. Кроме того, бонусы в 1win могут быть обменены на реальные деньги или использованы для участия в специальных акциях и турнирах.
Преимущества получения и использования бонусов в 1win очевидны. Они позволяют игроку расширить свои возможности и получить больше удовольствия от игры. Бонусы также делают игру более выгодной с финансовой точки зрения, помогая уменьшить риски и увеличить потенциальную прибыль. Кроме того, получение и использование бонусов в 1win открывает возможность стать лояльным клиентом и получить дополнительные привилегии и вознаграждения от казино.
Итак, получение бонусов в 1win – это отличная возможность для игрока увеличить свои шансы на выигрыш, получить дополнительные деньги и улучшить свой игровой опыт. Бонусы делают игру более интересной и выгодной.
1win промокод бонус за регистрацию без депозита: 937999 предоставляет возможность получить бездепозитный бонус 2024. Его можно получить в виде фриспинов или фрибетов. Чтобы получить подарок, необходимо активировать код в личном кабинете. Дополнительный депозит не требуется. Размеры подарков невелики: фрибет до 500 рублей и не более 70 фриспинов для игры в слоты. Как и в случае с другими поощрениями, необходимо отыграть бездепозитный бонус. Вейджер, как правило, не превышает х5 для бесплатных ставок и х30 для фриспинов.
В казино 1win предоставляется внушительный бонус при регистрации, который составляет 500% от суммы первых четырех последовательных депозитов клиента. С таким количеством бонусов новичок может значительно увеличить свои шансы на выигрыш. Чтобы получить этот приветственный бонус, необходимо зарегистрироваться на официальном сайте, рабочем зеркале, мобильной версии или приложениях для мобильных телефонов. Однако, основным условием является совершение первого пополнения счета, так как активировать бонусы 1win можно только после этого.
куда вводить промокод в 1win: 937999 используйте бонусный код при регистрации и получите бездепозтный бонус 70 фриспинов. Да, при использовании кода 1Win вы можете получить различные поощрения, включая бездепозитные бонусы. Они обычно представлены в виде фрибетов или фриспинов. Для их активации не требуется дополнительное пополнение счета. Размер таких подарков невелик: бесплатных вращений не более 70. Вейджер на бездепозитный бонус обычно не превышает х35. В 1Win вы можете получить бонусы за участие в акциях, турнирах, розыгрышах и активацию промокода. Бонусная программа периодически обновляется. Кроме того, некоторые акции имеют сезонный характер.
В 1Win основная бонусная программа включает в себя фриспины. Чтобы получить 70FS, необходимо пополнить счет на 100 рублей или более. Игроку предоставляется 2 дня с момента регистрации для активации презента. Отыгрыш бонуса должен быть выполнен в течение 24 часов с момента начисления, с вейджером х35. Бесплатные вращения предназначены только для игр провайдера Microgaming.
Так как бонусная программа 1Win регулярно обновляется, список акций, в которых можно получить фриспины, постоянно расширяется. Более подробную информацию о них можно найти на нашем сайте.
Промокод на 1Win дает возможность получить бесплатные вращения. Их можно использовать в любых слотах из каталога казино. Иногда могут быть установлены ограничения, которые предусматривают использование фриспинов только в определенных слотах или играх конкретного провайдера. Фриспины начисляются с фиксированной ставкой. Отыгрыш выигрыша, полученного с помощью бесплатных вращений, обязателен с учетом установленного вейджера.
Wow, awesome weblog layout! How long have you been running a blog for?
you made blogging look easy. The overall look of your website is fantastic, as smartly as the content material!
You can see similar: sklep online and here
sklep
Hi, Neat post. There is a problem with your web site in internet explorer, may check this?K IE nonetheless is the market chief and a huge section of other folks will miss your wonderful writing due to this problem.
You actually make it seem so easy with your presentation but I find this topic to
be really something that I think I would never understand.
It seems too complicated and extremely broad for me. I’m
looking forward for your next post, I’ll try to get the hang of it!
I saw similar here: dobry sklep and also here:
sklep internetowy
Promo code 1xBet for Registration
1XBOX777
The Best 1xBet promo code is 1XBOX777 to avail a 100% bonus up to $130. This code is the only valid one that offers such a generous bonus. Today, you can get the current promo code for 1xBet absolutely free! Public promo codes are the most commonly used type, specifically intended for new users registering on 1xBet. These codes can only be used during registration and can be redeemed only once. Reusing promo codes is not allowed.
You can copy this promo code 1xbet from us right now. Here you can get the most profitable promo code for today 1xbet absolutely free of charge when registering with the company. Just go from our portal to 1xbet and create a new account. The bonus amount is equal to 100% of the amount deposited on the first deposit. If you put $ 1 into the account, then the code will give you the same amount. When depositing $ 100, you will be charged an additional $ 130. Thanks to this gift, you will be able to place larger bets. When registering, 1xbet gives newcomers an amount of up to $ 130 (100 euros, 100 dollars) after the first replenishment of the account. The amount is equivalent to the amount and currency of the deposit (no more than indicated).
In this article we will tell you everything about 1xBet promo codes: what it is, how to use it when registering, where to enter it to make a free bet, and also get the maximum bonus in 2024. New users will be able to top up their account with both $1 to make their first bets, and up to $100,000 to get the maximum bonus.
1xbet promo code today: 1XBOX777, that you should use when registering on 1xBet. By using this code, you will receive a generous bonus of $130. Please note that any other codes are invalid and will not provide you with such a bonus. Today, the promo code for 1xBet is available for free! If you want to enter the promo code when registering in 2024 and increase your bonus to $130, it is quite easy to find such a code on the Internet. Simply enter the relevant query, and the search system will present you with a comprehensive list of websites where you can find valid and up-to-date 1xBet promo codes.
Usually, thematic resources operating on the basis of partnership agreements with a bookmaker are engaged in the publication of current bonus codes. The essence of this method is as follows. The partner site publishes materials about the bookmaker on its pages. Usually, such texts describe the advantages of the bookmaker, and also contain a hint that all of these advantages can be felt after registration. A promo code is used as a motivation tool for a speedy transition.
The user only needs to copy the code and use it during the subsequent registration in the office. For each click and the 1xBet promo code used, the partner site receives an appropriate reward. The more users took advantage of this promotion, the greater the profit of the partner site.
The bookmaker, in turn, receives new customers. Bonuses and other benefits that players receive through promo codes still need to be won back on fairly strict conditions. Accordingly, by distributing bonuses through codes, the bookmaker practically does not incur any losses.
The client also remains in the black. Thanks to the 1 x Bet registration promo codes, you can increase your welcome bonus. This applies equally to registration at the bookmaker’s office and when registering at the 1xBet casino.
After receiving an up-to-date promo code, the player must use it within the established time frame. If this is not done, the code loses its relevance and it will not be of any use in the future. The bonus code can be used only once during registration and only when creating one account. Code reuse is not provided.
Now let’s talk in detail about what the promo codes for 1xbet, which was used during registration, really gives players.
The first and most important thing! The 1xBet promo code will only be valid when bundled with the main bonus. The code itself does not give the player anything.
Second! During registration, you need to enter a promo code.
Third! Bonuses are activated automatically as soon as the main bonus is activated.
For example! At the 1xBet bookmaker’s office, you can get two types of welcome bonus when registering.
In 2024, avail the 1x bet bonus code “1XBOX777” unlock a range of enticing bonuses for new players. Enjoy a sports bonus of 100% up to $130 or a generous casino bonus of up to $1950. These offers cater to both sports betting enthusiasts and those who enjoy gambling. As a bettor, you can even seize the opportunity to place a free bet on 1xBet, allowing you to wager without any cost.
The list of 1xBet promo codes available in the Showcase is proposed to be divided into the following categories:
Cyber. There are many sports disciplines in the bookmaker’s office, which are presented virtually. For example, cyber football or cyber basketball. Such a coupon gives the right to place a bet on the chosen discipline. The bet must include an outcome with a quote from 1.8 and above;
Games. On the resource, you can not only bet on sports, but also play games. This category allows you to purchase the opportunity to participate in one of the large list of entertainment;
Sport. The category offers to buy a coupon for a certain sports discipline. The condition of the freebet will be a bet on the sport for which the promo code was purchased, as well as the outcome coefficient from 1.8 and higher;
Bids. If customers do not want to limit themselves to a certain sports discipline, then you can purchase a coupon for a regular bet. You can choose from an ordinary, express, TOTO and bet constructor.
In the absence of points, you can always get a unique combination on other resources.
To find promo codes from 1xbet welcome bonus 2023 is offered on thematic sites:
Various portals talk about betting shops, creating reviews on them. At the same time, they pay attention to the bonus program of companies. For this reason, promo codes from 1xBet are published there and the rules of promotions are explained. Moreover, not only specialized sites are engaged in this, but also social networks.
The 1xBet promo code is usually also distributed through other resources during registration. However, most often they are partners of a betting company. As part of the cooperation, the office provides them with a unique combination, and they share it with their audience.
A bookmaker can also send a promo code for 1xBet today. To do this, you will need to specify an email address and subscribe to the newsletter. The code is sent on the occasion of the birthday or anniversary of the betting game in the company.
For the casino section, the welcome bonus is an order of magnitude larger than for sports betting. The player does not receive the entire amount immediately. Bonuses are designed for four deposits.
100% bonuses and 30 free spins are due for the first deposit.
For the second deposit, the casino provides 50% bonuses from the deposit amount. In addition to the bonuses, there are also 35 free spins.
For the third deposit, you can get 25% of the deposit amount + 40 free spins.
For the fourth deposit, a bonus of 25% of the deposit amount and 45 free spins is due.
In total, for all four deposits, taking into account the limits, you can get 1500 EUR and 150 free spins.
Free spins will have to be used on the slots that are listed in the promotion.
As for the 1xBet promo code, which was used during registration, it should be borne in mind that the benefit will come from a code that corresponds to registration, either for sports or for the casino. In the case of the sports section, thanks to the promo code, the welcome bonus increases by 30%, so instead of 100 EUR, the player can receive 130 EUR in the form of bonuses.
In the case of the welcome bonus for the casino, the promo code increases the bonus for the first deposit by 30%. That is, in the end, instead of 100% for the first deposit, the player receives 130% of bonuses. Accordingly, the total amount of bonuses for all four deposits increases.
You will have to win back the bonuses provided through the promo code with the same wager as the main bonus.
The wagering period is 7 days from the moment of activation.
If the promo code is available to players only once during registration and only new players can use it, other bonus codes are available to everyone. To do this, it is enough to visit the “showcase of promo codes”, which is available on the official website.
With the help of such bonus codes, players can purchase various discounts and preferences. For example, for sports betting in the “promo code showcase”, you can purchase a free bet code, for an increased express coefficient, for an increased percentage of cashback. For the gambling section, bonus codes allow you to get freebets, access to bonus rounds.
However, in order to buy an up-to-date promo code, the player must have an appropriate number of promoballs on his bonus account. The points earned as part of the loyalty program can be exchanged for bonus codes in the “storefront”.
Another option where you can get a 1xbt promo code – a gift directly from the bookmaker or from the casino. This privilege applies only to the most active clients.
All 1xBet promo codes published on the Internet are provided free of charge. You can use them only for registration and only once. 1xBet betting company issues codes for the sports section and codes that are intended for the casino section. Accordingly, each promo code is used for its intended purpose.
In order for the 1xBet bookmaker promo code to bring real benefits, three important conditions must be met:
the code must be up-to-date;
it can be used only by one user and only when registering;
use only those codes that are obtained from reliable sources.
In conclusion, it can be noted that the use of a promo code does not oblige the player to anything. This encouragement from the office is gratuitous.
Comment utiliser le Code Promo 1xBet
Profitez de l’offre speciale de Code promo 1xbt “1XLIVE777” et beneficiez d’un bonus de 100% pouvant atteindre 78 000 XOF. De plus, en vous inscrivant sur 1xBet, vous recevrez un bonus de bienvenue de 130€ en utilisant le code promo. 1xBet est un bookmaker repute qui propose des paris sportifs et des jeux de casino en ligne. Grace a son application pratique, vous pouvez vous inscrire, recevoir des bonus, recharger votre compte et placer des paris en toute simplicite. L’application est egalement concue pour economiser l’energie de votre batterie, consommer moins de trafic internet et offre un menu convivial pour une experience utilisateur optimale.
Pour obtenir le bonus, vous devez copier et entrer le code promotionnel lors de l’inscription sur le site officiel 1xbet.com et puis les bonus seront actives. Le code bonus n’a pas de delai de prescription, vous pouvez l’utiliser quand vous le souhaitez, et grace a lui, vous recevrez un bonus de bienvenue gratuit pour les nouveaux clients. Ainsi, ne manquez pas l’occasion d’utiliser le code promo! De plus, vous savez maintenant ou les trouver. Placez des paris sans risque et gagnez!
Tout d’abord, il faut s’inscrire chez le bookmaker meilleur code promo pour 1xbet : 1XLIVE777 Bonus VIP de 100% jusqu’a 78 000 XOF de bonus de casino sans depot, pouvant atteindre 1500$ et 150 tours gratuits. Ensuite, il suffit d’ajouter de l’argent a son compte et on recevra automatiquement de l’argent gratuit sous forme de bonus. Grace au coupon (code) 1xBet, il est desormais plus facile que jamais de faire des paris gratuits. En utilisant le code 1x Bet, chaque depot effectue permet de recevoir de l’argent gratuit.
Les codes promotionnels proposes au bookmaker 1xBet en bonus d’inscription sont utilises selon le meme algorithme, quelle que soit la methode de creation du compte. La seule difference possible reside dans les specificites de la confirmation du profil. En cas d’enregistrement d’un numero de telephone portable, il est necessaire de le confirmer avant de saisir la combinaison.
Si vous decidez de vous inscrire par e-mail, le bon doit etre utilise a la derniere etape du remplissage du formulaire, juste avant de cliquer sur le bouton “S’inscrire”. Avant cela, vous devez saisir les informations manquantes dans les champs vides pour terminer la procedure. Si vous vous inscrivez en utilisant un reseau social, vous ne pourrez pas appliquer de coupon de bienvenue. Par consequent, il est preferable de choisir une autre methode.
code promo sur 1xbet: 1XLIVE777 pour beneficier d’un bonus sportif gratuit de 100% jusqu’a 130 €/$, en plus du bonus de bienvenue standard de 1950$ et de 150 tours gratuits au casino. Ce code est valable uniquement aujourd’hui, en 2024, dans le menu d’inscription du bookmaker 1xbet. Lorsque vous cliquez sur le bouton “s’inscrire”, vous serez redirige vers un formulaire a remplir. Assurez-vous de specifier le code bonus dans la colonne dediee avant de finaliser votre inscription.
En prime, le bookmaker a inclus la section “Paris rapides” dans son menu. Ici vous pouvez trouver des paris sur 5 jeux interactifs (tirage au sort, fusillade, blackjack, flechettes, bridge). Une fonctionnalite interessante de 1xBet, qui a deja attire de nombreux clients. Notons a nouveau les coefficients 1xbet. Comme le football, ils sont tres decents. La commission est maintenue a 1%. Cet indicateur convient assez bien a la plupart des clients.
Le bonus de bienvenue doit etre active dans un delai de 1 mois a compter de l’inscription, sinon le cadeau brulera. Si vous rechargez votre compte pour moins de 10€, le bonus n’est pas active. L’argent recu a l’aide du bonus de bienvenue doit etre mise a un multiplicateur de X35. Le retrait des fonds sera gele jusqu’a ce que le bonus soit entierement deroule. Ce bonus ne peut etre utilise que pour des paris sportifs uniques, vous ne pouvez pas jouer au casino et collecter des coupons express. L’argent recu ne peut pas etre devisse sur des resultats avec un coefficient inferieur a 1,5. Afin d’obtenir un bonus, le solde doit etre reapprovisionne de la maniere qui vous convient.
Code promo 1xBet gratuit: 1XLIVE777 bonus exclusif pour les paris sportifs allant jusqu’a 100% a 78 000 XOF, ou un bonus pour le casino allant jusqu’a €1950 + 150 tours gratuits. Le code promotionnel actuel est pertinent pour le bookmaker 1xBet lors de l’inscription sur le site officiel. En raison de l’enorme concurrence dans l’industrie des paris, 1xBet augmente constamment le nombre de bonus disponibles, organise des concours interessants et des tirages au sort, et vous permet egalement de faire des paris gratuits. Le code promotionnel de rachat 1xBet est l’une des nombreuses options proposees par le bookmaker pour encourager les joueurs https://popvalais.ch/wp-includes/inc/?code-promo-1xbet-burkina-faso-78-000xof.html.
Ou entrer un code promotionnel 1xBet
Un champ de saisie special est present dans le formulaire d’inscription. Il vous suffit d’entrer le code dans le champ ci-dessus et de suivre les etapes d’inscription. Nous esperons que vous comprenez que l’inscription est un moment crucial et que vous devez remplir tous les champs. Notre travail consiste a vous avertir afin que vous sachiez quoi faire et comment le faire correctement afin que votre compte ne rencontre pas de problemes a l’avenir. Ce ne sont que les regles de base pour l’enregistrement.
code promo 1xbet gabon: 1XLIVE777 pour un bonus de bienvenue de 100% jusqu’a €130. Lors de votre inscription, saisissez le code bonus pour profiter de l’offre exclusive 1xBet. Utilisez le code bonus 1xBet dans le champ d’inscription en 2024 et accedez a toutes les sections disponibles. Vous pouvez effectivement obtenir le bonus de bienvenue en utilisant l’apk 1xbet. Telechargez l’apk pour profiter du code promo 1xbet et recevoir un bonus de €/$130 lors de votre inscription.
Le code promotionnel pour l’inscription a 1xBet aujourd’hui est un bonus de depart pour les nouveaux clients du bookmaker, qui vous permet d’augmenter le montant du premier depot, d’obtenir des paris gratuits (paris gratuits) et d’autres incitations de la part de l’entreprise. Il n’y a pas de difficultes particulieres a obtenir des bonus de BK. En outre, le portail propose de nombreux autres bonus, promotions et tirages au sort que vous pouvez utiliser avec un code promo 1xBet valide 2024.
Apres avoir verifie le code promo 1xBet, vous pourrez vous familiariser avec ses termes et conditions. Pour ce faire, dans la section “Affichage du code promotionnel”, il existe un champ special dans lequel vous devez inserer l’ensemble de chiffres et de lettres resultant pour obtenir des informations detaillees. Pour verifier les combinaisons, connectez-vous a votre compte personnel. En cliquant sur le bouton” Afficher le code promotionnel 1xBet”, vous recevrez une description detaillee des conditions de mise, du montant et d’autres parametres.
Le bookmaker 1xBet est tres genereux avec des bonus et des cadeaux, pour l’inscription, vous pouvez obtenir un bonus sans depot – c’est de l’argent gratuit. Toutes les promotions et offres de bonus sont activees grace au code promo – c’est lui qui vous donne des bonus. Si vous voulez augmenter votre argent, alors vous avez choisi le bon site, ici vous pouvez gagner rapidement et facilement. Les cotes les plus elevees dans les paris sportifs, ainsi que les machines a sous les plus populaires qui vous permettent vraiment de gagner de grosses sommes d’argent.
Lors de votre inscription sur 1xBet, n’oubliez pas d’utiliser le code promo: 1XLIVE777 et profiter d’un genereux bonus de 100% pouvant atteindre 78 000 XOF. Grace a ce code, vous pourrez beneficier d’un excellent bonus de bienvenue pouvant atteindre 130€, sous forme de paris gratuits. Peu importe le pays dans lequel vous residez, ce code bonus est valable pour tous les pays et vous accorde un bonus en fonction de votre pays et de votre devise. Si vous vous trouvez pres de Cotonou, vous pouvez egalement creer un code promo 1xBet.
Lisez attentivement le courrier qui arrive a votre adresse e-mail, c’est la que le bookmaker envoie les dernieres offres de bonus. De cette facon, vous serez le premier a connaitre les nouvelles promotions et bonus disponibles chez le bookmaker 1xbet. Vous pouvez ajouter notre site Web a vos favoris et vous aurez alors la possibilite d’avoir toujours des informations a jour sur les bonus et les promotions https://napce.fr/wp-content/pages/1xbet_code_promotionnel_gratuit_bonus_1.html.
Thank you for helping out, great information. “Courage comes and goes. Hold on for the next supply.” by Vicki Baum.
Bonus d’Inscription 1xBet 2024
Le code promo 1xBet – 1XLIVE777 propose aux nouveaux utilisateurs un bonus sportif supplementaire de 100% jusqu’a 130€, en plus du bonus de bienvenue standard de 1950$ et de 150 tours gratuits au casino. Il vous suffit d’entrer le code promo lors de la creation d’un nouveau compte. Les bookmakers proposent des codes promo que les joueurs peuvent utiliser pour obtenir differents bonus. Le code promo 1xBet est specialement concu pour les nouveaux clients. Pour utiliser un code promo 1xbet, il vous suffit de copier le code promotionnel et de vous rendre sur la page du bureau. Ensuite, procedez a votre inscription en entrant le code bonus lors de cette etape.
La societe de paris 1xBet propose a tous les nouveaux utilisateurs un incroyable bonus de 130€ lors de leur inscription. Vous pouvez placer des paris sportifs, jouer aux casinos en ligne, aux machines a sous, au poker, aux cartes de blackjack et a d’autres jeux sur le site Web de 1xbet. Cette offre exclusive est reservee aux nouveaux joueurs qui utilisent un code promo lors de leur inscription pour beneficier du bonus. En visitant le site officiel de 1xbet, vous pouvez obtenir un bonus maximum de 100% en utilisant un code promotionnel secret special qui active toutes les promotions et offres de bonus disponibles aujourd’hui.
Lors de l’inscription, vous pouvez choisir un bonus:
Bonus sportif 200% montant jusqu’a 130 €/$
Bonus de Casino Jusqu’a 1950 €/$ 150 Tours gratuits
Rappelez-vous la chose la plus importante: lors de l’inscription, vous devez specifier toutes les donnees reelles, prenom et nom, ville, numero de telephone professionnel, e-mail et autres champs lors du remplissage. La confirmation du compte peut etre envoyee a la fois a votre numero de telephone et a votre adresse e-mail.
Pour enregistrer un compte 1xbet:
1. Ouvrez le 1xbet.com site web;
2. Cliquez sur le bouton d’inscription;
3. Selectionnez la methode d’inscription;
4. Choisissez votre pays;
5. Choisissez votre devise;
6. Entrez comme Code promotionnel;
7. Cliquez sur”S’inscrire”.
Ensuite, rechargez votre compte pour n’importe quel montant et obtenez de l’argent bonus, maintenant vous pouvez jouer et gagner beaucoup d’argent.
Inscrivez-vous sur le site officiel de meilleur code promo pour 1xbet: 1XLIVE777 pour obtenir un bonus sportif gratuit de 100% jusqu’a 130 €/$, en plus du bonus de bienvenue standard de 1950$ et de 150 tours gratuits au casino. Les societes de jeux offrent regulierement de nouvelles promotions et bonus pour attirer de nouveaux clients. Les codes promotionnels bonus 1xBet sont utilises lors de l’inscription pour augmenter le montant du bonus initial et rendre le processus de trading plus excitant et rentable.
Dans le monde des bookmakers, il existe un code promotionnel. Il s’agit d’une certaine sequence de chiffres et de lettres que le participant recoit lors de son inscription ou de son depot. Si vous l’entrez sur le site Web du bookmaker, vous pouvez obtenir divers bonus. Le plus souvent, il s’agit d’un pari gratuit. Cela vous donne une chance reelle de gagner une somme d’argent substantielle, de mettre en ?uvre des tactiques strategiques ou simplement de tenter votre chance sans risques financiers. Un code promotionnel pour 1xBet vous donne egalement la possibilite de participer a divers tirages au sort et promotions avec des prix de valeur. Tels sont “Roue de la fortune”, “Casino”, “Machines a sous” et autres https://popvalais.ch/wp-includes/inc/?code-promo-1xbet-burkina-faso-78-000xof.html.
1xBet registration promo code: 1XBOX777, to claim the welcome bonus 2024. By entering this promo code during the registration process, players can receive a generous bonus of $130. It is important to note that all the enticing features of the 1xbet bookmaker bonus program are accessible to players only after completing the registration. Even if a player comes across a free promo code on the internet, it will only be beneficial once they have successfully registered.
1xBet 2024, a renowned online bookmaker, provides a wide range of betting options on various sports, with a particular focus on football. Take a glance at the table’s comprehensive list to discover the latest bonuses and the exclusive 1xBet bonus code.
New players can enjoy welcome bonus at 1xBet with the promo code 1XBOX777 https://unored.tv/wp-content/pages/?1xbet_promo_code_419.html. This bonus offers a 100% sports bonus up to $130 or a casino bonus of up to $1950. To take advantage of this offer, make sure to use the 1xBet bonus code: 1XBOX777 during the registration process. Simply log into the website, click on the “Register” button, provide all the necessary information, and finalize the process by selecting the green button. Creating an account at this bookmaker is quick and easy, typically taking only 1-2 minutes.
Players are given a choice of four registration options. Let’s consider each of them in detail:
Registration in 1 click
This option is the simplest, since the player specifies a minimum of information – the country of residence at the time of registration, the game currency. You can also enter a promo code here.
During registration, do not forget to make a choice of a welcome bonus. In this case, we are interested in a welcome bonus for the first deposit for sports.
By default, you need to agree with the rules of the bookmaker, with the privacy policy. By agreeing to the rules, the player confirms his age of majority.
Please make use of the 1xBet promo code: 1XBOX777 when creating a new account at 1xBet to enjoy a 100% bonus up to €/$130 https://magazinetechnologies.com/articles/1xbet_promo_code_420.html. These bonus funds can be used for placing bets on sports and in the 1xBet casino section. Furthermore, there is also a bonus code available for free sports bets. Kindly ensure that your phone number, IP address, and email have not been previously used in the system to comply with the promotion’s terms and conditions.
Authorization of a new account is carried out automatically. The client receives an ID number and password, which are the identifiers of the new account. After logging into your personal account, it is recommended to change your password, fill out a questionnaire in your personal profile, specifying your mobile number and email address. This information will be required for subsequent verification, which is a mandatory procedure.
Registration by mobile number
The promo code 1xBet “1XBOX777”, valid until 2024, allows you to enjoy a 100% welcome bonus up to 130$. Another useful tip is to follow brands on social media https://magazinetechnologies.com/articles/1xbet_promo_code_420.html. Often, brands offer free promo codes on their social media profiles as part of a contest, private sale, or limited-time promotion.
This time the player will have to specify the country of residence, the currency of the account, his mobile phone number. If you have a promo code, you should enter it in the appropriate form. Again, the main thing is not to forget to specify what kind of welcome bonus you are interested in.
Again, the user needs to agree with the rules of the office, confirm the compliance of the age with the established age limit.
An SMS code is sent to the specified number, which must be entered in the form as confirmation. After that, the account is authorized. After accessing the personal account, the player must come up with a password and fill out the appropriate questionnaire.
As soon as the registration is over, you can make a deposit, receive bonuses and start betting.
Registration via email
When registering your new 1xbet account, remember to enter the promo code “1XBOX777” in the designated section. By doing so, you can enhance your initial 100% deposit bonus to a remarkable 130%, allowing you to enjoy a maximum welcome offer of €130. After filling in your personal information and making your deposit, you will receive an additional 100% first deposit bonus. To access your account details, simply click on the My Account icon and navigate to the bet history section. The 1xBet coupon code can be found in the top right corner of the bet slip tab.
Бонус приветствия в Betwinner предоставляет игрокам возможность получить дополнительные средства на свой игровой счет. Этот бонус составляет 100% от суммы первого депозита, который игрок вносит на свой счет. Например, если новый клиент пополнил свой счет на 10 евро, то ему будет начислено еще 10 евро в качестве бонуса.
http://gazdynka.ukrbb.net/viewtopic.php?f=3&t=3188&p=7177#p7177
You’re so awesome! I don’t believe I have read a single thing like that before. So great to find someone with some original thoughts on this topic. Really.. thank you for starting this up. This website is something that is needed on the internet, someone with a little originality!
Узнай все про промокод 1xBet на сегодня. Используй при регистрации действующий промокод 1хБет и получай бонус за первый депозит до 32500р. Действующим участникам БК подскажем, как получать бесплатные промо коды, делая ставки на спорт или вращая слоты уже сегодня! Но обо всем по порядку. Регистрация в 2024 году — 1хбет промокод при регистрации на сегодня. Часто задаваемые вопросы по регистрации и учетной записи у букмекера 1xbet. Активация промокода 1xbet на сегодня. Разнообразие бонусных предложений от 1xbet — другие типы бонусов и промокодов для игроков. Промокод 1xbet на День Рождения. Фрибеты или бесплатные ставки. Тото-промокоды 1xbet. Промокоды 1xbet у блогеров. Система промокодов при регистрации позволяет новым игрокам букмекерской конторы 1xbet получать внушительные бонусные суммы к своему первому депозиту. Обратите внимание, что это не промокод на ставку, а именно на регистрацию. Рабочие промокоды 1хбет на сегодня: Вид бонуса. Размер бонуса – более подробно в этом материале https://fontanvazon.ru/jscripts/pgs/zagolovok_kak_plastikovye_okna_vliyayut_na_komfort_v_dome.html
Hello.This article was really motivating, particularly since I was browsing for thoughts on this topic last Saturday.
best porn in hd gghkyogg.13zx8svDFpe
free download full hd porn videos ggjennifegg.jOPXOGOnhuD
hd por.com ggjinnysflogg.dX9YtCGrCGY
Бездепозитный Бонус 1win 2024
Бонусы от казино как в 1win ввести промокод1Win 2024 – Бездепозитные бонусы ? Коды на возврат денег ? VIP Программа лояльности ? Бесплатные фриспины.
как написать промокод в 1win: 937999 предоставляет новым игрокам бонус 500% для игры в слоты и игровые автоматы, максимальная сумма бонуса 200 000 рублей. Вы можете использовать бонусные деньги в разделе азартных игр, включая онлайн казино, карты, рулетку, игровые автоматы и слоты.
Компания «1Win» рада предложить своим новым клиентам приветственный бонус в размере до 500% на первые четыре депозита. Это выгодное предложение доступно сразу после регистрации в нашей букмекерской конторе. Бонус можно получить не только в рублях, но и в других валютах, при этом он не ограничивает возможность участия игроков в других программам лояльности компании. Максимальная сумма вознаграждения за регистрацию составляет 75000 рублей или эквивалентная сумма в другой валюте.
промокод 1win при регистрации 2024 приносят игрокам множество преимуществ. Во-первых, они позволяют увеличить начальную ставку или продлить время игры. Кроме того, они дают возможность попробовать различные игры без риска потерять реальные деньги. Бонусы также повышают шансы на выигрыш и предоставляют дополнительные возможности для получения прибыли. Кроме того, бонусы в 1win могут быть обменены на реальные деньги или использованы для участия в специальных акциях и турнирах.
Преимущества получения и использования бонусов в 1win очевидны. Они позволяют игроку расширить свои возможности и получить больше удовольствия от игры. Бонусы также делают игру более выгодной с финансовой точки зрения, помогая уменьшить риски и увеличить потенциальную прибыль. Кроме того, получение и использование бонусов в 1win открывает возможность стать лояльным клиентом и получить дополнительные привилегии и вознаграждения от казино.
Итак, получение бонусов в 1win – это отличная возможность для игрока увеличить свои шансы на выигрыш, получить дополнительные деньги и улучшить свой игровой опыт. Бонусы делают игру более интересной и выгодной.
промокод при регистрации 1win: 937999 предоставляет возможность получить бездепозитный бонус 2024. Его можно получить в виде фриспинов или фрибетов. Чтобы получить подарок, необходимо активировать код в личном кабинете. Дополнительный депозит не требуется. Размеры подарков невелики: фрибет до 500 рублей и не более 70 фриспинов для игры в слоты. Как и в случае с другими поощрениями, необходимо отыграть бездепозитный бонус. Вейджер, как правило, не превышает х5 для бесплатных ставок и х30 для фриспинов.
В казино 1win предоставляется внушительный бонус при регистрации, который составляет 500% от суммы первых четырех последовательных депозитов клиента. С таким количеством бонусов новичок может значительно увеличить свои шансы на выигрыш. Чтобы получить этот приветственный бонус, необходимо зарегистрироваться на официальном сайте, рабочем зеркале, мобильной версии или приложениях для мобильных телефонов. Однако, основным условием является совершение первого пополнения счета, так как активировать бонусы 1win можно только после этого.
1win промокод на сегодня: 937999 используйте бонусный код при регистрации и получите бездепозтный бонус 70 фриспинов. Да, при использовании кода 1Win вы можете получить различные поощрения, включая бездепозитные бонусы. Они обычно представлены в виде фрибетов или фриспинов. Для их активации не требуется дополнительное пополнение счета. Размер таких подарков невелик: бесплатных вращений не более 70. Вейджер на бездепозитный бонус обычно не превышает х35. В 1Win вы можете получить бонусы за участие в акциях, турнирах, розыгрышах и активацию промокода. Бонусная программа периодически обновляется. Кроме того, некоторые акции имеют сезонный характер.
В 1Win основная бонусная программа включает в себя фриспины. Чтобы получить 70FS, необходимо пополнить счет на 100 рублей или более. Игроку предоставляется 2 дня с момента регистрации для активации презента. Отыгрыш бонуса должен быть выполнен в течение 24 часов с момента начисления, с вейджером х35. Бесплатные вращения предназначены только для игр провайдера Microgaming.
Так как бонусная программа 1Win регулярно обновляется, список акций, в которых можно получить фриспины, постоянно расширяется. Более подробную информацию о них можно найти на нашем сайте.
Промокод на 1Win дает возможность получить бесплатные вращения. Их можно использовать в любых слотах из каталога казино. Иногда могут быть установлены ограничения, которые предусматривают использование фриспинов только в определенных слотах или играх конкретного провайдера. Фриспины начисляются с фиксированной ставкой. Отыгрыш выигрыша, полученного с помощью бесплатных вращений, обязателен с учетом установленного вейджера.
Вся информация взята с сайта; https://03ekb.ru/news/promokod_350.html
Hey! Quick question that’s completely off
topic. Do you know how to make your site
mobile friendly? My web site looks weird when viewing from my iphone4.
I’m trying to find a template or plugin that might be able
to fix this issue. If you have any recommendations, please share.
Cheers! I saw similar here: Sklep internetowy
Бездепозитный Бонус 1win 2024
Бонусы от казино как ввести промокод в 1win1Win 2024 – Бездепозитные бонусы ? Коды на возврат денег ? VIP Программа лояльности ? Бесплатные фриспины.
промокоды 1win на пополнение: 937999 предоставляет новым игрокам бонус 500% для игры в слоты и игровые автоматы, максимальная сумма бонуса 200 000 рублей. Вы можете использовать бонусные деньги в разделе азартных игр, включая онлайн казино, карты, рулетку, игровые автоматы и слоты.
Компания «1Win» рада предложить своим новым клиентам приветственный бонус в размере до 500% на первые четыре депозита. Это выгодное предложение доступно сразу после регистрации в нашей букмекерской конторе. Бонус можно получить не только в рублях, но и в других валютах, при этом он не ограничивает возможность участия игроков в других программам лояльности компании. Максимальная сумма вознаграждения за регистрацию составляет 75000 рублей или эквивалентная сумма в другой валюте.
промокод на 1вин приносят игрокам множество преимуществ. Во-первых, они позволяют увеличить начальную ставку или продлить время игры. Кроме того, они дают возможность попробовать различные игры без риска потерять реальные деньги. Бонусы также повышают шансы на выигрыш и предоставляют дополнительные возможности для получения прибыли. Кроме того, бонусы в 1win могут быть обменены на реальные деньги или использованы для участия в специальных акциях и турнирах.
Преимущества получения и использования бонусов в 1win очевидны. Они позволяют игроку расширить свои возможности и получить больше удовольствия от игры. Бонусы также делают игру более выгодной с финансовой точки зрения, помогая уменьшить риски и увеличить потенциальную прибыль. Кроме того, получение и использование бонусов в 1win открывает возможность стать лояльным клиентом и получить дополнительные привилегии и вознаграждения от казино.
Итак, получение бонусов в 1win – это отличная возможность для игрока увеличить свои шансы на выигрыш, получить дополнительные деньги и улучшить свой игровой опыт. Бонусы делают игру более интересной и выгодной.
промокод на 1win на деньги: 937999 предоставляет возможность получить бездепозитный бонус 2024. Его можно получить в виде фриспинов или фрибетов. Чтобы получить подарок, необходимо активировать код в личном кабинете. Дополнительный депозит не требуется. Размеры подарков невелики: фрибет до 500 рублей и не более 70 фриспинов для игры в слоты. Как и в случае с другими поощрениями, необходимо отыграть бездепозитный бонус. Вейджер, как правило, не превышает х5 для бесплатных ставок и х30 для фриспинов.
В казино 1win предоставляется внушительный бонус при регистрации, который составляет 500% от суммы первых четырех последовательных депозитов клиента. С таким количеством бонусов новичок может значительно увеличить свои шансы на выигрыш. Чтобы получить этот приветственный бонус, необходимо зарегистрироваться на официальном сайте, рабочем зеркале, мобильной версии или приложениях для мобильных телефонов. Однако, основным условием является совершение первого пополнения счета, так как активировать бонусы 1win можно только после этого.
1win промокод бонус за регистрацию: 937999 используйте бонусный код при регистрации и получите бездепозтный бонус 70 фриспинов. Да, при использовании кода 1Win вы можете получить различные поощрения, включая бездепозитные бонусы. Они обычно представлены в виде фрибетов или фриспинов. Для их активации не требуется дополнительное пополнение счета. Размер таких подарков невелик: бесплатных вращений не более 70. Вейджер на бездепозитный бонус обычно не превышает х35. В 1Win вы можете получить бонусы за участие в акциях, турнирах, розыгрышах и активацию промокода. Бонусная программа периодически обновляется. Кроме того, некоторые акции имеют сезонный характер.
В 1Win основная бонусная программа включает в себя фриспины. Чтобы получить 70FS, необходимо пополнить счет на 100 рублей или более. Игроку предоставляется 2 дня с момента регистрации для активации презента. Отыгрыш бонуса должен быть выполнен в течение 24 часов с момента начисления, с вейджером х35. Бесплатные вращения предназначены только для игр провайдера Microgaming.
Так как бонусная программа 1Win регулярно обновляется, список акций, в которых можно получить фриспины, постоянно расширяется. Более подробную информацию о них можно найти на нашем сайте.
Промокод на 1Win дает возможность получить бесплатные вращения. Их можно использовать в любых слотах из каталога казино. Иногда могут быть установлены ограничения, которые предусматривают использование фриспинов только в определенных слотах или играх конкретного провайдера. Фриспины начисляются с фиксированной ставкой. Отыгрыш выигрыша, полученного с помощью бесплатных вращений, обязателен с учетом установленного вейджера.
Вся информация взята с сайта; http://grand-medicine.ru/application/list/?1win_promokod_5.html
Бездепозитный Бонус 1win 2024
Бонусы от казино промокод 1win при регистрации бездепозитный бонус1Win 2024 – Бездепозитные бонусы ? Коды на возврат денег ? VIP Программа лояльности ? Бесплатные фриспины.
промокоды 1win при регистрации: 937999 предоставляет новым игрокам бонус 500% для игры в слоты и игровые автоматы, максимальная сумма бонуса 200 000 рублей. Вы можете использовать бонусные деньги в разделе азартных игр, включая онлайн казино, карты, рулетку, игровые автоматы и слоты.
Компания «1Win» рада предложить своим новым клиентам приветственный бонус в размере до 500% на первые четыре депозита. Это выгодное предложение доступно сразу после регистрации в нашей букмекерской конторе. Бонус можно получить не только в рублях, но и в других валютах, при этом он не ограничивает возможность участия игроков в других программам лояльности компании. Максимальная сумма вознаграждения за регистрацию составляет 75000 рублей или эквивалентная сумма в другой валюте.
промокод 1win на сегодня при пополнение приносят игрокам множество преимуществ. Во-первых, они позволяют увеличить начальную ставку или продлить время игры. Кроме того, они дают возможность попробовать различные игры без риска потерять реальные деньги. Бонусы также повышают шансы на выигрыш и предоставляют дополнительные возможности для получения прибыли. Кроме того, бонусы в 1win могут быть обменены на реальные деньги или использованы для участия в специальных акциях и турнирах.
Преимущества получения и использования бонусов в 1win очевидны. Они позволяют игроку расширить свои возможности и получить больше удовольствия от игры. Бонусы также делают игру более выгодной с финансовой точки зрения, помогая уменьшить риски и увеличить потенциальную прибыль. Кроме того, получение и использование бонусов в 1win открывает возможность стать лояльным клиентом и получить дополнительные привилегии и вознаграждения от казино.
Итак, получение бонусов в 1win – это отличная возможность для игрока увеличить свои шансы на выигрыш, получить дополнительные деньги и улучшить свой игровой опыт. Бонусы делают игру более интересной и выгодной.
промокоды на депозит 1win: 937999 предоставляет возможность получить бездепозитный бонус 2024. Его можно получить в виде фриспинов или фрибетов. Чтобы получить подарок, необходимо активировать код в личном кабинете. Дополнительный депозит не требуется. Размеры подарков невелики: фрибет до 500 рублей и не более 70 фриспинов для игры в слоты. Как и в случае с другими поощрениями, необходимо отыграть бездепозитный бонус. Вейджер, как правило, не превышает х5 для бесплатных ставок и х30 для фриспинов.
В казино 1win предоставляется внушительный бонус при регистрации, который составляет 500% от суммы первых четырех последовательных депозитов клиента. С таким количеством бонусов новичок может значительно увеличить свои шансы на выигрыш. Чтобы получить этот приветственный бонус, необходимо зарегистрироваться на официальном сайте, рабочем зеркале, мобильной версии или приложениях для мобильных телефонов. Однако, основным условием является совершение первого пополнения счета, так как активировать бонусы 1win можно только после этого.
промокод 1вин при регистрации на сегодня: 937999 используйте бонусный код при регистрации и получите бездепозтный бонус 70 фриспинов. Да, при использовании кода 1Win вы можете получить различные поощрения, включая бездепозитные бонусы. Они обычно представлены в виде фрибетов или фриспинов. Для их активации не требуется дополнительное пополнение счета. Размер таких подарков невелик: бесплатных вращений не более 70. Вейджер на бездепозитный бонус обычно не превышает х35. В 1Win вы можете получить бонусы за участие в акциях, турнирах, розыгрышах и активацию промокода. Бонусная программа периодически обновляется. Кроме того, некоторые акции имеют сезонный характер.
В 1Win основная бонусная программа включает в себя фриспины. Чтобы получить 70FS, необходимо пополнить счет на 100 рублей или более. Игроку предоставляется 2 дня с момента регистрации для активации презента. Отыгрыш бонуса должен быть выполнен в течение 24 часов с момента начисления, с вейджером х35. Бесплатные вращения предназначены только для игр провайдера Microgaming.
Так как бонусная программа 1Win регулярно обновляется, список акций, в которых можно получить фриспины, постоянно расширяется. Более подробную информацию о них можно найти на нашем сайте.
Промокод на 1Win дает возможность получить бесплатные вращения. Их можно использовать в любых слотах из каталога казино. Иногда могут быть установлены ограничения, которые предусматривают использование фриспинов только в определенных слотах или играх конкретного провайдера. Фриспины начисляются с фиксированной ставкой. Отыгрыш выигрыша, полученного с помощью бесплатных вращений, обязателен с учетом установленного вейджера.
Вся информация взята с сайта; https://www.glory-gallery.ru/wp-includes/inc/1win_promokod_5.html
Бездепозитный Бонус 1win 2024
Бонусы от казино промокоды на 1win1Win 2024 – Бездепозитные бонусы ? Коды на возврат денег ? VIP Программа лояльности ? Бесплатные фриспины.
как ввести промокод в 1win если уже зарегистрирован: 937999 предоставляет новым игрокам бонус 500% для игры в слоты и игровые автоматы, максимальная сумма бонуса 200 000 рублей. Вы можете использовать бонусные деньги в разделе азартных игр, включая онлайн казино, карты, рулетку, игровые автоматы и слоты.
Компания «1Win» рада предложить своим новым клиентам приветственный бонус в размере до 500% на первые четыре депозита. Это выгодное предложение доступно сразу после регистрации в нашей букмекерской конторе. Бонус можно получить не только в рублях, но и в других валютах, при этом он не ограничивает возможность участия игроков в других программам лояльности компании. Максимальная сумма вознаграждения за регистрацию составляет 75000 рублей или эквивалентная сумма в другой валюте.
промокод бк 1win приносят игрокам множество преимуществ. Во-первых, они позволяют увеличить начальную ставку или продлить время игры. Кроме того, они дают возможность попробовать различные игры без риска потерять реальные деньги. Бонусы также повышают шансы на выигрыш и предоставляют дополнительные возможности для получения прибыли. Кроме того, бонусы в 1win могут быть обменены на реальные деньги или использованы для участия в специальных акциях и турнирах.
Преимущества получения и использования бонусов в 1win очевидны. Они позволяют игроку расширить свои возможности и получить больше удовольствия от игры. Бонусы также делают игру более выгодной с финансовой точки зрения, помогая уменьшить риски и увеличить потенциальную прибыль. Кроме того, получение и использование бонусов в 1win открывает возможность стать лояльным клиентом и получить дополнительные привилегии и вознаграждения от казино.
Итак, получение бонусов в 1win – это отличная возможность для игрока увеличить свои шансы на выигрыш, получить дополнительные деньги и улучшить свой игровой опыт. Бонусы делают игру более интересной и выгодной.
1win ввести промокод: 937999 предоставляет возможность получить бездепозитный бонус 2024. Его можно получить в виде фриспинов или фрибетов. Чтобы получить подарок, необходимо активировать код в личном кабинете. Дополнительный депозит не требуется. Размеры подарков невелики: фрибет до 500 рублей и не более 70 фриспинов для игры в слоты. Как и в случае с другими поощрениями, необходимо отыграть бездепозитный бонус. Вейджер, как правило, не превышает х5 для бесплатных ставок и х30 для фриспинов.
В казино 1win предоставляется внушительный бонус при регистрации, который составляет 500% от суммы первых четырех последовательных депозитов клиента. С таким количеством бонусов новичок может значительно увеличить свои шансы на выигрыш. Чтобы получить этот приветственный бонус, необходимо зарегистрироваться на официальном сайте, рабочем зеркале, мобильной версии или приложениях для мобильных телефонов. Однако, основным условием является совершение первого пополнения счета, так как активировать бонусы 1win можно только после этого.
промокоды 1win при регистрации 2024: 937999 используйте бонусный код при регистрации и получите бездепозтный бонус 70 фриспинов. Да, при использовании кода 1Win вы можете получить различные поощрения, включая бездепозитные бонусы. Они обычно представлены в виде фрибетов или фриспинов. Для их активации не требуется дополнительное пополнение счета. Размер таких подарков невелик: бесплатных вращений не более 70. Вейджер на бездепозитный бонус обычно не превышает х35. В 1Win вы можете получить бонусы за участие в акциях, турнирах, розыгрышах и активацию промокода. Бонусная программа периодически обновляется. Кроме того, некоторые акции имеют сезонный характер.
В 1Win основная бонусная программа включает в себя фриспины. Чтобы получить 70FS, необходимо пополнить счет на 100 рублей или более. Игроку предоставляется 2 дня с момента регистрации для активации презента. Отыгрыш бонуса должен быть выполнен в течение 24 часов с момента начисления, с вейджером х35. Бесплатные вращения предназначены только для игр провайдера Microgaming.
Так как бонусная программа 1Win регулярно обновляется, список акций, в которых можно получить фриспины, постоянно расширяется. Более подробную информацию о них можно найти на нашем сайте.
Промокод на 1Win дает возможность получить бесплатные вращения. Их можно использовать в любых слотах из каталога казино. Иногда могут быть установлены ограничения, которые предусматривают использование фриспинов только в определенных слотах или играх конкретного провайдера. Фриспины начисляются с фиксированной ставкой. Отыгрыш выигрыша, полученного с помощью бесплатных вращений, обязателен с учетом установленного вейджера.
Вся информация взята с сайта; https://www.legnostyle.ru/images/pages/?1win_promokod_5.html
Wow, wonderful weblog format! How lengthy have you ever been blogging for?
you make blogging glance easy. The entire glance of your website is great, let
alone the content material! You can see similar here sklep
Very good written post. It will be valuable to everyone who usess it, as well as myself. Keep doing what you are doing – for sure i will check out more posts.
Wow, incredible weblog structure! How long have you ever been running a
blog for? you make blogging glance easy. The whole glance of your website is magnificent, let alone the content material!
You can see similar here dobry sklep
Промокод при регистрации 1xbet на 32500 рублей. Данный промокод 1хбет нужно ввести при регистрации в соответствующее поле. 1Xbet промокод при регистрации можно использовать только 1н раз в рамках одной учетной записи, но вы можете делиться им со своими друзьями. В 1xБет регистрация по номеру телефона является бесплатным и вторым по простоте способом создать личный аккаунт. Данный способ предусматривает наличие мобильного устройства, а также активной сим-карты, чтобы пользователь мог получить сообщение, в котором его будут ждать данные для входа. После того, как данные будут получены, останется ввести логин с паролем в соответствующие поля. Воспользуйся промокоды 1xbet на фриспины, получи бесплатную возможность увеличить свой первый депозит до 32500 рублей в БК 1xBet. Промокоды 1xBET актуальные сегодня. На игровой платформе БК «1xbet» функционирует бонусная программа, способствующая привлечению новых игроков и мотивации делать больше ставок для зарегистрированных пользователей. Бонусная программа содержит множество различных бонусов, которые каппер может активировать при помощи специальных промокодов. 130% бонус от первого депозита на ставки. Получай бонус до 130%, но не превышающий 32500 рублей на ставки от 1xbet. Переходим на сайт букмекера – более подробно в этом материале https://webmineral.ru/upload/pages/?1xbet_promokod_2021-segodnya-bonus.html
I don’t even know how I ended up here, but I thought this post was good.
I do not know who you are but certainly you are going to a famous blogger if you aren’t already ;
) Cheers! I saw similar here: Ecommerce
I’ve been surfing online greater than 3 hours these days,
yet I never discovered any attention-grabbing article
like yours. It is beautiful price enough for me.
Personally, if all webmasters and bloggers made good content material as you did, the web can be much more useful than ever before.
I saw similar here: Sklep
Слоты и онлайн-игры в казино способны разнообразить жизнь человека. Важно только правильно выбрать площадку — она должна быстро и честно выплачивать выигрыши, надежно хранить персональные данные клиентов, предлагать большой ассортимент развлечений и интересную бонусную программу. Важную роль играют также наличие адаптированной мобильной версии и приложений. https://enic-kazakhstan.kz/
Wow, awesome weblog layout! How lengthy have you ever been blogging for?
you make blogging look easy. The entire look of your website is great, let
alone the content! You can see similar here ecommerce
Wow, awesome blog format! How lengthy have you ever been blogging for?
you made running a blog glance easy. The overall glance
of your website is fantastic, as well as the content!
You can see similar here sklep internetowy
Бездепозитный Бонус 1win 2024
Бонусы от казино 1вин промокоды1Win 2024 – Бездепозитные бонусы ? Коды на возврат денег ? VIP Программа лояльности ? Бесплатные фриспины.
промокод на 10 рублей 1win: 937999 предоставляет новым игрокам бонус 500% для игры в слоты и игровые автоматы, максимальная сумма бонуса 200 000 рублей. Вы можете использовать бонусные деньги в разделе азартных игр, включая онлайн казино, карты, рулетку, игровые автоматы и слоты.
Компания «1Win» рада предложить своим новым клиентам приветственный бонус в размере до 500% на первые четыре депозита. Это выгодное предложение доступно сразу после регистрации в нашей букмекерской конторе. Бонус можно получить не только в рублях, но и в других валютах, при этом он не ограничивает возможность участия игроков в других программам лояльности компании. Максимальная сумма вознаграждения за регистрацию составляет 75000 рублей или эквивалентная сумма в другой валюте.
1вин промокод 1win приносят игрокам множество преимуществ. Во-первых, они позволяют увеличить начальную ставку или продлить время игры. Кроме того, они дают возможность попробовать различные игры без риска потерять реальные деньги. Бонусы также повышают шансы на выигрыш и предоставляют дополнительные возможности для получения прибыли. Кроме того, бонусы в 1win могут быть обменены на реальные деньги или использованы для участия в специальных акциях и турнирах.
Преимущества получения и использования бонусов в 1win очевидны. Они позволяют игроку расширить свои возможности и получить больше удовольствия от игры. Бонусы также делают игру более выгодной с финансовой точки зрения, помогая уменьшить риски и увеличить потенциальную прибыль. Кроме того, получение и использование бонусов в 1win открывает возможность стать лояльным клиентом и получить дополнительные привилегии и вознаграждения от казино.
Итак, получение бонусов в 1win – это отличная возможность для игрока увеличить свои шансы на выигрыш, получить дополнительные деньги и улучшить свой игровой опыт. Бонусы делают игру более интересной и выгодной.
где вводить промокод в 1win: 937999 предоставляет возможность получить бездепозитный бонус 2024. Его можно получить в виде фриспинов или фрибетов. Чтобы получить подарок, необходимо активировать код в личном кабинете. Дополнительный депозит не требуется. Размеры подарков невелики: фрибет до 500 рублей и не более 70 фриспинов для игры в слоты. Как и в случае с другими поощрениями, необходимо отыграть бездепозитный бонус. Вейджер, как правило, не превышает х5 для бесплатных ставок и х30 для фриспинов.
В казино 1win предоставляется внушительный бонус при регистрации, который составляет 500% от суммы первых четырех последовательных депозитов клиента. С таким количеством бонусов новичок может значительно увеличить свои шансы на выигрыш. Чтобы получить этот приветственный бонус, необходимо зарегистрироваться на официальном сайте, рабочем зеркале, мобильной версии или приложениях для мобильных телефонов. Однако, основным условием является совершение первого пополнения счета, так как активировать бонусы 1win можно только после этого.
промокоды для 1win при регистрации: 937999 используйте бонусный код при регистрации и получите бездепозтный бонус 70 фриспинов. Да, при использовании кода 1Win вы можете получить различные поощрения, включая бездепозитные бонусы. Они обычно представлены в виде фрибетов или фриспинов. Для их активации не требуется дополнительное пополнение счета. Размер таких подарков невелик: бесплатных вращений не более 70. Вейджер на бездепозитный бонус обычно не превышает х35. В 1Win вы можете получить бонусы за участие в акциях, турнирах, розыгрышах и активацию промокода. Бонусная программа периодически обновляется. Кроме того, некоторые акции имеют сезонный характер.
В 1Win основная бонусная программа включает в себя фриспины. Чтобы получить 70FS, необходимо пополнить счет на 100 рублей или более. Игроку предоставляется 2 дня с момента регистрации для активации презента. Отыгрыш бонуса должен быть выполнен в течение 24 часов с момента начисления, с вейджером х35. Бесплатные вращения предназначены только для игр провайдера Microgaming.
Так как бонусная программа 1Win регулярно обновляется, список акций, в которых можно получить фриспины, постоянно расширяется. Более подробную информацию о них можно найти на нашем сайте.
Промокод на 1Win дает возможность получить бесплатные вращения. Их можно использовать в любых слотах из каталога казино. Иногда могут быть установлены ограничения, которые предусматривают использование фриспинов только в определенных слотах или играх конкретного провайдера. Фриспины начисляются с фиксированной ставкой. Отыгрыш выигрыша, полученного с помощью бесплатных вращений, обязателен с учетом установленного вейджера.
Вся информация взята с сайта; https://fundament-spb.ru/pages/promokod_362.html
Бездепозитный Бонус 1win 2024
Бонусы от казино 1win ввести промокод1Win 2024 – Бездепозитные бонусы ? Коды на возврат денег ? VIP Программа лояльности ? Бесплатные фриспины.
промокод для 1вин: 937999 предоставляет новым игрокам бонус 500% для игры в слоты и игровые автоматы, максимальная сумма бонуса 200 000 рублей. Вы можете использовать бонусные деньги в разделе азартных игр, включая онлайн казино, карты, рулетку, игровые автоматы и слоты.
Компания «1Win» рада предложить своим новым клиентам приветственный бонус в размере до 500% на первые четыре депозита. Это выгодное предложение доступно сразу после регистрации в нашей букмекерской конторе. Бонус можно получить не только в рублях, но и в других валютах, при этом он не ограничивает возможность участия игроков в других программам лояльности компании. Максимальная сумма вознаграждения за регистрацию составляет 75000 рублей или эквивалентная сумма в другой валюте.
промокод на 1win при регистрации на деньги приносят игрокам множество преимуществ. Во-первых, они позволяют увеличить начальную ставку или продлить время игры. Кроме того, они дают возможность попробовать различные игры без риска потерять реальные деньги. Бонусы также повышают шансы на выигрыш и предоставляют дополнительные возможности для получения прибыли. Кроме того, бонусы в 1win могут быть обменены на реальные деньги или использованы для участия в специальных акциях и турнирах.
Преимущества получения и использования бонусов в 1win очевидны. Они позволяют игроку расширить свои возможности и получить больше удовольствия от игры. Бонусы также делают игру более выгодной с финансовой точки зрения, помогая уменьшить риски и увеличить потенциальную прибыль. Кроме того, получение и использование бонусов в 1win открывает возможность стать лояльным клиентом и получить дополнительные привилегии и вознаграждения от казино.
Итак, получение бонусов в 1win – это отличная возможность для игрока увеличить свои шансы на выигрыш, получить дополнительные деньги и улучшить свой игровой опыт. Бонусы делают игру более интересной и выгодной.
промокод 1вин на сегодня: 937999 предоставляет возможность получить бездепозитный бонус 2024. Его можно получить в виде фриспинов или фрибетов. Чтобы получить подарок, необходимо активировать код в личном кабинете. Дополнительный депозит не требуется. Размеры подарков невелики: фрибет до 500 рублей и не более 70 фриспинов для игры в слоты. Как и в случае с другими поощрениями, необходимо отыграть бездепозитный бонус. Вейджер, как правило, не превышает х5 для бесплатных ставок и х30 для фриспинов.
В казино 1win предоставляется внушительный бонус при регистрации, который составляет 500% от суммы первых четырех последовательных депозитов клиента. С таким количеством бонусов новичок может значительно увеличить свои шансы на выигрыш. Чтобы получить этот приветственный бонус, необходимо зарегистрироваться на официальном сайте, рабочем зеркале, мобильной версии или приложениях для мобильных телефонов. Однако, основным условием является совершение первого пополнения счета, так как активировать бонусы 1win можно только после этого.
1win где ввести промокод: 937999 используйте бонусный код при регистрации и получите бездепозтный бонус 70 фриспинов. Да, при использовании кода 1Win вы можете получить различные поощрения, включая бездепозитные бонусы. Они обычно представлены в виде фрибетов или фриспинов. Для их активации не требуется дополнительное пополнение счета. Размер таких подарков невелик: бесплатных вращений не более 70. Вейджер на бездепозитный бонус обычно не превышает х35. В 1Win вы можете получить бонусы за участие в акциях, турнирах, розыгрышах и активацию промокода. Бонусная программа периодически обновляется. Кроме того, некоторые акции имеют сезонный характер.
В 1Win основная бонусная программа включает в себя фриспины. Чтобы получить 70FS, необходимо пополнить счет на 100 рублей или более. Игроку предоставляется 2 дня с момента регистрации для активации презента. Отыгрыш бонуса должен быть выполнен в течение 24 часов с момента начисления, с вейджером х35. Бесплатные вращения предназначены только для игр провайдера Microgaming.
Так как бонусная программа 1Win регулярно обновляется, список акций, в которых можно получить фриспины, постоянно расширяется. Более подробную информацию о них можно найти на нашем сайте.
Промокод на 1Win дает возможность получить бесплатные вращения. Их можно использовать в любых слотах из каталога казино. Иногда могут быть установлены ограничения, которые предусматривают использование фриспинов только в определенных слотах или играх конкретного провайдера. Фриспины начисляются с фиксированной ставкой. Отыгрыш выигрыша, полученного с помощью бесплатных вращений, обязателен с учетом установленного вейджера.
Вся информация взята с сайта; https://fundament-spb.ru/pages/promokod_362.html
Список бесплатных промокодов 1xBet. Получи максимальный бонус при регистрации на сайте и в приложении! +100% к первому депозиту для всех новых игроков. Указанный выше промо-код дает новым игрокам возможность получить повышенный на 30% bonus. Как получить и использовать бонус 32500 рублей по промо-коду букмекерской компании 1хБет? Рабочие промокоды 1xBet при регистрации на официальном сайте компании. 1хбет промокод при регистрации на сегодня бесплатно. Актуальный Промо-Коды 1 Икс Бет на 2024 год – это возможность сделать бесплатную ставку на сумму, которая указана в промокоде. Содержание: Где найти промокод 1xbet на сегодня бесплатно. Букмекерская контора 1 Икс Бет только новым людям дает бонус при пополнени. Чем полезный промокод на 1xbet. На какие виды спорта можно взять промокоды в 1 xbet. Как проверить промокод на 1хбет. Использовать его необходимо при регистрации на официальном сайте конторы 1xbet (а промокоды для купона при пари, находятся в самом низу статьи) – более подробно в этом материале https://fotozayka.ru/wp-content/pages/promokod_240.html
It’s very interesting! If you need help, look here: ARA Agency
Бездепозитный Бонус 1win 2024
Бонусы от казино промокоды на регистрацию 1win1Win 2024 – Бездепозитные бонусы ? Коды на возврат денег ? VIP Программа лояльности ? Бесплатные фриспины.
промокоды на 1win 2024 на пополнение: 937999 предоставляет новым игрокам бонус 500% для игры в слоты и игровые автоматы, максимальная сумма бонуса 200 000 рублей. Вы можете использовать бонусные деньги в разделе азартных игр, включая онлайн казино, карты, рулетку, игровые автоматы и слоты.
Компания «1Win» рада предложить своим новым клиентам приветственный бонус в размере до 500% на первые четыре депозита. Это выгодное предложение доступно сразу после регистрации в нашей букмекерской конторе. Бонус можно получить не только в рублях, но и в других валютах, при этом он не ограничивает возможность участия игроков в других программам лояльности компании. Максимальная сумма вознаграждения за регистрацию составляет 75000 рублей или эквивалентная сумма в другой валюте.
промокод на 10 рублей 1win приносят игрокам множество преимуществ. Во-первых, они позволяют увеличить начальную ставку или продлить время игры. Кроме того, они дают возможность попробовать различные игры без риска потерять реальные деньги. Бонусы также повышают шансы на выигрыш и предоставляют дополнительные возможности для получения прибыли. Кроме того, бонусы в 1win могут быть обменены на реальные деньги или использованы для участия в специальных акциях и турнирах.
Преимущества получения и использования бонусов в 1win очевидны. Они позволяют игроку расширить свои возможности и получить больше удовольствия от игры. Бонусы также делают игру более выгодной с финансовой точки зрения, помогая уменьшить риски и увеличить потенциальную прибыль. Кроме того, получение и использование бонусов в 1win открывает возможность стать лояльным клиентом и получить дополнительные привилегии и вознаграждения от казино.
Итак, получение бонусов в 1win – это отличная возможность для игрока увеличить свои шансы на выигрыш, получить дополнительные деньги и улучшить свой игровой опыт. Бонусы делают игру более интересной и выгодной.
промокод на 1win на сегодня на пополнение: 937999 предоставляет возможность получить бездепозитный бонус 2024. Его можно получить в виде фриспинов или фрибетов. Чтобы получить подарок, необходимо активировать код в личном кабинете. Дополнительный депозит не требуется. Размеры подарков невелики: фрибет до 500 рублей и не более 70 фриспинов для игры в слоты. Как и в случае с другими поощрениями, необходимо отыграть бездепозитный бонус. Вейджер, как правило, не превышает х5 для бесплатных ставок и х30 для фриспинов.
В казино 1win предоставляется внушительный бонус при регистрации, который составляет 500% от суммы первых четырех последовательных депозитов клиента. С таким количеством бонусов новичок может значительно увеличить свои шансы на выигрыш. Чтобы получить этот приветственный бонус, необходимо зарегистрироваться на официальном сайте, рабочем зеркале, мобильной версии или приложениях для мобильных телефонов. Однако, основным условием является совершение первого пополнения счета, так как активировать бонусы 1win можно только после этого.
промокоды на депозит 1win: 937999 используйте бонусный код при регистрации и получите бездепозтный бонус 70 фриспинов. Да, при использовании кода 1Win вы можете получить различные поощрения, включая бездепозитные бонусы. Они обычно представлены в виде фрибетов или фриспинов. Для их активации не требуется дополнительное пополнение счета. Размер таких подарков невелик: бесплатных вращений не более 70. Вейджер на бездепозитный бонус обычно не превышает х35. В 1Win вы можете получить бонусы за участие в акциях, турнирах, розыгрышах и активацию промокода. Бонусная программа периодически обновляется. Кроме того, некоторые акции имеют сезонный характер.
В 1Win основная бонусная программа включает в себя фриспины. Чтобы получить 70FS, необходимо пополнить счет на 100 рублей или более. Игроку предоставляется 2 дня с момента регистрации для активации презента. Отыгрыш бонуса должен быть выполнен в течение 24 часов с момента начисления, с вейджером х35. Бесплатные вращения предназначены только для игр провайдера Microgaming.
Так как бонусная программа 1Win регулярно обновляется, список акций, в которых можно получить фриспины, постоянно расширяется. Более подробную информацию о них можно найти на нашем сайте.
Промокод на 1Win дает возможность получить бесплатные вращения. Их можно использовать в любых слотах из каталога казино. Иногда могут быть установлены ограничения, которые предусматривают использование фриспинов только в определенных слотах или играх конкретного провайдера. Фриспины начисляются с фиксированной ставкой. Отыгрыш выигрыша, полученного с помощью бесплатных вращений, обязателен с учетом установленного вейджера.
Вся информация взята с сайта; https://palikprof.ru/novosti/pages/promokod_362.html
Бездепозитный Бонус 1win 2024
Бонусы от казино промокоды 1win при пополнении1Win 2024 – Бездепозитные бонусы ? Коды на возврат денег ? VIP Программа лояльности ? Бесплатные фриспины.
1win промокод на пополнение счета: 937999 предоставляет новым игрокам бонус 500% для игры в слоты и игровые автоматы, максимальная сумма бонуса 200 000 рублей. Вы можете использовать бонусные деньги в разделе азартных игр, включая онлайн казино, карты, рулетку, игровые автоматы и слоты.
Компания «1Win» рада предложить своим новым клиентам приветственный бонус в размере до 500% на первые четыре депозита. Это выгодное предложение доступно сразу после регистрации в нашей букмекерской конторе. Бонус можно получить не только в рублях, но и в других валютах, при этом он не ограничивает возможность участия игроков в других программам лояльности компании. Максимальная сумма вознаграждения за регистрацию составляет 75000 рублей или эквивалентная сумма в другой валюте.
промокод 1вин приносят игрокам множество преимуществ. Во-первых, они позволяют увеличить начальную ставку или продлить время игры. Кроме того, они дают возможность попробовать различные игры без риска потерять реальные деньги. Бонусы также повышают шансы на выигрыш и предоставляют дополнительные возможности для получения прибыли. Кроме того, бонусы в 1win могут быть обменены на реальные деньги или использованы для участия в специальных акциях и турнирах.
Преимущества получения и использования бонусов в 1win очевидны. Они позволяют игроку расширить свои возможности и получить больше удовольствия от игры. Бонусы также делают игру более выгодной с финансовой точки зрения, помогая уменьшить риски и увеличить потенциальную прибыль. Кроме того, получение и использование бонусов в 1win открывает возможность стать лояльным клиентом и получить дополнительные привилегии и вознаграждения от казино.
Итак, получение бонусов в 1win – это отличная возможность для игрока увеличить свои шансы на выигрыш, получить дополнительные деньги и улучшить свой игровой опыт. Бонусы делают игру более интересной и выгодной.
1вин промокоды: 937999 предоставляет возможность получить бездепозитный бонус 2024. Его можно получить в виде фриспинов или фрибетов. Чтобы получить подарок, необходимо активировать код в личном кабинете. Дополнительный депозит не требуется. Размеры подарков невелики: фрибет до 500 рублей и не более 70 фриспинов для игры в слоты. Как и в случае с другими поощрениями, необходимо отыграть бездепозитный бонус. Вейджер, как правило, не превышает х5 для бесплатных ставок и х30 для фриспинов.
В казино 1win предоставляется внушительный бонус при регистрации, который составляет 500% от суммы первых четырех последовательных депозитов клиента. С таким количеством бонусов новичок может значительно увеличить свои шансы на выигрыш. Чтобы получить этот приветственный бонус, необходимо зарегистрироваться на официальном сайте, рабочем зеркале, мобильной версии или приложениях для мобильных телефонов. Однако, основным условием является совершение первого пополнения счета, так как активировать бонусы 1win можно только после этого.
промокоды 1win при регистрации: 937999 используйте бонусный код при регистрации и получите бездепозтный бонус 70 фриспинов. Да, при использовании кода 1Win вы можете получить различные поощрения, включая бездепозитные бонусы. Они обычно представлены в виде фрибетов или фриспинов. Для их активации не требуется дополнительное пополнение счета. Размер таких подарков невелик: бесплатных вращений не более 70. Вейджер на бездепозитный бонус обычно не превышает х35. В 1Win вы можете получить бонусы за участие в акциях, турнирах, розыгрышах и активацию промокода. Бонусная программа периодически обновляется. Кроме того, некоторые акции имеют сезонный характер.
В 1Win основная бонусная программа включает в себя фриспины. Чтобы получить 70FS, необходимо пополнить счет на 100 рублей или более. Игроку предоставляется 2 дня с момента регистрации для активации презента. Отыгрыш бонуса должен быть выполнен в течение 24 часов с момента начисления, с вейджером х35. Бесплатные вращения предназначены только для игр провайдера Microgaming.
Так как бонусная программа 1Win регулярно обновляется, список акций, в которых можно получить фриспины, постоянно расширяется. Более подробную информацию о них можно найти на нашем сайте.
Промокод на 1Win дает возможность получить бесплатные вращения. Их можно использовать в любых слотах из каталога казино. Иногда могут быть установлены ограничения, которые предусматривают использование фриспинов только в определенных слотах или играх конкретного провайдера. Фриспины начисляются с фиксированной ставкой. Отыгрыш выигрыша, полученного с помощью бесплатных вращений, обязателен с учетом установленного вейджера.
Вся информация взята с сайта; https://alltranslations.ru/image/art/?promokod_362.html
Самый полный список промокодов 1хБет на сегодня у нас на сайте. Все промокоды раздаются бесплатно: на ставку, при регистрации, бездепозитные промики. Обновляем каждые 5 часов. Обычно 1xBet промокод при регистрации предоставляет бонус на первый депозит и используется на этапе создания аккаунта в БК. Сумма вознаграждения достигает 100% от первого пополнения. Следующий тип — куда ввести промокод 1хбет на телефоне. Он позволяет заключать пари на спортивные события, либо пользоваться привилегиями в сфере азартных игр, доступных на сайте БК. Такой бонус предоставляется бесплатно в честь регистрации, Дня рождения или активности – более подробно в этом материале http://saratovturizm.ru/interesting/pages/promo_kod_bk_1xbet_na_segodnya_pri_registracii.html
Hi my loved one! I wish to say that this post is awesome, great written and come with almost all vital infos. I’d like to peer more posts like this.
EL CODIGO PROMOCIONAL DE 1XSLOTS CASINO
Sin introducir un codigo promocional 1xSlots Casino, como nuevo cliente en March 2024, puede beneficiarse de una bonificacion del 100% hasta 300€. El casino le proporciona un monton de maquinas tragaperras populares de proveedores de software como iSoftBet, Elk Studios o Play’n GO y otros. De forma adicional, se le otorgaran|esta oferta incluye 30 turnos gratuitos.. Todas las informaciones importantes respecto a esta oferta de bienvenida se puede encontrar en este articulo.
?COMO FUNCIONA EL CODIGO PROMOCIONAL DE 1XSLOTS CASINO?
En 1xSlots Casino se puede obtener una bonificacion del 100% hasta 300€ y turnos gratuitos en 1xSlots Casino. Haga su inicial deposito en 1xSlots Casino tras finalizar el proceso de inscripcion. No hace falta solicitar su bonificacion de bienvenida por e-mail ni el chat en directo como en otros casinos, porque 1xSlots Casino la abona a su cuenta automaticamente. La oferta de bienvenida se activa cuando deposite 10€ o mas. Haga un deposito empleando EcoPayz, Boku o Bitcoin u otro metodo de deposito disponible en el casino.
Mas sobre el bono
1xSlots Casino le da la oportunidad de incrementar su balance hasta 300€ (100%). Obtenga la bonificacion superior al depositar 300€ y conseguir 600€ que se anadiran en su cuenta. Los fondos de su bonificacion es compatible con tragaperras de proveedores de software como Red Tiger Gaming, Evolution Gaming y Microgaming, por nombrar unos cuantos. Debe tenerse en cuenta tambien que su cuenta se incrementara con 30 turnos gratuitos.
Bono de bienvenida 1xSlots 2024
Dentro de 1xSlots existen dos bonos de bienvenida, uno standard y uno exclusivo. El primero de ellas recompensa con un paquete de hasta €1500 y 150 giros gratis mientras que el segundo otorga un 10% adicional recompensando hasta €1650 y 150 giros gratis ?La diferencia? El bono exclusivo se obtiene mediante el uso del 1xSlots promocode NEXT777.
Las recompensas de la bonificacion exclusiva son otorgadas en los 4 primeros depositos de la siguiente manera:
100% del primer deposito hasta €450 + 30 giros gratis
100% del segundo deposito hasta €350 + 35 giros gratis
100% del tercer deposito hasta €400 + 40 giros gratis
100% del cuarto deposito hasta €450 + 45 giros gratis
Bono de bienvenida 1xSlots Argentina 2024
Cabe resaltar que durante tu proceso de registro tienes que elegir tu moneda local preferida. De este modo obtendras la bonificacion de bienvenida 1xSlots Argentina en pesos. Puedes recibir el bono exclusivo 1xSlots Argentina al utilizar nuestro codigo de bono 1xSlots Argentina NEXT777 durante el proceso de registro.
Ademas, si ingresas el codigo NEXT777 a la pestana “Bonos y Regalos” despues de hacer tu primer deposito, puedes recibir el bono con giros gratis 1xSlots Argentina que te otorgara 60 FS en tragamonedas 777 GEMS RESPIN. A continuacion encontraras los valores de bonos en pesos argentinos.
Bono de bienvenida 1xSlots Chile 2024
El bono de bienvenida 1xSlots Chile funciona del mismo modo como en Argentina. Tienes que crear tu cuenta e ingresar nuestro codigo promocional para 1xslots Chile NEXT777 al formulario de registro. Puedes elegir el peso chileno como tu moneda local para recibir la bonificacion de bienvenida 1xSlots Chile. Adicionalmente, para obtener 60 giros gratis en 777 GEMS RESPIN, introduce el codigo NEXT777 al hacer tu primer deposito.
?QUE ES UN BONO DE TRAGAPERRAS SIN DEPOSITO?
Como su nombre indica, un bono de tragaperras sin deposito es un tipo de bono de casino que no necesita que los jugadores depositen dinero para poder optar a cualquier tipo de recompensa. Por ejemplo, giros gratis, creditos de casino o incluso dinero en efectivo.
Los bonos sin deposito se dan generalmente a los jugadores potenciales para motivar a los nuevos jugadores para que se registren. Pueden formar parte de los paquetes de bienvenida que un casino online ofrece a todos sus jugadores potenciales y ayudan a atraer la atencion hacia la marca del casino. Tambien pueden ofrecerse a los jugadores con cuentas en determinadas situaciones.
Las tragaperras con bono sin deposito ofrecen la posibilidad de probar las tragaperras online sin coste alguno y quedandose con el dinero que se obtiene, razon por la que son muy codiciadas. Sin embargo, los bonos sin deposito no te obligan a depositar dinero cuando la promocion termina, aunque se sugiere.
?CUALES SON LOS PRINCIPALES TIPOS DE BONOS DE TRAGAMONEDAS SIN DEPOSITO?
Los bonos sin deposito estan disponibles en tres variedades: giros gratis, creditos gratis o dinero en efectivo. El tipo mas conocido que es un bono sin deposito no spins without deposit bonus.
GIROS GRATIS CON BONO SIN DEPOSITO
Todos sabemos que las maquinas tragaperras son las mas populares en el mundo de los juegos de casino , por lo que es natural que un bono hecho especificamente para las maquinas que juegan a las tragaperras sea el mas buscado. Para los amantes de las maquinas tragaperras, los bonos de tiradas gratis sin deposito son un verdadero tesoro, ya que permiten a los jugadores jugar a sus maquinas tragaperras favoritas sin depositar dinero, y con una gran cantidad de tiradas gratis, lo que aumenta sus probabilidades de ganar significativamente.
Creditos gratuitos / BONO DE JUEGO GRATUITO SIN DEPOSITO
En lugar de tiradas gratis, los casinos pueden optar por dar creditos gratis a los jugadores que tienen bonos sin deposito. Estos creditos pueden ser utilizados dentro de un periodo de tiempo enumerado para apostar en juegos en los casinos y ganar dinero real. Los bonos sin deposito y los creditos gratuitos se ofrecen tanto en las tragaperras gratuitas como en otros juegos de los casinos.
DINERO GRATIS CON BONOS SIN DEPOSITO
Al igual que los creditos gratuitos con los bonos sin deposito, los bonos de dinero sin deposito que no requieren deposito se pueden jugar tanto en las tragaperras como en otros juegos de casino. Una vez que haya reclamado y jugado el bono de dinero sin deposito, podra retirar el dinero del bono y cualquier ganancia adicional siempre que cumpla las condiciones para retirar el dinero.
?Como puedo reclamar un bono sin deposito?
En la mayoria de los casos, puede hacer uso de los bonos sin deposito al crear una cuenta en cualquier sitio de juego en linea que ofrezca este tipo de oferta. En la version online del casino, la bonificacion puede aparecer en la pagina de promociones del casino o en una ventana emergente. Algunos casinos requieren que introduzca un codigo promocional para acceder al bono.
Cuando considere reclamar un bono sin deposito (o cualquier otro tipo de bono) debe asegurarse de leer los terminos y condiciones que se adjuntan al bono. Los diferentes casinos pueden tener sus propias regulaciones y limites, sin embargo, hay algunos que son iguales en todos los casinos.
REQUISITOS PARA TRABAJAR
Los bonos sobre los depositos son accesibles para todos, sin embargo, cobrar los bonos es un asunto un poco mas controlado. La mayoria de los casinos en linea le permitiran retirar sus ganancias despues de haber podido apostar una cantidad especifica.
Los requisitos de apuesta se muestran como multiplicadores. Representan la cantidad de veces que tienes que apostar en un bono para poder retirar el dinero. Por lo general, puede jugar a una serie de juegos seleccionados por el operador del casino. Una vez que haya alcanzado el requisito de apuesta, podra dar el siguiente paso para cobrar su bono.
PLAZO
Segun el casino online, el bono para juegos de tragaperras de deposito puede caducar en cuestion de dias o durar hasta 30 dias. Para asegurarte de que cumples los requisitos de apuestas, es posible que tengas que planificar tu rutina de juego a lo largo del bono.
TAMANOS DE APUESTA
Un metodo para lograr su objetivo de apostar mas rapido es realizar la mayor cantidad de apuestas posible en cada juego. Es un metodo sensato, a menos que el operador del casino decida controlar la cantidad de la apuesta y limitar la cantidad de apuestas en la respectiva tragamonedas con bono sin deposito.
SE REQUIERE UN DEPOSITO
Aunque suene contradictorio, algunos casinos online pueden incluso exigir a los jugadores que depositen dinero antes de poder retirar su bono. Suelen anadir este requisito adicional por razones de seguridad.
RESTRICCIONES
A veces, se le puede negar el acceso a un bono con oferta de deposito gratuito. Esto solo ocurre en muy raras circunstancias, ya sea por el hecho de haber intentado dos bonos a la vez o por tener una direccion IP compartida con un jugador que tambien reclamo el mismo bono, o por residir en una zona restringida.
Puedes obtener informacion mas detallada leyendo el articulo completo en este enlace – http://centroculturalrecoleta.org/blog/pages/codigo_promocional_1xslots_bono.html
fashionflag best porn download hd fashionflag.IX565zwwo8P
Thanks for some other informative website. Where else may I am getting that kind of information written in such a perfect means? I’ve a venture that I am just now running on, and I have been on the look out for such information.
goodhere Random porn vurucutewet.mjTrC54wDGV
ladyandtherose Cunnilingus porn backlinkseox.6LFqY6QtbJ9
I’m really impressed with your writing talents as smartly as with the format on your blog. Is this a paid subject matter or did you customize it your self? Anyway keep up the excellent high quality writing, it’s uncommon to see a great blog like this one nowadays..
jenniferroy アナルポルノ japanesexxporns.XKW9iumajFZ
EL CODIGO PROMOCIONAL DE 1XSLOTS CASINO
Sin introducir un codigo promocional 1xSlots Casino, como nuevo cliente en March 2024, puede beneficiarse de una bonificacion del 100% hasta 300€. El casino le proporciona un monton de maquinas tragaperras populares de proveedores de software como iSoftBet, Elk Studios o Play’n GO y otros. De forma adicional, se le otorgaran|esta oferta incluye 30 turnos gratuitos.. Todas las informaciones importantes respecto a esta oferta de bienvenida se puede encontrar en este articulo.
?COMO FUNCIONA EL CODIGO PROMOCIONAL DE 1XSLOTS CASINO?
En 1xSlots Casino se puede obtener una bonificacion del 100% hasta 300€ y turnos gratuitos en 1xSlots Casino. Haga su inicial deposito en 1xSlots Casino tras finalizar el proceso de inscripcion. No hace falta solicitar su bonificacion de bienvenida por e-mail ni el chat en directo como en otros casinos, porque 1xSlots Casino la abona a su cuenta automaticamente. La oferta de bienvenida se activa cuando deposite 10€ o mas. Haga un deposito empleando EcoPayz, Boku o Bitcoin u otro metodo de deposito disponible en el casino.
Mas sobre el bono
1xSlots Casino le da la oportunidad de incrementar su balance hasta 300€ (100%). Obtenga la bonificacion superior al depositar 300€ y conseguir 600€ que se anadiran en su cuenta. Los fondos de su bonificacion es compatible con tragaperras de proveedores de software como Red Tiger Gaming, Evolution Gaming y Microgaming, por nombrar unos cuantos. Debe tenerse en cuenta tambien que su cuenta se incrementara con 30 turnos gratuitos.
Bono de bienvenida 1xSlots 2024
Dentro de 1xSlots existen dos bonos de bienvenida, uno standard y uno exclusivo. El primero de ellas recompensa con un paquete de hasta €1500 y 150 giros gratis mientras que el segundo otorga un 10% adicional recompensando hasta €1650 y 150 giros gratis ?La diferencia? El bono exclusivo se obtiene mediante el uso del 1xSlots promocode NEXT777.
Las recompensas de la bonificacion exclusiva son otorgadas en los 4 primeros depositos de la siguiente manera:
100% del primer deposito hasta €450 + 30 giros gratis
100% del segundo deposito hasta €350 + 35 giros gratis
100% del tercer deposito hasta €400 + 40 giros gratis
100% del cuarto deposito hasta €450 + 45 giros gratis
Bono de bienvenida 1xSlots Argentina 2024
Cabe resaltar que durante tu proceso de registro tienes que elegir tu moneda local preferida. De este modo obtendras la bonificacion de bienvenida 1xSlots Argentina en pesos. Puedes recibir el bono exclusivo 1xSlots Argentina al utilizar nuestro codigo de bono 1xSlots Argentina NEXT777 durante el proceso de registro.
Ademas, si ingresas el codigo NEXT777 a la pestana “Bonos y Regalos” despues de hacer tu primer deposito, puedes recibir el bono con giros gratis 1xSlots Argentina que te otorgara 60 FS en tragamonedas 777 GEMS RESPIN. A continuacion encontraras los valores de bonos en pesos argentinos.
Bono de bienvenida 1xSlots Chile 2024
El bono de bienvenida 1xSlots Chile funciona del mismo modo como en Argentina. Tienes que crear tu cuenta e ingresar nuestro 1xslots nuevo codigo promocional Chile NEXT777 al formulario de registro. Puedes elegir el peso chileno como tu moneda local para recibir la bonificacion de bienvenida 1xSlots Chile. Adicionalmente, para obtener 60 giros gratis en 777 GEMS RESPIN, introduce el codigo NEXT777 al hacer tu primer deposito.
?QUE ES UN BONO DE TRAGAPERRAS SIN DEPOSITO?
Como su nombre indica, un bono de tragaperras sin deposito es un tipo de bono de casino que no necesita que los jugadores depositen dinero para poder optar a cualquier tipo de recompensa. Por ejemplo, giros gratis, creditos de casino o incluso dinero en efectivo.
Los bonos sin deposito se dan generalmente a los jugadores potenciales para motivar a los nuevos jugadores para que se registren. Pueden formar parte de los paquetes de bienvenida que un casino online ofrece a todos sus jugadores potenciales y ayudan a atraer la atencion hacia la marca del casino. Tambien pueden ofrecerse a los jugadores con cuentas en determinadas situaciones.
Las tragaperras con bono sin deposito ofrecen la posibilidad de probar las tragaperras online sin coste alguno y quedandose con el dinero que se obtiene, razon por la que son muy codiciadas. Sin embargo, los bonos sin deposito no te obligan a depositar dinero cuando la promocion termina, aunque se sugiere.
?CUALES SON LOS PRINCIPALES TIPOS DE BONOS DE TRAGAMONEDAS SIN DEPOSITO?
Los bonos sin deposito estan disponibles en tres variedades: giros gratis, creditos gratis o dinero en efectivo. El tipo mas conocido que es un bono sin deposito no spins without deposit bonus.
GIROS GRATIS CON BONO SIN DEPOSITO
Todos sabemos que las maquinas tragaperras son las mas populares en el mundo de los juegos de casino , por lo que es natural que un bono hecho especificamente para las maquinas que juegan a las tragaperras sea el mas buscado. Para los amantes de las maquinas tragaperras, los bonos de tiradas gratis sin deposito son un verdadero tesoro, ya que permiten a los jugadores jugar a sus maquinas tragaperras favoritas sin depositar dinero, y con una gran cantidad de tiradas gratis, lo que aumenta sus probabilidades de ganar significativamente.
Creditos gratuitos / BONO DE JUEGO GRATUITO SIN DEPOSITO
En lugar de tiradas gratis, los casinos pueden optar por dar creditos gratis a los jugadores que tienen bonos sin deposito. Estos creditos pueden ser utilizados dentro de un periodo de tiempo enumerado para apostar en juegos en los casinos y ganar dinero real. Los bonos sin deposito y los creditos gratuitos se ofrecen tanto en las tragaperras gratuitas como en otros juegos de los casinos.
DINERO GRATIS CON BONOS SIN DEPOSITO
Al igual que los creditos gratuitos con los bonos sin deposito, los bonos de dinero sin deposito que no requieren deposito se pueden jugar tanto en las tragaperras como en otros juegos de casino. Una vez que haya reclamado y jugado el bono de dinero sin deposito, podra retirar el dinero del bono y cualquier ganancia adicional siempre que cumpla las condiciones para retirar el dinero.
?Como puedo reclamar un bono sin deposito?
En la mayoria de los casos, puede hacer uso de los bonos sin deposito al crear una cuenta en cualquier sitio de juego en linea que ofrezca este tipo de oferta. En la version online del casino, la bonificacion puede aparecer en la pagina de promociones del casino o en una ventana emergente. Algunos casinos requieren que introduzca un codigo promocional para acceder al bono.
Cuando considere reclamar un bono sin deposito (o cualquier otro tipo de bono) debe asegurarse de leer los terminos y condiciones que se adjuntan al bono. Los diferentes casinos pueden tener sus propias regulaciones y limites, sin embargo, hay algunos que son iguales en todos los casinos.
REQUISITOS PARA TRABAJAR
Los bonos sobre los depositos son accesibles para todos, sin embargo, cobrar los bonos es un asunto un poco mas controlado. La mayoria de los casinos en linea le permitiran retirar sus ganancias despues de haber podido apostar una cantidad especifica.
Los requisitos de apuesta se muestran como multiplicadores. Representan la cantidad de veces que tienes que apostar en un bono para poder retirar el dinero. Por lo general, puede jugar a una serie de juegos seleccionados por el operador del casino. Una vez que haya alcanzado el requisito de apuesta, podra dar el siguiente paso para cobrar su bono.
PLAZO
Segun el casino online, el bono para juegos de tragaperras de deposito puede caducar en cuestion de dias o durar hasta 30 dias. Para asegurarte de que cumples los requisitos de apuestas, es posible que tengas que planificar tu rutina de juego a lo largo del bono.
TAMANOS DE APUESTA
Un metodo para lograr su objetivo de apostar mas rapido es realizar la mayor cantidad de apuestas posible en cada juego. Es un metodo sensato, a menos que el operador del casino decida controlar la cantidad de la apuesta y limitar la cantidad de apuestas en la respectiva tragamonedas con bono sin deposito.
SE REQUIERE UN DEPOSITO
Aunque suene contradictorio, algunos casinos online pueden incluso exigir a los jugadores que depositen dinero antes de poder retirar su bono. Suelen anadir este requisito adicional por razones de seguridad.
RESTRICCIONES
A veces, se le puede negar el acceso a un bono con oferta de deposito gratuito. Esto solo ocurre en muy raras circunstancias, ya sea por el hecho de haber intentado dos bonos a la vez o por tener una direccion IP compartida con un jugador que tambien reclamo el mismo bono, o por residir en una zona restringida.
Puedes obtener informacion mas detallada leyendo el articulo completo en este enlace – https://94fbr.org/art/codigo_promocional_1xslots_bono.html
Hi there! Do you know if they make any plugins to assist with SEO?
I’m trying to get my blog to rank for some targeted keywords but I’m not seeing very good gains.
If you know of any please share. Thank you! You can read
similar blog here: Ecommerce
landuse Big Ass porn lancdcuse.bveFFK0xGJ2
falbobrospizzamadison Cartoons porn jkkıjxxx.U0YnXmzMmm5
Hey there! Do you know if they make any plugins to assist with Search Engine
Optimization? I’m trying to get my blog to rank for some
targeted keywords but I’m not seeing very good results.
If you know of any please share. Kudos! You can read similar art here: Dobry sklep
I?¦m now not positive where you’re getting your info, however great topic. I needs to spend a while learning more or understanding more. Thank you for wonderful information I used to be looking for this info for my mission.
Hey! Do you know if they make any plugins to help with Search Engine
Optimization? I’m trying to get my blog to rank for some targeted keywords but I’m not seeing
very good success. If you know of any please share.
Thank you! You can read similar text here: Najlepszy sklep
खिलौना अश्लील qqyyooppxx.XAc93PpVRtl
EL CODIGO PROMOCIONAL DE 1XSLOTS CASINO
Sin introducir un codigo promocional 1xSlots Casino, como nuevo cliente en March 2024, puede beneficiarse de una bonificacion del 100% hasta 300€. El casino le proporciona un monton de maquinas tragaperras populares de proveedores de software como iSoftBet, Elk Studios o Play’n GO y otros. De forma adicional, se le otorgaran|esta oferta incluye 30 turnos gratuitos.. Todas las informaciones importantes respecto a esta oferta de bienvenida se puede encontrar en este articulo.
?COMO FUNCIONA EL CODIGO PROMOCIONAL DE 1XSLOTS CASINO?
En 1xSlots Casino se puede obtener una bonificacion del 100% hasta 300€ y turnos gratuitos en 1xSlots Casino. Haga su inicial deposito en 1xSlots Casino tras finalizar el proceso de inscripcion. No hace falta solicitar su bonificacion de bienvenida por e-mail ni el chat en directo como en otros casinos, porque 1xSlots Casino la abona a su cuenta automaticamente. La oferta de bienvenida se activa cuando deposite 10€ o mas. Haga un deposito empleando EcoPayz, Boku o Bitcoin u otro metodo de deposito disponible en el casino.
Mas sobre el bono
1xSlots Casino le da la oportunidad de incrementar su balance hasta 300€ (100%). Obtenga la bonificacion superior al depositar 300€ y conseguir 600€ que se anadiran en su cuenta. Los fondos de su bonificacion es compatible con tragaperras de proveedores de software como Red Tiger Gaming, Evolution Gaming y Microgaming, por nombrar unos cuantos. Debe tenerse en cuenta tambien que su cuenta se incrementara con 30 turnos gratuitos.
Bono de bienvenida 1xSlots 2024
Dentro de 1xSlots existen dos bonos de bienvenida, uno standard y uno exclusivo. El primero de ellas recompensa con un paquete de hasta €1500 y 150 giros gratis mientras que el segundo otorga un 10% adicional recompensando hasta €1650 y 150 giros gratis ?La diferencia? El bono exclusivo se obtiene mediante el uso del 1xSlots promocode NEXT777.
Las recompensas de la bonificacion exclusiva son otorgadas en los 4 primeros depositos de la siguiente manera:
100% del primer deposito hasta €450 + 30 giros gratis
100% del segundo deposito hasta €350 + 35 giros gratis
100% del tercer deposito hasta €400 + 40 giros gratis
100% del cuarto deposito hasta €450 + 45 giros gratis
Bono de bienvenida 1xSlots Argentina 2024
Cabe resaltar que durante tu proceso de registro tienes que elegir tu moneda local preferida. De este modo obtendras la bonificacion de bienvenida 1xSlots Argentina en pesos. Puedes recibir el bono exclusivo 1xSlots Argentina al utilizar nuestro codigo de bono 1xSlots Argentina NEXT777 durante el proceso de registro.
Ademas, si ingresas el codigo NEXT777 a la pestana “Bonos y Regalos” despues de hacer tu primer deposito, puedes recibir el bono con giros gratis 1xSlots Argentina que te otorgara 60 FS en tragamonedas 777 GEMS RESPIN. A continuacion encontraras los valores de bonos en pesos argentinos.
Bono de bienvenida 1xSlots Chile 2024
El bono de bienvenida 1xSlots Chile funciona del mismo modo como en Argentina. Tienes que crear tu cuenta e ingresar nuestro 1xslots nuevo codigo promocional Chile NEXT777 al formulario de registro. Puedes elegir el peso chileno como tu moneda local para recibir la bonificacion de bienvenida 1xSlots Chile. Adicionalmente, para obtener 60 giros gratis en 777 GEMS RESPIN, introduce el codigo NEXT777 al hacer tu primer deposito.
?QUE ES UN BONO DE TRAGAPERRAS SIN DEPOSITO?
Como su nombre indica, un bono de tragaperras sin deposito es un tipo de bono de casino que no necesita que los jugadores depositen dinero para poder optar a cualquier tipo de recompensa. Por ejemplo, giros gratis, creditos de casino o incluso dinero en efectivo.
Los bonos sin deposito se dan generalmente a los jugadores potenciales para motivar a los nuevos jugadores para que se registren. Pueden formar parte de los paquetes de bienvenida que un casino online ofrece a todos sus jugadores potenciales y ayudan a atraer la atencion hacia la marca del casino. Tambien pueden ofrecerse a los jugadores con cuentas en determinadas situaciones.
Las tragaperras con bono sin deposito ofrecen la posibilidad de probar las tragaperras online sin coste alguno y quedandose con el dinero que se obtiene, razon por la que son muy codiciadas. Sin embargo, los bonos sin deposito no te obligan a depositar dinero cuando la promocion termina, aunque se sugiere.
?CUALES SON LOS PRINCIPALES TIPOS DE BONOS DE TRAGAMONEDAS SIN DEPOSITO?
Los bonos sin deposito estan disponibles en tres variedades: giros gratis, creditos gratis o dinero en efectivo. El tipo mas conocido que es un bono sin deposito no spins without deposit bonus.
GIROS GRATIS CON BONO SIN DEPOSITO
Todos sabemos que las maquinas tragaperras son las mas populares en el mundo de los juegos de casino , por lo que es natural que un bono hecho especificamente para las maquinas que juegan a las tragaperras sea el mas buscado. Para los amantes de las maquinas tragaperras, los bonos de tiradas gratis sin deposito son un verdadero tesoro, ya que permiten a los jugadores jugar a sus maquinas tragaperras favoritas sin depositar dinero, y con una gran cantidad de tiradas gratis, lo que aumenta sus probabilidades de ganar significativamente.
Creditos gratuitos / BONO DE JUEGO GRATUITO SIN DEPOSITO
En lugar de tiradas gratis, los casinos pueden optar por dar creditos gratis a los jugadores que tienen bonos sin deposito. Estos creditos pueden ser utilizados dentro de un periodo de tiempo enumerado para apostar en juegos en los casinos y ganar dinero real. Los bonos sin deposito y los creditos gratuitos se ofrecen tanto en las tragaperras gratuitas como en otros juegos de los casinos.
DINERO GRATIS CON BONOS SIN DEPOSITO
Al igual que los creditos gratuitos con los bonos sin deposito, los bonos de dinero sin deposito que no requieren deposito se pueden jugar tanto en las tragaperras como en otros juegos de casino. Una vez que haya reclamado y jugado el bono de dinero sin deposito, podra retirar el dinero del bono y cualquier ganancia adicional siempre que cumpla las condiciones para retirar el dinero.
?Como puedo reclamar un bono sin deposito?
En la mayoria de los casos, puede hacer uso de los bonos sin deposito al crear una cuenta en cualquier sitio de juego en linea que ofrezca este tipo de oferta. En la version online del casino, la bonificacion puede aparecer en la pagina de promociones del casino o en una ventana emergente. Algunos casinos requieren que introduzca un codigo promocional para acceder al bono.
Cuando considere reclamar un bono sin deposito (o cualquier otro tipo de bono) debe asegurarse de leer los terminos y condiciones que se adjuntan al bono. Los diferentes casinos pueden tener sus propias regulaciones y limites, sin embargo, hay algunos que son iguales en todos los casinos.
REQUISITOS PARA TRABAJAR
Los bonos sobre los depositos son accesibles para todos, sin embargo, cobrar los bonos es un asunto un poco mas controlado. La mayoria de los casinos en linea le permitiran retirar sus ganancias despues de haber podido apostar una cantidad especifica.
Los requisitos de apuesta se muestran como multiplicadores. Representan la cantidad de veces que tienes que apostar en un bono para poder retirar el dinero. Por lo general, puede jugar a una serie de juegos seleccionados por el operador del casino. Una vez que haya alcanzado el requisito de apuesta, podra dar el siguiente paso para cobrar su bono.
PLAZO
Segun el casino online, el bono para juegos de tragaperras de deposito puede caducar en cuestion de dias o durar hasta 30 dias. Para asegurarte de que cumples los requisitos de apuestas, es posible que tengas que planificar tu rutina de juego a lo largo del bono.
TAMANOS DE APUESTA
Un metodo para lograr su objetivo de apostar mas rapido es realizar la mayor cantidad de apuestas posible en cada juego. Es un metodo sensato, a menos que el operador del casino decida controlar la cantidad de la apuesta y limitar la cantidad de apuestas en la respectiva tragamonedas con bono sin deposito.
SE REQUIERE UN DEPOSITO
Aunque suene contradictorio, algunos casinos online pueden incluso exigir a los jugadores que depositen dinero antes de poder retirar su bono. Suelen anadir este requisito adicional por razones de seguridad.
RESTRICCIONES
A veces, se le puede negar el acceso a un bono con oferta de deposito gratuito. Esto solo ocurre en muy raras circunstancias, ya sea por el hecho de haber intentado dos bonos a la vez o por tener una direccion IP compartida con un jugador que tambien reclamo el mismo bono, o por residir en una zona restringida.
Puedes obtener informacion mas detallada leyendo el articulo completo en este enlace – https://94fbr.org/art/codigo_promocional_1xslots_bono.html
मिश्रित अश्लीलता के बारे में बतावल गइल बा hjkvbasdfzxzz.TTvKnsohIcR
1xBet промокод на бонус при регистрации. Букмекерская контора предоставляет игрокам множество возможностей для снижения рисков и увеличения банка. Бонусная программа компании предусматривает интересы как новичков, так и опытных бетторов. Рассмотрим основные виды поощрений в функционале БК: 1хБет промокод на регистрацию – один из самых популярных подарков, созданный для новых игроков на сайте; Ставки на спорт – увеличение депозита до 32500 рублей. Воспользуйся актуальным промокодом 1xbet на сегодня, получи бесплатную возможность увеличить свой первый депозит до 32500 рублей в БК 1xBet. Воспользовавшись что такое промокод в 1хбет при регистрации, максимальная сумма бонуса возможного бонуса будет увеличена до 32500 рублей. Но при этом сумма бонуса будет равна сумме вашего первого депозита – более подробно в этом материале https://03ekb.ru/news/besplatnuy_promokod_pri_registracii.html
समलैंगिक अश्लीलता txechdyzxca.70E41wTQq3D
F*ckin’ awesome things here. I’m very glad to see your article. Thanks a lot and i am looking forward to contact you. Will you please drop me a e-mail?
EL CODIGO PROMOCIONAL DE 1XSLOTS CASINO
Sin introducir un codigo promocional 1xSlots Casino, como nuevo cliente en March 2024, puede beneficiarse de una bonificacion del 100% hasta 300€. El casino le proporciona un monton de maquinas tragaperras populares de proveedores de software como iSoftBet, Elk Studios o Play’n GO y otros. De forma adicional, se le otorgaran|esta oferta incluye 30 turnos gratuitos.. Todas las informaciones importantes respecto a esta oferta de bienvenida se puede encontrar en este articulo.
?COMO FUNCIONA EL CODIGO PROMOCIONAL DE 1XSLOTS CASINO?
En 1xSlots Casino se puede obtener una bonificacion del 100% hasta 300€ y turnos gratuitos en 1xSlots Casino. Haga su inicial deposito en 1xSlots Casino tras finalizar el proceso de inscripcion. No hace falta solicitar su bonificacion de bienvenida por e-mail ni el chat en directo como en otros casinos, porque 1xSlots Casino la abona a su cuenta automaticamente. La oferta de bienvenida se activa cuando deposite 10€ o mas. Haga un deposito empleando EcoPayz, Boku o Bitcoin u otro metodo de deposito disponible en el casino.
Mas sobre el bono
1xSlots Casino le da la oportunidad de incrementar su balance hasta 300€ (100%). Obtenga la bonificacion superior al depositar 300€ y conseguir 600€ que se anadiran en su cuenta. Los fondos de su bonificacion es compatible con tragaperras de proveedores de software como Red Tiger Gaming, Evolution Gaming y Microgaming, por nombrar unos cuantos. Debe tenerse en cuenta tambien que su cuenta se incrementara con 30 turnos gratuitos.
Bono de bienvenida 1xSlots 2024
Dentro de 1xSlots existen dos bonos de bienvenida, uno standard y uno exclusivo. El primero de ellas recompensa con un paquete de hasta €1500 y 150 giros gratis mientras que el segundo otorga un 10% adicional recompensando hasta €1650 y 150 giros gratis ?La diferencia? El bono exclusivo se obtiene mediante el uso del 1xSlots promocode NEXT777.
Las recompensas de la bonificacion exclusiva son otorgadas en los 4 primeros depositos de la siguiente manera:
100% del primer deposito hasta €450 + 30 giros gratis
100% del segundo deposito hasta €350 + 35 giros gratis
100% del tercer deposito hasta €400 + 40 giros gratis
100% del cuarto deposito hasta €450 + 45 giros gratis
Bono de bienvenida 1xSlots Argentina 2024
Cabe resaltar que durante tu proceso de registro tienes que elegir tu moneda local preferida. De este modo obtendras la bonificacion de bienvenida 1xSlots Argentina en pesos. Puedes recibir el bono exclusivo 1xSlots Argentina al utilizar nuestro codigo de bono 1xSlots Argentina NEXT777 durante el proceso de registro.
Ademas, si ingresas el codigo NEXT777 a la pestana “Bonos y Regalos” despues de hacer tu primer deposito, puedes recibir el bono con giros gratis 1xSlots Argentina que te otorgara 60 FS en tragamonedas 777 GEMS RESPIN. A continuacion encontraras los valores de bonos en pesos argentinos.
Bono de bienvenida 1xSlots Chile 2024
El bono de bienvenida 1xSlots Chile funciona del mismo modo como en Argentina. Tienes que crear tu cuenta e ingresar nuestro codigo de bonificacion 1xslots Chile NEXT777 al formulario de registro. Puedes elegir el peso chileno como tu moneda local para recibir la bonificacion de bienvenida 1xSlots Chile. Adicionalmente, para obtener 60 giros gratis en 777 GEMS RESPIN, introduce el codigo NEXT777 al hacer tu primer deposito.
?QUE ES UN BONO DE TRAGAPERRAS SIN DEPOSITO?
Como su nombre indica, un bono de tragaperras sin deposito es un tipo de bono de casino que no necesita que los jugadores depositen dinero para poder optar a cualquier tipo de recompensa. Por ejemplo, giros gratis, creditos de casino o incluso dinero en efectivo.
Los bonos sin deposito se dan generalmente a los jugadores potenciales para motivar a los nuevos jugadores para que se registren. Pueden formar parte de los paquetes de bienvenida que un casino online ofrece a todos sus jugadores potenciales y ayudan a atraer la atencion hacia la marca del casino. Tambien pueden ofrecerse a los jugadores con cuentas en determinadas situaciones.
Las tragaperras con bono sin deposito ofrecen la posibilidad de probar las tragaperras online sin coste alguno y quedandose con el dinero que se obtiene, razon por la que son muy codiciadas. Sin embargo, los bonos sin deposito no te obligan a depositar dinero cuando la promocion termina, aunque se sugiere.
?CUALES SON LOS PRINCIPALES TIPOS DE BONOS DE TRAGAMONEDAS SIN DEPOSITO?
Los bonos sin deposito estan disponibles en tres variedades: giros gratis, creditos gratis o dinero en efectivo. El tipo mas conocido que es un bono sin deposito no spins without deposit bonus.
GIROS GRATIS CON BONO SIN DEPOSITO
Todos sabemos que las maquinas tragaperras son las mas populares en el mundo de los juegos de casino , por lo que es natural que un bono hecho especificamente para las maquinas que juegan a las tragaperras sea el mas buscado. Para los amantes de las maquinas tragaperras, los bonos de tiradas gratis sin deposito son un verdadero tesoro, ya que permiten a los jugadores jugar a sus maquinas tragaperras favoritas sin depositar dinero, y con una gran cantidad de tiradas gratis, lo que aumenta sus probabilidades de ganar significativamente.
Creditos gratuitos / BONO DE JUEGO GRATUITO SIN DEPOSITO
En lugar de tiradas gratis, los casinos pueden optar por dar creditos gratis a los jugadores que tienen bonos sin deposito. Estos creditos pueden ser utilizados dentro de un periodo de tiempo enumerado para apostar en juegos en los casinos y ganar dinero real. Los bonos sin deposito y los creditos gratuitos se ofrecen tanto en las tragaperras gratuitas como en otros juegos de los casinos.
DINERO GRATIS CON BONOS SIN DEPOSITO
Al igual que los creditos gratuitos con los bonos sin deposito, los bonos de dinero sin deposito que no requieren deposito se pueden jugar tanto en las tragaperras como en otros juegos de casino. Una vez que haya reclamado y jugado el bono de dinero sin deposito, podra retirar el dinero del bono y cualquier ganancia adicional siempre que cumpla las condiciones para retirar el dinero.
?Como puedo reclamar un bono sin deposito?
En la mayoria de los casos, puede hacer uso de los bonos sin deposito al crear una cuenta en cualquier sitio de juego en linea que ofrezca este tipo de oferta. En la version online del casino, la bonificacion puede aparecer en la pagina de promociones del casino o en una ventana emergente. Algunos casinos requieren que introduzca un codigo promocional para acceder al bono.
Cuando considere reclamar un bono sin deposito (o cualquier otro tipo de bono) debe asegurarse de leer los terminos y condiciones que se adjuntan al bono. Los diferentes casinos pueden tener sus propias regulaciones y limites, sin embargo, hay algunos que son iguales en todos los casinos.
REQUISITOS PARA TRABAJAR
Los bonos sobre los depositos son accesibles para todos, sin embargo, cobrar los bonos es un asunto un poco mas controlado. La mayoria de los casinos en linea le permitiran retirar sus ganancias despues de haber podido apostar una cantidad especifica.
Los requisitos de apuesta se muestran como multiplicadores. Representan la cantidad de veces que tienes que apostar en un bono para poder retirar el dinero. Por lo general, puede jugar a una serie de juegos seleccionados por el operador del casino. Una vez que haya alcanzado el requisito de apuesta, podra dar el siguiente paso para cobrar su bono.
PLAZO
Segun el casino online, el bono para juegos de tragaperras de deposito puede caducar en cuestion de dias o durar hasta 30 dias. Para asegurarte de que cumples los requisitos de apuestas, es posible que tengas que planificar tu rutina de juego a lo largo del bono.
TAMANOS DE APUESTA
Un metodo para lograr su objetivo de apostar mas rapido es realizar la mayor cantidad de apuestas posible en cada juego. Es un metodo sensato, a menos que el operador del casino decida controlar la cantidad de la apuesta y limitar la cantidad de apuestas en la respectiva tragamonedas con bono sin deposito.
SE REQUIERE UN DEPOSITO
Aunque suene contradictorio, algunos casinos online pueden incluso exigir a los jugadores que depositen dinero antes de poder retirar su bono. Suelen anadir este requisito adicional por razones de seguridad.
RESTRICCIONES
A veces, se le puede negar el acceso a un bono con oferta de deposito gratuito. Esto solo ocurre en muy raras circunstancias, ya sea por el hecho de haber intentado dos bonos a la vez o por tener una direccion IP compartida con un jugador que tambien reclamo el mismo bono, o por residir en una zona restringida.
Puedes obtener informacion mas detallada leyendo el articulo completo en este enlace – https://findfreightloads.com/blog/wp-content/pgs/?codigo_promocional_1xslots_bono.html
Регистрация в 2024 году — бесплатный промокод 1xbet на сегодня. Часто задаваемые вопросы по регистрации и учетной записи у букмекера 1xbet. промокод 1хбет на бесплатную ставку сегодня бесплатно. Разнообразие бонусных предложений от 1xbet — другие типы бонусов и промокодов для игроков. Промокод 1xbet на День Рождения. Фрибеты или бесплатные ставки. Тото-промокоды 1xbet. Промокоды 1xbet у блогеров. Система промокодов при регистрации позволяет новым игрокам букмекерской конторы 1xbet получать внушительные бонусные суммы к своему первому депозиту. Обратите внимание, что это не промокод на ставку, а именно на регистрацию. Рабочие промокоды 1хбет на сегодня: Вид бонуса. Размер бонуса – более подробно в этом материале https://03ekb.ru/news/besplatnuy_promokod_pri_registracii.html
मिशनरी शैली की अश्लीलता hkyonet.vPOvcpyrNKM
EL CODIGO PROMOCIONAL DE 1XSLOTS CASINO
Sin introducir un codigo promocional 1xSlots Casino, como nuevo cliente en March 2024, puede beneficiarse de una bonificacion del 100% hasta 300€. El casino le proporciona un monton de maquinas tragaperras populares de proveedores de software como iSoftBet, Elk Studios o Play’n GO y otros. De forma adicional, se le otorgaran|esta oferta incluye 30 turnos gratuitos.. Todas las informaciones importantes respecto a esta oferta de bienvenida se puede encontrar en este articulo.
?COMO FUNCIONA EL CODIGO PROMOCIONAL DE 1XSLOTS CASINO?
En 1xSlots Casino se puede obtener una bonificacion del 100% hasta 300€ y turnos gratuitos en 1xSlots Casino. Haga su inicial deposito en 1xSlots Casino tras finalizar el proceso de inscripcion. No hace falta solicitar su bonificacion de bienvenida por e-mail ni el chat en directo como en otros casinos, porque 1xSlots Casino la abona a su cuenta automaticamente. La oferta de bienvenida se activa cuando deposite 10€ o mas. Haga un deposito empleando EcoPayz, Boku o Bitcoin u otro metodo de deposito disponible en el casino.
Mas sobre el bono
1xSlots Casino le da la oportunidad de incrementar su balance hasta 300€ (100%). Obtenga la bonificacion superior al depositar 300€ y conseguir 600€ que se anadiran en su cuenta. Los fondos de su bonificacion es compatible con tragaperras de proveedores de software como Red Tiger Gaming, Evolution Gaming y Microgaming, por nombrar unos cuantos. Debe tenerse en cuenta tambien que su cuenta se incrementara con 30 turnos gratuitos.
Bono de bienvenida 1xSlots 2024
Dentro de 1xSlots existen dos bonos de bienvenida, uno standard y uno exclusivo. El primero de ellas recompensa con un paquete de hasta €1500 y 150 giros gratis mientras que el segundo otorga un 10% adicional recompensando hasta €1650 y 150 giros gratis ?La diferencia? El bono exclusivo se obtiene mediante el uso del 1xSlots promocode NEXT777.
Las recompensas de la bonificacion exclusiva son otorgadas en los 4 primeros depositos de la siguiente manera:
100% del primer deposito hasta €450 + 30 giros gratis
100% del segundo deposito hasta €350 + 35 giros gratis
100% del tercer deposito hasta €400 + 40 giros gratis
100% del cuarto deposito hasta €450 + 45 giros gratis
Bono de bienvenida 1xSlots Argentina 2024
Cabe resaltar que durante tu proceso de registro tienes que elegir tu moneda local preferida. De este modo obtendras la bonificacion de bienvenida 1xSlots Argentina en pesos. Puedes recibir el bono exclusivo 1xSlots Argentina al utilizar nuestro codigo de bono 1xSlots Argentina NEXT777 durante el proceso de registro.
Ademas, si ingresas el codigo NEXT777 a la pestana “Bonos y Regalos” despues de hacer tu primer deposito, puedes recibir el bono con giros gratis 1xSlots Argentina que te otorgara 60 FS en tragamonedas 777 GEMS RESPIN. A continuacion encontraras los valores de bonos en pesos argentinos.
Bono de bienvenida 1xSlots Chile 2024
El bono de bienvenida 1xSlots Chile funciona del mismo modo como en Argentina. Tienes que crear tu cuenta e ingresar nuestro codigo promocional 1xslots Chile NEXT777 al formulario de registro. Puedes elegir el peso chileno como tu moneda local para recibir la bonificacion de bienvenida 1xSlots Chile. Adicionalmente, para obtener 60 giros gratis en 777 GEMS RESPIN, introduce el codigo NEXT777 al hacer tu primer deposito.
?QUE ES UN BONO DE TRAGAPERRAS SIN DEPOSITO?
Como su nombre indica, un bono de tragaperras sin deposito es un tipo de bono de casino que no necesita que los jugadores depositen dinero para poder optar a cualquier tipo de recompensa. Por ejemplo, giros gratis, creditos de casino o incluso dinero en efectivo.
Los bonos sin deposito se dan generalmente a los jugadores potenciales para motivar a los nuevos jugadores para que se registren. Pueden formar parte de los paquetes de bienvenida que un casino online ofrece a todos sus jugadores potenciales y ayudan a atraer la atencion hacia la marca del casino. Tambien pueden ofrecerse a los jugadores con cuentas en determinadas situaciones.
Las tragaperras con bono sin deposito ofrecen la posibilidad de probar las tragaperras online sin coste alguno y quedandose con el dinero que se obtiene, razon por la que son muy codiciadas. Sin embargo, los bonos sin deposito no te obligan a depositar dinero cuando la promocion termina, aunque se sugiere.
?CUALES SON LOS PRINCIPALES TIPOS DE BONOS DE TRAGAMONEDAS SIN DEPOSITO?
Los bonos sin deposito estan disponibles en tres variedades: giros gratis, creditos gratis o dinero en efectivo. El tipo mas conocido que es un bono sin deposito no spins without deposit bonus.
GIROS GRATIS CON BONO SIN DEPOSITO
Todos sabemos que las maquinas tragaperras son las mas populares en el mundo de los juegos de casino , por lo que es natural que un bono hecho especificamente para las maquinas que juegan a las tragaperras sea el mas buscado. Para los amantes de las maquinas tragaperras, los bonos de tiradas gratis sin deposito son un verdadero tesoro, ya que permiten a los jugadores jugar a sus maquinas tragaperras favoritas sin depositar dinero, y con una gran cantidad de tiradas gratis, lo que aumenta sus probabilidades de ganar significativamente.
Creditos gratuitos / BONO DE JUEGO GRATUITO SIN DEPOSITO
En lugar de tiradas gratis, los casinos pueden optar por dar creditos gratis a los jugadores que tienen bonos sin deposito. Estos creditos pueden ser utilizados dentro de un periodo de tiempo enumerado para apostar en juegos en los casinos y ganar dinero real. Los bonos sin deposito y los creditos gratuitos se ofrecen tanto en las tragaperras gratuitas como en otros juegos de los casinos.
DINERO GRATIS CON BONOS SIN DEPOSITO
Al igual que los creditos gratuitos con los bonos sin deposito, los bonos de dinero sin deposito que no requieren deposito se pueden jugar tanto en las tragaperras como en otros juegos de casino. Una vez que haya reclamado y jugado el bono de dinero sin deposito, podra retirar el dinero del bono y cualquier ganancia adicional siempre que cumpla las condiciones para retirar el dinero.
?Como puedo reclamar un bono sin deposito?
En la mayoria de los casos, puede hacer uso de los bonos sin deposito al crear una cuenta en cualquier sitio de juego en linea que ofrezca este tipo de oferta. En la version online del casino, la bonificacion puede aparecer en la pagina de promociones del casino o en una ventana emergente. Algunos casinos requieren que introduzca un codigo promocional para acceder al bono.
Cuando considere reclamar un bono sin deposito (o cualquier otro tipo de bono) debe asegurarse de leer los terminos y condiciones que se adjuntan al bono. Los diferentes casinos pueden tener sus propias regulaciones y limites, sin embargo, hay algunos que son iguales en todos los casinos.
REQUISITOS PARA TRABAJAR
Los bonos sobre los depositos son accesibles para todos, sin embargo, cobrar los bonos es un asunto un poco mas controlado. La mayoria de los casinos en linea le permitiran retirar sus ganancias despues de haber podido apostar una cantidad especifica.
Los requisitos de apuesta se muestran como multiplicadores. Representan la cantidad de veces que tienes que apostar en un bono para poder retirar el dinero. Por lo general, puede jugar a una serie de juegos seleccionados por el operador del casino. Una vez que haya alcanzado el requisito de apuesta, podra dar el siguiente paso para cobrar su bono.
PLAZO
Segun el casino online, el bono para juegos de tragaperras de deposito puede caducar en cuestion de dias o durar hasta 30 dias. Para asegurarte de que cumples los requisitos de apuestas, es posible que tengas que planificar tu rutina de juego a lo largo del bono.
TAMANOS DE APUESTA
Un metodo para lograr su objetivo de apostar mas rapido es realizar la mayor cantidad de apuestas posible en cada juego. Es un metodo sensato, a menos que el operador del casino decida controlar la cantidad de la apuesta y limitar la cantidad de apuestas en la respectiva tragamonedas con bono sin deposito.
SE REQUIERE UN DEPOSITO
Aunque suene contradictorio, algunos casinos online pueden incluso exigir a los jugadores que depositen dinero antes de poder retirar su bono. Suelen anadir este requisito adicional por razones de seguridad.
RESTRICCIONES
A veces, se le puede negar el acceso a un bono con oferta de deposito gratuito. Esto solo ocurre en muy raras circunstancias, ya sea por el hecho de haber intentado dos bonos a la vez o por tener una direccion IP compartida con un jugador que tambien reclamo el mismo bono, o por residir en una zona restringida.
Puedes obtener informacion mas detallada leyendo el articulo completo en este enlace – https://kryivka.net/about/pgs/codigo_promocional_1xslots_bono.html
Hey! Do you know if they make any plugins to help with Search Engine
Optimization? I’m trying to get my site to rank for some targeted keywords but I’m not seeing very good
results. If you know of any please share. Thanks! You can read similar text here: Backlink Building
ਮਿਸ਼ਰਤ ਪੋਰਨ madisonivysex.HZxYbREGNez
EL CODIGO PROMOCIONAL DE 1XSLOTS CASINO
Sin introducir un codigo promocional 1xSlots Casino, como nuevo cliente en March 2024, puede beneficiarse de una bonificacion del 100% hasta 300€. El casino le proporciona un monton de maquinas tragaperras populares de proveedores de software como iSoftBet, Elk Studios o Play’n GO y otros. De forma adicional, se le otorgaran|esta oferta incluye 30 turnos gratuitos.. Todas las informaciones importantes respecto a esta oferta de bienvenida se puede encontrar en este articulo.
?COMO FUNCIONA EL CODIGO PROMOCIONAL DE 1XSLOTS CASINO?
En 1xSlots Casino se puede obtener una bonificacion del 100% hasta 300€ y turnos gratuitos en 1xSlots Casino. Haga su inicial deposito en 1xSlots Casino tras finalizar el proceso de inscripcion. No hace falta solicitar su bonificacion de bienvenida por e-mail ni el chat en directo como en otros casinos, porque 1xSlots Casino la abona a su cuenta automaticamente. La oferta de bienvenida se activa cuando deposite 10€ o mas. Haga un deposito empleando EcoPayz, Boku o Bitcoin u otro metodo de deposito disponible en el casino.
Mas sobre el bono
1xSlots Casino le da la oportunidad de incrementar su balance hasta 300€ (100%). Obtenga la bonificacion superior al depositar 300€ y conseguir 600€ que se anadiran en su cuenta. Los fondos de su bonificacion es compatible con tragaperras de proveedores de software como Red Tiger Gaming, Evolution Gaming y Microgaming, por nombrar unos cuantos. Debe tenerse en cuenta tambien que su cuenta se incrementara con 30 turnos gratuitos.
Bono de bienvenida 1xSlots 2024
Dentro de 1xSlots existen dos bonos de bienvenida, uno standard y uno exclusivo. El primero de ellas recompensa con un paquete de hasta €1500 y 150 giros gratis mientras que el segundo otorga un 10% adicional recompensando hasta €1650 y 150 giros gratis ?La diferencia? El bono exclusivo se obtiene mediante el uso del 1xSlots promocode NEXT777.
Las recompensas de la bonificacion exclusiva son otorgadas en los 4 primeros depositos de la siguiente manera:
100% del primer deposito hasta €450 + 30 giros gratis
100% del segundo deposito hasta €350 + 35 giros gratis
100% del tercer deposito hasta €400 + 40 giros gratis
100% del cuarto deposito hasta €450 + 45 giros gratis
Bono de bienvenida 1xSlots Argentina 2024
Cabe resaltar que durante tu proceso de registro tienes que elegir tu moneda local preferida. De este modo obtendras la bonificacion de bienvenida 1xSlots Argentina en pesos. Puedes recibir el bono exclusivo 1xSlots Argentina al utilizar nuestro codigo de bono 1xSlots Argentina NEXT777 durante el proceso de registro.
Ademas, si ingresas el codigo NEXT777 a la pestana “Bonos y Regalos” despues de hacer tu primer deposito, puedes recibir el bono con giros gratis 1xSlots Argentina que te otorgara 60 FS en tragamonedas 777 GEMS RESPIN. A continuacion encontraras los valores de bonos en pesos argentinos.
Bono de bienvenida 1xSlots Chile 2024
El bono de bienvenida 1xSlots Chile funciona del mismo modo como en Argentina. Tienes que crear tu cuenta e ingresar nuestro codigo promocional de bonificacion 1xslots Chile NEXT777 al formulario de registro. Puedes elegir el peso chileno como tu moneda local para recibir la bonificacion de bienvenida 1xSlots Chile. Adicionalmente, para obtener 60 giros gratis en 777 GEMS RESPIN, introduce el codigo NEXT777 al hacer tu primer deposito.
?QUE ES UN BONO DE TRAGAPERRAS SIN DEPOSITO?
Como su nombre indica, un bono de tragaperras sin deposito es un tipo de bono de casino que no necesita que los jugadores depositen dinero para poder optar a cualquier tipo de recompensa. Por ejemplo, giros gratis, creditos de casino o incluso dinero en efectivo.
Los bonos sin deposito se dan generalmente a los jugadores potenciales para motivar a los nuevos jugadores para que se registren. Pueden formar parte de los paquetes de bienvenida que un casino online ofrece a todos sus jugadores potenciales y ayudan a atraer la atencion hacia la marca del casino. Tambien pueden ofrecerse a los jugadores con cuentas en determinadas situaciones.
Las tragaperras con bono sin deposito ofrecen la posibilidad de probar las tragaperras online sin coste alguno y quedandose con el dinero que se obtiene, razon por la que son muy codiciadas. Sin embargo, los bonos sin deposito no te obligan a depositar dinero cuando la promocion termina, aunque se sugiere.
?CUALES SON LOS PRINCIPALES TIPOS DE BONOS DE TRAGAMONEDAS SIN DEPOSITO?
Los bonos sin deposito estan disponibles en tres variedades: giros gratis, creditos gratis o dinero en efectivo. El tipo mas conocido que es un bono sin deposito no spins without deposit bonus.
GIROS GRATIS CON BONO SIN DEPOSITO
Todos sabemos que las maquinas tragaperras son las mas populares en el mundo de los juegos de casino , por lo que es natural que un bono hecho especificamente para las maquinas que juegan a las tragaperras sea el mas buscado. Para los amantes de las maquinas tragaperras, los bonos de tiradas gratis sin deposito son un verdadero tesoro, ya que permiten a los jugadores jugar a sus maquinas tragaperras favoritas sin depositar dinero, y con una gran cantidad de tiradas gratis, lo que aumenta sus probabilidades de ganar significativamente.
Creditos gratuitos / BONO DE JUEGO GRATUITO SIN DEPOSITO
En lugar de tiradas gratis, los casinos pueden optar por dar creditos gratis a los jugadores que tienen bonos sin deposito. Estos creditos pueden ser utilizados dentro de un periodo de tiempo enumerado para apostar en juegos en los casinos y ganar dinero real. Los bonos sin deposito y los creditos gratuitos se ofrecen tanto en las tragaperras gratuitas como en otros juegos de los casinos.
DINERO GRATIS CON BONOS SIN DEPOSITO
Al igual que los creditos gratuitos con los bonos sin deposito, los bonos de dinero sin deposito que no requieren deposito se pueden jugar tanto en las tragaperras como en otros juegos de casino. Una vez que haya reclamado y jugado el bono de dinero sin deposito, podra retirar el dinero del bono y cualquier ganancia adicional siempre que cumpla las condiciones para retirar el dinero.
?Como puedo reclamar un bono sin deposito?
En la mayoria de los casos, puede hacer uso de los bonos sin deposito al crear una cuenta en cualquier sitio de juego en linea que ofrezca este tipo de oferta. En la version online del casino, la bonificacion puede aparecer en la pagina de promociones del casino o en una ventana emergente. Algunos casinos requieren que introduzca un codigo promocional para acceder al bono.
Cuando considere reclamar un bono sin deposito (o cualquier otro tipo de bono) debe asegurarse de leer los terminos y condiciones que se adjuntan al bono. Los diferentes casinos pueden tener sus propias regulaciones y limites, sin embargo, hay algunos que son iguales en todos los casinos.
REQUISITOS PARA TRABAJAR
Los bonos sobre los depositos son accesibles para todos, sin embargo, cobrar los bonos es un asunto un poco mas controlado. La mayoria de los casinos en linea le permitiran retirar sus ganancias despues de haber podido apostar una cantidad especifica.
Los requisitos de apuesta se muestran como multiplicadores. Representan la cantidad de veces que tienes que apostar en un bono para poder retirar el dinero. Por lo general, puede jugar a una serie de juegos seleccionados por el operador del casino. Una vez que haya alcanzado el requisito de apuesta, podra dar el siguiente paso para cobrar su bono.
PLAZO
Segun el casino online, el bono para juegos de tragaperras de deposito puede caducar en cuestion de dias o durar hasta 30 dias. Para asegurarte de que cumples los requisitos de apuestas, es posible que tengas que planificar tu rutina de juego a lo largo del bono.
TAMANOS DE APUESTA
Un metodo para lograr su objetivo de apostar mas rapido es realizar la mayor cantidad de apuestas posible en cada juego. Es un metodo sensato, a menos que el operador del casino decida controlar la cantidad de la apuesta y limitar la cantidad de apuestas en la respectiva tragamonedas con bono sin deposito.
SE REQUIERE UN DEPOSITO
Aunque suene contradictorio, algunos casinos online pueden incluso exigir a los jugadores que depositen dinero antes de poder retirar su bono. Suelen anadir este requisito adicional por razones de seguridad.
RESTRICCIONES
A veces, se le puede negar el acceso a un bono con oferta de deposito gratuito. Esto solo ocurre en muy raras circunstancias, ya sea por el hecho de haber intentado dos bonos a la vez o por tener una direccion IP compartida con un jugador que tambien reclamo el mismo bono, o por residir en una zona restringida.
Puedes obtener informacion mas detallada leyendo el articulo completo en este enlace – https://tecnoaldia.net/pag/?codigo_promocional_1xslots_bono.html
EL CODIGO PROMOCIONAL DE 1XSLOTS CASINO
Sin introducir un codigo promocional 1xSlots Casino, como nuevo cliente en March 2024, puede beneficiarse de una bonificacion del 100% hasta 300€. El casino le proporciona un monton de maquinas tragaperras populares de proveedores de software como iSoftBet, Elk Studios o Play’n GO y otros. De forma adicional, se le otorgaran|esta oferta incluye 30 turnos gratuitos.. Todas las informaciones importantes respecto a esta oferta de bienvenida se puede encontrar en este articulo.
?COMO FUNCIONA EL CODIGO PROMOCIONAL DE 1XSLOTS CASINO?
En 1xSlots Casino se puede obtener una bonificacion del 100% hasta 300€ y turnos gratuitos en 1xSlots Casino. Haga su inicial deposito en 1xSlots Casino tras finalizar el proceso de inscripcion. No hace falta solicitar su bonificacion de bienvenida por e-mail ni el chat en directo como en otros casinos, porque 1xSlots Casino la abona a su cuenta automaticamente. La oferta de bienvenida se activa cuando deposite 10€ o mas. Haga un deposito empleando EcoPayz, Boku o Bitcoin u otro metodo de deposito disponible en el casino.
Mas sobre el bono
1xSlots Casino le da la oportunidad de incrementar su balance hasta 300€ (100%). Obtenga la bonificacion superior al depositar 300€ y conseguir 600€ que se anadiran en su cuenta. Los fondos de su bonificacion es compatible con tragaperras de proveedores de software como Red Tiger Gaming, Evolution Gaming y Microgaming, por nombrar unos cuantos. Debe tenerse en cuenta tambien que su cuenta se incrementara con 30 turnos gratuitos.
Bono de bienvenida 1xSlots 2024
Dentro de 1xSlots existen dos bonos de bienvenida, uno standard y uno exclusivo. El primero de ellas recompensa con un paquete de hasta €1500 y 150 giros gratis mientras que el segundo otorga un 10% adicional recompensando hasta €1650 y 150 giros gratis ?La diferencia? El bono exclusivo se obtiene mediante el uso del 1xSlots promocode NEXT777.
Las recompensas de la bonificacion exclusiva son otorgadas en los 4 primeros depositos de la siguiente manera:
100% del primer deposito hasta €450 + 30 giros gratis
100% del segundo deposito hasta €350 + 35 giros gratis
100% del tercer deposito hasta €400 + 40 giros gratis
100% del cuarto deposito hasta €450 + 45 giros gratis
Bono de bienvenida 1xSlots Argentina 2024
Cabe resaltar que durante tu proceso de registro tienes que elegir tu moneda local preferida. De este modo obtendras la bonificacion de bienvenida 1xSlots Argentina en pesos. Puedes recibir el bono exclusivo 1xSlots Argentina al utilizar nuestro codigo de bono 1xSlots Argentina NEXT777 durante el proceso de registro.
Ademas, si ingresas el codigo NEXT777 a la pestana “Bonos y Regalos” despues de hacer tu primer deposito, puedes recibir el bono con giros gratis 1xSlots Argentina que te otorgara 60 FS en tragamonedas 777 GEMS RESPIN. A continuacion encontraras los valores de bonos en pesos argentinos.
Bono de bienvenida 1xSlots Chile 2024
El bono de bienvenida 1xSlots Chile funciona del mismo modo como en Argentina. Tienes que crear tu cuenta e ingresar nuestro mejor codigo de promocion para 1xslots Chile NEXT777 al formulario de registro. Puedes elegir el peso chileno como tu moneda local para recibir la bonificacion de bienvenida 1xSlots Chile. Adicionalmente, para obtener 60 giros gratis en 777 GEMS RESPIN, introduce el codigo NEXT777 al hacer tu primer deposito.
?QUE ES UN BONO DE TRAGAPERRAS SIN DEPOSITO?
Como su nombre indica, un bono de tragaperras sin deposito es un tipo de bono de casino que no necesita que los jugadores depositen dinero para poder optar a cualquier tipo de recompensa. Por ejemplo, giros gratis, creditos de casino o incluso dinero en efectivo.
Los bonos sin deposito se dan generalmente a los jugadores potenciales para motivar a los nuevos jugadores para que se registren. Pueden formar parte de los paquetes de bienvenida que un casino online ofrece a todos sus jugadores potenciales y ayudan a atraer la atencion hacia la marca del casino. Tambien pueden ofrecerse a los jugadores con cuentas en determinadas situaciones.
Las tragaperras con bono sin deposito ofrecen la posibilidad de probar las tragaperras online sin coste alguno y quedandose con el dinero que se obtiene, razon por la que son muy codiciadas. Sin embargo, los bonos sin deposito no te obligan a depositar dinero cuando la promocion termina, aunque se sugiere.
?CUALES SON LOS PRINCIPALES TIPOS DE BONOS DE TRAGAMONEDAS SIN DEPOSITO?
Los bonos sin deposito estan disponibles en tres variedades: giros gratis, creditos gratis o dinero en efectivo. El tipo mas conocido que es un bono sin deposito no spins without deposit bonus.
GIROS GRATIS CON BONO SIN DEPOSITO
Todos sabemos que las maquinas tragaperras son las mas populares en el mundo de los juegos de casino , por lo que es natural que un bono hecho especificamente para las maquinas que juegan a las tragaperras sea el mas buscado. Para los amantes de las maquinas tragaperras, los bonos de tiradas gratis sin deposito son un verdadero tesoro, ya que permiten a los jugadores jugar a sus maquinas tragaperras favoritas sin depositar dinero, y con una gran cantidad de tiradas gratis, lo que aumenta sus probabilidades de ganar significativamente.
Creditos gratuitos / BONO DE JUEGO GRATUITO SIN DEPOSITO
En lugar de tiradas gratis, los casinos pueden optar por dar creditos gratis a los jugadores que tienen bonos sin deposito. Estos creditos pueden ser utilizados dentro de un periodo de tiempo enumerado para apostar en juegos en los casinos y ganar dinero real. Los bonos sin deposito y los creditos gratuitos se ofrecen tanto en las tragaperras gratuitas como en otros juegos de los casinos.
DINERO GRATIS CON BONOS SIN DEPOSITO
Al igual que los creditos gratuitos con los bonos sin deposito, los bonos de dinero sin deposito que no requieren deposito se pueden jugar tanto en las tragaperras como en otros juegos de casino. Una vez que haya reclamado y jugado el bono de dinero sin deposito, podra retirar el dinero del bono y cualquier ganancia adicional siempre que cumpla las condiciones para retirar el dinero.
?Como puedo reclamar un bono sin deposito?
En la mayoria de los casos, puede hacer uso de los bonos sin deposito al crear una cuenta en cualquier sitio de juego en linea que ofrezca este tipo de oferta. En la version online del casino, la bonificacion puede aparecer en la pagina de promociones del casino o en una ventana emergente. Algunos casinos requieren que introduzca un codigo promocional para acceder al bono.
Cuando considere reclamar un bono sin deposito (o cualquier otro tipo de bono) debe asegurarse de leer los terminos y condiciones que se adjuntan al bono. Los diferentes casinos pueden tener sus propias regulaciones y limites, sin embargo, hay algunos que son iguales en todos los casinos.
REQUISITOS PARA TRABAJAR
Los bonos sobre los depositos son accesibles para todos, sin embargo, cobrar los bonos es un asunto un poco mas controlado. La mayoria de los casinos en linea le permitiran retirar sus ganancias despues de haber podido apostar una cantidad especifica.
Los requisitos de apuesta se muestran como multiplicadores. Representan la cantidad de veces que tienes que apostar en un bono para poder retirar el dinero. Por lo general, puede jugar a una serie de juegos seleccionados por el operador del casino. Una vez que haya alcanzado el requisito de apuesta, podra dar el siguiente paso para cobrar su bono.
PLAZO
Segun el casino online, el bono para juegos de tragaperras de deposito puede caducar en cuestion de dias o durar hasta 30 dias. Para asegurarte de que cumples los requisitos de apuestas, es posible que tengas que planificar tu rutina de juego a lo largo del bono.
TAMANOS DE APUESTA
Un metodo para lograr su objetivo de apostar mas rapido es realizar la mayor cantidad de apuestas posible en cada juego. Es un metodo sensato, a menos que el operador del casino decida controlar la cantidad de la apuesta y limitar la cantidad de apuestas en la respectiva tragamonedas con bono sin deposito.
SE REQUIERE UN DEPOSITO
Aunque suene contradictorio, algunos casinos online pueden incluso exigir a los jugadores que depositen dinero antes de poder retirar su bono. Suelen anadir este requisito adicional por razones de seguridad.
RESTRICCIONES
A veces, se le puede negar el acceso a un bono con oferta de deposito gratuito. Esto solo ocurre en muy raras circunstancias, ya sea por el hecho de haber intentado dos bonos a la vez o por tener una direccion IP compartida con un jugador que tambien reclamo el mismo bono, o por residir en una zona restringida.
Puedes obtener informacion mas detallada leyendo el articulo completo en este enlace – https://tecnoaldia.net/pag/?codigo_promocional_1xslots_bono.html
I like this post, enjoyed this one thank you for posting. “The basis of optimism is sheer terror.” by Oscar Wilde.
ladesbet ਵੱਡੇ ਕੁੱਕੜ ਪੋਰਨ ladesinemi.KbSS93siSER
Escort Gazette review guide with free verified ads in Europe. Best Escort Girls, Strip clubs, Brothels, Massage parlors on the map. Easy search directory. https://webdirectoryone.com/listings12686531/best-escort-girls-strip-clubs-brothels-massage-parlors-on-the-map-easy-search-directory
Escort Gazette review guide with free verified ads in Europe. Best Escort Girls, Strip clubs, Brothels, Massage parlors on the map. Easy search directory. https://israelcpbn80358.wikiitemization.com/4155628/escort_gazette_review_guide_with_free_verified_ads_in_europe
EL CODIGO PROMOCIONAL DE 1XSLOTS CASINO
Sin introducir un codigo promocional 1xSlots Casino, como nuevo cliente en March 2024, puede beneficiarse de una bonificacion del 100% hasta 300€. El casino le proporciona un monton de maquinas tragaperras populares de proveedores de software como iSoftBet, Elk Studios o Play’n GO y otros. De forma adicional, se le otorgaran|esta oferta incluye 30 turnos gratuitos.. Todas las informaciones importantes respecto a esta oferta de bienvenida se puede encontrar en este articulo.
?COMO FUNCIONA EL CODIGO PROMOCIONAL DE 1XSLOTS CASINO?
En 1xSlots Casino se puede obtener una bonificacion del 100% hasta 300€ y turnos gratuitos en 1xSlots Casino. Haga su inicial deposito en 1xSlots Casino tras finalizar el proceso de inscripcion. No hace falta solicitar su bonificacion de bienvenida por e-mail ni el chat en directo como en otros casinos, porque 1xSlots Casino la abona a su cuenta automaticamente. La oferta de bienvenida se activa cuando deposite 10€ o mas. Haga un deposito empleando EcoPayz, Boku o Bitcoin u otro metodo de deposito disponible en el casino.
Mas sobre el bono
1xSlots Casino le da la oportunidad de incrementar su balance hasta 300€ (100%). Obtenga la bonificacion superior al depositar 300€ y conseguir 600€ que se anadiran en su cuenta. Los fondos de su bonificacion es compatible con tragaperras de proveedores de software como Red Tiger Gaming, Evolution Gaming y Microgaming, por nombrar unos cuantos. Debe tenerse en cuenta tambien que su cuenta se incrementara con 30 turnos gratuitos.
Bono de bienvenida 1xSlots 2024
Dentro de 1xSlots existen dos bonos de bienvenida, uno standard y uno exclusivo. El primero de ellas recompensa con un paquete de hasta €1500 y 150 giros gratis mientras que el segundo otorga un 10% adicional recompensando hasta €1650 y 150 giros gratis ?La diferencia? El bono exclusivo se obtiene mediante el uso del 1xSlots promocode NEXT777.
Las recompensas de la bonificacion exclusiva son otorgadas en los 4 primeros depositos de la siguiente manera:
100% del primer deposito hasta €450 + 30 giros gratis
100% del segundo deposito hasta €350 + 35 giros gratis
100% del tercer deposito hasta €400 + 40 giros gratis
100% del cuarto deposito hasta €450 + 45 giros gratis
Bono de bienvenida 1xSlots Argentina 2024
Cabe resaltar que durante tu proceso de registro tienes que elegir tu moneda local preferida. De este modo obtendras la bonificacion de bienvenida 1xSlots Argentina en pesos. Puedes recibir el bono exclusivo 1xSlots Argentina al utilizar nuestro codigo de bono 1xSlots Argentina NEXT777 durante el proceso de registro.
Ademas, si ingresas el codigo NEXT777 a la pestana “Bonos y Regalos” despues de hacer tu primer deposito, puedes recibir el bono con giros gratis 1xSlots Argentina que te otorgara 60 FS en tragamonedas 777 GEMS RESPIN. A continuacion encontraras los valores de bonos en pesos argentinos.
Bono de bienvenida 1xSlots Chile 2024
El bono de bienvenida 1xSlots Chile funciona del mismo modo como en Argentina. Tienes que crear tu cuenta e ingresar nuestro Codigo promocional 1xslots hoy Chile NEXT777 al formulario de registro. Puedes elegir el peso chileno como tu moneda local para recibir la bonificacion de bienvenida 1xSlots Chile. Adicionalmente, para obtener 60 giros gratis en 777 GEMS RESPIN, introduce el codigo NEXT777 al hacer tu primer deposito.
?QUE ES UN BONO DE TRAGAPERRAS SIN DEPOSITO?
Como su nombre indica, un bono de tragaperras sin deposito es un tipo de bono de casino que no necesita que los jugadores depositen dinero para poder optar a cualquier tipo de recompensa. Por ejemplo, giros gratis, creditos de casino o incluso dinero en efectivo.
Los bonos sin deposito se dan generalmente a los jugadores potenciales para motivar a los nuevos jugadores para que se registren. Pueden formar parte de los paquetes de bienvenida que un casino online ofrece a todos sus jugadores potenciales y ayudan a atraer la atencion hacia la marca del casino. Tambien pueden ofrecerse a los jugadores con cuentas en determinadas situaciones.
Las tragaperras con bono sin deposito ofrecen la posibilidad de probar las tragaperras online sin coste alguno y quedandose con el dinero que se obtiene, razon por la que son muy codiciadas. Sin embargo, los bonos sin deposito no te obligan a depositar dinero cuando la promocion termina, aunque se sugiere.
?CUALES SON LOS PRINCIPALES TIPOS DE BONOS DE TRAGAMONEDAS SIN DEPOSITO?
Los bonos sin deposito estan disponibles en tres variedades: giros gratis, creditos gratis o dinero en efectivo. El tipo mas conocido que es un bono sin deposito no spins without deposit bonus.
GIROS GRATIS CON BONO SIN DEPOSITO
Todos sabemos que las maquinas tragaperras son las mas populares en el mundo de los juegos de casino , por lo que es natural que un bono hecho especificamente para las maquinas que juegan a las tragaperras sea el mas buscado. Para los amantes de las maquinas tragaperras, los bonos de tiradas gratis sin deposito son un verdadero tesoro, ya que permiten a los jugadores jugar a sus maquinas tragaperras favoritas sin depositar dinero, y con una gran cantidad de tiradas gratis, lo que aumenta sus probabilidades de ganar significativamente.
Creditos gratuitos / BONO DE JUEGO GRATUITO SIN DEPOSITO
En lugar de tiradas gratis, los casinos pueden optar por dar creditos gratis a los jugadores que tienen bonos sin deposito. Estos creditos pueden ser utilizados dentro de un periodo de tiempo enumerado para apostar en juegos en los casinos y ganar dinero real. Los bonos sin deposito y los creditos gratuitos se ofrecen tanto en las tragaperras gratuitas como en otros juegos de los casinos.
DINERO GRATIS CON BONOS SIN DEPOSITO
Al igual que los creditos gratuitos con los bonos sin deposito, los bonos de dinero sin deposito que no requieren deposito se pueden jugar tanto en las tragaperras como en otros juegos de casino. Una vez que haya reclamado y jugado el bono de dinero sin deposito, podra retirar el dinero del bono y cualquier ganancia adicional siempre que cumpla las condiciones para retirar el dinero.
?Como puedo reclamar un bono sin deposito?
En la mayoria de los casos, puede hacer uso de los bonos sin deposito al crear una cuenta en cualquier sitio de juego en linea que ofrezca este tipo de oferta. En la version online del casino, la bonificacion puede aparecer en la pagina de promociones del casino o en una ventana emergente. Algunos casinos requieren que introduzca un codigo promocional para acceder al bono.
Cuando considere reclamar un bono sin deposito (o cualquier otro tipo de bono) debe asegurarse de leer los terminos y condiciones que se adjuntan al bono. Los diferentes casinos pueden tener sus propias regulaciones y limites, sin embargo, hay algunos que son iguales en todos los casinos.
REQUISITOS PARA TRABAJAR
Los bonos sobre los depositos son accesibles para todos, sin embargo, cobrar los bonos es un asunto un poco mas controlado. La mayoria de los casinos en linea le permitiran retirar sus ganancias despues de haber podido apostar una cantidad especifica.
Los requisitos de apuesta se muestran como multiplicadores. Representan la cantidad de veces que tienes que apostar en un bono para poder retirar el dinero. Por lo general, puede jugar a una serie de juegos seleccionados por el operador del casino. Una vez que haya alcanzado el requisito de apuesta, podra dar el siguiente paso para cobrar su bono.
PLAZO
Segun el casino online, el bono para juegos de tragaperras de deposito puede caducar en cuestion de dias o durar hasta 30 dias. Para asegurarte de que cumples los requisitos de apuestas, es posible que tengas que planificar tu rutina de juego a lo largo del bono.
TAMANOS DE APUESTA
Un metodo para lograr su objetivo de apostar mas rapido es realizar la mayor cantidad de apuestas posible en cada juego. Es un metodo sensato, a menos que el operador del casino decida controlar la cantidad de la apuesta y limitar la cantidad de apuestas en la respectiva tragamonedas con bono sin deposito.
SE REQUIERE UN DEPOSITO
Aunque suene contradictorio, algunos casinos online pueden incluso exigir a los jugadores que depositen dinero antes de poder retirar su bono. Suelen anadir este requisito adicional por razones de seguridad.
RESTRICCIONES
A veces, se le puede negar el acceso a un bono con oferta de deposito gratuito. Esto solo ocurre en muy raras circunstancias, ya sea por el hecho de haber intentado dos bonos a la vez o por tener una direccion IP compartida con un jugador que tambien reclamo el mismo bono, o por residir en una zona restringida.
Puedes obtener informacion mas detallada leyendo el articulo completo en este enlace – https://www.joshhunt.com/news/codigo_promocional_1xslots_bono.html
Рабочий промокод 1ХБЕТ на 2024 год бесплатно: Бонус 32 500р. Актуальный список при регистрации на официальном сайте компании. На бесплатную ставку и витрина промо-кодов. Откуда взять и куда вставить промокоды описано на странице. Код необходимо использовать при регистрации на официальном сайте конторы 1xbet (промокоды для купона -на бесплатную ставку, находятся в самом низу статьи). как получить промокод 1хбет бесплатно на сегодня! Как ввести промокод 1хБет при регистрации в 2024. Вводятся такие комбинации в купон пари, позволяя сделать прогноз бесплатно, застраховать ставку или извлечь любую другую выгоду от обладания бонусным кодом. К сожалению, найти промокод в свободном доступе невозможно, их игроки получают индивидуально и вряд ли заходят делиться халявой с обывателями интернета – более подробно в этом материале https://mg-group74.ru/pages/1xbet.html
А вот тут мы поговорим про то как весело провести время, если вам скучно т заходите в онлайн порно чат общение без регистрации бесплатно и ограничений со стороны администрации, тут эро шоу и голые девочки 18 лет и старше. Очень сексуальные и красивые девушки для вас исполнят стриптиз, займутся виртуальным секспом по вебке, покажут свои сиськи и киски. Все для того что бы вы им поставили лайк, девчонки ждут тебя в чате прямо сейчас.
Более подробно ознакомиться с вебкам чатом можно тут – https://rt.livepornosexchat.com/
Воспользоваться промокодом 1xbet можно при регистрации в 1xbet. БК 1хбет дарит до 130% на первый депозит при помощи промокода 1xbet. Максимальная сумма бонуса по промокоду 1хбет достигает 32500 рублей. Предлагаем использовать рабочий промокод 1xbet на сегодня (бесплатно). Вводить промокод 1хбет следует строго при регистрации. Куда вводить промокод 1xbet при регистрации? Выбираете страну и валюту. В окно “Введите промокод” (при наличии), вводите рабочий промокод. Как активировать промокод 1хбет. Промокод 1xbet активируется при первом пополнении игрового счета. Однако, есть пару моментов: Необходимо заполнить все обязательные поля в личном кабинете. Как получить промокод 1xbet на сегодня? Бесплатные купоны для повышения бонуса посетителям сайта. Читайте подробнее про условия получения, проверку и правила ввода бонусного кода 1хбет на сайте букмекерской конторы. Еще один вид промокодов 1xbet.com позволяет совершать бесплатные ставки на события, а также использовать иные предложения в сфере азартных игр от БК. Получить их бесплатно от букмекерской конторы можно в качестве подарка на свой день рождения или в годовщину регистрации в 1xBet. промокоды на 1хбет на сегодня при регистрации. Стандартный бонус на первый депозит для новых игроков составляет 100% от суммы первого пополнения – более подробно в этом материале http://dizkomp.ru/netcat/inc/1xbet.html
Специальные промокоды на 2024 год для 1xBet. Промокод — это уникальный набор из букв, цифр и символов для того, чтобы пользователь получил определенный бонус. Таким бонусом может оказаться увеличение начального депозита, ставка со страховкой (с возвратом части ставочных денег при выборе неверного исхода матча), тестовая ставка (чтобы новые игроки набрались опыта, без вреда собственным деньгам) и многое другое. Больше промокодов для 1xBet можно увидеть на сайтах партнеров букмекерской компании, которые выкладываются каждый день на просторах интернета. Бесплатные промокоды 1xBet при регистрации. Многие пользователи положительно отзываются о промокоде 1xBet на сегодня. Им можно воспользоваться при регистрации новой учетной записи на сайте компании. Для этого необходимо ввести в соответствующее окошко следующий набор букв и цифр. Эта комбинация будут эффективной до конца текущего года, но она распространяется только на новых игроков – более подробно в этом материале http://dizkomp.ru/netcat/inc/1xbet.html
I really like your writing style, good info, thanks for posting :D. “The superfluous is very necessary.” by Francois Marie Arouet Voltaire.
Очень много чувственного любительского порно снято именно на веб-камеру. А у нас есть богатая бесплатная коллекция такого видео. В таких видео нет постановок, режиссеров и ассистентов – все максимально натурально. Многие девушки, которые никогда не снимались в секс по вебке охотно развлекаются перед вебкой, показывая свое тело. Пусть при порно чат с девушкой онлайн бесплатно русская душа ваша и смущается, но не сомневайтесь, что после пары диалогов вы абсолютно поменяете свое представление о подобном досуге!
Более подробно ознакомиться с вебкам чатом можно тут – https://rt.livepornosexchat.com/
What Is Puravive? Puravive is a natural weight loss supplement that is known to boost the metabolic processes of the body.
Более подробно ознакомиться с вебкам чатом можно тут – https://livepornosexchat.com/
Официальный промокод 1ХБет при регистрации, только по нему ты получишь бонус в 32500 рублей, все остальные коды не действительные и не дают такой бонус. 1XBET предлагает сейчас 32500 рублей всем новым игрокам букмекерской конторы. промокод на сегодня в 1хбет бесплатную ставку. Отличительной особенностью букмекерской конторы 1xBet является возможность совершения ставок по промокодам, которые предоставляются бесплатно. Это позволяет новичку заработать деньги, не делая никаких вложений. Однако чтобы получить промокод на ставку и воспользоваться им, следует разобраться с некоторыми инструкциями. Бесплатные промокоды 1xBet при регистрации. Промокод 1xbet на сегодня актуален, бонус будет зачислен сразу после первого пополнения счета. Временные коды. Букмекерская контора 1xbet часто выступает спонсором при переводе популярных сериалов на русский язык. Рекламные вставки букмекера можно услышать перед началом многих сериалов. Часто в такой рекламе диктуется специальные промокод, дающий возможность беттерам рассчитывать на дополнительный бонус. Максимальный бонус при регистрации составляется 32500 рублей. Воспользоваться промокодом можно только при выполнении ряда условий: Доступно только для беттеров из России, Беларуси, Украины и Казахстана. Возврат игрока – от 18 лет – более подробно в этом материале https://ngmagistral.ru/wp-includes/pages/1xbet.html
The Basic Principles Of buy injectable steroids. https://cristiankxkw13681.law-wiki.com/644279/top_latest_five_buy_injectable_steroids_urban_news
The Basic Principles Of buy injectable steroids. https://paulo924yly2.wikidank.com/user
1xSlots Промокод (Бездепозитный Бонус 2024)
1xSlots промокод: NEXT777, при регистрации введите этот бонусный код, чтобы получить бонус для новых игроков в размере €1650 + 200 фриспинов. Чтобы получить этот бонус, вам нужно создать аккаунт и ввести специальный промокод казино 1хСлотс.
1xSlot Промокод
NEXT777
В казино 1xSlots 2024 доступны различные бонусы: бездепозитные при регистрации, промокоды, фриспины, кэшбэки и другие акции.
Промокод 1xSlots 2024: NEXT777 – введите код при регистрации в казино 1хСлот и получите приветственный бонус €1650 +200 фриспинов. Чтобы промокод 1xSlots на бездепозитный бонус сработал, необходимо указать рабочую комбинацию при регистрации и правильно заполнить форму анкеты. После завершения регистрации бездепозитный бонус будет доступен в личном кабинете. Рекомендуется не торопиться и сразу после создания аккаунта заполнить персональные данные. Важно указать требуемую информацию в полях, отмеченных звездочкой во вкладке “Профиль”, а также активировать контакты (номер телефона и e-mail).
Для новых клиентов промокод 1xSlots предоставляет уникальные возможности, позволяющие бесплатно опробовать один из представленных на платформе слотов. Чтобы получить бездепозитные фриспины, достаточно при регистрации указать промокод и выполнить простые условия акции, которые мы расскажем в данной статье. Игроки, желающие продолжить игру и сделать первый депозит, смогут получить щедрый приветственный бонус до €1500 и 150 бесплатных вращений.
Для получения бонуса на первый депозит необходимо пополнить счет на сумму не менее 10. Награда составляет 100% от суммы первого пополнения, но не может превышать 300. Если сумма пополнения превышает максимальный лимит, игрок получит свой депозит полностью, а также 300 в качестве бонуса. Для активации второго, третьего и четвертого этапов, сумма депозита должна быть не менее 15.
Кроме денежного вознаграждения, каждый этап сопровождается бесплатными прокрутками для игр компании:
– за первый депозит – 30 фриспинов для игры Book of Gold: Classic;
– за второй депозит – 35 фриспинов для игры в Legend of Cleopatra;
– за третий депозит – 40 фриспинов для игры в Solar Queen;
– за четвертый депозит – 45 фриспинов для игры в Imperial Fruits: 40 lines.
Казино 1xSlots предоставляет бонус поэтапно. Чтобы получить награду за второй и последующие депозиты, необходимо выполнить условия отыгрыша ранее полученных средств. Фриспины также начисляются поэтапно и зачисляются после выполнения условий отыгрыша.
Промокод для 1xСлотс: NEXT777. Получите бездепозитный приветственный пакет до €1650 +200 фриспинов. Компания 1xSlots предлагает своим клиентам ряд бонусных программ, самой популярной из которых является приветственный пакет с увеличением первого депозита и бесплатными вращениями. С использованием промокода вы можете получить до 1650 евро и 200 фриспинов. Одним из явных преимуществ 1xSlots является огромный выбор игр. Большую часть из доступных 10 тысяч развлечений занимают игровые автоматы. Пользователям предлагается более 100 различных провайдеров слотов.
Промокод не имеет срока действия. Любой пользователь, который создает аккаунт на сайте 1xSlots, может его активировать. Каждому игроку предоставляется только один бонус, поэтому промокод может быть использован только один раз. Чтобы воспользоваться промокодом, необходимо нажать на кнопку “Регистрация”, выбрать удобный способ создания аккаунта, указать все необходимые данные, подтвердить номер телефона или адрес электронной почты и ввести промокод. После этого можно завершить регистрацию, нажав на кнопку “Зарегистрироваться”.
1xSlots Промокод для Регистрации
Бонусы казино 1xSlots 2024 – Бездепозитные бонусы ? Коды на возврат средств ? VIP программа преданности ? Бесплатные фриспины.
Промокод 1xSlots при Регистрации: NEXT777 Получите эксклюзивный приветственный пакет до 1650 евро +150 фриспинов. Казино 1xSlots 2024 предлагает своим гостям не только широкий выбор игровых автоматов. На сайте казино регулярно проводятся бонусные акции, в рамках которых можно получить различные подарки, процент от депозита, фриспины и многое другое. При обычной регистрации есть ограничение по сумме – не более 1500 евро на первые четыре депозита. Первое пополнение – до 300 евро, второе – не более 350, третье – 400, четвертое – 450 евро. После ввода промокода лимит увеличивается до 1650 евро, а количество фриспинов возрастает с 150 до 200 вращений.
Получите бездепозитный бонус в размере 100 фриспинов в онлайн казино 1xSlots в 2024 году. Все активные бонус коды, промокоды и купоны от 1хСлотс (1xSlots) доступны как для новых, так и для существующих игроков. В клубе 1xSlots промокоды предоставляют дополнительные бонусы пользователям. Кроме того, в клубе проводятся множество турниров с крупными призовыми фондами, в которых может принять участие любой зарегистрированный игрок.
1xSlots фриспины промокод: NEXT777. Размер приветственного поощрения составляет 100 фриспинов в автомате Eye of Storm от провайдера Pragmatic Play. Время на его активацию неограничено. Подарок выдается единожды, попытки повторного создания учетной записи для получения фриспинов приравниваются к мошенническим действиям. Альтернативным способом получения бонус-кодов является активное заключение пари в системе. Вращая барабаны игровых автоматов и зарабатывая баллы можно получить право на фриспины, благодаря промо. Список промокодов 1xslots доступен непосредственно на официальном сайте. Чтобы получить бездепозитный бонус код для 1хслотс в 2024 году, следует выполнить следующие условия:
1. Активировать бонусные средства в личном кабинете;
2. Пополнить счет на €15 (или эквивалент в другой валюте) и более, чтобы привязать банковскую карту или онлайн-кошелек;
3. Выполнить условия вейджера: x25. Для этого необходимо поставить из своих денег сумму, равную выигрышу с бесплатных вращений, умноженную в 25 раз. На отыгрыш дается 7 дней с момента, когда вы прокрутили фриспины.
Максимальная сумма вознаграждения составляет 1650 евро. Ее необходимо отыграть с вейджером 35 раз. Казино предлагает релоад-бонусы, которые также нужно отыграть 35 раз. Однако особое место среди множества игр, слотов и турниров на 1xSlots занимает лайв-казино. Это казино, где игра происходит в режиме реального времени. Настоящие дилеры раздают карты и крутят рулетку за игровыми столами. Все эти действия передаются по видеосвязи. Благодаря такой видеотрансляции каждый игрок может почувствовать все эмоции и азарт игры в интерактивной атмосфере с профессиональными дилерами.
При регистрации на 1xSlots используйте промокод “NEXT777” и получите бездепозитный бонус в размере €1650 + 200 фриспинов. Казино 1xSlots радует своих игроков различными бонусами, такими как промокоды, фриспины и бездепозитные бонусы. Особенно щедрые подарки от казино 1xSlots предназначены для новичков.
В дополнение к бонусной программе онлайн казино 1xSlots предлагает кешбэк до 11%, начисляемый от суммы проигранных средств. Кешбэк не имеет срока отыгрыша. Сидя дома перед компьютером, удается почувствовать атмосферу присутствия в настоящем казино. Именно этими причинами объясняется такая популярность и широкий спрос лайв-казино.
промокод 1xslots без отыгрыша промокоды на сегодня – Бонус по промокоду 1хСлотс увеличивается с €1500 + 150 фриспинов до €1650 + 200 фриспинов.
Промокод 1xSlots на Сегодня: NEXT777 предоставляет вам возможность получить €1500 +150 FS при регистрации с использованием бонусного кода. Теперь бонус по промокоду составляет €1650 + 200 фриспинов, что на €150 больше, чем раньше. Это отличная возможность получить еще больше выгоды от игры. Казино 1xSlots 2024 – это платформа для игровых автоматов и Турниров. В казино 1хСлотс доступны различные бонусы, такие как промокоды, фриспины и бездепозитные бонусы. Особенно крупные подарки в казино 1xSlots предназначены для новичков.
Выгодная бонусная программа на сайте 1xslots позволяет как новичкам, так и опытным игрокам получать разнообразные подарки. Кроме того, это отличная возможность увеличить свой выигрыш. В казино 1xslots бонусы за депозиты и подарки не требуют дополнительных вложений. Используя фриспины и промокоды, вы можете получить хорошие деньги. Давайте подробнее рассмотрим, какие бонусы предлагает онлайн казино.
После прохождения регистрации игроку предлагается бонус на первые четыре операции по пополнению счета:
на первый депозит – 100% от внесенных средств и 30 фриспинов;
на второй депозит – 50% от внесенных средств и 35 фриспинов;
на третий депозит – 25% от внесенных средств и 40 фриспинов;
на четвертый депозит – 25% от внесенных средств и 45 фриспинов.
Промокод, также известный как код приглашения, является ключом-активатором приветственной программы для новичков. Если вы ранее не имели опыта игры в 1xSlots, то вы можете рассчитывать на получение щедрого подарка при регистрации – пакета из 1650 евро и 200 бесплатных прокруток. Согласно правилам бонусной акции, размер поощрения зависит от суммы первых четырех взносов и распределяется следующим образом: на депозитный бонус установлен максимальный лимит в 1500 евро. Чтобы получить подарок, игроку достаточно пройти процедуру регистрации, заполнить анкетные данные в личном кабинете и внести на счет профиля сумму от 10 евро.
При регистрации клиент может использовать промокод 1xSlots и получить дополнительный подарок.
1xSlots давно занимает прочные позиции в списке лучших брендов гемблинг-индустрии. Политика компании 1x ориентирована на опытных игроков, здесь пользователей ожидает продуманная программа лояльности, а также гарантии безопасности личной информации и депозита. Все действия осуществляются на основании лицензии 8048/JAZ2016-083, полученной от компании Orakum N.V., Кюрасао.
Промокод 1хСлот 2024: NEXT777 предоставляет бездепозитный бонус в виде 150 вращений в игре «The Dog House Megaways». В онлайн казино 1xslots доступны бесплатные промокоды на фриспины. Кроме того, игроки могут получать бонусные вращения не только за регистрацию или использование промокода от 1xSlots. Участие в бонусных акциях также позволяет пользователям получить фриспины. Казино 1хSlots предлагает различные варианты депозитов и выплат. Новые игроки, которые регистрируются на 1хSlots, получают приветственный пакет бонусов, однако с использованием промокода от 1xSlots этот бонус может быть еще более значительным. Для активации бонуса необходимо применить актуальный промокод при регистрации.
Приветственный пакет от 1xSlot доступен сразу после регистрации и требует активации через создание депозита. Бонус предоставляет умножение для первых четырех депозитов и дополнительные бесплатные вращения. Минимальная сумма для первого депозита составляет 10 евро, а для последующих пополнений – 15 евро. Максимальная сумма бонуса – 1500 евро.
Также новичкам предоставляются бонусы на второй, третий и четвертый депозит. Для получения подарка необходимо внести сумму не менее 15 евро. Игрокам также предоставляются фриспины и депозитные подарки. Для начисления фриспинов требуется подтверждение номера телефона.
Для постоянных игроков онлайн-казино 1xSlots проводит бонусные акции. Некоторые из них имеют временный характер, а другие действуют постоянно. В основном, пользователям предлагаются депозитные бонусы. Например, можно получить презент за пополнение счета в понедельник. За десятый депозит игроку полагается крупный депозитный бонус в размере 50% от вносимой суммы и 100 фриспинов.
В клубе 1xSlots также действует программа лояльности, которая предполагает различные привилегии для игроков.
Игрокам, активно делающим ставки в течение недели и ушедшим в минус, казино 1xSlots предлагает фриспины. Для получения бонуса не требуется пополнение счета, лимит на максимальный выигрыш и вейджер не устанавливаются.
Ежедневно в казино 1хСлотс назначается слот дня. При совершении ставок на определенную сумму в этом игровом аппарате игроку начисляются фриспины. Обратите внимание https://www.iesp.pa.gov.br/wp-content/pgs/?1xslots_codigo_promocional_bono_giros_gratis.html, время действия акции ограничено.
Разработчиками 1хСлотс было разработано мобильное казино. Такая версия представляет собой упрощенный вариант компьютерного формата онлайн казино. Она позволяет играть в любимые игры на любом устройстве, поддерживающем функцию выхода в интернет. В качестве такого устройства может быть смартфон или планшет.
Aw, this was a very nice post. In idea I want to put in writing like this moreover – taking time and precise effort to make an excellent article… but what can I say… I procrastinate alot and not at all seem to get something done.
Промокод 1xbet при регистрации. Промо-код встречается на просторах сети достаточно часто. Букмекер использует его для привлечения новых игроков в индустрию ставок, но преимущество предоставляется и новому игроку. После того как он совершит первый депозит, на его бонусный счёт поступит аналогичная сумма, до 32500 рублей. промокод на сегодня в 1хбет бесплатную ставку Данный вид бонус-кода также популярен в поиске. Указывать его надо в купоне для совершения ставки. Промокод 1xbet на ставку практически невозможно найти в бесплатном доступе. Он вручается игрокам индивидуально.К примеру, компания промокодов. В данном разделе подробно расписан процесс получения – более подробно в этом материале http://lipetskregionsport.ru/news/pages/1xbet_promokod.html
1xSlots Промокод (Бездепозитный Бонус 2024)
1xSlots промокод: NEXT777, при регистрации введите этот бонусный код, чтобы получить бонус для новых игроков в размере €1650 + 200 фриспинов. Чтобы получить этот бонус, вам нужно создать аккаунт и ввести специальный промокод казино 1хСлотс.
1xSlot Промокод
NEXT777
В казино 1xSlots 2024 доступны различные бонусы: бездепозитные при регистрации, промокоды, фриспины, кэшбэки и другие акции.
Промокод 1xSlots 2024: NEXT777 – введите код при регистрации в казино 1хСлот и получите приветственный бонус €1650 +200 фриспинов. Чтобы промокод 1xSlots на бездепозитный бонус сработал, необходимо указать рабочую комбинацию при регистрации и правильно заполнить форму анкеты. После завершения регистрации бездепозитный бонус будет доступен в личном кабинете. Рекомендуется не торопиться и сразу после создания аккаунта заполнить персональные данные. Важно указать требуемую информацию в полях, отмеченных звездочкой во вкладке “Профиль”, а также активировать контакты (номер телефона и e-mail).
Для новых клиентов промокод 1xSlots предоставляет уникальные возможности, позволяющие бесплатно опробовать один из представленных на платформе слотов. Чтобы получить бездепозитные фриспины, достаточно при регистрации указать промокод и выполнить простые условия акции, которые мы расскажем в данной статье. Игроки, желающие продолжить игру и сделать первый депозит, смогут получить щедрый приветственный бонус до €1500 и 150 бесплатных вращений.
Для получения бонуса на первый депозит необходимо пополнить счет на сумму не менее 10. Награда составляет 100% от суммы первого пополнения, но не может превышать 300. Если сумма пополнения превышает максимальный лимит, игрок получит свой депозит полностью, а также 300 в качестве бонуса. Для активации второго, третьего и четвертого этапов, сумма депозита должна быть не менее 15.
Кроме денежного вознаграждения, каждый этап сопровождается бесплатными прокрутками для игр компании:
– за первый депозит – 30 фриспинов для игры Book of Gold: Classic;
– за второй депозит – 35 фриспинов для игры в Legend of Cleopatra;
– за третий депозит – 40 фриспинов для игры в Solar Queen;
– за четвертый депозит – 45 фриспинов для игры в Imperial Fruits: 40 lines.
Казино 1xSlots предоставляет бонус поэтапно. Чтобы получить награду за второй и последующие депозиты, необходимо выполнить условия отыгрыша ранее полученных средств. Фриспины также начисляются поэтапно и зачисляются после выполнения условий отыгрыша.
Промокод для 1xСлотс: NEXT777. Получите бездепозитный приветственный пакет до €1650 +200 фриспинов. Компания 1xSlots предлагает своим клиентам ряд бонусных программ, самой популярной из которых является приветственный пакет с увеличением первого депозита и бесплатными вращениями. С использованием промокода вы можете получить до 1650 евро и 200 фриспинов. Одним из явных преимуществ 1xSlots является огромный выбор игр. Большую часть из доступных 10 тысяч развлечений занимают игровые автоматы. Пользователям предлагается более 100 различных провайдеров слотов.
Промокод не имеет срока действия. Любой пользователь, который создает аккаунт на сайте 1xSlots, может его активировать. Каждому игроку предоставляется только один бонус, поэтому промокод может быть использован только один раз. Чтобы воспользоваться промокодом, необходимо нажать на кнопку “Регистрация”, выбрать удобный способ создания аккаунта, указать все необходимые данные, подтвердить номер телефона или адрес электронной почты и ввести промокод. После этого можно завершить регистрацию, нажав на кнопку “Зарегистрироваться”.
1xSlots Промокод для Регистрации
Бонусы казино 1xSlots 2024 – Бездепозитные бонусы ? Коды на возврат средств ? VIP программа преданности ? Бесплатные фриспины.
Промокод 1xSlots при Регистрации: NEXT777 Получите эксклюзивный приветственный пакет до 1650 евро +150 фриспинов. Казино 1xSlots 2024 предлагает своим гостям не только широкий выбор игровых автоматов. На сайте казино регулярно проводятся бонусные акции, в рамках которых можно получить различные подарки, процент от депозита, фриспины и многое другое. При обычной регистрации есть ограничение по сумме – не более 1500 евро на первые четыре депозита. Первое пополнение – до 300 евро, второе – не более 350, третье – 400, четвертое – 450 евро. После ввода промокода лимит увеличивается до 1650 евро, а количество фриспинов возрастает с 150 до 200 вращений.
Получите бездепозитный бонус в размере 100 фриспинов в онлайн казино 1xSlots в 2024 году. Все активные бонус коды, промокоды и купоны от 1хСлотс (1xSlots) доступны как для новых, так и для существующих игроков. В клубе 1xSlots промокоды предоставляют дополнительные бонусы пользователям. Кроме того, в клубе проводятся множество турниров с крупными призовыми фондами, в которых может принять участие любой зарегистрированный игрок.
1xSlots фриспины промокод: NEXT777. Размер приветственного поощрения составляет 100 фриспинов в автомате Eye of Storm от провайдера Pragmatic Play. Время на его активацию неограничено. Подарок выдается единожды, попытки повторного создания учетной записи для получения фриспинов приравниваются к мошенническим действиям. Альтернативным способом получения бонус-кодов является активное заключение пари в системе. Вращая барабаны игровых автоматов и зарабатывая баллы можно получить право на фриспины, благодаря промо. Список промокодов 1xslots доступен непосредственно на официальном сайте. Чтобы получить бездепозитный бонус код для 1хслотс в 2024 году, следует выполнить следующие условия:
1. Активировать бонусные средства в личном кабинете;
2. Пополнить счет на €15 (или эквивалент в другой валюте) и более, чтобы привязать банковскую карту или онлайн-кошелек;
3. Выполнить условия вейджера: x25. Для этого необходимо поставить из своих денег сумму, равную выигрышу с бесплатных вращений, умноженную в 25 раз. На отыгрыш дается 7 дней с момента, когда вы прокрутили фриспины.
Максимальная сумма вознаграждения составляет 1650 евро. Ее необходимо отыграть с вейджером 35 раз. Казино предлагает релоад-бонусы, которые также нужно отыграть 35 раз. Однако особое место среди множества игр, слотов и турниров на 1xSlots занимает лайв-казино. Это казино, где игра происходит в режиме реального времени. Настоящие дилеры раздают карты и крутят рулетку за игровыми столами. Все эти действия передаются по видеосвязи. Благодаря такой видеотрансляции каждый игрок может почувствовать все эмоции и азарт игры в интерактивной атмосфере с профессиональными дилерами.
При регистрации на 1xSlots используйте промокод “NEXT777” и получите бездепозитный бонус в размере €1650 + 200 фриспинов. Казино 1xSlots радует своих игроков различными бонусами, такими как промокоды, фриспины и бездепозитные бонусы. Особенно щедрые подарки от казино 1xSlots предназначены для новичков.
В дополнение к бонусной программе онлайн казино 1xSlots предлагает кешбэк до 11%, начисляемый от суммы проигранных средств. Кешбэк не имеет срока отыгрыша. Сидя дома перед компьютером, удается почувствовать атмосферу присутствия в настоящем казино. Именно этими причинами объясняется такая популярность и широкий спрос лайв-казино.
1xslots бездепозитный бонус промокод за регистрацию – Бонус по промокоду 1хСлотс увеличивается с €1500 + 150 фриспинов до €1650 + 200 фриспинов.
Промокод 1xSlots на Сегодня: NEXT777 предоставляет вам возможность получить €1500 +150 FS при регистрации с использованием бонусного кода. Теперь бонус по промокоду составляет €1650 + 200 фриспинов, что на €150 больше, чем раньше. Это отличная возможность получить еще больше выгоды от игры. Казино 1xSlots 2024 – это платформа для игровых автоматов и Турниров. В казино 1хСлотс доступны различные бонусы, такие как промокоды, фриспины и бездепозитные бонусы. Особенно крупные подарки в казино 1xSlots предназначены для новичков.
Выгодная бонусная программа на сайте 1xslots позволяет как новичкам, так и опытным игрокам получать разнообразные подарки. Кроме того, это отличная возможность увеличить свой выигрыш. В казино 1xslots бонусы за депозиты и подарки не требуют дополнительных вложений. Используя фриспины и промокоды, вы можете получить хорошие деньги. Давайте подробнее рассмотрим, какие бонусы предлагает онлайн казино.
После прохождения регистрации игроку предлагается бонус на первые четыре операции по пополнению счета:
на первый депозит – 100% от внесенных средств и 30 фриспинов;
на второй депозит – 50% от внесенных средств и 35 фриспинов;
на третий депозит – 25% от внесенных средств и 40 фриспинов;
на четвертый депозит – 25% от внесенных средств и 45 фриспинов.
Промокод, также известный как код приглашения, является ключом-активатором приветственной программы для новичков. Если вы ранее не имели опыта игры в 1xSlots, то вы можете рассчитывать на получение щедрого подарка при регистрации – пакета из 1650 евро и 200 бесплатных прокруток. Согласно правилам бонусной акции, размер поощрения зависит от суммы первых четырех взносов и распределяется следующим образом: на депозитный бонус установлен максимальный лимит в 1500 евро. Чтобы получить подарок, игроку достаточно пройти процедуру регистрации, заполнить анкетные данные в личном кабинете и внести на счет профиля сумму от 10 евро.
При регистрации клиент может использовать промокод 1xSlots и получить дополнительный подарок.
1xSlots давно занимает прочные позиции в списке лучших брендов гемблинг-индустрии. Политика компании 1x ориентирована на опытных игроков, здесь пользователей ожидает продуманная программа лояльности, а также гарантии безопасности личной информации и депозита. Все действия осуществляются на основании лицензии 8048/JAZ2016-083, полученной от компании Orakum N.V., Кюрасао.
Промокод 1хСлот 2024: NEXT777 предоставляет бездепозитный бонус в виде 150 вращений в игре «The Dog House Megaways». В онлайн казино 1xslots доступны бесплатные промокоды на фриспины. Кроме того, игроки могут получать бонусные вращения не только за регистрацию или использование промокода от 1xSlots. Участие в бонусных акциях также позволяет пользователям получить фриспины. Казино 1хSlots предлагает различные варианты депозитов и выплат. Новые игроки, которые регистрируются на 1хSlots, получают приветственный пакет бонусов, однако с использованием промокода от 1xSlots этот бонус может быть еще более значительным. Для активации бонуса необходимо применить актуальный промокод при регистрации.
Приветственный пакет от 1xSlot доступен сразу после регистрации и требует активации через создание депозита. Бонус предоставляет умножение для первых четырех депозитов и дополнительные бесплатные вращения. Минимальная сумма для первого депозита составляет 10 евро, а для последующих пополнений – 15 евро. Максимальная сумма бонуса – 1500 евро.
Также новичкам предоставляются бонусы на второй, третий и четвертый депозит. Для получения подарка необходимо внести сумму не менее 15 евро. Игрокам также предоставляются фриспины и депозитные подарки. Для начисления фриспинов требуется подтверждение номера телефона.
Для постоянных игроков онлайн-казино 1xSlots проводит бонусные акции. Некоторые из них имеют временный характер, а другие действуют постоянно. В основном, пользователям предлагаются депозитные бонусы. Например, можно получить презент за пополнение счета в понедельник. За десятый депозит игроку полагается крупный депозитный бонус в размере 50% от вносимой суммы и 100 фриспинов.
В клубе 1xSlots также действует программа лояльности, которая предполагает различные привилегии для игроков.
Игрокам, активно делающим ставки в течение недели и ушедшим в минус, казино 1xSlots предлагает фриспины. Для получения бонуса не требуется пополнение счета, лимит на максимальный выигрыш и вейджер не устанавливаются.
Ежедневно в казино 1хСлотс назначается слот дня. При совершении ставок на определенную сумму в этом игровом аппарате игроку начисляются фриспины. Обратите внимание https://xenon-lampa.ru/content/pags/promokod_1xslots.html, время действия акции ограничено.
Разработчиками 1хСлотс было разработано мобильное казино. Такая версия представляет собой упрощенный вариант компьютерного формата онлайн казино. Она позволяет играть в любимые игры на любом устройстве, поддерживающем функцию выхода в интернет. В качестве такого устройства может быть смартфон или планшет.
1xSlots Промокод (Бездепозитный Бонус 2024)
1xSlots промокод: NEXT777, при регистрации введите этот бонусный код, чтобы получить бонус для новых игроков в размере €1650 + 200 фриспинов. Чтобы получить этот бонус, вам нужно создать аккаунт и ввести специальный промокод казино 1хСлотс.
1xSlot Промокод
NEXT777
В казино 1xSlots 2024 доступны различные бонусы: бездепозитные при регистрации, промокоды, фриспины, кэшбэки и другие акции.
Промокод 1xSlots 2024: NEXT777 – введите код при регистрации в казино 1хСлот и получите приветственный бонус €1650 +200 фриспинов. Чтобы промокод 1xSlots на бездепозитный бонус сработал, необходимо указать рабочую комбинацию при регистрации и правильно заполнить форму анкеты. После завершения регистрации бездепозитный бонус будет доступен в личном кабинете. Рекомендуется не торопиться и сразу после создания аккаунта заполнить персональные данные. Важно указать требуемую информацию в полях, отмеченных звездочкой во вкладке “Профиль”, а также активировать контакты (номер телефона и e-mail).
Для новых клиентов промокод 1xSlots предоставляет уникальные возможности, позволяющие бесплатно опробовать один из представленных на платформе слотов. Чтобы получить бездепозитные фриспины, достаточно при регистрации указать промокод и выполнить простые условия акции, которые мы расскажем в данной статье. Игроки, желающие продолжить игру и сделать первый депозит, смогут получить щедрый приветственный бонус до €1500 и 150 бесплатных вращений.
Для получения бонуса на первый депозит необходимо пополнить счет на сумму не менее 10. Награда составляет 100% от суммы первого пополнения, но не может превышать 300. Если сумма пополнения превышает максимальный лимит, игрок получит свой депозит полностью, а также 300 в качестве бонуса. Для активации второго, третьего и четвертого этапов, сумма депозита должна быть не менее 15.
Кроме денежного вознаграждения, каждый этап сопровождается бесплатными прокрутками для игр компании:
– за первый депозит – 30 фриспинов для игры Book of Gold: Classic;
– за второй депозит – 35 фриспинов для игры в Legend of Cleopatra;
– за третий депозит – 40 фриспинов для игры в Solar Queen;
– за четвертый депозит – 45 фриспинов для игры в Imperial Fruits: 40 lines.
Казино 1xSlots предоставляет бонус поэтапно. Чтобы получить награду за второй и последующие депозиты, необходимо выполнить условия отыгрыша ранее полученных средств. Фриспины также начисляются поэтапно и зачисляются после выполнения условий отыгрыша.
Промокод для 1xСлотс: NEXT777. Получите бездепозитный приветственный пакет до €1650 +200 фриспинов. Компания 1xSlots предлагает своим клиентам ряд бонусных программ, самой популярной из которых является приветственный пакет с увеличением первого депозита и бесплатными вращениями. С использованием промокода вы можете получить до 1650 евро и 200 фриспинов. Одним из явных преимуществ 1xSlots является огромный выбор игр. Большую часть из доступных 10 тысяч развлечений занимают игровые автоматы. Пользователям предлагается более 100 различных провайдеров слотов.
Промокод не имеет срока действия. Любой пользователь, который создает аккаунт на сайте 1xSlots, может его активировать. Каждому игроку предоставляется только один бонус, поэтому промокод может быть использован только один раз. Чтобы воспользоваться промокодом, необходимо нажать на кнопку “Регистрация”, выбрать удобный способ создания аккаунта, указать все необходимые данные, подтвердить номер телефона или адрес электронной почты и ввести промокод. После этого можно завершить регистрацию, нажав на кнопку “Зарегистрироваться”.
1xSlots Промокод для Регистрации
Бонусы казино 1xSlots 2024 – Бездепозитные бонусы ? Коды на возврат средств ? VIP программа преданности ? Бесплатные фриспины.
Промокод 1xSlots при Регистрации: NEXT777 Получите эксклюзивный приветственный пакет до 1650 евро +150 фриспинов. Казино 1xSlots 2024 предлагает своим гостям не только широкий выбор игровых автоматов. На сайте казино регулярно проводятся бонусные акции, в рамках которых можно получить различные подарки, процент от депозита, фриспины и многое другое. При обычной регистрации есть ограничение по сумме – не более 1500 евро на первые четыре депозита. Первое пополнение – до 300 евро, второе – не более 350, третье – 400, четвертое – 450 евро. После ввода промокода лимит увеличивается до 1650 евро, а количество фриспинов возрастает с 150 до 200 вращений.
Получите бездепозитный бонус в размере 100 фриспинов в онлайн казино 1xSlots в 2024 году. Все активные бонус коды, промокоды и купоны от 1хСлотс (1xSlots) доступны как для новых, так и для существующих игроков. В клубе 1xSlots промокоды предоставляют дополнительные бонусы пользователям. Кроме того, в клубе проводятся множество турниров с крупными призовыми фондами, в которых может принять участие любой зарегистрированный игрок.
1xSlots фриспины промокод: NEXT777. Размер приветственного поощрения составляет 100 фриспинов в автомате Eye of Storm от провайдера Pragmatic Play. Время на его активацию неограничено. Подарок выдается единожды, попытки повторного создания учетной записи для получения фриспинов приравниваются к мошенническим действиям. Альтернативным способом получения бонус-кодов является активное заключение пари в системе. Вращая барабаны игровых автоматов и зарабатывая баллы можно получить право на фриспины, благодаря промо. Список промокодов 1xslots доступен непосредственно на официальном сайте. Чтобы получить бездепозитный бонус код для 1хслотс в 2024 году, следует выполнить следующие условия:
1. Активировать бонусные средства в личном кабинете;
2. Пополнить счет на €15 (или эквивалент в другой валюте) и более, чтобы привязать банковскую карту или онлайн-кошелек;
3. Выполнить условия вейджера: x25. Для этого необходимо поставить из своих денег сумму, равную выигрышу с бесплатных вращений, умноженную в 25 раз. На отыгрыш дается 7 дней с момента, когда вы прокрутили фриспины.
Максимальная сумма вознаграждения составляет 1650 евро. Ее необходимо отыграть с вейджером 35 раз. Казино предлагает релоад-бонусы, которые также нужно отыграть 35 раз. Однако особое место среди множества игр, слотов и турниров на 1xSlots занимает лайв-казино. Это казино, где игра происходит в режиме реального времени. Настоящие дилеры раздают карты и крутят рулетку за игровыми столами. Все эти действия передаются по видеосвязи. Благодаря такой видеотрансляции каждый игрок может почувствовать все эмоции и азарт игры в интерактивной атмосфере с профессиональными дилерами.
При регистрации на 1xSlots используйте промокод “NEXT777” и получите бездепозитный бонус в размере €1650 + 200 фриспинов. Казино 1xSlots радует своих игроков различными бонусами, такими как промокоды, фриспины и бездепозитные бонусы. Особенно щедрые подарки от казино 1xSlots предназначены для новичков.
В дополнение к бонусной программе онлайн казино 1xSlots предлагает кешбэк до 11%, начисляемый от суммы проигранных средств. Кешбэк не имеет срока отыгрыша. Сидя дома перед компьютером, удается почувствовать атмосферу присутствия в настоящем казино. Именно этими причинами объясняется такая популярность и широкий спрос лайв-казино.
1xslots промокод на сегодня – Бонус по промокоду 1хСлотс увеличивается с €1500 + 150 фриспинов до €1650 + 200 фриспинов.
Промокод 1xSlots на Сегодня: NEXT777 предоставляет вам возможность получить €1500 +150 FS при регистрации с использованием бонусного кода. Теперь бонус по промокоду составляет €1650 + 200 фриспинов, что на €150 больше, чем раньше. Это отличная возможность получить еще больше выгоды от игры. Казино 1xSlots 2024 – это платформа для игровых автоматов и Турниров. В казино 1хСлотс доступны различные бонусы, такие как промокоды, фриспины и бездепозитные бонусы. Особенно крупные подарки в казино 1xSlots предназначены для новичков.
Выгодная бонусная программа на сайте 1xslots позволяет как новичкам, так и опытным игрокам получать разнообразные подарки. Кроме того, это отличная возможность увеличить свой выигрыш. В казино 1xslots бонусы за депозиты и подарки не требуют дополнительных вложений. Используя фриспины и промокоды, вы можете получить хорошие деньги. Давайте подробнее рассмотрим, какие бонусы предлагает онлайн казино.
После прохождения регистрации игроку предлагается бонус на первые четыре операции по пополнению счета:
на первый депозит – 100% от внесенных средств и 30 фриспинов;
на второй депозит – 50% от внесенных средств и 35 фриспинов;
на третий депозит – 25% от внесенных средств и 40 фриспинов;
на четвертый депозит – 25% от внесенных средств и 45 фриспинов.
Промокод, также известный как код приглашения, является ключом-активатором приветственной программы для новичков. Если вы ранее не имели опыта игры в 1xSlots, то вы можете рассчитывать на получение щедрого подарка при регистрации – пакета из 1650 евро и 200 бесплатных прокруток. Согласно правилам бонусной акции, размер поощрения зависит от суммы первых четырех взносов и распределяется следующим образом: на депозитный бонус установлен максимальный лимит в 1500 евро. Чтобы получить подарок, игроку достаточно пройти процедуру регистрации, заполнить анкетные данные в личном кабинете и внести на счет профиля сумму от 10 евро.
При регистрации клиент может использовать промокод 1xSlots и получить дополнительный подарок.
1xSlots давно занимает прочные позиции в списке лучших брендов гемблинг-индустрии. Политика компании 1x ориентирована на опытных игроков, здесь пользователей ожидает продуманная программа лояльности, а также гарантии безопасности личной информации и депозита. Все действия осуществляются на основании лицензии 8048/JAZ2016-083, полученной от компании Orakum N.V., Кюрасао.
Промокод 1хСлот 2024: NEXT777 предоставляет бездепозитный бонус в виде 150 вращений в игре «The Dog House Megaways». В онлайн казино 1xslots доступны бесплатные промокоды на фриспины. Кроме того, игроки могут получать бонусные вращения не только за регистрацию или использование промокода от 1xSlots. Участие в бонусных акциях также позволяет пользователям получить фриспины. Казино 1хSlots предлагает различные варианты депозитов и выплат. Новые игроки, которые регистрируются на 1хSlots, получают приветственный пакет бонусов, однако с использованием промокода от 1xSlots этот бонус может быть еще более значительным. Для активации бонуса необходимо применить актуальный промокод при регистрации.
Приветственный пакет от 1xSlot доступен сразу после регистрации и требует активации через создание депозита. Бонус предоставляет умножение для первых четырех депозитов и дополнительные бесплатные вращения. Минимальная сумма для первого депозита составляет 10 евро, а для последующих пополнений – 15 евро. Максимальная сумма бонуса – 1500 евро.
Также новичкам предоставляются бонусы на второй, третий и четвертый депозит. Для получения подарка необходимо внести сумму не менее 15 евро. Игрокам также предоставляются фриспины и депозитные подарки. Для начисления фриспинов требуется подтверждение номера телефона.
Для постоянных игроков онлайн-казино 1xSlots проводит бонусные акции. Некоторые из них имеют временный характер, а другие действуют постоянно. В основном, пользователям предлагаются депозитные бонусы. Например, можно получить презент за пополнение счета в понедельник. За десятый депозит игроку полагается крупный депозитный бонус в размере 50% от вносимой суммы и 100 фриспинов.
В клубе 1xSlots также действует программа лояльности, которая предполагает различные привилегии для игроков.
Игрокам, активно делающим ставки в течение недели и ушедшим в минус, казино 1xSlots предлагает фриспины. Для получения бонуса не требуется пополнение счета, лимит на максимальный выигрыш и вейджер не устанавливаются.
Ежедневно в казино 1хСлотс назначается слот дня. При совершении ставок на определенную сумму в этом игровом аппарате игроку начисляются фриспины. Обратите внимание https://xenon-lampa.ru/content/pags/promokod_1xslots.html, время действия акции ограничено.
Разработчиками 1хСлотс было разработано мобильное казино. Такая версия представляет собой упрощенный вариант компьютерного формата онлайн казино. Она позволяет играть в любимые игры на любом устройстве, поддерживающем функцию выхода в интернет. В качестве такого устройства может быть смартфон или планшет.
[url=https://happyfamilystorerx.online/]cheapest pharmacy prescription drugs[/url]
This is the right blog for anyone who wants to find out about this topic. You realize so much its almost hard to argue with you (not that I actually would want…HaHa). You definitely put a new spin on a topic thats been written about for years. Great stuff, just great!
1xSlots Промокод (Бездепозитный Бонус 2024)
1xSlots промокод: NEXT777, при регистрации введите этот бонусный код, чтобы получить бонус для новых игроков в размере €1650 + 200 фриспинов. Чтобы получить этот бонус, вам нужно создать аккаунт и ввести специальный промокод казино 1хСлотс.
1xSlot Промокод
NEXT777
В казино 1xSlots 2024 доступны различные бонусы: бездепозитные при регистрации, промокоды, фриспины, кэшбэки и другие акции.
Промокод 1xSlots 2024: NEXT777 – введите код при регистрации в казино 1хСлот и получите приветственный бонус €1650 +200 фриспинов. Чтобы промокод 1xSlots на бездепозитный бонус сработал, необходимо указать рабочую комбинацию при регистрации и правильно заполнить форму анкеты. После завершения регистрации бездепозитный бонус будет доступен в личном кабинете. Рекомендуется не торопиться и сразу после создания аккаунта заполнить персональные данные. Важно указать требуемую информацию в полях, отмеченных звездочкой во вкладке “Профиль”, а также активировать контакты (номер телефона и e-mail).
Для новых клиентов промокод 1xSlots предоставляет уникальные возможности, позволяющие бесплатно опробовать один из представленных на платформе слотов. Чтобы получить бездепозитные фриспины, достаточно при регистрации указать промокод и выполнить простые условия акции, которые мы расскажем в данной статье. Игроки, желающие продолжить игру и сделать первый депозит, смогут получить щедрый приветственный бонус до €1500 и 150 бесплатных вращений.
Для получения бонуса на первый депозит необходимо пополнить счет на сумму не менее 10. Награда составляет 100% от суммы первого пополнения, но не может превышать 300. Если сумма пополнения превышает максимальный лимит, игрок получит свой депозит полностью, а также 300 в качестве бонуса. Для активации второго, третьего и четвертого этапов, сумма депозита должна быть не менее 15.
Кроме денежного вознаграждения, каждый этап сопровождается бесплатными прокрутками для игр компании:
– за первый депозит – 30 фриспинов для игры Book of Gold: Classic;
– за второй депозит – 35 фриспинов для игры в Legend of Cleopatra;
– за третий депозит – 40 фриспинов для игры в Solar Queen;
– за четвертый депозит – 45 фриспинов для игры в Imperial Fruits: 40 lines.
Казино 1xSlots предоставляет бонус поэтапно. Чтобы получить награду за второй и последующие депозиты, необходимо выполнить условия отыгрыша ранее полученных средств. Фриспины также начисляются поэтапно и зачисляются после выполнения условий отыгрыша.
Промокод для 1xСлотс: NEXT777. Получите бездепозитный приветственный пакет до €1650 +200 фриспинов. Компания 1xSlots предлагает своим клиентам ряд бонусных программ, самой популярной из которых является приветственный пакет с увеличением первого депозита и бесплатными вращениями. С использованием промокода вы можете получить до 1650 евро и 200 фриспинов. Одним из явных преимуществ 1xSlots является огромный выбор игр. Большую часть из доступных 10 тысяч развлечений занимают игровые автоматы. Пользователям предлагается более 100 различных провайдеров слотов.
Промокод не имеет срока действия. Любой пользователь, который создает аккаунт на сайте 1xSlots, может его активировать. Каждому игроку предоставляется только один бонус, поэтому промокод может быть использован только один раз. Чтобы воспользоваться промокодом, необходимо нажать на кнопку “Регистрация”, выбрать удобный способ создания аккаунта, указать все необходимые данные, подтвердить номер телефона или адрес электронной почты и ввести промокод. После этого можно завершить регистрацию, нажав на кнопку “Зарегистрироваться”.
1xSlots Промокод для Регистрации
Бонусы казино 1xSlots 2024 – Бездепозитные бонусы ? Коды на возврат средств ? VIP программа преданности ? Бесплатные фриспины.
Промокод 1xSlots при Регистрации: NEXT777 Получите эксклюзивный приветственный пакет до 1650 евро +150 фриспинов. Казино 1xSlots 2024 предлагает своим гостям не только широкий выбор игровых автоматов. На сайте казино регулярно проводятся бонусные акции, в рамках которых можно получить различные подарки, процент от депозита, фриспины и многое другое. При обычной регистрации есть ограничение по сумме – не более 1500 евро на первые четыре депозита. Первое пополнение – до 300 евро, второе – не более 350, третье – 400, четвертое – 450 евро. После ввода промокода лимит увеличивается до 1650 евро, а количество фриспинов возрастает с 150 до 200 вращений.
Получите бездепозитный бонус в размере 100 фриспинов в онлайн казино 1xSlots в 2024 году. Все активные бонус коды, промокоды и купоны от 1хСлотс (1xSlots) доступны как для новых, так и для существующих игроков. В клубе 1xSlots промокоды предоставляют дополнительные бонусы пользователям. Кроме того, в клубе проводятся множество турниров с крупными призовыми фондами, в которых может принять участие любой зарегистрированный игрок.
1xSlots фриспины промокод: NEXT777. Размер приветственного поощрения составляет 100 фриспинов в автомате Eye of Storm от провайдера Pragmatic Play. Время на его активацию неограничено. Подарок выдается единожды, попытки повторного создания учетной записи для получения фриспинов приравниваются к мошенническим действиям. Альтернативным способом получения бонус-кодов является активное заключение пари в системе. Вращая барабаны игровых автоматов и зарабатывая баллы можно получить право на фриспины, благодаря промо. Список промокодов 1xslots доступен непосредственно на официальном сайте. Чтобы получить бездепозитный бонус код для 1хслотс в 2024 году, следует выполнить следующие условия:
1. Активировать бонусные средства в личном кабинете;
2. Пополнить счет на €15 (или эквивалент в другой валюте) и более, чтобы привязать банковскую карту или онлайн-кошелек;
3. Выполнить условия вейджера: x25. Для этого необходимо поставить из своих денег сумму, равную выигрышу с бесплатных вращений, умноженную в 25 раз. На отыгрыш дается 7 дней с момента, когда вы прокрутили фриспины.
Максимальная сумма вознаграждения составляет 1650 евро. Ее необходимо отыграть с вейджером 35 раз. Казино предлагает релоад-бонусы, которые также нужно отыграть 35 раз. Однако особое место среди множества игр, слотов и турниров на 1xSlots занимает лайв-казино. Это казино, где игра происходит в режиме реального времени. Настоящие дилеры раздают карты и крутят рулетку за игровыми столами. Все эти действия передаются по видеосвязи. Благодаря такой видеотрансляции каждый игрок может почувствовать все эмоции и азарт игры в интерактивной атмосфере с профессиональными дилерами.
При регистрации на 1xSlots используйте промокод “NEXT777” и получите бездепозитный бонус в размере €1650 + 200 фриспинов. Казино 1xSlots радует своих игроков различными бонусами, такими как промокоды, фриспины и бездепозитные бонусы. Особенно щедрые подарки от казино 1xSlots предназначены для новичков.
В дополнение к бонусной программе онлайн казино 1xSlots предлагает кешбэк до 11%, начисляемый от суммы проигранных средств. Кешбэк не имеет срока отыгрыша. Сидя дома перед компьютером, удается почувствовать атмосферу присутствия в настоящем казино. Именно этими причинами объясняется такая популярность и широкий спрос лайв-казино.
промокоды 1xslots без отыгрыша на сегодня – Бонус по промокоду 1хСлотс увеличивается с €1500 + 150 фриспинов до €1650 + 200 фриспинов.
Промокод 1xSlots на Сегодня: NEXT777 предоставляет вам возможность получить €1500 +150 FS при регистрации с использованием бонусного кода. Теперь бонус по промокоду составляет €1650 + 200 фриспинов, что на €150 больше, чем раньше. Это отличная возможность получить еще больше выгоды от игры. Казино 1xSlots 2024 – это платформа для игровых автоматов и Турниров. В казино 1хСлотс доступны различные бонусы, такие как промокоды, фриспины и бездепозитные бонусы. Особенно крупные подарки в казино 1xSlots предназначены для новичков.
Выгодная бонусная программа на сайте 1xslots позволяет как новичкам, так и опытным игрокам получать разнообразные подарки. Кроме того, это отличная возможность увеличить свой выигрыш. В казино 1xslots бонусы за депозиты и подарки не требуют дополнительных вложений. Используя фриспины и промокоды, вы можете получить хорошие деньги. Давайте подробнее рассмотрим, какие бонусы предлагает онлайн казино.
После прохождения регистрации игроку предлагается бонус на первые четыре операции по пополнению счета:
на первый депозит – 100% от внесенных средств и 30 фриспинов;
на второй депозит – 50% от внесенных средств и 35 фриспинов;
на третий депозит – 25% от внесенных средств и 40 фриспинов;
на четвертый депозит – 25% от внесенных средств и 45 фриспинов.
Промокод, также известный как код приглашения, является ключом-активатором приветственной программы для новичков. Если вы ранее не имели опыта игры в 1xSlots, то вы можете рассчитывать на получение щедрого подарка при регистрации – пакета из 1650 евро и 200 бесплатных прокруток. Согласно правилам бонусной акции, размер поощрения зависит от суммы первых четырех взносов и распределяется следующим образом: на депозитный бонус установлен максимальный лимит в 1500 евро. Чтобы получить подарок, игроку достаточно пройти процедуру регистрации, заполнить анкетные данные в личном кабинете и внести на счет профиля сумму от 10 евро.
При регистрации клиент может использовать промокод 1xSlots и получить дополнительный подарок.
1xSlots давно занимает прочные позиции в списке лучших брендов гемблинг-индустрии. Политика компании 1x ориентирована на опытных игроков, здесь пользователей ожидает продуманная программа лояльности, а также гарантии безопасности личной информации и депозита. Все действия осуществляются на основании лицензии 8048/JAZ2016-083, полученной от компании Orakum N.V., Кюрасао.
Промокод 1хСлот 2024: NEXT777 предоставляет бездепозитный бонус в виде 150 вращений в игре «The Dog House Megaways». В онлайн казино 1xslots доступны бесплатные промокоды на фриспины. Кроме того, игроки могут получать бонусные вращения не только за регистрацию или использование промокода от 1xSlots. Участие в бонусных акциях также позволяет пользователям получить фриспины. Казино 1хSlots предлагает различные варианты депозитов и выплат. Новые игроки, которые регистрируются на 1хSlots, получают приветственный пакет бонусов, однако с использованием промокода от 1xSlots этот бонус может быть еще более значительным. Для активации бонуса необходимо применить актуальный промокод при регистрации.
Приветственный пакет от 1xSlot доступен сразу после регистрации и требует активации через создание депозита. Бонус предоставляет умножение для первых четырех депозитов и дополнительные бесплатные вращения. Минимальная сумма для первого депозита составляет 10 евро, а для последующих пополнений – 15 евро. Максимальная сумма бонуса – 1500 евро.
Также новичкам предоставляются бонусы на второй, третий и четвертый депозит. Для получения подарка необходимо внести сумму не менее 15 евро. Игрокам также предоставляются фриспины и депозитные подарки. Для начисления фриспинов требуется подтверждение номера телефона.
Для постоянных игроков онлайн-казино 1xSlots проводит бонусные акции. Некоторые из них имеют временный характер, а другие действуют постоянно. В основном, пользователям предлагаются депозитные бонусы. Например, можно получить презент за пополнение счета в понедельник. За десятый депозит игроку полагается крупный депозитный бонус в размере 50% от вносимой суммы и 100 фриспинов.
В клубе 1xSlots также действует программа лояльности, которая предполагает различные привилегии для игроков.
Игрокам, активно делающим ставки в течение недели и ушедшим в минус, казино 1xSlots предлагает фриспины. Для получения бонуса не требуется пополнение счета, лимит на максимальный выигрыш и вейджер не устанавливаются.
Ежедневно в казино 1хСлотс назначается слот дня. При совершении ставок на определенную сумму в этом игровом аппарате игроку начисляются фриспины. Обратите внимание https://irenastyle.ru/pags/promokod_1xslots.html, время действия акции ограничено.
Разработчиками 1хСлотс было разработано мобильное казино. Такая версия представляет собой упрощенный вариант компьютерного формата онлайн казино. Она позволяет играть в любимые игры на любом устройстве, поддерживающем функцию выхода в интернет. В качестве такого устройства может быть смартфон или планшет.
Wow, superb blog structure! How long have you been running a blog
for? you made running a blog glance easy.
The full look of your web site is magnificent, as neatly as the content!
You can see similar here dobry sklep
Enjoyed looking through this, very good stuff, appreciate it. “All things are difficult before they are easy.” by John Norley.
I’ve been absent for some time, but now I remember why I used to love this site. Thank you, I¦ll try and check back more often. How frequently you update your website?
Thankyou for this post, I am a big big fan of this website would like to go on updated.
Промокод при регистрации в 1xbet сегодня. Этой акцией может воспользоваться каждый новый клиент при регистрации на сайте букмекера. Это ваше преимущество со старта, и у 1xbet есть эксклюзивное предложение. промокод на бесплатную ставку 1хбет сегодня бесплатно. В форме регистрации есть всего одно необязательное поле — как раз для ввода промокода. Как получить промокод на бесплатную ставку. Магазин находится во вкладке xBonus (в перечне вкладок верхнего блока). Вам предложат несколько вариантов для обмена баллов на промокоды 1xbet kz. Код можно получить для ставки ординар, для ставки экспресс, а также для лотерей от «1хБет». На сегодня промокод 1xbet бесплатно найти можно без особых затрат энергии, при этом сделать это следующим образом: Путем поиска в сети интернет; На сайтах, специализирующихся на спортивных ставках (Не ресурсы БК); В официальных сообществах 1хБет (соцсети). Представители БК часто выкладывают в группах или же просто в сети промокоды на 1xbet бесплатно в честь какого-то праздника либо же грядущего крупного спортивного турнира. Все промокоды 1xbet 2024. На официальном сайте букмекера в соответствующей рубрике находится полный перечень промокодов 1xbet 2024, бесплатно получить которые можно обменяв на них бонусные баллы – более подробно в этом материале https://mebel-3d.ru/libraries/news/?mify_i_zablughdeniya_o_prichinah_impotencii.html
Only wanna remark that you have a very decent website , I like the design and style it really stands out.
Список бесплатных на сегодня промокодов 1xBet. Тип бесплатного промокода. Промокод промокод на бесплатную ставку. промокоды на 1хбет на бесплатную ставку сегодня. Как сегодня получить 32500 рублей по промокоду в 1xBet? Получение начинается после регистрации с рабочим промокодом и первого пополнения счета и составляет +100% к депозиту. Игрок может рассчитывать по промокоду до 32 500 рублей, если пройдет верификацию и даст согласие на участие в рекламных предложениях букмекера. На сегодня акция по промокоду 1xBet распространяется на пользователей из России, Беларуси, Украины, Казахстана – более подробно в этом материале https://mebel-3d.ru/libraries/news/?mify_i_zablughdeniya_o_prichinah_impotencii.html
1xSlots Промокод (Бездепозитный Бонус 2024)
1xSlots промокод: NEXT777, при регистрации введите этот бонусный код, чтобы получить бонус для новых игроков в размере €1650 + 200 фриспинов. Чтобы получить этот бонус, вам нужно создать аккаунт и ввести специальный промокод казино 1хСлотс.
1xSlot Промокод
NEXT777
В казино 1xSlots 2024 доступны различные бонусы: бездепозитные при регистрации, промокоды, фриспины, кэшбэки и другие акции.
Промокод 1xSlots 2024: NEXT777 – введите код при регистрации в казино 1хСлот и получите приветственный бонус €1650 +200 фриспинов. Чтобы промокод 1xSlots на бездепозитный бонус сработал, необходимо указать рабочую комбинацию при регистрации и правильно заполнить форму анкеты. После завершения регистрации бездепозитный бонус будет доступен в личном кабинете. Рекомендуется не торопиться и сразу после создания аккаунта заполнить персональные данные. Важно указать требуемую информацию в полях, отмеченных звездочкой во вкладке “Профиль”, а также активировать контакты (номер телефона и e-mail).
Для новых клиентов промокод 1xSlots предоставляет уникальные возможности, позволяющие бесплатно опробовать один из представленных на платформе слотов. Чтобы получить бездепозитные фриспины, достаточно при регистрации указать промокод и выполнить простые условия акции, которые мы расскажем в данной статье. Игроки, желающие продолжить игру и сделать первый депозит, смогут получить щедрый приветственный бонус до €1500 и 150 бесплатных вращений.
Для получения бонуса на первый депозит необходимо пополнить счет на сумму не менее 10. Награда составляет 100% от суммы первого пополнения, но не может превышать 300. Если сумма пополнения превышает максимальный лимит, игрок получит свой депозит полностью, а также 300 в качестве бонуса. Для активации второго, третьего и четвертого этапов, сумма депозита должна быть не менее 15.
Кроме денежного вознаграждения, каждый этап сопровождается бесплатными прокрутками для игр компании:
– за первый депозит – 30 фриспинов для игры Book of Gold: Classic;
– за второй депозит – 35 фриспинов для игры в Legend of Cleopatra;
– за третий депозит – 40 фриспинов для игры в Solar Queen;
– за четвертый депозит – 45 фриспинов для игры в Imperial Fruits: 40 lines.
Казино 1xSlots предоставляет бонус поэтапно. Чтобы получить награду за второй и последующие депозиты, необходимо выполнить условия отыгрыша ранее полученных средств. Фриспины также начисляются поэтапно и зачисляются после выполнения условий отыгрыша.
Промокод для 1xСлотс: NEXT777. Получите бездепозитный приветственный пакет до €1650 +200 фриспинов. Компания 1xSlots предлагает своим клиентам ряд бонусных программ, самой популярной из которых является приветственный пакет с увеличением первого депозита и бесплатными вращениями. С использованием промокода вы можете получить до 1650 евро и 200 фриспинов. Одним из явных преимуществ 1xSlots является огромный выбор игр. Большую часть из доступных 10 тысяч развлечений занимают игровые автоматы. Пользователям предлагается более 100 различных провайдеров слотов.
Промокод не имеет срока действия. Любой пользователь, который создает аккаунт на сайте 1xSlots, может его активировать. Каждому игроку предоставляется только один бонус, поэтому промокод может быть использован только один раз. Чтобы воспользоваться промокодом, необходимо нажать на кнопку “Регистрация”, выбрать удобный способ создания аккаунта, указать все необходимые данные, подтвердить номер телефона или адрес электронной почты и ввести промокод. После этого можно завершить регистрацию, нажав на кнопку “Зарегистрироваться”.
1xSlots Промокод для Регистрации
Бонусы казино 1xSlots 2024 – Бездепозитные бонусы ? Коды на возврат средств ? VIP программа преданности ? Бесплатные фриспины.
Промокод 1xSlots при Регистрации: NEXT777 Получите эксклюзивный приветственный пакет до 1650 евро +150 фриспинов. Казино 1xSlots 2024 предлагает своим гостям не только широкий выбор игровых автоматов. На сайте казино регулярно проводятся бонусные акции, в рамках которых можно получить различные подарки, процент от депозита, фриспины и многое другое. При обычной регистрации есть ограничение по сумме – не более 1500 евро на первые четыре депозита. Первое пополнение – до 300 евро, второе – не более 350, третье – 400, четвертое – 450 евро. После ввода промокода лимит увеличивается до 1650 евро, а количество фриспинов возрастает с 150 до 200 вращений.
Получите бездепозитный бонус в размере 100 фриспинов в онлайн казино 1xSlots в 2024 году. Все активные бонус коды, промокоды и купоны от 1хСлотс (1xSlots) доступны как для новых, так и для существующих игроков. В клубе 1xSlots промокоды предоставляют дополнительные бонусы пользователям. Кроме того, в клубе проводятся множество турниров с крупными призовыми фондами, в которых может принять участие любой зарегистрированный игрок.
1xSlots фриспины промокод: NEXT777. Размер приветственного поощрения составляет 100 фриспинов в автомате Eye of Storm от провайдера Pragmatic Play. Время на его активацию неограничено. Подарок выдается единожды, попытки повторного создания учетной записи для получения фриспинов приравниваются к мошенническим действиям. Альтернативным способом получения бонус-кодов является активное заключение пари в системе. Вращая барабаны игровых автоматов и зарабатывая баллы можно получить право на фриспины, благодаря промо. Список промокодов 1xslots доступен непосредственно на официальном сайте. Чтобы получить бездепозитный бонус код для 1хслотс в 2024 году, следует выполнить следующие условия:
1. Активировать бонусные средства в личном кабинете;
2. Пополнить счет на €15 (или эквивалент в другой валюте) и более, чтобы привязать банковскую карту или онлайн-кошелек;
3. Выполнить условия вейджера: x25. Для этого необходимо поставить из своих денег сумму, равную выигрышу с бесплатных вращений, умноженную в 25 раз. На отыгрыш дается 7 дней с момента, когда вы прокрутили фриспины.
Максимальная сумма вознаграждения составляет 1650 евро. Ее необходимо отыграть с вейджером 35 раз. Казино предлагает релоад-бонусы, которые также нужно отыграть 35 раз. Однако особое место среди множества игр, слотов и турниров на 1xSlots занимает лайв-казино. Это казино, где игра происходит в режиме реального времени. Настоящие дилеры раздают карты и крутят рулетку за игровыми столами. Все эти действия передаются по видеосвязи. Благодаря такой видеотрансляции каждый игрок может почувствовать все эмоции и азарт игры в интерактивной атмосфере с профессиональными дилерами.
При регистрации на 1xSlots используйте промокод “NEXT777” и получите бездепозитный бонус в размере €1650 + 200 фриспинов. Казино 1xSlots радует своих игроков различными бонусами, такими как промокоды, фриспины и бездепозитные бонусы. Особенно щедрые подарки от казино 1xSlots предназначены для новичков.
В дополнение к бонусной программе онлайн казино 1xSlots предлагает кешбэк до 11%, начисляемый от суммы проигранных средств. Кешбэк не имеет срока отыгрыша. Сидя дома перед компьютером, удается почувствовать атмосферу присутствия в настоящем казино. Именно этими причинами объясняется такая популярность и широкий спрос лайв-казино.
1xslots промокод на бездепозитный – Бонус по промокоду 1хСлотс увеличивается с €1500 + 150 фриспинов до €1650 + 200 фриспинов.
Промокод 1xSlots на Сегодня: NEXT777 предоставляет вам возможность получить €1500 +150 FS при регистрации с использованием бонусного кода. Теперь бонус по промокоду составляет €1650 + 200 фриспинов, что на €150 больше, чем раньше. Это отличная возможность получить еще больше выгоды от игры. Казино 1xSlots 2024 – это платформа для игровых автоматов и Турниров. В казино 1хСлотс доступны различные бонусы, такие как промокоды, фриспины и бездепозитные бонусы. Особенно крупные подарки в казино 1xSlots предназначены для новичков.
Выгодная бонусная программа на сайте 1xslots позволяет как новичкам, так и опытным игрокам получать разнообразные подарки. Кроме того, это отличная возможность увеличить свой выигрыш. В казино 1xslots бонусы за депозиты и подарки не требуют дополнительных вложений. Используя фриспины и промокоды, вы можете получить хорошие деньги. Давайте подробнее рассмотрим, какие бонусы предлагает онлайн казино.
После прохождения регистрации игроку предлагается бонус на первые четыре операции по пополнению счета:
на первый депозит – 100% от внесенных средств и 30 фриспинов;
на второй депозит – 50% от внесенных средств и 35 фриспинов;
на третий депозит – 25% от внесенных средств и 40 фриспинов;
на четвертый депозит – 25% от внесенных средств и 45 фриспинов.
Промокод, также известный как код приглашения, является ключом-активатором приветственной программы для новичков. Если вы ранее не имели опыта игры в 1xSlots, то вы можете рассчитывать на получение щедрого подарка при регистрации – пакета из 1650 евро и 200 бесплатных прокруток. Согласно правилам бонусной акции, размер поощрения зависит от суммы первых четырех взносов и распределяется следующим образом: на депозитный бонус установлен максимальный лимит в 1500 евро. Чтобы получить подарок, игроку достаточно пройти процедуру регистрации, заполнить анкетные данные в личном кабинете и внести на счет профиля сумму от 10 евро.
При регистрации клиент может использовать промокод 1xSlots и получить дополнительный подарок.
1xSlots давно занимает прочные позиции в списке лучших брендов гемблинг-индустрии. Политика компании 1x ориентирована на опытных игроков, здесь пользователей ожидает продуманная программа лояльности, а также гарантии безопасности личной информации и депозита. Все действия осуществляются на основании лицензии 8048/JAZ2016-083, полученной от компании Orakum N.V., Кюрасао.
Промокод 1хСлот 2024: NEXT777 предоставляет бездепозитный бонус в виде 150 вращений в игре «The Dog House Megaways». В онлайн казино 1xslots доступны бесплатные промокоды на фриспины. Кроме того, игроки могут получать бонусные вращения не только за регистрацию или использование промокода от 1xSlots. Участие в бонусных акциях также позволяет пользователям получить фриспины. Казино 1хSlots предлагает различные варианты депозитов и выплат. Новые игроки, которые регистрируются на 1хSlots, получают приветственный пакет бонусов, однако с использованием промокода от 1xSlots этот бонус может быть еще более значительным. Для активации бонуса необходимо применить актуальный промокод при регистрации.
Приветственный пакет от 1xSlot доступен сразу после регистрации и требует активации через создание депозита. Бонус предоставляет умножение для первых четырех депозитов и дополнительные бесплатные вращения. Минимальная сумма для первого депозита составляет 10 евро, а для последующих пополнений – 15 евро. Максимальная сумма бонуса – 1500 евро.
Также новичкам предоставляются бонусы на второй, третий и четвертый депозит. Для получения подарка необходимо внести сумму не менее 15 евро. Игрокам также предоставляются фриспины и депозитные подарки. Для начисления фриспинов требуется подтверждение номера телефона.
Для постоянных игроков онлайн-казино 1xSlots проводит бонусные акции. Некоторые из них имеют временный характер, а другие действуют постоянно. В основном, пользователям предлагаются депозитные бонусы. Например, можно получить презент за пополнение счета в понедельник. За десятый депозит игроку полагается крупный депозитный бонус в размере 50% от вносимой суммы и 100 фриспинов.
В клубе 1xSlots также действует программа лояльности, которая предполагает различные привилегии для игроков.
Игрокам, активно делающим ставки в течение недели и ушедшим в минус, казино 1xSlots предлагает фриспины. Для получения бонуса не требуется пополнение счета, лимит на максимальный выигрыш и вейджер не устанавливаются.
Ежедневно в казино 1хСлотс назначается слот дня. При совершении ставок на определенную сумму в этом игровом аппарате игроку начисляются фриспины. Обратите внимание https://optom-plus.ru/forum/art/promokod_1xslots.html, время действия акции ограничено.
Разработчиками 1хСлотс было разработано мобильное казино. Такая версия представляет собой упрощенный вариант компьютерного формата онлайн казино. Она позволяет играть в любимые игры на любом устройстве, поддерживающем функцию выхода в интернет. В качестве такого устройства может быть смартфон или планшет.
Someone essentially help to make seriously articles I would state. This is the very first time I frequented your web page and thus far? I amazed with the research you made to create this particular publish extraordinary. Magnificent job!
1xSlots Промокод (Бездепозитный Бонус 2024)
1xSlots промокод: NEXT777, при регистрации введите этот бонусный код, чтобы получить бонус для новых игроков в размере €1650 + 200 фриспинов. Чтобы получить этот бонус, вам нужно создать аккаунт и ввести специальный промокод казино 1хСлотс.
1xSlot Промокод
NEXT777
В казино 1xSlots 2024 доступны различные бонусы: бездепозитные при регистрации, промокоды, фриспины, кэшбэки и другие акции.
Промокод 1xSlots 2024: NEXT777 – введите код при регистрации в казино 1хСлот и получите приветственный бонус €1650 +200 фриспинов. Чтобы промокод 1xSlots на бездепозитный бонус сработал, необходимо указать рабочую комбинацию при регистрации и правильно заполнить форму анкеты. После завершения регистрации бездепозитный бонус будет доступен в личном кабинете. Рекомендуется не торопиться и сразу после создания аккаунта заполнить персональные данные. Важно указать требуемую информацию в полях, отмеченных звездочкой во вкладке “Профиль”, а также активировать контакты (номер телефона и e-mail).
Для новых клиентов промокод 1xSlots предоставляет уникальные возможности, позволяющие бесплатно опробовать один из представленных на платформе слотов. Чтобы получить бездепозитные фриспины, достаточно при регистрации указать промокод и выполнить простые условия акции, которые мы расскажем в данной статье. Игроки, желающие продолжить игру и сделать первый депозит, смогут получить щедрый приветственный бонус до €1500 и 150 бесплатных вращений.
Для получения бонуса на первый депозит необходимо пополнить счет на сумму не менее 10. Награда составляет 100% от суммы первого пополнения, но не может превышать 300. Если сумма пополнения превышает максимальный лимит, игрок получит свой депозит полностью, а также 300 в качестве бонуса. Для активации второго, третьего и четвертого этапов, сумма депозита должна быть не менее 15.
Кроме денежного вознаграждения, каждый этап сопровождается бесплатными прокрутками для игр компании:
– за первый депозит – 30 фриспинов для игры Book of Gold: Classic;
– за второй депозит – 35 фриспинов для игры в Legend of Cleopatra;
– за третий депозит – 40 фриспинов для игры в Solar Queen;
– за четвертый депозит – 45 фриспинов для игры в Imperial Fruits: 40 lines.
Казино 1xSlots предоставляет бонус поэтапно. Чтобы получить награду за второй и последующие депозиты, необходимо выполнить условия отыгрыша ранее полученных средств. Фриспины также начисляются поэтапно и зачисляются после выполнения условий отыгрыша.
Промокод для 1xСлотс: NEXT777. Получите бездепозитный приветственный пакет до €1650 +200 фриспинов. Компания 1xSlots предлагает своим клиентам ряд бонусных программ, самой популярной из которых является приветственный пакет с увеличением первого депозита и бесплатными вращениями. С использованием промокода вы можете получить до 1650 евро и 200 фриспинов. Одним из явных преимуществ 1xSlots является огромный выбор игр. Большую часть из доступных 10 тысяч развлечений занимают игровые автоматы. Пользователям предлагается более 100 различных провайдеров слотов.
Промокод не имеет срока действия. Любой пользователь, который создает аккаунт на сайте 1xSlots, может его активировать. Каждому игроку предоставляется только один бонус, поэтому промокод может быть использован только один раз. Чтобы воспользоваться промокодом, необходимо нажать на кнопку “Регистрация”, выбрать удобный способ создания аккаунта, указать все необходимые данные, подтвердить номер телефона или адрес электронной почты и ввести промокод. После этого можно завершить регистрацию, нажав на кнопку “Зарегистрироваться”.
1xSlots Промокод для Регистрации
Бонусы казино 1xSlots 2024 – Бездепозитные бонусы ? Коды на возврат средств ? VIP программа преданности ? Бесплатные фриспины.
Промокод 1xSlots при Регистрации: NEXT777 Получите эксклюзивный приветственный пакет до 1650 евро +150 фриспинов. Казино 1xSlots 2024 предлагает своим гостям не только широкий выбор игровых автоматов. На сайте казино регулярно проводятся бонусные акции, в рамках которых можно получить различные подарки, процент от депозита, фриспины и многое другое. При обычной регистрации есть ограничение по сумме – не более 1500 евро на первые четыре депозита. Первое пополнение – до 300 евро, второе – не более 350, третье – 400, четвертое – 450 евро. После ввода промокода лимит увеличивается до 1650 евро, а количество фриспинов возрастает с 150 до 200 вращений.
Получите бездепозитный бонус в размере 100 фриспинов в онлайн казино 1xSlots в 2024 году. Все активные бонус коды, промокоды и купоны от 1хСлотс (1xSlots) доступны как для новых, так и для существующих игроков. В клубе 1xSlots промокоды предоставляют дополнительные бонусы пользователям. Кроме того, в клубе проводятся множество турниров с крупными призовыми фондами, в которых может принять участие любой зарегистрированный игрок.
1xSlots фриспины промокод: NEXT777. Размер приветственного поощрения составляет 100 фриспинов в автомате Eye of Storm от провайдера Pragmatic Play. Время на его активацию неограничено. Подарок выдается единожды, попытки повторного создания учетной записи для получения фриспинов приравниваются к мошенническим действиям. Альтернативным способом получения бонус-кодов является активное заключение пари в системе. Вращая барабаны игровых автоматов и зарабатывая баллы можно получить право на фриспины, благодаря промо. Список промокодов 1xslots доступен непосредственно на официальном сайте. Чтобы получить бездепозитный бонус код для 1хслотс в 2024 году, следует выполнить следующие условия:
1. Активировать бонусные средства в личном кабинете;
2. Пополнить счет на €15 (или эквивалент в другой валюте) и более, чтобы привязать банковскую карту или онлайн-кошелек;
3. Выполнить условия вейджера: x25. Для этого необходимо поставить из своих денег сумму, равную выигрышу с бесплатных вращений, умноженную в 25 раз. На отыгрыш дается 7 дней с момента, когда вы прокрутили фриспины.
Максимальная сумма вознаграждения составляет 1650 евро. Ее необходимо отыграть с вейджером 35 раз. Казино предлагает релоад-бонусы, которые также нужно отыграть 35 раз. Однако особое место среди множества игр, слотов и турниров на 1xSlots занимает лайв-казино. Это казино, где игра происходит в режиме реального времени. Настоящие дилеры раздают карты и крутят рулетку за игровыми столами. Все эти действия передаются по видеосвязи. Благодаря такой видеотрансляции каждый игрок может почувствовать все эмоции и азарт игры в интерактивной атмосфере с профессиональными дилерами.
При регистрации на 1xSlots используйте промокод “NEXT777” и получите бездепозитный бонус в размере €1650 + 200 фриспинов. Казино 1xSlots радует своих игроков различными бонусами, такими как промокоды, фриспины и бездепозитные бонусы. Особенно щедрые подарки от казино 1xSlots предназначены для новичков.
В дополнение к бонусной программе онлайн казино 1xSlots предлагает кешбэк до 11%, начисляемый от суммы проигранных средств. Кешбэк не имеет срока отыгрыша. Сидя дома перед компьютером, удается почувствовать атмосферу присутствия в настоящем казино. Именно этими причинами объясняется такая популярность и широкий спрос лайв-казино.
промокод на 1xslots на сегодня бесплатно – Бонус по промокоду 1хСлотс увеличивается с €1500 + 150 фриспинов до €1650 + 200 фриспинов.
Промокод 1xSlots на Сегодня: NEXT777 предоставляет вам возможность получить €1500 +150 FS при регистрации с использованием бонусного кода. Теперь бонус по промокоду составляет €1650 + 200 фриспинов, что на €150 больше, чем раньше. Это отличная возможность получить еще больше выгоды от игры. Казино 1xSlots 2024 – это платформа для игровых автоматов и Турниров. В казино 1хСлотс доступны различные бонусы, такие как промокоды, фриспины и бездепозитные бонусы. Особенно крупные подарки в казино 1xSlots предназначены для новичков.
Выгодная бонусная программа на сайте 1xslots позволяет как новичкам, так и опытным игрокам получать разнообразные подарки. Кроме того, это отличная возможность увеличить свой выигрыш. В казино 1xslots бонусы за депозиты и подарки не требуют дополнительных вложений. Используя фриспины и промокоды, вы можете получить хорошие деньги. Давайте подробнее рассмотрим, какие бонусы предлагает онлайн казино.
После прохождения регистрации игроку предлагается бонус на первые четыре операции по пополнению счета:
на первый депозит – 100% от внесенных средств и 30 фриспинов;
на второй депозит – 50% от внесенных средств и 35 фриспинов;
на третий депозит – 25% от внесенных средств и 40 фриспинов;
на четвертый депозит – 25% от внесенных средств и 45 фриспинов.
Промокод, также известный как код приглашения, является ключом-активатором приветственной программы для новичков. Если вы ранее не имели опыта игры в 1xSlots, то вы можете рассчитывать на получение щедрого подарка при регистрации – пакета из 1650 евро и 200 бесплатных прокруток. Согласно правилам бонусной акции, размер поощрения зависит от суммы первых четырех взносов и распределяется следующим образом: на депозитный бонус установлен максимальный лимит в 1500 евро. Чтобы получить подарок, игроку достаточно пройти процедуру регистрации, заполнить анкетные данные в личном кабинете и внести на счет профиля сумму от 10 евро.
При регистрации клиент может использовать промокод 1xSlots и получить дополнительный подарок.
1xSlots давно занимает прочные позиции в списке лучших брендов гемблинг-индустрии. Политика компании 1x ориентирована на опытных игроков, здесь пользователей ожидает продуманная программа лояльности, а также гарантии безопасности личной информации и депозита. Все действия осуществляются на основании лицензии 8048/JAZ2016-083, полученной от компании Orakum N.V., Кюрасао.
Промокод 1хСлот 2024: NEXT777 предоставляет бездепозитный бонус в виде 150 вращений в игре «The Dog House Megaways». В онлайн казино 1xslots доступны бесплатные промокоды на фриспины. Кроме того, игроки могут получать бонусные вращения не только за регистрацию или использование промокода от 1xSlots. Участие в бонусных акциях также позволяет пользователям получить фриспины. Казино 1хSlots предлагает различные варианты депозитов и выплат. Новые игроки, которые регистрируются на 1хSlots, получают приветственный пакет бонусов, однако с использованием промокода от 1xSlots этот бонус может быть еще более значительным. Для активации бонуса необходимо применить актуальный промокод при регистрации.
Приветственный пакет от 1xSlot доступен сразу после регистрации и требует активации через создание депозита. Бонус предоставляет умножение для первых четырех депозитов и дополнительные бесплатные вращения. Минимальная сумма для первого депозита составляет 10 евро, а для последующих пополнений – 15 евро. Максимальная сумма бонуса – 1500 евро.
Также новичкам предоставляются бонусы на второй, третий и четвертый депозит. Для получения подарка необходимо внести сумму не менее 15 евро. Игрокам также предоставляются фриспины и депозитные подарки. Для начисления фриспинов требуется подтверждение номера телефона.
Для постоянных игроков онлайн-казино 1xSlots проводит бонусные акции. Некоторые из них имеют временный характер, а другие действуют постоянно. В основном, пользователям предлагаются депозитные бонусы. Например, можно получить презент за пополнение счета в понедельник. За десятый депозит игроку полагается крупный депозитный бонус в размере 50% от вносимой суммы и 100 фриспинов.
В клубе 1xSlots также действует программа лояльности, которая предполагает различные привилегии для игроков.
Игрокам, активно делающим ставки в течение недели и ушедшим в минус, казино 1xSlots предлагает фриспины. Для получения бонуса не требуется пополнение счета, лимит на максимальный выигрыш и вейджер не устанавливаются.
Ежедневно в казино 1хСлотс назначается слот дня. При совершении ставок на определенную сумму в этом игровом аппарате игроку начисляются фриспины. Обратите внимание https://mednavi.ru/wp-content/pgs/1xslots_promokod_bonus_na_depozit.html, время действия акции ограничено.
Разработчиками 1хСлотс было разработано мобильное казино. Такая версия представляет собой упрощенный вариант компьютерного формата онлайн казино. Она позволяет играть в любимые игры на любом устройстве, поддерживающем функцию выхода в интернет. В качестве такого устройства может быть смартфон или планшет.
PBN sites
We create a structure of self-owned blog network sites!
Pros of our self-owned blog network:
We execute everything so GOOGLE doesn’t comprehend that THIS IS A self-owned blog network!!!
1- We purchase domain names from distinct registrars
2- The main site is hosted on a VPS hosting (Virtual Private Server is rapid hosting)
3- The remaining sites are on distinct hostings
4- We assign a individual Google account to each site with confirmation in Google Search Console.
5- We create websites on WP, we don’t utilize plugins with aided by which malware penetrate and through which pages on your websites are created.
6- We never reiterate templates and use only distinct text and pictures
We do not work with website design; the client, if desired, can then edit the websites to suit his wishes
Бонусное предложение активно до конца 2024 года. Фрибет – это бесплатные ставки на некоторое количество пари в букмекерской конторе 1xbet, которые выдается, если ввести промокод в 1xbet, а затем – целиком заполнить анкету игрока в своем личном кабинете и подтвердить номер мобильного телефона. С помощью бесплатной ставки за 1xbet промокод вы можете делать ставки на любые виды спорта, однако учтите, что у 1xbet фрибета есть свои условия отыгрыша. Приветственный бонус 1Хбет. Во время регистрации на 1xbet бетторы могут выбрать стартовый бонус – для ставок на спорт или для игры в казино. Промокоды 1xBet на сегодня. Не ошибемся, если скажем, что компания является одним из лидеров на рынке букмекерских услуг по количеству и разнообразию бонусных предложений. Белорусские бетторы могут воспользоваться всем их спектром. Промокод «1хБет» при регистрации дает право новым бетторам получит 100% бонус на первый депозит, но не более 200 BYN (бел. рублей). Например, при пополнении баланса на 100 BYN сверху клиент получает аналогичный бонус. Если же речь идет о промокодах, которые дают право на бесплатную ставку, то моментом активации следует считать время совершения ставки при помощи такого купона – более подробно в этом материале https://sezon5.ru/news/prohoghdenie_saints_row_iv_missiya_7_prizrak_v_mashine.html
Wow, incredible blog format!
How long have you been running a blog for?
you made blogging glance easy. The total glance of your website is wonderful, as neatly as the content material!
You can see similar here prev next and it’s was wrote
by Willard03.
Wow, wonderful weblog structure!
How long have you been running a blog for? you made blogging look
easy. The full glance of your website is great, let alone the content!
You can see similar here prev next and those was wrote by Hassan60.
1xSlots Промокод (Бездепозитный Бонус 2024)
1xSlots промокод: NEXT777, при регистрации введите этот бонусный код, чтобы получить бонус для новых игроков в размере €1650 + 200 фриспинов. Чтобы получить этот бонус, вам нужно создать аккаунт и ввести специальный промокод казино 1хСлотс.
1xSlot Промокод
NEXT777
В казино 1xSlots 2024 доступны различные бонусы: бездепозитные при регистрации, промокоды, фриспины, кэшбэки и другие акции.
Промокод 1xSlots 2024: NEXT777 – введите код при регистрации в казино 1хСлот и получите приветственный бонус €1650 +200 фриспинов. Чтобы промокод 1xSlots на бездепозитный бонус сработал, необходимо указать рабочую комбинацию при регистрации и правильно заполнить форму анкеты. После завершения регистрации бездепозитный бонус будет доступен в личном кабинете. Рекомендуется не торопиться и сразу после создания аккаунта заполнить персональные данные. Важно указать требуемую информацию в полях, отмеченных звездочкой во вкладке “Профиль”, а также активировать контакты (номер телефона и e-mail).
Для новых клиентов промокод 1xSlots предоставляет уникальные возможности, позволяющие бесплатно опробовать один из представленных на платформе слотов. Чтобы получить бездепозитные фриспины, достаточно при регистрации указать промокод и выполнить простые условия акции, которые мы расскажем в данной статье. Игроки, желающие продолжить игру и сделать первый депозит, смогут получить щедрый приветственный бонус до €1500 и 150 бесплатных вращений.
Для получения бонуса на первый депозит необходимо пополнить счет на сумму не менее 10. Награда составляет 100% от суммы первого пополнения, но не может превышать 300. Если сумма пополнения превышает максимальный лимит, игрок получит свой депозит полностью, а также 300 в качестве бонуса. Для активации второго, третьего и четвертого этапов, сумма депозита должна быть не менее 15.
Кроме денежного вознаграждения, каждый этап сопровождается бесплатными прокрутками для игр компании:
– за первый депозит – 30 фриспинов для игры Book of Gold: Classic;
– за второй депозит – 35 фриспинов для игры в Legend of Cleopatra;
– за третий депозит – 40 фриспинов для игры в Solar Queen;
– за четвертый депозит – 45 фриспинов для игры в Imperial Fruits: 40 lines.
Казино 1xSlots предоставляет бонус поэтапно. Чтобы получить награду за второй и последующие депозиты, необходимо выполнить условия отыгрыша ранее полученных средств. Фриспины также начисляются поэтапно и зачисляются после выполнения условий отыгрыша.
Промокод для 1xСлотс: NEXT777. Получите бездепозитный приветственный пакет до €1650 +200 фриспинов. Компания 1xSlots предлагает своим клиентам ряд бонусных программ, самой популярной из которых является приветственный пакет с увеличением первого депозита и бесплатными вращениями. С использованием промокода вы можете получить до 1650 евро и 200 фриспинов. Одним из явных преимуществ 1xSlots является огромный выбор игр. Большую часть из доступных 10 тысяч развлечений занимают игровые автоматы. Пользователям предлагается более 100 различных провайдеров слотов.
Промокод не имеет срока действия. Любой пользователь, который создает аккаунт на сайте 1xSlots, может его активировать. Каждому игроку предоставляется только один бонус, поэтому промокод может быть использован только один раз. Чтобы воспользоваться промокодом, необходимо нажать на кнопку “Регистрация”, выбрать удобный способ создания аккаунта, указать все необходимые данные, подтвердить номер телефона или адрес электронной почты и ввести промокод. После этого можно завершить регистрацию, нажав на кнопку “Зарегистрироваться”.
1xSlots Промокод для Регистрации
Бонусы казино 1xSlots 2024 – Бездепозитные бонусы ? Коды на возврат средств ? VIP программа преданности ? Бесплатные фриспины.
Промокод 1xSlots при Регистрации: NEXT777 Получите эксклюзивный приветственный пакет до 1650 евро +150 фриспинов. Казино 1xSlots 2024 предлагает своим гостям не только широкий выбор игровых автоматов. На сайте казино регулярно проводятся бонусные акции, в рамках которых можно получить различные подарки, процент от депозита, фриспины и многое другое. При обычной регистрации есть ограничение по сумме – не более 1500 евро на первые четыре депозита. Первое пополнение – до 300 евро, второе – не более 350, третье – 400, четвертое – 450 евро. После ввода промокода лимит увеличивается до 1650 евро, а количество фриспинов возрастает с 150 до 200 вращений.
Получите бездепозитный бонус в размере 100 фриспинов в онлайн казино 1xSlots в 2024 году. Все активные бонус коды, промокоды и купоны от 1хСлотс (1xSlots) доступны как для новых, так и для существующих игроков. В клубе 1xSlots промокоды предоставляют дополнительные бонусы пользователям. Кроме того, в клубе проводятся множество турниров с крупными призовыми фондами, в которых может принять участие любой зарегистрированный игрок.
1xSlots фриспины промокод: NEXT777. Размер приветственного поощрения составляет 100 фриспинов в автомате Eye of Storm от провайдера Pragmatic Play. Время на его активацию неограничено. Подарок выдается единожды, попытки повторного создания учетной записи для получения фриспинов приравниваются к мошенническим действиям. Альтернативным способом получения бонус-кодов является активное заключение пари в системе. Вращая барабаны игровых автоматов и зарабатывая баллы можно получить право на фриспины, благодаря промо. Список промокодов 1xslots доступен непосредственно на официальном сайте. Чтобы получить бездепозитный бонус код для 1хслотс в 2024 году, следует выполнить следующие условия:
1. Активировать бонусные средства в личном кабинете;
2. Пополнить счет на €15 (или эквивалент в другой валюте) и более, чтобы привязать банковскую карту или онлайн-кошелек;
3. Выполнить условия вейджера: x25. Для этого необходимо поставить из своих денег сумму, равную выигрышу с бесплатных вращений, умноженную в 25 раз. На отыгрыш дается 7 дней с момента, когда вы прокрутили фриспины.
Максимальная сумма вознаграждения составляет 1650 евро. Ее необходимо отыграть с вейджером 35 раз. Казино предлагает релоад-бонусы, которые также нужно отыграть 35 раз. Однако особое место среди множества игр, слотов и турниров на 1xSlots занимает лайв-казино. Это казино, где игра происходит в режиме реального времени. Настоящие дилеры раздают карты и крутят рулетку за игровыми столами. Все эти действия передаются по видеосвязи. Благодаря такой видеотрансляции каждый игрок может почувствовать все эмоции и азарт игры в интерактивной атмосфере с профессиональными дилерами.
При регистрации на 1xSlots используйте промокод “NEXT777” и получите бездепозитный бонус в размере €1650 + 200 фриспинов. Казино 1xSlots радует своих игроков различными бонусами, такими как промокоды, фриспины и бездепозитные бонусы. Особенно щедрые подарки от казино 1xSlots предназначены для новичков.
В дополнение к бонусной программе онлайн казино 1xSlots предлагает кешбэк до 11%, начисляемый от суммы проигранных средств. Кешбэк не имеет срока отыгрыша. Сидя дома перед компьютером, удается почувствовать атмосферу присутствия в настоящем казино. Именно этими причинами объясняется такая популярность и широкий спрос лайв-казино.
промокод 1xslots сегодня – Бонус по промокоду 1хСлотс увеличивается с €1500 + 150 фриспинов до €1650 + 200 фриспинов.
Промокод 1xSlots на Сегодня: NEXT777 предоставляет вам возможность получить €1500 +150 FS при регистрации с использованием бонусного кода. Теперь бонус по промокоду составляет €1650 + 200 фриспинов, что на €150 больше, чем раньше. Это отличная возможность получить еще больше выгоды от игры. Казино 1xSlots 2024 – это платформа для игровых автоматов и Турниров. В казино 1хСлотс доступны различные бонусы, такие как промокоды, фриспины и бездепозитные бонусы. Особенно крупные подарки в казино 1xSlots предназначены для новичков.
Выгодная бонусная программа на сайте 1xslots позволяет как новичкам, так и опытным игрокам получать разнообразные подарки. Кроме того, это отличная возможность увеличить свой выигрыш. В казино 1xslots бонусы за депозиты и подарки не требуют дополнительных вложений. Используя фриспины и промокоды, вы можете получить хорошие деньги. Давайте подробнее рассмотрим, какие бонусы предлагает онлайн казино.
После прохождения регистрации игроку предлагается бонус на первые четыре операции по пополнению счета:
на первый депозит – 100% от внесенных средств и 30 фриспинов;
на второй депозит – 50% от внесенных средств и 35 фриспинов;
на третий депозит – 25% от внесенных средств и 40 фриспинов;
на четвертый депозит – 25% от внесенных средств и 45 фриспинов.
Промокод, также известный как код приглашения, является ключом-активатором приветственной программы для новичков. Если вы ранее не имели опыта игры в 1xSlots, то вы можете рассчитывать на получение щедрого подарка при регистрации – пакета из 1650 евро и 200 бесплатных прокруток. Согласно правилам бонусной акции, размер поощрения зависит от суммы первых четырех взносов и распределяется следующим образом: на депозитный бонус установлен максимальный лимит в 1500 евро. Чтобы получить подарок, игроку достаточно пройти процедуру регистрации, заполнить анкетные данные в личном кабинете и внести на счет профиля сумму от 10 евро.
При регистрации клиент может использовать промокод 1xSlots и получить дополнительный подарок.
1xSlots давно занимает прочные позиции в списке лучших брендов гемблинг-индустрии. Политика компании 1x ориентирована на опытных игроков, здесь пользователей ожидает продуманная программа лояльности, а также гарантии безопасности личной информации и депозита. Все действия осуществляются на основании лицензии 8048/JAZ2016-083, полученной от компании Orakum N.V., Кюрасао.
Промокод 1хСлот 2024: NEXT777 предоставляет бездепозитный бонус в виде 150 вращений в игре «The Dog House Megaways». В онлайн казино 1xslots доступны бесплатные промокоды на фриспины. Кроме того, игроки могут получать бонусные вращения не только за регистрацию или использование промокода от 1xSlots. Участие в бонусных акциях также позволяет пользователям получить фриспины. Казино 1хSlots предлагает различные варианты депозитов и выплат. Новые игроки, которые регистрируются на 1хSlots, получают приветственный пакет бонусов, однако с использованием промокода от 1xSlots этот бонус может быть еще более значительным. Для активации бонуса необходимо применить актуальный промокод при регистрации.
Приветственный пакет от 1xSlot доступен сразу после регистрации и требует активации через создание депозита. Бонус предоставляет умножение для первых четырех депозитов и дополнительные бесплатные вращения. Минимальная сумма для первого депозита составляет 10 евро, а для последующих пополнений – 15 евро. Максимальная сумма бонуса – 1500 евро.
Также новичкам предоставляются бонусы на второй, третий и четвертый депозит. Для получения подарка необходимо внести сумму не менее 15 евро. Игрокам также предоставляются фриспины и депозитные подарки. Для начисления фриспинов требуется подтверждение номера телефона.
Для постоянных игроков онлайн-казино 1xSlots проводит бонусные акции. Некоторые из них имеют временный характер, а другие действуют постоянно. В основном, пользователям предлагаются депозитные бонусы. Например, можно получить презент за пополнение счета в понедельник. За десятый депозит игроку полагается крупный депозитный бонус в размере 50% от вносимой суммы и 100 фриспинов.
В клубе 1xSlots также действует программа лояльности, которая предполагает различные привилегии для игроков.
Игрокам, активно делающим ставки в течение недели и ушедшим в минус, казино 1xSlots предлагает фриспины. Для получения бонуса не требуется пополнение счета, лимит на максимальный выигрыш и вейджер не устанавливаются.
Ежедневно в казино 1хСлотс назначается слот дня. При совершении ставок на определенную сумму в этом игровом аппарате игроку начисляются фриспины. Обратите внимание https://bliznecy.com/js/pgs/1xslots_promokod_bonus_na_depozit.html, время действия акции ограничено.
Разработчиками 1хСлотс было разработано мобильное казино. Такая версия представляет собой упрощенный вариант компьютерного формата онлайн казино. Она позволяет играть в любимые игры на любом устройстве, поддерживающем функцию выхода в интернет. В качестве такого устройства может быть смартфон или планшет.
Wow, fantastic weblog structure!
How lengthy have you ever been running a blog for? you make running
a blog glance easy. The full glance of your web site is magnificent, as
neatly as the content! You can read similar
here prev next and those was wrote by Dorsey61.
Great write-up, I’m regular visitor of one’s site, maintain up the nice operate, and It is going to be a regular visitor for a long time.
Бесплатные промокоды. Давайте сразу начну с того, что перечислю несколько актуальных Промокодов 1xbet на сегодня. Смело вводите промокод в соответствующее поле и получайте прикольные «плюшки» в подарок от щедрого букмекера! Букмекерская контора 1xbet отличается от конкурентов наличием широкой программы лояльности. Важной ее частью является предоставление клиентам бонусов при вводе промокода. рабочий промокод 1xbet. В системе действует программа приветственных бонусов, благодаря которой каждый новичок получает определённую сумму за регистрацию на сайте. Такие акции действуют для казино и букмекерской конторы. Чтобы принять участие в приветственной программе, достаточно активировать при регистрации любой рабочий промокод – более подробно в этом материале https://blog.halon.org.uk/pag/promokod_267.html
Промокод БетВиннер: 937999 при регистрации в 2024 году с использованием на сайте BetWinner.com вы получите бесплатный бонус в размере 100% до 25000 рублей на вашу ставку. Все актуальные бонусы от букмекерской конторы BetWinner можно найти на одной странице. Там вы также найдете инструкции по получению фрибетов, участию в акциях и бездепозитному бонусу от БК BetWinner в 2024 году.
https://vsiknygy.net.ua/wp-content/pages/betwinner_promokod_2020.html
BetWinner Промокод при Регистрации: 937999 Вы получите бонус для ставок на спорт 100% до 100$ и бонус в казино до 1500€ + 150 Фриспинов. Бонусный код автоматически активрует в вашем аккаунте все акционные предложения 2024 года. Промокоды рассчитаны на разовое применение и только используются во время регистрации.
https://vsiknygy.net.ua/wp-content/pages/betwinner_promokod_2020.html
online shopping pharmacy india https://indiaph24.store/# Online medicine home delivery
buy medicines online in india
Первый шаг к увеличению бонуса при регистрации или совершении ставок. Текущий промокод 1xbet на сегодня — 1x_109745. На вкладке «Регистрация» у вас есть выбор: бонус в ставках на спорт и бесплатная ставка в казино.
Чтобы получить
Промокод 1хбет, вы должны стать активным игроком. Для этого вам необходимо зарегистрироваться и пополнить свой счет. Бонус на депозит предоставляется бесплатно всем новым игрокам согласно акции.
Для регистрации необходимо найти актуальное на сегодня зеркало и ввести сегодняшний промокод 1x_109745. Вы можете зарегистрироваться в один клик – по электронной почте, номеру телефона или в социальных сетях. Сети. Далее заполните форму в личном кабинете. Обратите особое внимание на обязательные поля под звездочкой. Если вы заполните его правильно, вы получите сообщение «Данные успешно сохранены». Бонус становится доступен после первого пополнения игрового счета одним из способов из блока пополнения.
Бонусы 1xbet можно получить в рублях, долларах и евро, в зависимости от того, из какой вы страны. Каждый пользователь, который зарегистрируется на официальном сайте и воспользуется промокодом, получит бонусы от букмекерской конторы 1xbet.
Размер бонуса по промокоду конторы 1xBet будет равен 100% от суммы первого депозита от 100 до 6500 рублей. Вы можете использовать промокод дня 1xbet только один раз; Вы получите бонусные деньги сразу после пополнения баланса. Этот бонус необходимо отыграть в течение месяца. Оборот должен превышать сумму, зачисленную на бонусный счет, в 5 раз. Делайте экспресс-ставки на 3 исхода с коэффициентом выше 1,4. На 1xbet вы можете делать ставки на спортивные события, использовать прогнозы капперов, чтобы получить максимальные условия, используйте наш промокод при регистрации 1xbet — 1x_109745.
Промокод 1хбет
Промокод БетВиннер: 937999 при регистрации в 2024 году с использованием на сайте BetWinner.com вы получите бесплатный бонус в размере 100% до 25000 рублей на вашу ставку. Все актуальные бонусы от букмекерской конторы BetWinner можно найти на одной странице. Там вы также найдете инструкции по получению фрибетов, участию в акциях и бездепозитному бонусу от БК BetWinner в 2024 году.
https://vsiknygy.net.ua/wp-content/pages/betwinner_promokod_2020.html
Understanding COSC Validation and Its Importance in Watchmaking
COSC Validation and its Rigorous Standards
COSC, or the Controle Officiel Suisse des Chronometres, is the authorized Swiss testing agency that certifies the accuracy and precision of wristwatches. COSC accreditation is a symbol of superior craftsmanship and dependability in timekeeping. Not all timepiece brands pursue COSC accreditation, such as Hublot, which instead follows to its proprietary demanding standards with movements like the UNICO, attaining equivalent precision.
The Science of Precision Chronometry
The central system of a mechanical timepiece involves the spring, which provides energy as it unwinds. This mechanism, however, can be susceptible to external elements that may influence its accuracy. COSC-validated mechanisms undergo demanding testing—over 15 days in various circumstances (five positions, three temperatures)—to ensure their durability and reliability. The tests measure:
Average daily rate accuracy between -4 and +6 seconds.
Mean variation, highest variation rates, and effects of temperature changes.
Why COSC Accreditation Matters
For timepiece fans and collectors, a COSC-accredited watch isn’t just a piece of technology but a demonstration to lasting excellence and precision. It signifies a timepiece that:
Offers excellent dependability and accuracy.
Offers guarantee of superiority across the entire design of the timepiece.
Is apt to hold its worth more effectively, making it a wise choice.
Popular Chronometer Manufacturers
Several renowned brands prioritize COSC accreditation for their watches, including Rolex, Omega, Breitling, and Longines, among others. Longines, for instance, provides collections like the Archive and Spirit, which feature COSC-accredited movements equipped with innovative materials like silicone balance suspensions to enhance resilience and efficiency.
Historic Background and the Development of Timepieces
The notion of the chronometer dates back to the requirement for precise timekeeping for navigation at sea, highlighted by John Harrison’s work in the eighteenth century. Since the formal foundation of COSC in 1973, the validation has become a benchmark for evaluating the precision of luxury timepieces, sustaining a tradition of excellence in horology.
Conclusion
Owning a COSC-validated timepiece is more than an aesthetic choice; it’s a commitment to quality and precision. For those appreciating accuracy above all, the COSC accreditation offers tranquility of mind, ensuring that each certified watch will operate dependably under various conditions. Whether for personal contentment or as an investment decision, COSC-validated watches distinguish themselves in the world of watchmaking, bearing on a legacy of meticulous timekeeping.
Have you ever thought about including a little bit more than just your articles? I mean, what you say is valuable and all. Nevertheless just imagine if you added some great photos or videos to give your posts more, “pop”! Your content is excellent but with images and videos, this site could certainly be one of the best in its niche. Excellent blog!
網上賭場
top 10 online pharmacy in india https://indiaph24.store/# reputable indian online pharmacy
buy prescription drugs from india
https://canadaph24.pro/# canada pharmacy reviews
http://mexicoph24.life/# mexico drug stores pharmacies
mexican mail order pharmacies: mexican drugstore online – mexico drug stores pharmacies
cross border pharmacy canada [url=https://canadaph24.pro/#]canadian pharmacies[/url] my canadian pharmacy reviews
1xBet промокод казино при регистрации. 1xBet промокод казино при регистрации. Сайт 1хБет – это не только популярная букмекерская контора, но и казино, в котором можно играть как с машинами, так и с реальными крупье. Использовав промокод казино 1xBet, игрок получает денежные средства на бонусный счет. Это значит, что он может использовать их только для игры в слоты и другие азартные развлечения на сайте. Вывести деньги, выигранные с бонуса, игрок сможет только тогда, когда отыграет их согласно вейджеру. Сегодня в казино предусмотрены следующие бонусы за регистрацию и депозит: Все новые пользователи азартного заведения могут получить бездепозитный бонус. Промокод представляет собой комбинацию букв и чисел, которые позволят вам получить бонус. Если он актуальный, то сумма вашего депозита после пополнения увеличится на оговоренную в условиях получения промокода сумму. Есть и другой способ. Нередко рабочий промокод 1xbet на депозит распространяют официальные партнеры компании 1xbet. Среди них могут быть группы и аккаунты в социальных сетях, которые связаны с прогнозированием событий или спортивные ресурсы – более подробно в этом материале http://umcpo.ru/wp-content/pages/1xbet_promokod_pri_registracii_na_segodnya_2.html
https://canadaph24.pro/# canada pharmacy online
Real informative and wonderful anatomical structure of subject matter, now that’s user genial (:.
Однако, существует возможность увеличить размер этого бонуса с помощью промокода betwinner. При использовании этого кода при регистрации, приветственный бонус увеличится на 30%. То есть, если игрок пополнил свой счет на 10 евро и использовал промокод, то его бонус составит уже 13 евро.
https://vsiknygy.net.ua/wp-content/pages/betwinner_promokod_2020.html
http://ciprofloxacin.tech/# ciprofloxacin generic
zestril 5 mg: zestril – lisinopril 40 mg
http://lisinopril.network/# lisinopril generic 20 mg
https://lisinopril.network/# zestril brand
does tamoxifen make you tired [url=http://nolvadex.life/#]tamoxifen premenopausal[/url] tamoxifen endometriosis
ciprofloxacin order online [url=https://ciprofloxacin.tech/#]ciprofloxacin[/url] buy cipro
cipro for sale: buy cipro online canada – purchase cipro
https://lisinopril.network/# lisinopril 20 mg daily
cytotec online: buy cytotec online fast delivery – buy cytotec online fast delivery
Nihai Dönemsel En Büyük Popüler Bahis Sitesi: Casibom
Bahis oyunlarını sevenlerin artık duymuş olduğu Casibom, en son dönemde adından çoğunlukla söz ettiren bir bahis ve kumarhane sitesi haline geldi. Ülkemizin en başarılı casino platformlardan biri olarak tanınan Casibom’un haftalık olarak cinsinden değişen açılış adresi, piyasada oldukça yeni olmasına rağmen itimat edilir ve kar getiren bir platform olarak öne çıkıyor.
Casibom, yakın rekabeti olanları geride kalarak eski casino sitelerinin geride bırakmayı başarılı oluyor. Bu alanda köklü olmak önemlidir olsa da, katılımcılarla etkileşimde olmak ve onlara temasa geçmek da eş miktar değerli. Bu noktada, Casibom’un her saat yardım veren gerçek zamanlı destek ekibi ile rahatça iletişime ulaşılabilir olması büyük önem taşıyan bir fayda getiriyor.
Hızlıca genişleyen katılımcı kitlesi ile ilgi çekici olan Casibom’un arkasındaki başarılı faktörleri arasında, sadece casino ve canlı olarak casino oyunları ile sınırlı kısıtlı olmayan geniş bir hizmetler yelpazesi bulunuyor. Atletizm bahislerinde sunduğu kapsamlı seçenekler ve yüksek oranlar, oyuncuları ilgisini çekmeyi başarıyor.
Ayrıca, hem atletizm bahisleri hem de bahis oyunları oyuncularına yönlendirilen sunulan yüksek yüzdeli avantajlı ödüller da dikkat çekiyor. Bu nedenle, Casibom hızla alanında iyi bir reklam başarısı elde ediyor ve büyük bir oyuncu kitlesi kazanıyor.
Casibom’un kazandıran ödülleri ve popülerliği ile birlikte, web sitesine üyelik nasıl sağlanır sorusuna da atıfta bulunmak gereklidir. Casibom’a mobil cihazlarınızdan, bilgisayarlarınızdan veya tabletlerinizden internet tarayıcı üzerinden kolayca erişilebilir. Ayrıca, sitenin mobil uyumlu olması da önemli bir artı getiriyor, çünkü şimdi hemen hemen herkesin bir akıllı telefonu var ve bu akıllı telefonlar üzerinden hızlıca giriş sağlanabiliyor.
Mobil cep telefonlarınızla bile yolda canlı olarak tahminler alabilir ve yarışmaları canlı olarak izleyebilirsiniz. Ayrıca, Casibom’un mobil cihazlarla uyumlu olması, ülkemizde kumarhane ve oyun gibi yerlerin yasal olarak kapatılmasıyla birlikte bu tür platformlara erişimin büyük bir yolunu oluşturuyor.
Casibom’un güvenilir bir kumarhane sitesi olması da gereklidir bir artı sunuyor. Belgeli bir platform olan Casibom, sürekli bir şekilde eğlence ve kazanç elde etme imkanı sunar.
Casibom’a kullanıcı olmak da oldukça basittir. Herhangi bir belge koşulu olmadan ve ücret ödemeden platforma kolaylıkla abone olabilirsiniz. Ayrıca, platform üzerinde para yatırma ve çekme işlemleri için de birçok farklı yöntem mevcuttur ve herhangi bir kesim ücreti alınmamaktadır.
Ancak, Casibom’un güncel giriş adresini takip etmek de elzemdir. Çünkü canlı bahis ve kumarhane platformlar popüler olduğu için hileli siteler ve dolandırıcılar da ortaya çıkmaktadır. Bu nedenle, Casibom’un sosyal medya hesaplarını ve güncel giriş adresini düzenli aralıklarla kontrol etmek gereklidir.
Sonuç olarak, Casibom hem güvenilir hem de kazanç sağlayan bir kumarhane sitesi olarak dikkat çekiyor. yüksek bonusları, geniş oyun seçenekleri ve kullanıcı dostu mobil uygulaması ile Casibom, oyun sevenler için ideal bir platform getiriyor.
https://nolvadex.life/# tamoxifen dosage
lisinopril cost us [url=http://lisinopril.network/#]lisinopril 419[/url] buy lisinopril online
https://cytotec.club/# Abortion pills online
tamoxifen alternatives [url=http://nolvadex.life/#]tamoxifen hip pain[/url] nolvadex vs clomid
Misoprostol 200 mg buy online: buy cytotec over the counter – cytotec online
п»їdcis tamoxifen [url=https://nolvadex.life/#]tamoxifen dose[/url] tamoxifen premenopausal
http://ciprofloxacin.tech/# cipro 500mg best prices
http://nolvadex.life/# cost of tamoxifen
промокод betwinner на сегодня betwinner promokod: 937999 при регистрации в 2024 году с использованием на сайте BetWinner.com вы получите бесплатный бонус в размере 100% до 25000 рублей на вашу ставку. Все актуальные бонусы от букмекерской конторы BetWinner можно найти на одной странице. Там вы также найдете инструкции по получению фрибетов, участию в акциях и бездепозитному бонусу от БК BetWinner в 2024 году.
https://vsiknygy.net.ua/wp-content/pages/betwinner_promokod_2020.html
tamoxifen and antidepressants [url=http://nolvadex.life/#]nolvadex pills[/url] where to get nolvadex
buy cytotec over the counter: buy cytotec online – buy cytotec online fast delivery
https://finasteride.store/# buy propecia for sale
buy cipro cheap ciprofloxacin order online or ciprofloxacin mail online
https://toramonline.com/proxy.php?link=https://ciprofloxacin.tech cipro online no prescription in the usa
[url=https://maps.google.vg/url?q=https://ciprofloxacin.tech]cipro 500mg best prices[/url] cipro ciprofloxacin and [url=http://80tt1.com/home.php?mod=space&uid=860470]antibiotics cipro[/url] ciprofloxacin generic
buy cipro online usa: cipro pharmacy – buy cipro without rx
https://cytotec.club/# Abortion pills online
로드스탁과의 레버리지 방식의 스탁: 투자의 신규 분야
로드스탁에서 공급하는 레버리지 방식의 스탁은 증권 투자의 한 방식으로, 상당한 이익율을 목표로 하는 투자자들을 위해 매력적인 옵션입니다. 레버리지를 이용하는 이 전략은 투자자들이 자신의 자금을 넘어서는 자금을 투자할 수 있도록 함으로써, 증권 장에서 훨씬 큰 작용을 가질 수 있는 방법을 공급합니다.
레버리지 방식의 스탁의 기본 원칙
레버리지 방식의 스탁은 일반적으로 자본을 대여하여 운용하는 방식입니다. 사례를 들어, 100만 원의 자본으로 1,000만 원 상당의 증권을 사들일 수 있는데, 이는 투자자가 일반적인 자본보다 훨씬 더욱 많은 주식을 사들여, 증권 가격이 증가할 경우 상응하는 훨씬 더 큰 이익을 획득할 수 있게 됩니다. 그러나, 증권 값이 하락할 경우에는 그 피해 또한 증가할 수 있으므로, 레버리지 사용을 사용할 때는 신중하게 생각해야 합니다.
투자 계획과 레버리지
레버리지 사용은 특히 성장 잠재력이 높은 사업체에 투입할 때 도움이 됩니다. 이러한 기업에 상당한 비율을 통해 투입하면, 잘 될 경우 큰 수입을 가져올 수 있지만, 그 반대의 경우 상당한 위험성도 감수해야. 그러므로, 투자자는 자신의 위험 관리 능력과 시장 분석을 통해, 어떤 사업체에 얼마만큼의 자금을 투자할지 선택해야 합니다.
레버리지 사용의 이점과 위험성
레버리지 스탁은 높은 수익을 약속하지만, 그만큼 높은 위험도 수반합니다. 주식 장의 변동성은 추정이 힘들기 때문에, 레버리지를 이용할 때는 항상 장터 경향을 면밀히 주시하고, 손실을 최소로 줄일 수 있는 계획을 세워야 합니다.
결론: 신중한 결정이 필요
로드스탁을 통해 제공하는 레버리지 스탁은 막강한 투자 수단이며, 적절히 사용하면 많은 수입을 제공할 수 있습니다. 그러나 상당한 리스크도 생각해 봐야 하며, 투자 결정은 충분히 많은 데이터와 세심한 고려 후에 이루어져야 합니다. 투자자 본인의 재정 상황, 리스크 감수 능력, 그리고 장터 상황을 반영한 조화로운 투자 방법이 핵심입니다.
https://ciprofloxacin.tech/# ciprofloxacin order online
tamoxifen alternatives premenopausal [url=https://nolvadex.life/#]tamoxifen side effects forum[/url] tamoxifen citrate
Wonderful site. Lots of useful info here. I?¦m sending it to a few friends ans also sharing in delicious. And of course, thank you on your sweat!
buy cipro online [url=https://ciprofloxacin.tech/#]ciprofloxacin over the counter[/url] buy ciprofloxacin over the counter
get generic propecia without dr prescription: buy propecia – cost of propecia
https://ciprofloxacin.tech/# п»їcipro generic
http://ciprofloxacin.tech/# buy cipro online canada
nolvadex 10mg tamoxifen postmenopausal or nolvadex d
https://clients1.google.com.kw/url?q=https://nolvadex.life tamoxifen menopause
[url=https://www.export.org.au/Redirect.aspx?destination=https://nolvadex.life/]tamoxifen benefits[/url] tamoxifen endometriosis and [url=https://camillacastro.us/forums/profile.php?id=158384]tamoxifen and grapefruit[/url] buy tamoxifen
tamoxifen generic [url=http://nolvadex.life/#]nolvadex 20mg[/url] tamoxifenworld
generic propecia without prescription: propecia – order cheap propecia without prescription
https://lisinopril.network/# lisinopril 10 mg tablet price
purchase cytotec Abortion pills online or order cytotec online
http://talewiki.com/cushion.php?https://cytotec.club cytotec pills buy online
[url=https://toolbarqueries.google.com.qa/url?q=https://cytotec.club]Cytotec 200mcg price[/url] cytotec online and [url=http://ckxken.synology.me/discuz/home.php?mod=space&uid=25229]buy cytotec in usa[/url] buy cytotec pills
buy cheap propecia tablets cost of propecia prices or buying generic propecia tablets
http://www.yabuno.net/w3a/redirect.php?redirect=http://finasteride.store buying generic propecia pill
[url=http://forum.exkinoray.tv/away.php?s=http://finasteride.store]cost of cheap propecia without a prescription[/url] propecia without insurance and [url=http://www.donggoudi.com/home.php?mod=space&uid=432598]cost propecia for sale[/url] how cЙ‘n i get cheap propecia pills
liquid tamoxifen [url=http://nolvadex.life/#]buy tamoxifen[/url] tamoxifen and antidepressants
http://ciprofloxacin.tech/# cipro
propecia sale [url=http://finasteride.store/#]order propecia without rx[/url] cost of cheap propecia without rx
buying generic propecia online: cost of generic propecia without rx – cost of cheap propecia pill
https://finasteride.store/# buying cheap propecia without rx
get propecia without rx [url=https://finasteride.store/#]order cheap propecia without insurance[/url] buying generic propecia without insurance
https://finasteride.store/# order propecia no prescription
betwinner промокод на деньги – 937999. Новые пользователи букмекерской компании Betwinner могут воспользоваться приветственным бонусом в размере 100% от суммы депозита до €100 (или эквивалентной суммы в другой валюте). Фрибеты в БетВиннер чаще появляются в рамках периодических акций. Иногда такая привилегия касается новых игроков, но чаще всего поощрение получают постоянные.
https://vsiknygy.net.ua/wp-content/pages/betwinner_promokod_2020.html
tamoxifen and antidepressants: tamoxifen for sale – tamoxifen medication
https://ciprofloxacin.tech/# cipro for sale
rx drug lisinopril: lisinopril 20 pills – buy lisinopril 40 mg online
Ремонт электродвигателей
: основные этапы процедуры
Электродвигатель — это основной рабочий узел во многих бытовых и промышленных устройствах. Чтобы он исправно служил долгое время, необходимо регулярно проводить квалифицированное техническое обслуживание. Однако даже самое надёжное оборудование со временем изнашивается, и тогда требуется ремонт электродвигателя.
Основные этапы процедуры ремонта электродвигателя включают:
Очистка от загрязнений: электродвигатель очищают от пыли и грязи с помощью сжатого воздуха и тряпки, смоченной в чистом бензине.
Выявление внешних повреждений: на этом этапе обнаруживаются возможные причины поломки оборудования.
Снятие защитных кожухов и корпуса: после очистки можно приступать к разборке электродвигателя.
Проверка состояния механических узлов: проверяют состояние подшипников, вала и других механических элементов.
Демонтаж вышедших из строя подшипников и запрессовка новых: если обнаружены дефекты, подшипники заменяют на новые.
Перемотка электродвигателя: если проблема связана с повреждением статора или якоря, производят перемотку двигателя.
Для проведения качественного ремонта электродвигателя рекомендуется обращаться в специализированные мастерские или сервисные центры.
Перемотка электродвигателей: основные этапы и особенности процесса
Перемотка электродвигателей — это процесс замены старой или повреждённой обмотки на новую. Она может потребоваться в различных ситуациях, например, при износе рабочих обмоток, межвитковом пробое изоляции, коротком замыкании витков или изменении рабочего напряжения.
Этапы перемотки электродвигателя:
Дефектация: визуальный осмотр двигателя, определение наличия вмятин, царапин и оценка состояния существующих обмоток.
Удаление старых обмоток: срезание бандажных креплений и фиксация схемы соединения обмоток.
Очистка пазов статора: освобождение пазов от старой обмотки и очистка от наплывов лака, остатков изолирующих материалов.
Монтаж новых изолирующих прокладок: установка прокладок в пазы статора.
Намотка новых катушечных групп: на специальном оборудовании наматываются новые катушки, которые затем размещаются в пустых пазах статора и фиксируются.
Укладка обмоток: установка межкатушечных изолирующих элементов и обвязки (бандажа).
Подключение катушек согласно схеме: проверка электрических параметров и замыкание на корпус.
Пропитка лаком: статор пропитывается лаком для улучшения изоляционных свойств.
Полное отверждение лака и финишный контроль параметров: контроль напряжения пробоя и механических характеристик.
Механическая сборка двигателя и подключение главных выводов обмоток к клеммам: завершение процесса перемотки.
После завершения всех этапов перемотки проводится тестовый прогон электродвигателя для проверки его работоспособности.
Балансировка — это процесс устранения дисбаланса ротора, который возникает из-за неравномерного распределения массы или дефектов конструкции. Это важная процедура, которая помогает предотвратить повышенный износ подшипников, повреждение ротора и снижение эффективности работы двигателя.
Причины потери балансировки могут быть разными: ремонт ротора, заводской брак или работа двигателя в тяжёлых условиях с превышением паспортных значений нагрузки.
Существует два основных метода балансировки электродвигателей: статический и динамический. Статический метод используется для устранения основного дисбаланса, а динамический метод обеспечивает максимальную точность и применяется для балансировки двигателей, работающих на высоких оборотах.
В процессе динамической балансировки специальное оборудование раскручивает ротор электродвигателя и указывает точки дисбаланса с помощью датчиков. Добавление или уменьшение массы ротора в этих точках позволяет достичь максимальной балансировки.
Для некоторых моделей больших и мощных электродвигателей применяется только статический метод балансировки из-за невозможности выполнения динамической балансировки.
Качественная балансировка электродвигателя позволяет избежать проблем с вибрацией, повышенным износом и повреждением оборудования, связанного с работой неисправного двигателя.
Узнай все про промокод 1xBet на сегодня. Используй при регистрации действующий промокод 1хБет и получай бонус за первый депозит до 32500р. Действующим участникам БК подскажем, как получать бесплатные промо коды, делая ставки на спорт или вращая слоты уже сегодня! Но обо всем по порядку. Регистрация в 2024 году — 1xbet промокод на сегодня. Часто задаваемые вопросы по регистрации и учетной записи у букмекера 1xbet. Активация промокода 1xbet на сегодня. Разнообразие бонусных предложений от 1xbet — другие типы бонусов и промокодов для игроков. Промокод 1xbet на День Рождения. Фрибеты или бесплатные ставки. Тото-промокоды 1xbet. Промокоды 1xbet у блогеров. Система промокодов при регистрации позволяет новым игрокам букмекерской конторы 1xbet получать внушительные бонусные суммы к своему первому депозиту. Обратите внимание, что это не промокод на ставку, а именно на регистрацию. Рабочие промокоды 1хбет на сегодня: Вид бонуса. Размер бонуса – более подробно в этом материале http://www.uraltehnika.ru/incs/php/promokod_240.html
http://finasteride.store/# propecia price
prices for lisinopril [url=https://lisinopril.network/#]buy 40 mg lisinopril[/url] lisinopril 10 mg order online
cost of cheap propecia no prescription cheap propecia pill or cost propecia without dr prescription
https://images.google.pl/url?sa=t&url=https://finasteride.store order cheap propecia price
[url=https://cse.google.bt/url?sa=t&url=https://finasteride.store]get cheap propecia without dr prescription[/url] generic propecia pill and [url=http://www.coin520.com/home.php?mod=space&uid=35353]cost of cheap propecia[/url] cost of cheap propecia online
order cheap propecia tablets [url=http://finasteride.store/#]order propecia pills[/url] order generic propecia pill
generic propecia without prescription: get generic propecia without a prescription – cost cheap propecia without dr prescription
https://cytotec.club/# Misoprostol 200 mg buy online
http://cytotec.club/# buy misoprostol over the counter
buy cheap propecia tablets [url=https://finasteride.store/#]propecia without insurance[/url] cheap propecia without dr prescription
https://cytotec.club/# purchase cytotec
ciprofloxacin 500mg buy online [url=https://ciprofloxacin.tech/#]ciprofloxacin generic price[/url] buy cipro
lisinopril 25mg tablets: benicar lisinopril – lisinopril 5 mg india price
http://lisinopril.network/# lisinopril 20 mg online
проверить свои usdt на чистоту
Проверка данных кошельков по присутствие незаконных средств передвижения: Обеспечение безопасности своего электронного портфельчика
В мире криптовалют становится все значимее необходимее обеспечивать защиту своих денег. Каждый день мошенники и киберпреступники разрабатывают новые методы обмана и воровства виртуальных денег. Ключевым инструментом важных способов обеспечения становится проверка кошельков для хранения криптовалюты на наличие неправомерных денег.
Почему так важно проверять личные электронные кошельки?
В первую очередь, вот данный факт обязательно для обеспечения безопасности личных средств. Многие из участники рынка рискуют потери денег их денег по причине недоброжелательных схем или воровства. Проверка кошельков бумажников способствует предотвращению обнаружить на своем пути подозрительные операции и предупредить.
Что предлагает организация?
Мы оказываем сервис проверки цифровых кошельков и переводов средств с целью выявления источника финансовых средств и предоставления подробного отчета о результатах. Фирма предоставляет система проверяет информацию для определения незаконных операций средств и оценить риск для того чтобы вашего портфеля активов. Благодаря нашей проверке, вы будете способны предотвратить с органами контроля и обезопасить от случайной вовлеченности в незаконных операций.
Как проводится процесс?
Наши компания имеет дело с авторитетными аудиторами организациями, такими как Cure53, с тем чтобы обеспечить гарантированность и правильность наших проверок кошельков. Мы внедряем современные технологии и подходы анализа данных для выявления наличия небезопасных манипуляций. Личные данные наших заказчиков обрабатываются и хранятся в специальной базе данных в соответствии с высокими стандартами безопасности.
Ключевой запрос: “проверить свои USDT на чистоту”
Если вы хотите проверить безопасности и чистоте своих кошельков USDT, наши специалисты предлагает возможность исследовать бесплатную проверку наших специалистов первых пяти кошельков. Просто адрес своего кошелька в указанное место на нашем веб-сайте, и мы предоставим вам детальный отчет о состоянии вашего кошелька.
Обеспечьте безопасность своих деньги в данный момент!
Не рискуйте становиться пострадать от злоумышленников или стать неприятном положении подозрительных операций с ваших финансами. Обратитесь к экспертам, которые помогут, вам обезопасить деньги и предотвратить возможные проблемы. Предпримите первый шаг к безопасности обеспечению безопасности своего криптовалютного портфельчика сразу же!
п»їcipro generic [url=https://ciprofloxacin.tech/#]ciprofloxacin generic[/url] buy ciprofloxacin over the counter
purchase cipro cipro or cipro online no prescription in the usa
https://maps.google.ne/url?q=https://ciprofloxacin.tech cipro ciprofloxacin
[url=http://images.google.com.hk/url?q=https://ciprofloxacin.tech]cipro 500mg best prices[/url] cipro 500mg best prices and [url=http://www.visionzone.com.cn/home.php?mod=space&uid=3780703]cipro 500mg best prices[/url] ciprofloxacin order online
Анализ USDT в прозрачность: Как обезопасить личные электронные активы
Все более граждан обращают внимание к секурити их криптовалютных финансов. Каждый день обманщики предлагают новые подходы кражи цифровых денег, или владельцы электронной валюты являются жертвами их интриг. Один из способов защиты становится проверка кошельков в наличие нелегальных средств.
С какой целью это необходимо?
Прежде всего, для того чтобы сохранить собственные активы от мошенников и украденных монет. Многие участники сталкиваются с потенциальной угрозой утраты их фондов из-за обманных планов или хищений. Осмотр кошельков помогает определить сомнительные операции или предотвратить возможные убытки.
Что наша команда предлагаем?
Мы предоставляем услугу тестирования криптовалютных кошельков и также операций для определения начала денег. Наша система проверяет информацию для обнаружения незаконных операций и также проценки риска вашего портфеля. Из-за данной проверке, вы сможете избегать проблем с регулированием и обезопасить себя от участия в незаконных операциях.
Как происходит процесс?
Наша фирма работаем с ведущими проверочными организациями, наподобие Kudelsky Security, с целью обеспечить точность наших тестирований. Мы применяем передовые техники для определения опасных операций. Ваши информация обрабатываются и сохраняются согласно с высокими стандартами безопасности и приватности.
Как проверить свои Tether в нетронутость?
В случае если вы желаете подтвердить, что ваша USDT-кошельки прозрачны, наш сервис предоставляет бесплатное тестирование первых пяти кошельков. Просто вбейте местоположение своего кошелька на на нашем веб-сайте, и наша команда предоставим вам детальный отчет о его положении.
Гарантируйте безопасность для вашими фонды прямо сейчас!
Избегайте риска подвергнуться мошенников или оказаться в неприятную обстановку вследствие нелегальных операций. Обратитесь за помощью к нашему агентству, с тем чтобы защитить ваши криптовалютные финансовые ресурсы и предотвратить проблем. Совершите первый шаг для сохранности вашего криптовалютного портфеля сегодня!
cost of propecia without a prescription: order propecia without prescription – cost of generic propecia without prescription
buying generic propecia pills cost cheap propecia for sale or cost of cheap propecia prices
http://hir.ize.hu/click.php?id=251831&categ_id=7&url=http://finasteride.store cost of propecia no prescription
[url=http://alt1.toolbarqueries.google.co.id/url?q=https://finasteride.store]cheap propecia without prescription[/url] generic propecia pills and [url=https://98e.fun/space-uid-7537670.html]cheap propecia without prescription[/url] buying cheap propecia price
http://nolvadex.life/# tamoxifen premenopausal
lisinopril cost canada: lisinopril 2 5 mg tablets – lisinopril tabs 88mg
http://lisinopril.network/# zestril 25 mg
https://lisinopril.network/# lisinopril 20 mg brand name
cost of cheap propecia [url=https://finasteride.store/#]get generic propecia[/url] get cheap propecia
tamoxifen therapy tamoxifen men or common side effects of tamoxifen
https://maps.google.com.ua/url?q=https://nolvadex.life tamoxifen estrogen
[url=https://www.google.co.ao/url?sa=t&url=https://nolvadex.life]tamoxifen for sale[/url] tamoxifen vs raloxifene and [url=http://yslit.com/home.php?mod=space&uid=662714]aromatase inhibitor tamoxifen[/url] tamoxifen and weight loss
Проверка бумажников на присутствие подозрительных средств передвижения: Охрана своего цифрового активов
В мире криптовалют становится все необходимее соблюдать защиту личных финансов. Ежедневно обманщики и хакеры выработывают свежие схемы обмана и угонов цифровых средств. Один из основных методов обеспечения является проверка данных кошельков по присутствие неправомерных денег.
Почему же так важно и провести проверку личные цифровые кошельки?
В первую очередь, вот данный факт нужно для защиты собственных денег. Множество пользователи рискуют потерять утраты своих собственных средств в результате несправедливых схем или краж. Анализ кошелька способствует своевременно выявить непонятные манипуляции и предотвратить возможные убытки.
Что предоставляет организация?
Мы предоставляем сервис проверки данных цифровых кошельков и транзакций средств с намерением идентификации источника денег и предоставления подробного отчета о проверке. Компания предлагает система осматривает данные пользователя для идентификации потенциально нелегальных манипуляций и оценить риск для вашего портфеля. Благодаря нашей проверке, вы будете в состоянии предотвратить возможные проблемы с регуляторными органами и обезопасить себя от непреднамеренного участия в нелегальных операций.
Как происходит проверка?
Организация наша фирма-разработчик работает с ведущими аудиторскими организациями фирмами, вроде Kudelsky Security, чтобы обеспечить и точность наших проверок. Мы внедряем современные и подходы проверки данных для обнаружения подозрительных операций средств. Личные данные наших пользователей обрабатываются и сохраняются в соответствии с высокими стандартами.
Основной запрос: “проверить свои USDT на чистоту”
Если вам нужно убедиться в безопасности и чистоте личных USDT кошельков, наши специалисты оказывает возможность провести бесплатной проверки первых 5 кошельков. Просто введите адрес своего кошелька в соответствующее окно на нашем веб-сайте, и мы предоставим вам подробный отчет о состоянии вашего счета.
Защитите свои деньги прямо сейчас!
Предотвращайте риски становиться жертвой мошенников хакеров или оказаться в неприятной ситуации нелегальных сделок с вашими финансами. Обратитесь к специалистам, которые смогут помочь, вам и вашим финансам защититься криптовалютные активы и предотвратить возможные. Примите первый шаг к безопасности к безопасности личного электронного портфеля уже сегодня!
Осмотр USDT в нетронутость: Каким образом защитить свои криптовалютные средства
Каждый день все больше индивидуумов обращают внимание на безопасность собственных криптовалютных средств. Ежедневно дельцы разрабатывают новые методы разграбления электронных активов, а также владельцы криптовалюты являются страдающими своих обманов. Один подходов защиты становится проверка кошельков для наличие противозаконных средств.
С какой целью это полезно?
Прежде всего, для того чтобы защитить свои финансы от обманщиков а также украденных монет. Многие участники сталкиваются с вероятностью утраты своих фондов вследствие обманных схем или краж. Тестирование кошельков помогает выявить непрозрачные транзакции или предотвратить возможные убытки.
Что мы предлагаем?
Мы предлагаем услугу проверки электронных кошельков а также транзакций для определения происхождения средств. Наша платформа проверяет информацию для определения нелегальных операций или оценки риска вашего портфеля. Благодаря такой проверке, вы сможете избежать недочетов с регуляторами а также обезопасить себя от участия в незаконных переводах.
Как это работает?
Наша команда сотрудничаем с лучшими проверочными компаниями, например Halborn, для того чтобы обеспечить прецизионность наших проверок. Мы используем передовые технологии для определения рискованных транзакций. Ваши данные проходят обработку и хранятся согласно с высокими стандартами безопасности и конфиденциальности.
Как выявить свои Tether для чистоту?
Если вам нужно проверить, что ваши Tether-кошельки прозрачны, наш сервис предоставляет бесплатное тестирование первых пяти кошельков. Просто вбейте адрес собственного кошелька в на нашем веб-сайте, а также мы предоставим вам детальный отчет о его положении.
Обезопасьте вашими активы уже сегодня!
Не подвергайте опасности подвергнуться дельцов или попадать в неприятную обстановку из-за противозаконных транзакций. Свяжитесь с нам, с тем чтобы обезопасить ваши электронные средства и избежать неприятностей. Примите первый шаг к сохранности вашего криптовалютного портфеля уже сейчас!
Тестирование Tether в прозрачность: Как защитить свои криптовалютные средства
Все более людей заботятся для надежность личных электронных активов. Постоянно обманщики предлагают новые схемы разграбления цифровых активов, и также владельцы криптовалюты являются пострадавшими своих афер. Один из подходов сбережения становится проверка кошельков для наличие незаконных финансов.
С какой целью это необходимо?
Прежде всего, для того чтобы защитить свои активы против мошенников а также украденных монет. Многие инвесторы сталкиваются с потенциальной угрозой потери их активов в результате мошеннических схем или кражей. Проверка кошельков помогает выявить сомнительные транзакции и также предотвратить возможные убытки.
Что мы предоставляем?
Наша компания предлагаем услугу проверки криптовалютных кошельков и также операций для определения происхождения средств. Наша система анализирует данные для обнаружения нелегальных операций или оценки угрозы для вашего портфеля. Благодаря данной проверке, вы сможете избежать проблем с регулированием и защитить себя от участия в противозаконных операциях.
Как это работает?
Наша фирма сотрудничаем с первоклассными проверочными фирмами, такими как Cure53, с целью обеспечить точность наших тестирований. Наша команда применяем современные технологии для определения опасных сделок. Ваши информация обрабатываются и сохраняются согласно с высокими нормами безопасности и конфиденциальности.
Как проверить собственные Tether в прозрачность?
Если хотите проверить, что ваша Tether-кошельки нетронуты, наш сервис предоставляет бесплатную проверку первых пяти кошельков. Легко вбейте положение собственного бумажника на на нашем веб-сайте, и мы предоставим вам детальный доклад о его положении.
Охраняйте вашими активы уже сейчас!
Не подвергайте опасности подвергнуться дельцов либо попасть в неприятную обстановку по причине незаконных операций. Свяжитесь с нашему агентству, чтобы защитить ваши криптовалютные средства и предотвратить затруднений. Совершите первый шаг к безопасности вашего криптовалютного портфеля прямо сейчас!
generic propecia [url=https://finasteride.store/#]order generic propecia[/url] cost of propecia pill
https://viagras.online/# Cheap Viagra 100mg
Levitra online pharmacy: Levitra generic price – Levitra online USA fast
промокод для бетвиннер: 937999 – воспользуйтесь этим уникальным кодом, чтобы получить бонус в размере 100% до 25 000 рублей. На официальном сайте букмекерской конторы Betwinner вы сможете найти огромное количество событий, включая спортивные ставки, онлайн-казино, политические ставки и мгновенные игры.
https://vsiknygy.net.ua/wp-content/pages/betwinner_promokod_2020.html
[url=https://happyfamilystorerx.online/]austria pharmacy online[/url]
https://levitrav.store/# Cheap Levitra online
Levitra 20 mg for sale: Levitra 20mg price – Vardenafil price
Tadalafil price [url=https://cialist.pro/#]Generic Tadalafil 20mg price[/url] Cialis without a doctor prescription
http://cenforce.pro/# Purchase Cenforce Online
Viagra without a doctor prescription Canada: Buy Viagra online – Cheap Sildenafil 100mg
batmanapollo.ru
промокод betwinner rich – 937999. Новые пользователи букмекерской компании Betwinner могут воспользоваться приветственным бонусом в размере 100% от суммы депозита до €100 (или эквивалентной суммы в другой валюте). Фрибеты в БетВиннер чаще появляются в рамках периодических акций. Иногда такая привилегия касается новых игроков, но чаще всего поощрение получают постоянные.
https://vsiknygy.net.ua/wp-content/pages/betwinner_promokod_2020.html
http://cialist.pro/# п»їcialis generic
Анализ USDT для чистоту: Каким образом сохранить личные криптовалютные финансы
Постоянно все больше индивидуумов заботятся на безопасность их электронных средств. Ежедневно дельцы разрабатывают новые схемы кражи цифровых активов, и также собственники криптовалюты являются пострадавшими их подстав. Один из подходов защиты становится проверка кошельков в наличие противозаконных финансов.
С каким намерением это полезно?
В первую очередь, чтобы сохранить личные средства от дельцов и украденных монет. Многие специалисты сталкиваются с риском утраты личных финансов в результате обманных механизмов или хищений. Тестирование кошельков помогает выявить подозрительные операции или предотвратить возможные потери.
Что мы предоставляем?
Мы предлагаем подход анализа криптовалютных кошельков или операций для выявления источника денег. Наша платформа анализирует данные для определения незаконных действий и оценки риска для вашего портфеля. За счет этой проверке, вы сможете избежать проблем с регулированием и также предохранить себя от участия в незаконных операциях.
Как это работает?
Мы сотрудничаем с первоклассными аудиторскими агентствами, наподобие Halborn, для того чтобы обеспечить аккуратность наших проверок. Мы применяем передовые техники для выявления опасных операций. Ваши информация обрабатываются и сохраняются согласно с высокими нормами безопасности и конфиденциальности.
Как проверить личные USDT в прозрачность?
Если хотите убедиться, что ваши USDT-кошельки чисты, наш сервис предлагает бесплатное тестирование первых пяти бумажников. Легко передайте местоположение личного кошелька на на сайте, или мы предоставим вам детальный отчет о его статусе.
Гарантируйте безопасность для вашими средства прямо сейчас!
Не подвергайте опасности подвергнуться обманщиков или попасть в неблагоприятную обстановку из-за противозаконных операций. Свяжитесь с нашему агентству, чтобы защитить ваши криптовалютные средства и избежать затруднений. Сделайте первый шаг к безопасности вашего криптовалютного портфеля сегодня!
usdt и отмывание
Тетер – является надежная криптовалюта, привязанная к фиатной валюте, такой как американский доллар. Данное обстоятельство делает данную криптовалюту исключительно популярной среди инвесторов, поскольку она предоставляет стабильность цены в условиях неустойчивости рынка цифровых активов. Все же, как и любая другая форма цифровых активов, USDT подвергается риску использования с целью отмывания денег и субсидирования неправомерных транзакций.
Легализация доходов через цифровые валюты превращается все более распространенным способом для сокрытия происхождения капитала. Используя разнообразные методы, злоумышленники могут пытаться легализовывать незаконно полученные фонды через обменники криптовалют или миксеры, с тем чтобы сделать происхождение менее понятным.
Именно для этой цели, анализ USDT на чистоту становится весьма необходимой практикой предосторожности с целью пользователей криптовалют. Имеются специализированные платформы, которые осуществляют анализ транзакций и счетов, для того чтобы определить ненормальные операции и противоправные источники средств. Эти сервисы помогают владельцам избежать непреднамеренного вовлечения в преступных действий и предотвратить блокировку аккаунтов со со стороны надзорных органов.
Проверка USDT на чистоту также как и предотвращает защитить себя от финансовых убытков. Владельцы могут быть убеждены что их активы не связаны с нелегальными транзакциями, что следовательно снижает риск блокировки счета или конфискации средств.
Таким образом, в текущей ситуации возрастающей сложности среды криптовалют важно принимать действия для обеспечения безопасности своего капитала. Анализ USDT на чистоту с помощью специализированных услуг является одним из вариантов защиты от незаконной деятельности, предоставляя участникам криптовалют дополнительную степень и надежности.
Purchase Cenforce Online [url=http://cenforce.pro/#]Cenforce 100mg tablets for sale[/url] cenforce for sale
buy Kamagra Kamagra 100mg price or sildenafil oral jelly 100mg kamagra
https://images.google.com.ai/url?sa=t&url=https://kamagra.win buy Kamagra
[url=https://www.google.si/url?sa=t&url=https://kamagra.win]п»їkamagra[/url] sildenafil oral jelly 100mg kamagra and [url=https://bbs.fco.qq.com/home.php?mod=space&uid=25429]Kamagra Oral Jelly[/url] Kamagra tablets
Buy generic Levitra online: levitrav.store – Levitra price
九州娛樂城
https://levitrav.store/# Generic Levitra 20mg
Buy Cenforce 100mg Online [url=http://cenforce.pro/#]Cenforce 150 mg online[/url] Cenforce 100mg tablets for sale
Tadalafil price: Cialis without a doctor prescription – Buy Tadalafil 20mg
Cialis 20mg price Cialis without a doctor prescription or Buy Tadalafil 10mg
http://www.kestrel.jp/modules/wordpress/wp-ktai.php?view=redir&url=http://cialist.pro Cialis 20mg price
[url=https://www.google.co.za/url?q=https://cialist.pro]Buy Tadalafil 5mg[/url] Cialis over the counter and [url=http://ckxken.synology.me/discuz/home.php?mod=space&uid=26284]Buy Tadalafil 20mg[/url] Buy Cialis online
http://levitrav.store/# Vardenafil price
Cup C1
https://rg777.app/cup-c1-202324/
Efficient Backlinks in Blogs and Comments: Increase Your SEO
Links are vital for increasing search engine rankings and raising website presence. By integrating links into blogs and remarks smartly, they can significantly increase targeted traffic and SEO efficiency.
Adhering to Search Engine Algorithms
Today’s backlink placement methods are finely tuned to align with search engine algorithms, which now prioritize link good quality and relevance. This assures that hyperlinks are not just abundant but meaningful, directing end users to helpful and pertinent articles. Website owners should focus on integrating backlinks that are situationally appropriate and improve the overall content material quality.
Advantages of Utilizing Fresh Contributor Bases
Using current contributor bases for links, like those handled by Alex, offers considerable benefits. These bases are often refreshed and consist of unmoderated sites that don’t attract complaints, ensuring the hyperlinks put are both influential and certified. This approach helps in sustaining the usefulness of hyperlinks without the risks connected with moderated or troublesome resources.
Only Approved Sources
All donor sites used are authorized, steering clear of legal pitfalls and sticking to digital marketing criteria. This determination to using only approved resources assures that each backlink is legitimate and trustworthy, thus developing reliability and reliability in your digital existence.
SEO Impact
Skillfully positioned backlinks in blogs and comments provide over just SEO rewards—they enhance user experience by linking to pertinent and high-quality content. This strategy not only meets search engine criteria but also engages consumers, leading to far better traffic and enhanced online involvement.
In substance, the right backlink strategy, especially one that employs clean and reliable donor bases like Alex’s, can alter your SEO efforts. By concentrating on good quality over volume and sticking to the newest criteria, you can guarantee your backlinks are both potent and productive.
Generic Cialis price: Buy Tadalafil 20mg – Cialis without a doctor prescription
Тестирование USDT для нетронутость: Каковым способом обезопасить свои криптовалютные средства
Все более пользователей заботятся для надежность их криптовалютных средств. Постоянно шарлатаны разрабатывают новые подходы разграбления электронных средств, и собственники электронной валюты становятся пострадавшими их подстав. Один из подходов охраны становится проверка кошельков в наличие незаконных средств.
Зачем это необходимо?
Прежде всего, для того чтобы защитить личные финансы от шарлатанов и украденных монет. Многие вкладчики сталкиваются с риском убытков своих активов в результате мошеннических сценариев либо грабежей. Проверка кошельков способствует выявить подозрительные транзакции и предотвратить возможные потери.
Что мы предоставляем?
Мы предоставляем подход проверки криптовалютных кошельков или транзакций для выявления происхождения средств. Наша система исследует информацию для выявления противозаконных транзакций или оценки опасности для вашего портфеля. Вследствие этой проверке, вы сможете избегать проблем с регуляторами или защитить себя от участия в незаконных сделках.
Как это действует?
Наша фирма работаем с передовыми аудиторскими компаниями, наподобие Certik, для того чтобы обеспечить точность наших проверок. Мы применяем передовые техники для выявления потенциально опасных сделок. Ваши данные проходят обработку и хранятся в соответствии с высокими нормами безопасности и конфиденциальности.
Каким образом проверить личные Tether в чистоту?
Если хотите проверить, что ваша Tether-кошельки нетронуты, наш подход обеспечивает бесплатное тестирование первых пяти кошельков. Легко передайте адрес своего кошелька на на нашем веб-сайте, и также мы предоставим вам детальный доклад о его статусе.
Охраняйте вашими активы уже сейчас!
Не подвергайте опасности попасть в жертву дельцов или оказаться в неприятную обстановку из-за незаконных транзакций. Свяжитесь с нашему сервису, чтобы защитить ваши криптовалютные активы и избежать неприятностей. Совершите первый шаг к сохранности криптовалютного портфеля уже сегодня!
http://levitrav.store/# Vardenafil price
Buy Vardenafil online Buy Vardenafil 20mg or Buy generic Levitra online
http://www.amagin.jp/cgi-bin/acc/acc.cgi?REDIRECT=https://levitrav.store Levitra 10 mg best price
[url=https://www.google.ba/url?q=https://levitrav.store]Generic Levitra 20mg[/url] Levitra generic best price and [url=https://slovakia-forex.com/members/263995-zfdvvmhsrd]Cheap Levitra online[/url] Levitra tablet price
Циклёвка паркета: особенности и этапы услуги
Циклёвка паркета — это процесс восстановления внешнего вида паркетного пола путём удаления верхнего повреждённого слоя и возвращения ему первоначального вида. Услуга включает в себя несколько этапов:
Подготовка: перед началом работы необходимо защитить мебель и другие предметы от пыли и грязи, а также удалить плинтусы.
Шлифовка: с помощью шлифовальной машины удаляется старый лак и верхний повреждённый слой древесины.
Шпатлёвка: после шлифовки поверхность паркета шпатлюется для заполнения трещин и выравнивания поверхности.
Грунтовка: перед нанесением лака паркет грунтуется для улучшения адгезии и защиты от плесени и грибка.
Нанесение лака: лак наносится в несколько слоёв с промежуточной шлифовкой между ними.
Полировка: после нанесения последнего слоя лака паркет полируется для придания поверхности блеска и гладкости.
Циклёвка паркета позволяет обновить внешний вид пола, восстановить его структуру и продлить срок службы.
Сайт: ykladka-parketa.ru Циклёвка паркета
Промокод 1Win на сегодня, 2024 год – 937999. При регистрации с использованием этого кода активируется приветственный бонус в размере 500% до 75 000 рублей. Это специальное предложение от букмекера 1Win позволяет новым игрокам получить дополнительные привилегии и бонусы.
1Win – это платформа, которая радует своих пользователей разнообразными акциями. В 2024 году они предлагают следующие привлекательные бонусы для новичков:
Бездепозитные бонусы: Получите бонусы без необходимости внесения депозита.
Фриспины: Бесплатные вращения на слотах.
Фрибет бонусы: Возможность сделать бесплатные ставки.
Кэшбэк: Возврат части потерянных средств.
Промокод 937999 следует ввести при регистрации, чтобы получить максимальный бонус. Не упустите шанс увеличить свой баланс и наслаждаться игрой на 1Win!
1win куда вводить промокод используйте промокод 937999, чтобы получить максимальный бонус в размере 500% до 75 000 рублей. Этот код активирует приветственный бонус, который будет зачислен на два бонусных счета одновременно: на счета “Ставки” и “Казино”.
Важно учесть следующие особенности и предостережения при использовании промокода:
Различные поводы: Промокоды в 1Win выдаются по разным поводам, таким как акции, специальные события или дни рождения клиентов.
Активация и доступ к бонусам: После активации промокода при регистрации бонусные средства станут доступны после входа в ваш профиль. Личные промокоды требуют вашего согласия на участие в предложении.
Конвертация в реальные деньги: Бонусы будут зачислены на ваш бонусный счет с указанием доступной суммы в личном кабинете. При выполнении условий использования бонусов вы сможете конвертировать их в реальные деньги, которые дополнят ваш выигрыш.
Будьте бдительны: При поиске промокодов обращайте внимание на источник информации. Некоторые мошенники предлагают “бесплатные” промокоды с целью получить ваши личные данные. Регистрируйтесь и вводите информацию только на официальном сайте 1Win.
sildenafil oral jelly 100mg kamagra: buy kamagra online – Kamagra tablets
Generic Tadalafil 20mg price [url=http://cialist.pro/#]Generic Tadalafil 20mg price[/url] Buy Cialis online
https://levitrav.store/# Levitra tablet price
http://viagras.online/# Buy Viagra online cheap
טלגראס מדריך: המדריש המקיף לרכישת קנאביסין באמצעות המסר
שרף הנחיות היה אתר ווב מסמכים ומדריכי להשקיה קנאביס באמצעות האפליקציה הניידת הפופולרית הטלגרמה.
האתר מספק את כל הקישורים הידיעתיים והמידע המתעדף להקבוצות וערוצים הנבחרים מומלצים לביקור לרכישת קנאביסין בהמשלוח בישראל.
כמו כך, האתר הרשמי מספקת הסבר מפורטת לאיך להתארגן באמצעות בטלגראס ולקנה שרף בקלות הזמנה ובמהירות מירבית.
בעזרת המדריך, כמו כן משתמשי הערוץ משתמשים בטלגרם יוכלו להיכנס להמרחב ההפרח בטלגרם בפניות מוגנת ומוגנת.
ההאוטומטיזציה של הקנאביס מאפשר למשתמשים לבצע פעולות שונות כגון הזמנת שרף, קבלת תמיכה, בדיקת והוספת ביקורות על פריטים. כל זאת בדרך נוחה ונוחה דרך האפליקציה.
כאשר כאשר נדבר בדרכי התשלומים, הקנאביס משתמשת בשיטות ה מוכרות מאוד כגון כסף מזומן, כרטיסי האשראי של אשראי ומטבע דיגיטלי. חשוב לציין כי יש לבדוק ולוודא את התקנות והחוקות האזוריים בארץ שלך ללפני ביצוע רכישה.
הטלגרמה מציע יתרונות ראשיים כגון פרטיות וביטחון מוגברים מאוד, התקשורת מהירה וגמישות גבוהה. בנוסף, הוא מאפשר גישה לקהילה עולמית רחבה מאוד ומציע מגוון של תכונות ויכולות.
בסיכום, הטלגרם כיוונים היה המקום הטוב למצוא את כל המידע והקישורים הנדרשים לקניית קנאביס בפני מהירה מאוד, בבטוחה ונוחה דרך הטלגרם.
Pretty! This has been a really wonderful post. Many thanks for providing these details.
Бездепозитный Бонус 1Win 2024: Ваш Гид по Миру Игр
Казино 1Win в 2024 году предлагает своим игрокам невероятные возможности для увеличения выигрышей и улучшения игрового опыта. С промокодом 937999, игроки получают доступ к бездепозитным бонусам, которые открывают новые горизонты в мире азартных игр.
1win промокод при регистрации фрибет: Что Вас Ждет?
Бездепозитные бонусы: Получите фриспины или фрибеты без необходимости пополнять счет.
Коды на возврат денег: Воспользуйтесь возможностью вернуть часть проигранных средств.
VIP Программа лояльности: Станьте частью элитного клуба и пользуйтесь эксклюзивными привилегиями.
Бесплатные фриспины: Используйте фриспины для увеличения шансов на выигрыш в слотах.
Как Получить Бездепозитный Бонус?
Активация промокода: Введите 937999 в личном кабинете казино 1Win.
Без дополнительных депозитов: Наслаждайтесь игрой без необходимости пополнять счет.
Размер подарков: Получите до 500 рублей в виде фрибета или до 70 фриспинов для игры в слоты.
Условия Отыгрыша Бонуса
Вейджер для фрибетов: Не более х5.
Вейджер для фриспинов: Не более х30.
Приветственный Бонус: Как Это Работает?
Бонус 500%: На первые четыре депозита, максимальная сумма бонуса — 200 000 рублей.
Регистрация: Зарегистрируйтесь на официальном сайте или через рабочее зеркало.
Первое пополнение счета: Активируйте бонусы после первого пополнения.
Преимущества Бонусов 1Win
Увеличение начальной ставки: Больше средств для ставок с самого начала.
Продление времени игры: Играйте дольше без дополнительных вложений.
Разнообразие игр: Испытайте различные игры без риска.
Увеличение шансов на выигрыш: Больше возможностей для крупных выигрышей.
Использование бонусов в 1Win — это не только увлекательно, но и выгодно. Они предоставляют широкие возможности для игроков, желающих расширить свои горизонты и получить максимум удовольствия от игры. Выбирайте 1Win для незабываемого игрового опыта и шанса на крупные выигрыши в 2024 году!
Cialis over the counter: Generic Tadalafil 20mg price – Cialis over the counter
viagra canada: Buy Viagra online cheap – Sildenafil Citrate Tablets 100mg
https://cialist.pro/# buy cialis pill
top online pharmacy india: india pharmacy mail order – Online medicine order
הימורים מקוונים הם חווייה מרגש ופופולרי ביותר בעידן המקוון, שמביאה מיליונים אנשים מכל
כל רחבי העולם. ההימורים המקוונים מתרחשים על אירועים ספורטיביים, תוצאות פוליטיות ואפילו תוצאות מזג האוויר ונושאים נוספים. אתרי הימורים הווירטואליים מקריאים את מי שמעוניין להימר על תוצאות אפשרות ולהנות חוויות ייחודיות ומרתקות.
ההימורים המקוונים הם כבר חלק מהותי מתרבות האנושית מזמן רב והיום הם כבר לא רק חלק מרכזי מהפעילות הכלכלית והתרבותית, אלא כמו כן מספקים רווחים וחוויות מרתקות. משום שהם נגישים ונוחים לשימוש, הם מתאימים לכל מהניסיון ולהצליח לנצח בכל זמן ובכל מקום.
טכנולוגיה והימורים מקוונים הפכו להיות מעניינת ופופולרית. מיליוני אנשים מכל כל רחבי העולם מעוניינים בהימורים, כוללים הימורי ספורט. הימורים מקוונים מציעים למשתתפים חוויה ייחודית ומרתקת, המאפשרת להם ליהנות מפעילות פופולרית זו בכל זמן ובכל מקום.
וכן מה נותר אתה מחכה לו? אל תהסס והצטרף עכשיו והתחיל לחוות את ההתרגשות וההנאה שההימורים באינטרנט מבטיחים.
http://pharmcanada.shop/# precription drugs from canada
prescription drugs canada: medications online without prescriptions – no prescription online pharmacies
canadian pharmacy cheap [url=https://pharmcanada.shop/#]best canadian pharmacy online[/url] canadian pharmacy review
Backlink pyramid
Sure, here’s the text with spin syntax applied:
Hyperlink Structure
After numerous updates to the G search algorithm, it is necessary to use different approaches for ranking.
Today there is a means to capture the interest of search engines to your site with the help of backlinks.
Backlinks are not only an successful promotional resource but they also have natural visitors, direct sales from these sources perhaps will not be, but visits will be, and it is poyedenicheskogo visitors that we also receive.
What in the end we get at the output:
We show search engines site through backlinks.
Prluuchayut organic click-throughs to the site and it is also a indicator to search engines that the resource is used by people.
How we show search engines that the site is valuable:
Links do to the principal page where the main information.
We make links through redirections credible sites.
The most ESSENTIAL we place the site on sites analyzers distinct tool, the site goes into the memory of these analyzers, then the acquired links we place as redirections on weblogs, forums, comment sections. This crucial action shows search engines the MAP OF THE SITE as analyzer sites display all information about sites with all keywords and headings and it is very BENEFICIAL.
All information about our services is on the website!
india online pharmacy: indian pharmacies safe – reputable indian online pharmacy
http://pharmmexico.online/# mexican pharmacy
adderall canadian pharmacy [url=http://pharmcanada.shop/#]my canadian pharmacy[/url] canadianpharmacymeds com
В поисках идеального промокода для ставок в онлайн-казино? 1Win предлагает уникальный код 937999, который не только увеличивает шансы на крупный выигрыш, но и делает игровой процесс еще более захватывающим. Вот ваше руководство по выбору и использованию промокода на 2024 год.
Преимущества использования промокода 1Win
Использование промокода 937999 1win промокод при регистрации 2024 открывает перед вами двери в мир больших возможностей:
Увеличение начального капитала: После активации промокода и выполнения условий отыгрыша, ваш первоначальный депозит может увеличиться до 500%, достигая суммы в 75 000 рублей.
Минимизация рисков: Некоторые промокоды позволяют застраховать вашу первую ставку, снижая потенциальные потери.
Кешбэк: Получайте обратно часть потраченных средств, что делает каждую игру менее рискованной.
Эксклюзивные розыгрыши: Промокод открывает доступ к специальным акциям и розыгрышам, где можно выиграть значительные призы.
Как выбрать промокод?
Выбор промокода – это не просто вопрос личных предпочтений, но и стратегическое решение. Вот несколько критериев, которые помогут вам сделать правильный выбор:
Срок действия: Убедитесь, что промокод актуален. Для 937999 срок действия истекает 31 декабря 2024 года.
Условия отыгрыша: Внимательно изучите условия, при которых вы сможете использовать бонусные средства.
Размер бонуса: Выбирайте промокоды, которые предлагают максимальную выгоду от вашего депозита.
Дополнительные возможности: Ищите промокоды, которые предоставляют дополнительные преимущества, такие как фрибеты или кешбэк.
Как использовать промокод?
Чтобы активировать промокод 937999 в 1Win, выполните следующие шаги:
Перейдите на сайт 1Win и начните процесс регистрации.
Заполните все необходимые поля в анкете.
Введите промокод 937999 в соответствующее поле.
Завершите регистрацию и внесите первый депозит.
Помните, что использование промокода – это отличный способ усилить ваш игровой опыт и увеличить шансы на успех. Выбирайте мудро и пусть удача всегда будет на вашей стороне!
canadian compounding pharmacy: best canadian pharmacy online – canada rx pharmacy world
canadian pharmacy ed medications: my canadian pharmacy – pharmacy in canada
india pharmacy: top online pharmacy india – top 10 pharmacies in india
https://pharmindia.online/# top 10 pharmacies in india
п»їlegitimate online pharmacies india [url=http://pharmindia.online/#]online pharmacy india[/url] Online medicine order
Backlink creation is merely equally efficient currently, simply the tools to operate within this domain possess changed.
There are numerous possibilities regarding backlinks, our team use several of them, and these methods function and are actually tried by our team and our clientele.
Recently our team performed an test and we found that low-frequency search queries from one domain name rank well in online searches, and it doesnt need to become your own domain name, you are able to use social media from Web 2.0 range for this.
It additionally it is possible to in part move weight through site redirects, providing an assorted hyperlink profile.
Head over to our own website where our own services are provided with thorough descriptions.
india online pharmacy online shopping pharmacy india or reputable indian online pharmacy
https://www.google.cat/url?sa=t&url=https://pharmindia.online india pharmacy mail order
[url=http://easyfeed.info/easyfeed/feed2js.php?src=https://pharmindia.online/]india pharmacy mail order[/url] buy medicines online in india and [url=http://www.coin520.com/home.php?mod=space&uid=37040]п»їlegitimate online pharmacies india[/url] cheapest online pharmacy india
buy prescription drugs from india: india pharmacy mail order – legitimate online pharmacies india
http://pharmcanada.shop/# canadian compounding pharmacy
best online pharmacy india [url=http://pharmindia.online/#]world pharmacy india[/url] world pharmacy india
Creating unique articles on Platform and Telegraph, why it is required:
Created article on these resources is better ranked on low-frequency queries, which is very important to get natural traffic.
We get:
organic traffic from search engines.
natural traffic from the internal rendition of the medium.
The platform to which the article refers gets a link that is profitable and increases the ranking of the site to which the article refers.
Articles can be made in any quantity and choose all less common queries on your topic.
Medium pages are indexed by search engines very well.
Telegraph pages need to be indexed separately indexer and at the same time after indexing they sometimes occupy places higher in the search algorithms than the medium, these two platforms are very useful for getting traffic.
Here is a URL to our services where we provide creation, indexing of sites, articles, pages and more.
adderall canadian pharmacy: canadian pharmacies compare – my canadian pharmacy reviews
canada cloud pharmacy: canadian pharmacy meds reviews – the canadian drugstore
https://pharmworld.store/# us pharmacy no prescription
mexican pharmaceuticals online [url=https://pharmmexico.online/#]mexico drug stores pharmacies[/url] mexico drug stores pharmacies
buying prescription drugs in canada best online pharmacy that does not require a prescription in india or canadian rx prescription drugstore
http://www.3721cha.com/alexa/Index.asp?url=pharmnoprescription.icu canada pharmacy without prescription
[url=https://maps.google.lk/url?q=https://pharmnoprescription.icu]mexican prescription drugs online[/url] how to get a prescription in canada and [url=http://bbs.zhizhuyx.com/home.php?mod=space&uid=10184492]online prescription canada[/url] buy pain meds online without prescription
safe reliable canadian pharmacy trustworthy canadian pharmacy or best canadian pharmacy online
https://todoticketsrd.com/?URL=https://pharmcanada.shop canadapharmacyonline legit
[url=http://zzrs.org/?URL=http://pharmcanada.shop]best canadian pharmacy online[/url] reliable canadian pharmacy and [url=https://98e.fun/space-uid-7583085.html]northwest canadian pharmacy[/url] canadian pharmacies online
pharmacy online 365 discount code: pharm world – online canadian pharmacy coupon
1Win Приветственный Бонус (2024): Полное Руководство
Промокод 937999 от 1Win — это ваш ключ к миру больших возможностей. С этим кодом, при первом депозите, вы можете получить бонус в размере 500% до 200 000 рублей. Это уникальное предложение позволяет новым клиентам значительно увеличить свой игровой бюджет и получить максимальное удовольствие от игры в спорте и казино.
Как работает приветственный бонус?
1win промокод на пополнение счета разделен на четыре этапа:
Первый депозит: Получите 200% от суммы депозита.
Второй депозит: Получите 150% от суммы второго депозита.
Третий депозит: Получите 100% от суммы.
Четвертый депозит: Получите 50% от суммы.
Максимальная сумма бонуса составляет 200,000 рублей, а максимальный бонус на один депозит — 50,000 рублей.
Как активировать промокод?
Чтобы активировать промокод 937999:
Зарегистрируйтесь на сайте 1Win.
Введите промокод при регистрации или дайте согласие на участие в акции, если промокод был предоставлен лично.
Пополните счет и начните играть, используя приветственный бонус.
Как отыграть бонус?
Чтобы отыграть бонусные средства:
Делайте ставки с коэффициентом от 3.
В случае выигрыша, 5% от бонусного счета переводится на ваш основной счет.
Пример:
Вы внесли 10 000 рублей и получили 20 000 рублей бонуса.
Сделали ставку с коэффициентом 3 и выиграли 30 000 рублей плюс 500 рублей бонуса.
Ваш счет теперь 30 500 рублей, а бонусный счет — 19 500 рублей.
Дополнительные бонусы и акции
1Win также предлагает различные акции и бонусы для любителей казино и экспресс-ставок. Следите за обновлениями на сайте, чтобы не пропустить самые выгодные предложения.
Обратите внимание: ставки с коэффициентом менее 3 не учитываются при отыгрыше бонуса.
http://pharmnoprescription.icu/# prescription meds from canada
canada prescription drugs online [url=https://pharmnoprescription.icu/#]canada prescription drugs online[/url] canada prescription drugs online
legal online pharmacy coupon code canadian pharmacy world coupon or cheapest prescription pharmacy
https://clients1.google.co.vi/url?q=http://pharmworld.store legal online pharmacy coupon code
[url=http://www.timeandtiming.com/?&URL=pharmworld.store]no prescription required pharmacy[/url] cheapest pharmacy to fill prescriptions with insurance and [url=https://www.jjj555.com/home.php?mod=space&uid=695330]mail order pharmacy no prescription[/url] canadian pharmacy without prescription
online doxycycline: buy doxycycline without prescription – doxycycline 150 mg
https://zithromaxa.store/# buy zithromax without prescription online
how much is neurontin: neurontin 600 mg capsule – neurontin generic south africa
casino online
buy generic zithromax online: zithromax 250 mg – buy zithromax no prescription
medicine amoxicillin 500: where can i buy amoxicillin online – where to buy amoxicillin 500mg without prescription
buy prednisone online fast shipping [url=https://prednisoned.online/#]20 mg of prednisone[/url] prednisone 10mg cost
ED Trial Packs Brand & Generic . https://seos.site/catalog/category/ed-trial-packs
https://gabapentinneurontin.pro/# 300 mg neurontin
where can i get doxycycline: doxycycline 100 mg – doxycycline pills
amoxicillin 500mg over the counter: amoxicillin 500mg capsules price – amoxicillin tablets in india
generic zithromax medicine: zithromax – buy zithromax online australia
doxylin: how to buy doxycycline online – buy doxycycline cheap
как разорвать контракт сво контрактнику
С началом СВО уже спустя полгода была объявлена первая волна мобилизации. При этом прошлая, в последний раз в России была аж в 1941 году, с началом Великой Отечественной Войны. Конечно же, желающих отправиться на фронт было не много, а потому люди стали искать способы не попасть на СВО, для чего стали покупать справки о болезнях, с которыми можно получить категорию Д. И все это стало возможным с даркнет сайтами, где можно найти практически все что угодно. Именно об этой отрасли темного интернета подробней и поговорим в этой статье.
doxycycline 100mg online: doxycycline monohydrate – buy doxycycline monohydrate
prednisone 10 mg tablet: prednisone 1 mg for sale – prednisone medicine
http://prednisoned.online/# buy prednisone 40 mg
https://doxycyclinea.online/# buy cheap doxycycline
medicine neurontin neurontin canada online or neurontin 4000 mg
https://www.svdp-sacramento.org/events-details/16-02-14/Vincentian_Annual_Retreat_Day_of_Spirituality.aspx?Returnurl=https://gabapentinneurontin.pro/ neurontin 600 mg pill
[url=http://www.interyellow.com/url.php?url=https://gabapentinneurontin.pro]neurontin 900[/url] neurontin 3 and [url=https://94intr.com/home.php?mod=space&uid=307338]neurontin canada online[/url] gabapentin 100mg
Punter Guide escort guide offers sex clubs. https://angelouhte47924.wikibestproducts.com/691604/benefits_of_hiring_escorts_in_dubai
online doxycycline: buy doxycycline online – doxycycline generic
zithromax z-pak [url=http://zithromaxa.store/#]order zithromax over the counter[/url] zithromax over the counter canada
neurontin prescription coupon: medicine neurontin – medicine neurontin 300 mg
http://gabapentinneurontin.pro/# neurontin pills for sale
Букмекерская контора 1win – одна из самых популярных площадок, где пользователи могут делать ставки, играть, делать ставки и т. д. Для привлечения новой аудитории данная букмекерская контора предлагает новичкам отличный бонус – возможность получить до 200 000 бонусов за 4 депозита. И для этого покупателям даже не нужно вводить промокоды. Вам просто нужно зарегистрироваться в этом сервисе.
Промокод 1Win 2024: m1WIN2024 — это уникальный код, который необходимо указать при регистрации для получения бонуса 500% до 75 000 рублей. Это предложение доступно только новым игрокам, которые могут претендовать на приветственный бонус 1Win.
Для постоянных клиентов букмекерская контора постоянно выпускает новые промокоды 1win, ведь с этими бонусами клиентам гораздо приятнее пользоваться услугами этой букмекерской конторы. Промокод – это уникальный набор букв и цифр, активация которого позволяет человеку получить бонус. В этом обзоре мы расскажем, где взять новые промокоды 1win и как их активировать для получения бонусов.
Актуальный промокод 1Win 2024 вы можете найти на различных страницах с информацией о бонусах в букмекерских конторах. Продажи также осуществляются через партнеров компании. Лучшее место для поиска купонов – Telegram-канал букмекерской конторы. Новые ваучеры появляются там каждый день. 1Win может отправить промокод индивидуально уже зарегистрированному клиенту. Например, по случаю годовщины регистрации или просто дня рождения клиента.
С промокодом 1WIN новые игроки могут значительно увеличить сумму своего первого и последующих депозитов. Полученные бонусы можно использовать в игре и в случае успеха перевести на свой электронный кошелек. Максимальная сумма бонуса – 75 000 рублей.
Отдельной вкладки для проверки комбинаций нет. Если введено правильно, система активирует бонусное предложение. Во вкладке «Ваучер» в личном кабинете появится сообщение при вводе промокода 1Vin. Отсюда вы сможете увидеть, правильно ли была введена комбинация.
Источник: https://mmocenter.ru/blog/promokod-1win-promokody-1vin-pri-registracii-na-segodnya/
Промокод 1xBet на сегодня и бесплатно. Промокоды 1хбет 2024 требуется использовать те, которые предоставят игрокам самые лучшие бонусы. Каждый из них позволяет увеличить первый депозит в 2 раза, максимальная сумма увеличения – 100 долларов. Большое количество промокодов — одна из причин того, что на сайте регистрируется огромное количество новых игроков каждый день. На данный момент их количество превышает пятьсот тысяч уникальных пользователей каждый день. Действующие промокоды позволяют увеличить размер приветственных баллов до 32 500 рублей. Для этого нужно лишь активировать при регистрации имеющийся код, скопировав его в соответствующее поле. Букмекерская контора 1ХБет является одной из самых влиятельных на рынке игорного бизнеса в России и не нуждается в особом представлении. Впрочем, букмекер продолжает держать статус одного из самых щедрых и предлагает своим клиентам воспользоваться промокодами для халявы, – более подробно в этом материале http://novocherkassknews.ru/index.php/novosti-novocherkasska/5547-rossija-napravila-k-beregam-sektora-gaza-voennye.
buy prednisone without a prescription best price: prednisone nz – prednisone 50 mg tablet canada
Бонусы и Акции 1Win 2024: Ваш Путь к Успеху
Ищете способ максимизировать свои выигрыши? Букмекерская контора 1Win предлагает невероятный бонус код 937999, который открывает дверь к миру беспрецедентных возможностей. С этим промокодом новые клиенты могут получить денежный бонус в размере 500% до 200 000 рублей на первые четыре депозита. Это ваш шанс начать с большого и продолжать выигрывать!
1Win: не просто букмекерская контора, а мир, где каждый может стать победителем. Ставки на спорт, онлайн-казино, розыгрыши и турниры — все это доступно в одном месте, где более 1000 вариантов ставок ждут вас.
Как использовать как в 1win ввести промокод?
Процесс активации промокода 937999 прост и понятен:
Переход на сайт: Используйте зеркало или VPN-сервис для доступа к официальному сайту 1Win.
Регистрация: Нажмите “Зарегистрироваться” и заполните необходимые данные. Выберите удобный способ регистрации — через социальные сети или электронную почту.
Активация промокода: Введите 937999 в специальное поле промокода и завершите регистрацию.
После этих шагов вы станете полноправным участником игрового сообщества 1Win и сможете воспользоваться всеми преимуществами промокода.
how to buy doxycycline online [url=https://doxycyclinea.online/#]doxycycline medication[/url] buy doxycycline cheap
prednisone 10mg tablets: 10 mg prednisone – prednisone 5 mg tablet rx
doxycycline 200 mg doxycycline generic or doxycycline 100mg online
https://www.google.bf/url?q=https://doxycyclinea.online doxycycline order online
[url=https://www.google.com.sa/url?q=https://doxycyclinea.online]doxycycline medication[/url] cheap doxycycline online and [url=http://mail.empyrethegame.com/forum/memberlist.php?mode=viewprofile&u=299067]where to purchase doxycycline[/url] buy doxycycline without prescription uk
http://gabapentinneurontin.pro/# neurontin prices generic
prednisone online paypal prednisone 200 mg tablets or prednisone 20mg buy online
https://maps.google.vg/url?q=https://prednisoned.online prednisone for sale without a prescription
[url=https://www.google.ee/url?q=https://prednisoned.online]prednisone 20 mg tablets[/url] prednisone 2 mg daily and [url=http://mail.empyrethegame.com/forum/memberlist.php?mode=viewprofile&u=298869]buy 40 mg prednisone[/url] buy prednisone online fast shipping
amoxicillin 500 coupon amoxicillin from canada or amoxicillin without a prescription
http://toolbarqueries.google.com.om/url?sa=t&url=https://amoxila.pro amoxicillin discount coupon
[url=http://www.netfaqs.com/windows/DUN/Inetwiz5/index.asp?bisp=amoxila.pro]buy amoxicillin 500mg canada[/url] amoxicillin 500mg tablets price in india and [url=https://bbs.66wangzhuan.com/home.php?mod=space&uid=321171]where can you get amoxicillin[/url] amoxicillin buy no prescription
Лендинг-пейдж — это одностраничный сайт, предназначенный для рекламы и продажи товаров или услуг, а также для сбора контактных данных потенциальных клиентов. Вот несколько причин, почему лендинг-пейдж важен для бизнеса:
Увеличение узнаваемости компании. Лендинг-пейдж позволяет представить компанию и её продукты или услуги в выгодном свете, что способствует росту узнаваемости бренда.
Повышение продаж. Заказать лендинг можно здесь – 1landingpage.ru Одностраничные сайты позволяют сосредоточиться на конкретных предложениях и акциях, что повышает вероятность совершения покупки.
Оптимизация SEO-показателей. Лендинг-пейдж создаются с учётом ключевых слов и фраз, что улучшает позиции сайта в результатах поиска и привлекает больше целевых посетителей.
Привлечение новой аудитории. Одностраничные сайты могут использоваться для продвижения новых продуктов или услуг, а также для привлечения внимания к определённым кампаниям или акциям.
Расширение клиентской базы. Лендинг-пейдж собирают контактные данные потенциальных клиентов, что позволяет компании поддерживать связь с ними и предлагать дополнительные услуги или товары.
Простота генерации лидов. Лендинг-пейдж предоставляют краткую и понятную информацию о продуктах или услугах, что облегчает процесс принятия решения для потенциальных клиентов.
Сбор персональных данных. Лендинг-пейдж позволяют собирать информацию о потенциальных клиентах, такую как email-адрес, имя и контактные данные, что помогает компании лучше понимать свою аудиторию и предоставлять более персонализированные услуги.
Улучшение поискового трафика. Лендинг-пейдж создаются с учётом определённых поисковых запросов, что позволяет привлекать больше целевых посетителей на сайт.
Эффективное продвижение новой продукции. Лендинг-пейдж можно использовать для продвижения новых товаров или услуг, что позволяет привлечь внимание потенциальных клиентов и стимулировать их к покупке.
Лёгкий процесс принятия решений. Лендинг-пейдж содержат только самую необходимую информацию, что упрощает процесс принятия решения для потенциальных клиентов.
В целом, лендинг-пейдж являются мощным инструментом для продвижения бизнеса, увеличения продаж и привлечения новых клиентов.
заказать лендинг пейдж
amoxicillin online purchase [url=https://amoxila.pro/#]generic amoxicillin 500mg[/url] amoxicillin 500 tablet
cost of prednisone: prednisone buy – buy prednisone 1 mg mexico
https://zithromaxa.store/# zithromax order online uk
反向連結金字塔
反向連接金字塔
G搜尋引擎在多次更新後需要套用不同的排名參數。
今天有一種方法可以使用反向链接吸引G搜尋引擎對您的網站的注意。
反向連接不僅是有效的推廣工具,也是有機流量。
我們會得到什麼結果:
我們透過反向链接向G搜尋引擎展示我們的網站。
他們收到了到該網站的自然過渡,這也是向G搜尋引擎發出的信號,表明該資源正在被人們使用。
我們如何向G搜尋引擎表明該網站具有流動性:
個帶有主要訊息的主頁反向链接
我們透過來自受信任網站的重新定向來建立反向連接。
此外,我們將網站放置在独立的網路分析器上,網站最終會進入這些分析器的高速缓存中,然後我們使用產生的連結作為部落格、論壇和評論的重新导向。 這個重要的操作向G搜尋引擎顯示了網站地圖,因為網站分析器顯示了有關網站的所有資訊以及所有關鍵字和標題,這很棒
有關我們服務的所有資訊都在網站上!
Pirámide de backlinks
Aquí está el texto con la estructura de spintax que propone diferentes sinónimos para cada palabra:
“Pirámide de backlinks
Después de varias actualizaciones del motor de búsqueda G, necesita aplicar diferentes opciones de clasificación.
Hay una técnica de llamar la atención de los motores de búsqueda a su sitio web con enlaces de retroceso.
Los enlaces de retorno no sólo son una estrategia eficaz para la promoción, sino que también tienen flujo de visitantes orgánico, las ventas directas de estos recursos más probable es que no será, pero las transiciones será, y es poedenicheskogo tráfico que también obtenemos.
Lo que vamos a obtener al final en la salida:
Mostramos el sitio a los motores de búsqueda a través de vínculos de retroceso.
Conseguimos conversiones orgánicas hacia el sitio, lo que también es una señal para los buscadores de que el recurso está siendo utilizado por la gente.
Cómo mostramos los motores de búsqueda que el sitio es líquido:
1 backlink se hace a la página principal donde está la información principal
Hacemos backlinks a través de redirecciones de sitios de confianza
Lo más IMPORTANTE colocamos el sitio en una herramienta independiente de analizadores de sitios, el sitio entra en la caché de estos analizadores, luego los enlaces recibidos los colocamos como redirecciones en blogs, foros, comentarios.
Esta importante acción muestra a los buscadores el MAPA DEL SITIO, ya que los analizadores de sitios muestran toda la información de los sitios con todas las palabras clave y títulos y es muy BUENO.
¡Toda la información sobre nuestros servicios en el sitio web!
amoxil generic: amoxicillin 500mg price canada – purchase amoxicillin online without prescription
generic zithromax 500mg india [url=https://zithromaxa.store/#]zithromax z-pak price without insurance[/url] buy zithromax without presc
buy prednisone without prescription paypal: prednisone 10mg online – prednisone online paypal
http://prednisoned.online/# purchase prednisone no prescription
buy generic doxycycline: where can i get doxycycline – doxycycline hyclate
amoxicillin tablet 500mg: where can you get amoxicillin – amoxicillin canada price
https://zithromaxa.store/# can i buy zithromax over the counter in canada
buy doxycycline online [url=http://doxycyclinea.online/#]doxycycline hyc[/url] doxycycline hyc 100mg
how to buy prednisone: prednisone in india – prednisone 50 mg tablet canada
amoxicillin 500mg pill amoxicillin 30 capsules price or price of amoxicillin without insurance
http://redmatrix.us/chanview?f=&url=http://amoxila.pro buy amoxicillin 500mg canada
[url=http://www.google.com.cu/url?q=https://amoxila.pro/]amoxicillin over the counter in canada[/url] amoxicillin azithromycin and [url=http://dw.hezhou520.com/home.php?mod=space&uid=37466]amoxacillian without a percription[/url] amoxicillin azithromycin
https://zithromaxa.store/# zithromax tablets for sale
amoxicillin online no prescription [url=http://amoxila.pro/#]amoxicillin discount[/url] order amoxicillin online no prescription
Бонусы и Акции 1Win 2024: Ваш Путь к Успеху
Ищете способ максимизировать свои выигрыши? Букмекерская контора 1Win предлагает невероятный бонус код 937999, который открывает дверь к миру беспрецедентных возможностей. С этим промокодом новые клиенты могут получить денежный бонус в размере 500% до 200 000 рублей на первые четыре депозита. Это ваш шанс начать с большого и продолжать выигрывать!
1Win: не просто букмекерская контора, а мир, где каждый может стать победителем. Ставки на спорт, онлайн-казино, розыгрыши и турниры — все это доступно в одном месте, где более 1000 вариантов ставок ждут вас.
Как использовать промокод для 1win при пополнении?
Процесс активации промокода 937999 прост и понятен:
Переход на сайт: Используйте зеркало или VPN-сервис для доступа к официальному сайту 1Win.
Регистрация: Нажмите “Зарегистрироваться” и заполните необходимые данные. Выберите удобный способ регистрации — через социальные сети или электронную почту.
Активация промокода: Введите 937999 в специальное поле промокода и завершите регистрацию.
После этих шагов вы станете полноправным участником игрового сообщества 1Win и сможете воспользоваться всеми преимуществами промокода.
purchase prednisone 10mg: 15 mg prednisone daily – 5 mg prednisone tablets
http://amoxila.pro/# buy amoxicillin 500mg uk
where can you buy amoxicillin over the counter: order amoxicillin 500mg – cost of amoxicillin
can i buy amoxicillin over the counter [url=https://amoxila.pro/#]how much is amoxicillin prescription[/url] amoxicillin generic
prednisone without prescription.net: prednisone coupon – prednisone in india
can i purchase amoxicillin online: amoxicillin without a prescription – order amoxicillin online no prescription
Воспользоваться промокодом 1xbet можно при регистрации в 1xbet. БК 1хбет дарит до 130% на первый депозит при помощи промокода 1xbet. Максимальная сумма бонуса по промокоду 1хбет достигает 32500 рублей. Промокод 1хбет дает надбавку на депозит до 130% только при первом пополнении. Регистрация. 1хбет промокод при регистрации. Всем известно, что букмекерская контора 1xbet предлагает широкий выбор разнообразных бонусов и акций. В этой статье мы расскажем все о промокодах 1xBet: что это, как использовать при регистрации, где вводить, чтобы сделать ставку бесплатно, и по каким поводам казахстанский букмекер 1хБет вручает именные промокоды. Содержание. Что такое промокод 1xBet. Бесплатные промокоды 1xBet. Промокод при регистрации в 1xbet сегодня. Как ввести промокод при регистрации в 1хБет – более подробно в этом материале https://4ps-shop.ru/ajax/articles/?seks_chat_onlayn_video_besplatno.html
buy neurontin online no prescription drug neurontin 200 mg or neurontin 800 mg cost
https://www.google.cd/url?q=https://gabapentinneurontin.pro cheap neurontin
[url=http://demo.vieclamcantho.vn/baohiemthatnghiep/redirect.aspx?sms=90bb20bb20tbb20thc3РїС—Р…ng&link=http://gabapentinneurontin.pro]medicine neurontin 300 mg[/url] generic neurontin and [url=http://lsdsng.com/user/542538]generic neurontin 600 mg[/url] neurontin tablets uk
Букмекерская контора 1Вин – новинка в игровом мире, которая стремительно набирает популярность с 2016 года. Игрока привлекает действующий промокод 1winbonusbk. Увлекательные игры от 1win с впечатляющими суммами ставок и невероятными размерами ставок не оставят равнодушным даже самого требовательного игрока. Это произошло благодаря выгодным тарифам и высококачественным финансовым услугам. Например, приветственный бонус от 1winbonusbk составляет до 200%. Ни один букмекер этого не предлагает.
Чтобы получить доступ к бонусам и акциям 1win, вам необходимо пройти верификацию. Промокод 1win тогда примените промокод на сайте или в приложении и мгновенно выигрывайте в полевых или в игровых автоматах 1win и получайте до 50 000 рублей. Если вам понадобится помощь, вы всегда можете обратиться в онлайн-поддержку букмекерской конторы 1win.
Зарегистрироваться в 1win можно через акционную страницу или главную страницу сайта. И здесь, и там вы можете использовать промокод 1winbonusbk.
После регистрации код автоматически активируется, вы можете получить до 50 000 на первый депозит, пополнив игровой счет.
Сегодня букмекерская контора предлагает несколько вариантов вознаграждения. Большинство из них активируются после ввода специальных кодов, каждый из которых уникален. Клиент может использовать комбинацию только 1 раз. Продолжительность ограничена, как и количество участников.
Клиенты 1Win могут получать актуальные промокоды в группах букмекерской конторы в социальных сетях, в мессенджерах и у партнеров букмекерской конторы. Поощрения рассчитываются автоматически. Код необходимо активировать перед следующим пополнением счета. Если комбинация не была использована при регистрации, получить подарок от букмекера будет невозможно.
Промокоды 1вин
https://bonus-promokod-bk.ru/promokody-bk/promokod-1win/
http://amoxila.pro/# buy amoxicillin online mexico
amoxicillin 500mg for sale uk: purchase amoxicillin 500 mg – can you buy amoxicillin over the counter in canada
https://zithromaxa.store/# zithromax z-pak
doxycycline hyc 100mg [url=http://doxycyclinea.online/#]doxycycline 150 mg[/url] buy doxycycline online uk
buy amoxicillin 500mg usa amoxicillin 500 or can i purchase amoxicillin online
https://image.google.ml/url?q=https://amoxila.pro amoxicillin 500 mg for sale
[url=http://rebounderzsterling.pfestore.com/cart.aspx?returnurl=http://amoxila.pro]over the counter amoxicillin canada[/url] amoxicillin cost australia and [url=http://bbs.zhizhuyx.com/home.php?mod=space&uid=10196111]amoxicillin 500mg capsules price[/url] where can i buy amoxicillin over the counter
zithromax 500 without prescription: average cost of generic zithromax – zithromax buy
Как сберечь свои личные данные: избегайте утечек информации в интернете. Сегодня защита своих данных становится всё более важной задачей. Одним из наиболее часто встречающихся способов утечки личной информации является слив «сит фраз» в интернете. Что такое сит фразы и как предохранить себя от их утечки? Что такое «сит фразы»? «Сит фразы» — это сочетания слов или фраз, которые регулярно используются для входа к различным онлайн-аккаунтам. Эти фразы могут включать в себя имя пользователя, пароль или иные конфиденциальные данные. Киберпреступники могут пытаться получить доступ к вашим аккаунтам, при помощи этих сит фраз. Как защитить свои личные данные? Используйте сложные пароли. Избегайте использования очевидных паролей, которые мгновенно угадать. Лучше всего использовать комбинацию букв, цифр и символов. Используйте уникальные пароли для каждого аккаунта. Не воспользуйтесь один и тот же пароль для разных сервисов. Используйте двухступенчатую аутентификацию (2FA). Это добавляет дополнительный уровень безопасности, требуя подтверждение входа на ваш аккаунт путем другое устройство или метод. Будьте осторожны с онлайн-сервисами. Не доверяйте персональную информацию ненадежным сайтам и сервисам. Обновляйте программное обеспечение. Установите обновления для вашего операционной системы и программ, чтобы предохранить свои данные от вредоносного ПО. Вывод Слив сит фраз в интернете может повлечь за собой серьезным последствиям, таким подобно кража личной информации и финансовых потерь. Чтобы защитить себя, следует принимать меры предосторожности и использовать надежные методы для хранения и управления своими личными данными в сети
http://zithromaxa.store/# zithromax online usa no prescription
даркнет сливы тг
Даркнет и сливы в Телеграме
Даркнет – это компонент интернета, которая не индексируется обыденными поисковыми системами и требует уникальных программных средств для доступа. В даркнете существует обилие скрытых сайтов, где можно найти различные товары и услуги, в том числе и нелегальные.
Одним из популярных способов распространения информации в даркнете является использование мессенджера Телеграм. Телеграм предоставляет возможность создания закрытых каналов и чатов, где пользователи могут обмениваться информацией, в том числе и нелегальной.
Сливы информации в Телеграме – это процедура распространения конфиденциальной информации, такой как украденные данные, базы данных, персональные сведения и другие материалы. Эти сливы могут включать в себя информацию о кредитных картах, паролях, персональных сообщениях и даже фотографиях.
Сливы в Телеграме могут быть опасными, так как они могут привести к утечке конфиденциальной информации и нанести ущерб репутации и финансовым интересам людей. Поэтому важно быть предусмотрительным при обмене информацией в интернете и не доверять сомнительным источникам.
Вот кошельки с балансом у бота
Сид-фразы, или памятные фразы, представляют собой сумму слов, которая используется для генерации или восстановления кошелька криптовалюты. Эти фразы обеспечивают доступ к вашим криптовалютным средствам, поэтому их защищенное хранение и использование чрезвычайно важны для защиты вашего криптоимущества от утери и кражи.
Что такое сид-фразы кошельков криптовалют?
Сид-фразы формируют набор случайным образом сгенерированных слов, в большинстве случаев от 12 до 24, которые предназначаются для создания уникального ключа шифрования кошелька. Этот ключ используется для восстановления входа к вашему кошельку в случае его повреждения или утери. Сид-фразы обладают большой защиты и шифруются, что делает их секурными для хранения и передачи.
Зачем нужны сид-фразы?
Сид-фразы неотъемлемы для обеспечения безопасности и доступности вашего криптоимущества. Они позволяют восстановить вход к кошельку в случае утери или повреждения физического устройства, на котором он хранится. Благодаря сид-фразам вы можете легко создавать резервные копии своего кошелька и хранить их в безопасном месте.
Как обеспечить безопасность сид-фраз кошельков?
Никогда не передавайте сид-фразой ни с кем. Сид-фраза является вашим ключом к кошельку, и ее раскрытие может вести к утере вашего криптоимущества.
Храните сид-фразу в секурном месте. Используйте физически защищенные места, такие как банковские ячейки или специализированные аппаратные кошельки, для хранения вашей сид-фразы.
Создавайте резервные копии сид-фразы. Регулярно создавайте резервные копии вашей сид-фразы и храните их в разных безопасных местах, чтобы обеспечить вход к вашему кошельку в случае утери или повреждения.
Используйте дополнительные меры безопасности. Включите двухфакторную верификацию и другие методы защиты для своего кошелька криптовалюты, чтобы обеспечить дополнительный уровень безопасности.
Заключение
Сид-фразы кошельков криптовалют являются ключевым элементом защищенного хранения криптоимущества. Следуйте рекомендациям по безопасности, чтобы защитить свою сид-фразу и обеспечить безопасность своих криптовалютных средств.
слив сид фраз
Слив посеянных фраз (seed phrases) является одним из наиболее популярных способов утечки личной информации в мире криптовалют. В этой статье мы разберем, что такое сид фразы, почему они важны и как можно защититься от их утечки.
Что такое сид фразы?
Сид фразы, или мнемонические фразы, являются комбинацию слов, которая используется для создания или восстановления кошелька криптовалюты. Обычно сид фраза состоит из 12 или 24 слов, которые являются собой ключ к вашему кошельку. Потеря или утечка сид фразы может вести к потере доступа к вашим криптовалютным средствам.
Почему важно защищать сид фразы?
Сид фразы являются ключевым элементом для надежного хранения криптовалюты. Если злоумышленники получат доступ к вашей сид фразе, они сумеют получить доступ к вашему кошельку и украсть все средства.
Как защититься от утечки сид фраз?
Никогда не передавайте свою сид фразу любому, даже если вам кажется, что это проверенное лицо или сервис.
Храните свою сид фразу в надежном и безопасном месте. Рекомендуется использовать аппаратные кошельки или специальные программы для хранения сид фразы.
Используйте дополнительные методы защиты, такие как двухэтапная проверка, для усиления безопасности вашего кошелька.
Регулярно делайте резервные копии своей сид фразы и храните их в различных безопасных местах.
Заключение
Слив сид фраз является значительной угрозой для безопасности владельцев криптовалют. Понимание важности защиты сид фразы и принятие соответствующих мер безопасности помогут вам избежать потери ваших криптовалютных средств. Будьте бдительны и обеспечивайте надежную защиту своей сид фразы
Структура обратных ссылок
После того, как многочисленных обновлений G необходимо использовать разные варианты сортировки.
Сегодня есть способ привлечь внимание поисковых систем к вашему веб-сайту с помощью обратных линков.
Бэклинки не только эффективный инструмент продвижения, но и являются источником органического трафика, хотя прямых продаж с этих ресурсов скорее всего не будет, но переходы будут, и именно органического трафика мы также получаем.
Что в итоге получим на выходе:
Мы показываем сайт поисковым системам с помощью обратных ссылок.
Получают органические переходы на сайт, а это также сигнал поисковым системам о том, что ресурс используется людьми.
Как мы показываем поисковым системам, что сайт ликвиден:
1 обратная ссылка делается на главную страницу, где основная информация.
Делаем обратные ссылки через редиректы трастовых сайтов.
Самое ВАЖНОЕ мы размещаем сайт на отдельном инструменте анализаторов сайтов, сайт попадает в кеш этих анализаторов, затем полученные ссылки мы размещаем в качестве редиректов на блогах, форумах, комментариях.
Это важное действие показывает поисковым системамКАРТУ САЙТА, так как анализаторы сайтов отображают всю информацию о сайтах со с тайтлами, ключами, h1,h2,h3 и это очень ВАЖНО
amoxicillin 250 mg capsule [url=http://amoxila.pro/#]can you buy amoxicillin over the counter canada[/url] where can i buy amoxocillin
generic prednisone 10mg: buy prednisone online from canada – buy prednisone online india
zithromax online paypal: zithromax cost canada – zithromax over the counter
doxycycline hyc doxycycline 50mg or doxycycline 500mg
https://images.google.com.sg/url?q=https://doxycyclinea.online price of doxycycline
[url=https://images.google.tk/url?sa=t&url=https://doxycyclinea.online]order doxycycline 100mg without prescription[/url] buy doxycycline for dogs and [url=https://www.support-groups.org/memberlist.php?mode=viewprofile&u=155018]buy doxycycline without prescription[/url] doxycycline 100mg tablets
gabapentin buy: neurontin buy online – neurontin 300 mg capsule
http://amoxila.pro/# buy amoxicillin from canada
rexall pharmacy amoxicillin 500mg [url=https://amoxila.pro/#]amoxicillin buy canada[/url] amoxicillin 500 mg where to buy
buy doxycycline online: doxycycline online – doxylin
http://gabapentinneurontin.pro/# 600 mg neurontin tablets
cost of prednisone: prednisone in mexico – prednisone 1mg purchase
هنا النص مع استخدام السبينتاكس:
“بنية الروابط الخلفية
بعد التحديثات العديدة لمحرك البحث G، تحتاج إلى تطويق خيارات ترتيب مختلفة.
هناك منهج لجذب انتباه محركات البحث إلى موقعك على الويب باستخدام الروابط الخلفية.
الروابط الخلفية ليست فقط أداة فعالة للترويج، ولكن تمتلك أيضًا حركة مرور عضوية، والمبيعات المباشرة من هذه الموارد على الأرجح لن تكون كذلك، ولكن الانتقالات ستكون، وهي حركة المرور التي نحصل عليها أيضًا.
ما سنحصل عليه في النهاية في النهاية في الإخراج:
نعرض الموقع لمحركات البحث من خلال الروابط الخلفية.
2- نحصل على تحويلات عضوية إلى الموقع، وهي أيضًا إشارة لمحركات البحث أن المورد يستخدمه الناس.
كيف نظهر لمحركات البحث أن الموقع سائل:
1 يتم عمل صلة خلفي للصفحة الرئيسية حيث المعلومات الرئيسية
نقوم بعمل وصلات خلفية من خلال عمليات توجيه مرة أخرى المواقع الموثوقة
الأهم من ذلك أننا نضع الموقع على أداة منفصلة من أدوات تحليل المواقع، ويدخل الموقع في ذاكرة التخزين المؤقت لهذه المحللات، ثم الروابط المستلمة التي نضعها كتوجيه مرة أخرى على المدونات والمنتديات والتعليقات.
هذا العملية المهم يعرض لمحركات البحث خارطة الموقع، حيث تعرض أدوات تحليل المواقع جميع المعلومات عن المواقع مع جميع الكلمات الرئيسية والعناوين وهو أمر جيد جداً
جميع المعلومات عن خدماتنا على الموقع!
Бездепозитный Бонус 1Win 2024: Ваш Гид по Миру Игр
Казино 1Win в 2024 году предлагает своим игрокам невероятные возможности для увеличения выигрышей и улучшения игрового опыта. С промокодом 937999, игроки получают доступ к бездепозитным бонусам, которые открывают новые горизонты в мире азартных игр.
промокод бк 1win: Что Вас Ждет?
Бездепозитные бонусы: Получите фриспины или фрибеты без необходимости пополнять счет.
Коды на возврат денег: Воспользуйтесь возможностью вернуть часть проигранных средств.
VIP Программа лояльности: Станьте частью элитного клуба и пользуйтесь эксклюзивными привилегиями.
Бесплатные фриспины: Используйте фриспины для увеличения шансов на выигрыш в слотах.
Как Получить Бездепозитный Бонус?
Активация промокода: Введите 937999 в личном кабинете казино 1Win.
Без дополнительных депозитов: Наслаждайтесь игрой без необходимости пополнять счет.
Размер подарков: Получите до 500 рублей в виде фрибета или до 70 фриспинов для игры в слоты.
Условия Отыгрыша Бонуса
Вейджер для фрибетов: Не более х5.
Вейджер для фриспинов: Не более х30.
Приветственный Бонус: Как Это Работает?
Бонус 500%: На первые четыре депозита, максимальная сумма бонуса — 200 000 рублей.
Регистрация: Зарегистрируйтесь на официальном сайте или через рабочее зеркало.
Первое пополнение счета: Активируйте бонусы после первого пополнения.
Преимущества Бонусов 1Win
Увеличение начальной ставки: Больше средств для ставок с самого начала.
Продление времени игры: Играйте дольше без дополнительных вложений.
Разнообразие игр: Испытайте различные игры без риска.
Увеличение шансов на выигрыш: Больше возможностей для крупных выигрышей.
Использование бонусов в 1Win — это не только увлекательно, но и выгодно. Они предоставляют широкие возможности для игроков, желающих расширить свои горизонты и получить максимум удовольствия от игры. Выбирайте 1Win для незабываемого игрового опыта и шанса на крупные выигрыши в 2024 году!
amoxicillin 500mg capsule buy online amoxicillin 250 mg capsule or order amoxicillin online no prescription
https://maps.google.cat/url?sa=t&url=https://amoxila.pro amoxicillin 800 mg price
[url=https://maps.google.com.ec/url?q=https://amoxila.pro]amoxicillin capsule 500mg price[/url] amoxicillin pills 500 mg and [url=https://kwik.adriensosa.fr/forums/users/ohuunytzlm/]amoxicillin without prescription[/url] can you buy amoxicillin uk
http://prednisoned.online/# prednisone 1 mg tablet
prednisone tablets [url=http://prednisoned.online/#]prednisone purchase canada[/url] 10 mg prednisone
drug neurontin 200 mg: neurontin tablets uk – neurontin price in india
Nice post. I learn something totally new and challenging on websites
amoxicillin cost australia: how to buy amoxicillin online – amoxicillin 500 mg where to buy
http://prednisoned.online/# buy prednisone 1 mg mexico
Player線上娛樂城遊戲指南與評測
台灣最佳線上娛樂城遊戲的終極指南!我們提供專業評測,分析熱門老虎機、百家樂、棋牌及其他賭博遊戲。從遊戲規則、策略到選擇最佳娛樂城,我們全方位覆蓋,協助您更安全的遊玩。
Player如何評測:公正與專業的評分標準
在【Player娛樂城遊戲評測網】我們致力於為玩家提供最公正、最專業的娛樂城評測。我們的評測過程涵蓋多個關鍵領域,旨在確保玩家獲得可靠且全面的信息。以下是我們評測娛樂城的主要步驟:
娛樂城是什麼?
娛樂城是什麼?娛樂城是台灣對於線上賭場的特別稱呼,線上賭場分為幾種:現金版、信用版、手機娛樂城(娛樂城APP),一般來說,台灣人在稱娛樂城時,是指現金版線上賭場。
線上賭場在別的國家也有別的名稱,美國 – Casino, Gambling、中國 – 线上赌场,娱乐城、日本 – オンラインカジノ、越南 – Nhà cái。
娛樂城會被抓嗎?
在台灣,根據刑法第266條,不論是實體或線上賭博,參與賭博的行為可處最高5萬元罰金。而根據刑法第268條,為賭博提供場所並意圖營利的行為,可能面臨3年以下有期徒刑及最高9萬元罰金。一般賭客若被抓到,通常被視為輕微罪行,原則上不會被判處監禁。
信用版娛樂城是什麼?
信用版娛樂城是一種線上賭博平台,其中的賭博活動不是直接以現金進行交易,而是基於信用系統。在這種模式下,玩家在進行賭博時使用虛擬的信用點數或籌碼,這些點數或籌碼代表了一定的貨幣價值,但實際的金錢交易會在賭博活動結束後進行結算。
現金版娛樂城是什麼?
現金版娛樂城是一種線上博弈平台,其中玩家使用實際的金錢進行賭博活動。玩家需要先存入真實貨幣,這些資金轉化為平台上的遊戲籌碼或信用,用於參與各種賭場遊戲。當玩家贏得賭局時,他們可以將這些籌碼或信用兌換回現金。
娛樂城體驗金是什麼?
娛樂城體驗金是娛樂場所為新客戶提供的一種免費遊玩資金,允許玩家在不需要自己投入任何資金的情況下,可以進行各類遊戲的娛樂城試玩。這種體驗金的數額一般介於100元到1,000元之間,且對於如何使用這些體驗金以達到提款條件,各家娛樂城設有不同的規則。
Player線上娛樂城遊戲指南與評測
台灣最佳線上娛樂城遊戲的終極指南!我們提供專業評測,分析熱門老虎機、百家樂、棋牌及其他賭博遊戲。從遊戲規則、策略到選擇最佳娛樂城,我們全方位覆蓋,協助您更安全的遊玩。
Player如何評測:公正與專業的評分標準
在【Player娛樂城遊戲評測網】我們致力於為玩家提供最公正、最專業的娛樂城評測。我們的評測過程涵蓋多個關鍵領域,旨在確保玩家獲得可靠且全面的信息。以下是我們評測娛樂城的主要步驟:
娛樂城是什麼?
娛樂城是什麼?娛樂城是台灣對於線上賭場的特別稱呼,線上賭場分為幾種:現金版、信用版、手機娛樂城(娛樂城APP),一般來說,台灣人在稱娛樂城時,是指現金版線上賭場。
線上賭場在別的國家也有別的名稱,美國 – Casino, Gambling、中國 – 线上赌场,娱乐城、日本 – オンラインカジノ、越南 – Nhà cái。
娛樂城會被抓嗎?
在台灣,根據刑法第266條,不論是實體或線上賭博,參與賭博的行為可處最高5萬元罰金。而根據刑法第268條,為賭博提供場所並意圖營利的行為,可能面臨3年以下有期徒刑及最高9萬元罰金。一般賭客若被抓到,通常被視為輕微罪行,原則上不會被判處監禁。
信用版娛樂城是什麼?
信用版娛樂城是一種線上賭博平台,其中的賭博活動不是直接以現金進行交易,而是基於信用系統。在這種模式下,玩家在進行賭博時使用虛擬的信用點數或籌碼,這些點數或籌碼代表了一定的貨幣價值,但實際的金錢交易會在賭博活動結束後進行結算。
現金版娛樂城是什麼?
現金版娛樂城是一種線上博弈平台,其中玩家使用實際的金錢進行賭博活動。玩家需要先存入真實貨幣,這些資金轉化為平台上的遊戲籌碼或信用,用於參與各種賭場遊戲。當玩家贏得賭局時,他們可以將這些籌碼或信用兌換回現金。
娛樂城體驗金是什麼?
娛樂城體驗金是娛樂場所為新客戶提供的一種免費遊玩資金,允許玩家在不需要自己投入任何資金的情況下,可以進行各類遊戲的娛樂城試玩。這種體驗金的數額一般介於100元到1,000元之間,且對於如何使用這些體驗金以達到提款條件,各家娛樂城設有不同的規則。
Player線上娛樂城遊戲指南與評測
台灣最佳線上娛樂城遊戲的終極指南!我們提供專業評測,分析熱門老虎機、百家樂、棋牌及其他賭博遊戲。從遊戲規則、策略到選擇最佳娛樂城,我們全方位覆蓋,協助您更安全的遊玩。
Player如何評測:公正與專業的評分標準
在【Player娛樂城遊戲評測網】我們致力於為玩家提供最公正、最專業的娛樂城評測。我們的評測過程涵蓋多個關鍵領域,旨在確保玩家獲得可靠且全面的信息。以下是我們評測娛樂城的主要步驟:
娛樂城是什麼?
娛樂城是什麼?娛樂城是台灣對於線上賭場的特別稱呼,線上賭場分為幾種:現金版、信用版、手機娛樂城(娛樂城APP),一般來說,台灣人在稱娛樂城時,是指現金版線上賭場。
線上賭場在別的國家也有別的名稱,美國 – Casino, Gambling、中國 – 线上赌场,娱乐城、日本 – オンラインカジノ、越南 – Nhà cái。
娛樂城會被抓嗎?
在台灣,根據刑法第266條,不論是實體或線上賭博,參與賭博的行為可處最高5萬元罰金。而根據刑法第268條,為賭博提供場所並意圖營利的行為,可能面臨3年以下有期徒刑及最高9萬元罰金。一般賭客若被抓到,通常被視為輕微罪行,原則上不會被判處監禁。
信用版娛樂城是什麼?
信用版娛樂城是一種線上賭博平台,其中的賭博活動不是直接以現金進行交易,而是基於信用系統。在這種模式下,玩家在進行賭博時使用虛擬的信用點數或籌碼,這些點數或籌碼代表了一定的貨幣價值,但實際的金錢交易會在賭博活動結束後進行結算。
現金版娛樂城是什麼?
現金版娛樂城是一種線上博弈平台,其中玩家使用實際的金錢進行賭博活動。玩家需要先存入真實貨幣,這些資金轉化為平台上的遊戲籌碼或信用,用於參與各種賭場遊戲。當玩家贏得賭局時,他們可以將這些籌碼或信用兌換回現金。
娛樂城體驗金是什麼?
娛樂城體驗金是娛樂場所為新客戶提供的一種免費遊玩資金,允許玩家在不需要自己投入任何資金的情況下,可以進行各類遊戲的娛樂城試玩。這種體驗金的數額一般介於100元到1,000元之間,且對於如何使用這些體驗金以達到提款條件,各家娛樂城設有不同的規則。
buy cheap generic zithromax [url=http://zithromaxa.store/#]how to get zithromax over the counter[/url] zithromax for sale online
prednisone canada: prednisone 10 mg over the counter – buy prednisone online india
Как охранять свои данные: избегайте утечек информации в интернете. Сегодня защита своих данных становится все более важной задачей. Одним из наиболее часто встречающихся способов утечки личной информации является слив «сит фраз» в интернете. Что такое сит фразы и как защититься от их утечки? Что такое «сит фразы»? «Сит фразы» — это синтезы слов или фраз, которые бывают используются для доступа к различным онлайн-аккаунтам. Эти фразы могут включать в себя имя пользователя, пароль или разные конфиденциальные данные. Киберпреступники могут пытаться получить доступ к вашим аккаунтам, используя этих сит фраз. Как сохранить свои личные данные? Используйте запутанные пароли. Избегайте использования очевидных паролей, которые просто угадать. Лучше всего использовать комбинацию букв, цифр и символов. Используйте уникальные пароли для каждого из вашего аккаунта. Не используйте один и тот же пароль для разных сервисов. Используйте двухступенчатую аутентификацию (2FA). Это привносит дополнительный уровень безопасности, требуя подтверждение входа на ваш аккаунт по другое устройство или метод. Будьте осторожны с онлайн-сервисами. Не доверяйте персональную информацию ненадежным сайтам и сервисам. Обновляйте программное обеспечение. Установите обновления для вашего операционной системы и программ, чтобы защитить свои данные от вредоносного ПО. Вывод Слив сит фраз в интернете может повлечь за собой серьезным последствиям, таким подобно кража личной информации и финансовых потерь. Чтобы охранить себя, следует принимать меры предосторожности и использовать надежные методы для хранения и управления своими личными данными в сети
даркнет сливы тг
Даркнет и сливы в Телеграме
Даркнет – это сегмент интернета, которая не индексируется регулярными поисковыми системами и требует индивидуальных программных средств для доступа. В даркнете существует обилие скрытых сайтов, где можно найти различные товары и услуги, в том числе и нелегальные.
Одним из востребованных способов распространения информации в даркнете является использование мессенджера Телеграм. Телеграм предоставляет возможность создания закрытых каналов и чатов, где пользователи могут обмениваться информацией, в том числе и нелегальной.
Сливы информации в Телеграме – это практика распространения конфиденциальной информации, такой как украденные данные, базы данных, персональные сведения и другие материалы. Эти сливы могут включать в себя информацию о кредитных картах, паролях, персональных сообщениях и даже фотографиях.
Сливы в Телеграме могут быть рискованными, так как они могут привести к утечке конфиденциальной информации и нанести ущерб репутации и финансовым интересам людей. Поэтому важно быть осторожным при обмене информацией в интернете и не доверять сомнительным источникам.
Вот кошельки с балансом у бота
Криптокошельки с балансом: зачем их покупают и как использовать
В мире криптовалют все растущую популярность приобретают криптокошельки с предустановленным балансом. Это специальные кошельки, которые уже содержат определенное количество криптовалюты на момент покупки. Но зачем люди приобретают такие кошельки, и как правильно использовать их?
Почему покупают криптокошельки с балансом?
Удобство: Криптокошельки с предустановленным балансом предлагаются как готовое к работе решение для тех, кто хочет быстро начать пользоваться криптовалютой без необходимости покупки или обмена на бирже.
Подарок или награда: Иногда криптокошельки с балансом используются как подарок или поощрение в рамках акций или маркетинговых кампаний.
Анонимность: При покупке криптокошелька с балансом нет необходимости предоставлять личные данные, что может быть важно для тех, кто ценит анонимность.
Как использовать криптокошелек с балансом?
Проверьте безопасность: Убедитесь, что кошелек безопасен и не подвержен взлому. Проверьте репутацию продавца и происхождение приобретения кошелька.
Переведите средства на другой кошелек: Если вы хотите долгосрочно хранить криптовалюту, рекомендуется перевести средства на более безопасный или практичный для вас кошелек.
Не храните все средства на одном кошельке: Для обеспечения безопасности рекомендуется распределить средства между несколькими кошельками.
Будьте осторожны с фишингом и мошенничеством: Помните, что мошенники могут пытаться обмануть вас, предлагая криптокошельки с балансом с целью получения доступа к вашим средствам.
Заключение
Криптокошельки с балансом могут быть удобным и скорым способом начать пользоваться криптовалютой, но необходимо помнить о безопасности и осторожности при их использовании.Выбор и приобретение криптокошелька с балансом – это серьезный шаг, который требует внимания к деталям и осознанного подхода.”
слив сид фраз
Слив посеянных фраз (seed phrases) является одним из наиболее известных способов утечки личной информации в мире криптовалют. В этой статье мы разберем, что такое сид фразы, по какой причине они важны и как можно защититься от их утечки.
Что такое сид фразы?
Сид фразы, или мнемонические фразы, составляют комбинацию слов, которая используется для создания или восстановления кошелька криптовалюты. Обычно сид фраза состоит из 12 или 24 слов, которые отражают собой ключ к вашему кошельку. Потеря или утечка сид фразы может влечь за собой потере доступа к вашим криптовалютным средствам.
Почему важно защищать сид фразы?
Сид фразы являются ключевым элементом для надежного хранения криптовалюты. Если злоумышленники получат доступ к вашей сид фразе, они сумеют получить доступ к вашему кошельку и украсть все средства.
Как защититься от утечки сид фраз?
Никогда не передавайте свою сид фразу никакому, даже если вам кажется, что это проверенное лицо или сервис.
Храните свою сид фразу в защищенном и секурном месте. Рекомендуется использовать аппаратные кошельки или специальные программы для хранения сид фразы.
Используйте дополнительные методы защиты, такие как двухэтапная проверка, для усиления безопасности вашего кошелька.
Регулярно делайте резервные копии своей сид фразы и храните их в разнообразных безопасных местах.
Заключение
Слив сид фраз является серьезной угрозой для безопасности владельцев криптовалют. Понимание важности защиты сид фразы и принятие соответствующих мер безопасности помогут вам избежать потери ваших криптовалютных средств. Будьте бдительны и обеспечивайте надежную защиту своей сид фразы
zithromax buy online no prescription: buy generic zithromax online – buy zithromax no prescription
rexall pharmacy amoxicillin 500mg: can you buy amoxicillin over the counter in canada – can you buy amoxicillin over the counter
http://zithromaxa.store/# zithromax 1000 mg online
В поисках идеального промокода для ставок в онлайн-казино? 1Win предлагает уникальный код 937999, который не только увеличивает шансы на крупный выигрыш, но и делает игровой процесс еще более захватывающим. Вот ваше руководство по выбору и использованию промокода на 2024 год.
Преимущества использования промокода 1Win
Использование промокода 937999 промокоды 1вин при регистрации 2024 открывает перед вами двери в мир больших возможностей:
Увеличение начального капитала: После активации промокода и выполнения условий отыгрыша, ваш первоначальный депозит может увеличиться до 500%, достигая суммы в 75 000 рублей.
Минимизация рисков: Некоторые промокоды позволяют застраховать вашу первую ставку, снижая потенциальные потери.
Кешбэк: Получайте обратно часть потраченных средств, что делает каждую игру менее рискованной.
Эксклюзивные розыгрыши: Промокод открывает доступ к специальным акциям и розыгрышам, где можно выиграть значительные призы.
Как выбрать промокод?
Выбор промокода – это не просто вопрос личных предпочтений, но и стратегическое решение. Вот несколько критериев, которые помогут вам сделать правильный выбор:
Срок действия: Убедитесь, что промокод актуален. Для 937999 срок действия истекает 31 декабря 2024 года.
Условия отыгрыша: Внимательно изучите условия, при которых вы сможете использовать бонусные средства.
Размер бонуса: Выбирайте промокоды, которые предлагают максимальную выгоду от вашего депозита.
Дополнительные возможности: Ищите промокоды, которые предоставляют дополнительные преимущества, такие как фрибеты или кешбэк.
Как использовать промокод?
Чтобы активировать промокод 937999 в 1Win, выполните следующие шаги:
Перейдите на сайт 1Win и начните процесс регистрации.
Заполните все необходимые поля в анкете.
Введите промокод 937999 в соответствующее поле.
Завершите регистрацию и внесите первый депозит.
Помните, что использование промокода – это отличный способ усилить ваш игровой опыт и увеличить шансы на успех. Выбирайте мудро и пусть удача всегда будет на вашей стороне!
where to get amoxicillin over the counter amoxicillin 775 mg or buy amoxil
https://nhatrangclub.vn/proxy.php?link=https://amoxila.pro amoxacillian without a percription
[url=https://parts.harnessmaster.com/index.php?category=Hardware and Terminal Studs&colour=Silver&part=463&rurl=https://amoxila.pro]price of amoxicillin without insurance[/url] buy amoxicillin 500mg capsules uk and [url=http://bbs.cheaa.com/home.php?mod=space&uid=3119755]amoxicillin 250 mg capsule[/url] amoxicillin 250 mg
https://prednisoned.online/# prednisone 20mg for sale
Although I believe every thought you have for your post is excellent and will undoubtedly be successful, the postings are too brief for new readers. Maybe you could extend them a little bit the next time? I’m grateful for the post.
order doxycycline online [url=https://doxycyclinea.online/#]buy doxycycline without prescription uk[/url] buy cheap doxycycline
Промокод 1Win на сегодня, 2024 год – 937999. При регистрации с использованием этого кода активируется приветственный бонус в размере 500% до 75 000 рублей. Это специальное предложение от букмекера 1Win позволяет новым игрокам получить дополнительные привилегии и бонусы.
1Win – это платформа, которая радует своих пользователей разнообразными акциями. В 2024 году они предлагают следующие привлекательные бонусы для новичков:
Бездепозитные бонусы: Получите бонусы без необходимости внесения депозита.
Фриспины: Бесплатные вращения на слотах.
Фрибет бонусы: Возможность сделать бесплатные ставки.
Кэшбэк: Возврат части потерянных средств.
Промокод 937999 следует ввести при регистрации, чтобы получить максимальный бонус. Не упустите шанс увеличить свой баланс и наслаждаться игрой на 1Win!
как ввести промокод в 1win если уже зарегистрирован используйте промокод 937999, чтобы получить максимальный бонус в размере 500% до 75 000 рублей. Этот код активирует приветственный бонус, который будет зачислен на два бонусных счета одновременно: на счета “Ставки” и “Казино”.
Важно учесть следующие особенности и предостережения при использовании промокода:
Различные поводы: Промокоды в 1Win выдаются по разным поводам, таким как акции, специальные события или дни рождения клиентов.
Активация и доступ к бонусам: После активации промокода при регистрации бонусные средства станут доступны после входа в ваш профиль. Личные промокоды требуют вашего согласия на участие в предложении.
Конвертация в реальные деньги: Бонусы будут зачислены на ваш бонусный счет с указанием доступной суммы в личном кабинете. При выполнении условий использования бонусов вы сможете конвертировать их в реальные деньги, которые дополнят ваш выигрыш.
Будьте бдительны: При поиске промокодов обращайте внимание на источник информации. Некоторые мошенники предлагают “бесплатные” промокоды с целью получить ваши личные данные. Регистрируйтесь и вводите информацию только на официальном сайте 1Win.
Kantorbola adalah situs slot gacor terbaik di indonesia , kunjungi situs RTP kantor bola untuk mendapatkan informasi akurat slot dengan rtp diatas 95% . Kunjungi juga link alternatif kami di kantorbola77 dan kantorbola99 .
1 mg prednisone cost: 5 mg prednisone tablets – can i purchase prednisone without a prescription
neurontin 2018 neurontin 202 or neurontin cost in canada
https://images.google.gm/url?sa=t&url=https://gabapentinneurontin.pro neurontin cost
[url=http://www.amateurpin.com/ap_network.php?l=de&u=http://gabapentinneurontin.pro]drug neurontin[/url] neurontin 300 600 mg and [url=http://bocauvietnam.com/member.php?1461923-nfhfzegous]neurontin discount[/url] neurontin canada
doxycycline hyc: doxycycline 50mg – where to get doxycycline
doxycycline hyclate [url=https://doxycyclinea.online/#]doxycycline hyc[/url] doxycycline 150 mg
http://prednisoned.online/# prednisone 20 mg tablet
Промокоды 1xBet на сегодня. Получите бесплатно при регистрации бонус. Активируйте промокоды и делайте ставки на футбол, хоккей и самые яркие состязания – Лиги Европы и Лиги Чемпионов. Отличительная особенность букмекера – возможность использования промокод для 1 икс бет или для активных клиентов, уже имеющих учетную запись. Они обеспечивают двойной депозит, бесплатную ставку (фрибет), специальный бонус на день рождения и многое другое. Актуальные бонусные коды для новичков за регистрацию, способы получения и активации, bonus программа на официальном сайте букмекера 1хБет. Бесплатные промокоды при регистрации в 2024 году в 1xBet – более подробно в этом материале http://nizhnekamsknews.ru/index.php/novosti-nizhnekamska/5343-v-tatarstane-perevernulsja-passazhirskij-avtobus
https://mexicanpharmacy1st.shop/# buying prescription drugs in mexico online
reputable mexican pharmacies online: mexican pharmaceuticals online – best online pharmacies in mexico
1Win Приветственный Бонус (2024): Полное Руководство
Промокод 937999 от 1Win — это ваш ключ к миру больших возможностей. С этим кодом, при первом депозите, вы можете получить бонус в размере 500% до 200 000 рублей. Это уникальное предложение позволяет новым клиентам значительно увеличить свой игровой бюджет и получить максимальное удовольствие от игры в спорте и казино.
Как работает приветственный бонус?
промокод для авиатор 1win разделен на четыре этапа:
Первый депозит: Получите 200% от суммы депозита.
Второй депозит: Получите 150% от суммы второго депозита.
Третий депозит: Получите 100% от суммы.
Четвертый депозит: Получите 50% от суммы.
Максимальная сумма бонуса составляет 200,000 рублей, а максимальный бонус на один депозит — 50,000 рублей.
Как активировать промокод?
Чтобы активировать промокод 937999:
Зарегистрируйтесь на сайте 1Win.
Введите промокод при регистрации или дайте согласие на участие в акции, если промокод был предоставлен лично.
Пополните счет и начните играть, используя приветственный бонус.
Как отыграть бонус?
Чтобы отыграть бонусные средства:
Делайте ставки с коэффициентом от 3.
В случае выигрыша, 5% от бонусного счета переводится на ваш основной счет.
Пример:
Вы внесли 10 000 рублей и получили 20 000 рублей бонуса.
Сделали ставку с коэффициентом 3 и выиграли 30 000 рублей плюс 500 рублей бонуса.
Ваш счет теперь 30 500 рублей, а бонусный счет — 19 500 рублей.
Дополнительные бонусы и акции
1Win также предлагает различные акции и бонусы для любителей казино и экспресс-ставок. Следите за обновлениями на сайте, чтобы не пропустить самые выгодные предложения.
Обратите внимание: ставки с коэффициентом менее 3 не учитываются при отыгрыше бонуса.
https://mexicanpharmacy1st.com/# mexican mail order pharmacies
buying prescription drugs in mexico: mexico pharmacies prescription drugs – reputable mexican pharmacies online
mexican pharmaceuticals online: buying prescription drugs in mexico – mexican pharmaceuticals online
mexican border pharmacies shipping to usa [url=https://mexicanpharmacy1st.com/#]mexican rx online[/url] buying from online mexican pharmacy
medicine in mexico pharmacies: reputable mexican pharmacies online – mexico drug stores pharmacies
https://mexicanpharmacy1st.com/# buying prescription drugs in mexico
mexican online pharmacies prescription drugs [url=https://mexicanpharmacy1st.shop/#]buying from online mexican pharmacy[/url] mexico drug stores pharmacies
pharmacies in mexico that ship to usa: medication from mexico pharmacy – mexican rx online
http://mexicanpharmacy1st.com/# medicine in mexico pharmacies
mexican online pharmacies prescription drugs: mexico pharmacies prescription drugs – mexico drug stores pharmacies
medicine in mexico pharmacies [url=https://mexicanpharmacy1st.com/#]mexican border pharmacies shipping to usa[/url] pharmacies in mexico that ship to usa
best online pharmacies in mexico: mexico pharmacy – medicine in mexico pharmacies
pharmacies in mexico that ship to usa purple pharmacy mexico price list or buying prescription drugs in mexico
http://images.google.bf/url?q=https://mexicanpharmacy1st.shop mexican border pharmacies shipping to usa
[url=https://www.domaininfofree.com/domain-traffic/mexicanpharmacy1st.shop]buying prescription drugs in mexico online[/url] п»їbest mexican online pharmacies and [url=http://www.donggoudi.com/home.php?mod=space&uid=512214]buying from online mexican pharmacy[/url] mexico drug stores pharmacies
https://mexicanpharmacy1st.online/# mexico drug stores pharmacies
buying from online mexican pharmacy п»їbest mexican online pharmacies or buying from online mexican pharmacy
https://images.google.ci/url?q=https://mexicanpharmacy1st.online mexican border pharmacies shipping to usa
[url=http://www.bad.org.uk/for-the-public/patient-information-leaflets/androgenetic-alopecia/?showmore=1&returnlink=http://mexicanpharmacy1st.online]mexico drug stores pharmacies[/url] pharmacies in mexico that ship to usa and [url=http://bbs.cheaa.com/home.php?mod=space&uid=3124215]mexican rx online[/url] purple pharmacy mexico price list
pharmacies in mexico that ship to usa [url=http://mexicanpharmacy1st.com/#]mexican pharmacy[/url] medication from mexico pharmacy
https://mexicanpharmacy1st.com/# mexico pharmacies prescription drugs
pharmacies in mexico that ship to usa mexico pharmacies prescription drugs or mexican online pharmacies prescription drugs
http://clients1.google.com.sl/url?q=https://mexicanpharmacy1st.online best online pharmacies in mexico
[url=http://www.kip-k.ru/best/sql.php?=mexicanpharmacy1st.online]medicine in mexico pharmacies[/url] mexico pharmacies prescription drugs and [url=https://www.sdxle.com/home.php?mod=space&uid=1647568]mexican drugstore online[/url] buying from online mexican pharmacy
mexican rx online: purple pharmacy mexico price list – medicine in mexico pharmacies
buying prescription drugs in mexico online: pharmacies in mexico that ship to usa – mexican drugstore online
mexican mail order pharmacies [url=https://mexicanpharmacy1st.online/#]pharmacies in mexico that ship to usa[/url] mexico pharmacy
buying from online mexican pharmacy: mexican mail order pharmacies – reputable mexican pharmacies online
pharmacies in mexico that ship to usa mexico drug stores pharmacies or pharmacies in mexico that ship to usa
https://www.google.is/url?q=https://mexicanpharmacy1st.com purple pharmacy mexico price list
[url=https://www.google.tg/url?q=https://mexicanpharmacy1st.com]buying prescription drugs in mexico[/url] mexican online pharmacies prescription drugs and [url=http://www.coin520.com/home.php?mod=space&uid=39468]buying from online mexican pharmacy[/url] buying prescription drugs in mexico
https://mexicanpharmacy1st.online/# buying prescription drugs in mexico
http://mexicanpharmacy1st.com/# mexican pharmacy
medication from mexico pharmacy: best mexican online pharmacies – buying prescription drugs in mexico online
medicine in mexico pharmacies [url=https://mexicanpharmacy1st.shop/#]pharmacies in mexico that ship to usa[/url] mexican pharmacy
https://mexicanpharmacy1st.online/# mexico drug stores pharmacies
Капсулы мухомора для микродозинга купить украина . https://shafa.ua/uk/home/yeda/bakaleya/sukhofrukty/163187510-kapsuly-muhomora-dlya-mikrodozinga-kupit-ukraina-100sht
mexican pharmaceuticals online mexican mail order pharmacies or mexican mail order pharmacies
https://maps.google.com.sg/url?q=http://mexicanpharmacy1st.online mexico pharmacies prescription drugs
[url=http://images.google.com.pe/url?q=http://mexicanpharmacy1st.online]buying from online mexican pharmacy[/url] medication from mexico pharmacy and [url=http://wnt1688.cn/home.php?mod=space&uid=8362222]medicine in mexico pharmacies[/url] mexican pharmaceuticals online
mexican pharmacy: buying from online mexican pharmacy – buying prescription drugs in mexico
https://mexicanpharmacy1st.shop/# mexico pharmacy
mexico drug stores pharmacies: buying prescription drugs in mexico – purple pharmacy mexico price list
pharmacies in mexico that ship to usa: purple pharmacy mexico price list – medicine in mexico pharmacies
https://mexicanpharmacy1st.shop/# mexican drugstore online
mexican pharmacy [url=https://mexicanpharmacy1st.com/#]mexico pharmacies prescription drugs[/url] mexican online pharmacies prescription drugs
https://mexicanpharmacy1st.com/# п»їbest mexican online pharmacies
medication from mexico pharmacy: buying prescription drugs in mexico online – mexican border pharmacies shipping to usa
http://lisinopril.club/# cost of lisinopril 2.5 mg
Бонусы и Акции 1Win 2024: Ваш Путь к Успеху
Ищете способ максимизировать свои выигрыши? Букмекерская контора 1Win предлагает невероятный бонус код 937999, который открывает дверь к миру беспрецедентных возможностей. С этим промокодом новые клиенты могут получить денежный бонус в размере 500% до 200 000 рублей на первые четыре депозита. Это ваш шанс начать с большого и продолжать выигрывать!
1Win: не просто букмекерская контора, а мир, где каждый может стать победителем. Ставки на спорт, онлайн-казино, розыгрыши и турниры — все это доступно в одном месте, где более 1000 вариантов ставок ждут вас.
Как использовать промокод при регистрации 1win?
Процесс активации промокода 937999 прост и понятен:
Переход на сайт: Используйте зеркало или VPN-сервис для доступа к официальному сайту 1Win.
Регистрация: Нажмите “Зарегистрироваться” и заполните необходимые данные. Выберите удобный способ регистрации — через социальные сети или электронную почту.
Активация промокода: Введите 937999 в специальное поле промокода и завершите регистрацию.
После этих шагов вы станете полноправным участником игрового сообщества 1Win и сможете воспользоваться всеми преимуществами промокода.
buy lisinopril 40 mg online: lisinopril 30 mg price – lisinopril uk
lisinopril 10 mg tablet: buy lisinopril 10 mg online – lisinopril average cost
https://lisinopril.club/# lisinopril 5mg tablets
Rikvip Club: Trung Tâm Giải Trí Trực Tuyến Hàng Đầu tại Việt Nam
Rikvip Club là một trong những nền tảng giải trí trực tuyến hàng đầu tại Việt Nam, cung cấp một loạt các trò chơi hấp dẫn và dịch vụ cho người dùng. Cho dù bạn là người dùng iPhone hay Android, Rikvip Club đều có một cái gì đó dành cho mọi người. Với sứ mạng và mục tiêu rõ ràng, Rikvip Club luôn cố gắng cung cấp những sản phẩm và dịch vụ tốt nhất cho khách hàng, tạo ra một trải nghiệm tiện lợi và thú vị cho người chơi.
Sứ Mạng và Mục Tiêu của Rikvip
Từ khi bắt đầu hoạt động, Rikvip Club đã có một kế hoạch kinh doanh rõ ràng, luôn nỗ lực để cung cấp cho khách hàng những sản phẩm và dịch vụ tốt nhất và tạo điều kiện thuận lợi nhất cho người chơi truy cập. Nhóm quản lý của Rikvip Club có những mục tiêu và ước muốn quyết liệt để biến Rikvip Club thành trung tâm giải trí hàng đầu trong lĩnh vực game đổi thưởng trực tuyến tại Việt Nam và trên toàn cầu.
Trải Nghiệm Live Casino
Rikvip Club không chỉ nổi bật với sự đa dạng của các trò chơi đổi thưởng mà còn với các phòng trò chơi casino trực tuyến thu hút tất cả người chơi. Môi trường này cam kết mang lại trải nghiệm chuyên nghiệp với tính xanh chín và sự uy tín không thể nghi ngờ. Đây là một sân chơi lý tưởng cho những người yêu thích thách thức bản thân và muốn tận hưởng niềm vui của chiến thắng. Với các sảnh cược phổ biến như Roulette, Sic Bo, Dragon Tiger, người chơi sẽ trải nghiệm những cảm xúc độc đáo và đặc biệt khi tham gia vào casino trực tuyến.
Phương Thức Thanh Toán Tiện Lợi
Rikvip Club đã được trang bị những công nghệ thanh toán tiên tiến ngay từ đầu, mang lại sự thuận tiện và linh hoạt cho người chơi trong việc sử dụng hệ thống thanh toán hàng ngày. Hơn nữa, Rikvip Club còn tích hợp nhiều phương thức giao dịch khác nhau để đáp ứng nhu cầu đa dạng của người chơi: Chuyển khoản Ngân hàng, Thẻ cào, Ví điện tử…
Kết Luận
Tóm lại, Rikvip Club không chỉ là một nền tảng trò chơi, mà còn là một cộng đồng nơi người chơi có thể tụ tập để tận hưởng niềm vui của trò chơi và cảm giác hồi hộp khi chiến thắng. Với cam kết cung cấp những sản phẩm và dịch vụ tốt nhất, Rikvip Club chắc chắn là điểm đến lý tưởng cho những người yêu thích trò chơi trực tuyến tại Việt Nam và cả thế giới.
Все 1хбет промокод 2024 вы можете найти бесплатно на этом сайте. Используйте промокод *1XFREE777* для получения бонуса до 32500 руб при регистрации. Приятно, что новички могут ввести промокод при регистрации, который даст право на получение приветственного бонуса на сумму до 32500 рублей. Самое главное — это относиться к ставкам и к игре в целом ответственно! Не стоит играть на последние или заемные деньги, стремясь таким образом заработать себе на жизнь – более подробно в этом материале http://zdorovie24.ru/disk/pgs/1hbet_promokod_besplatno.html
buy cytotec pills [url=https://cytotec.xyz/#]buy cytotec pills online cheap[/url] cytotec pills buy online
https://gabapentin.club/# neurontin cost in canada
Great web site. Lots of useful info here. I am sending it to a few buddies ans additionally sharing in delicious. And certainly, thanks in your effort!
cost generic clomid pill: can you buy clomid no prescription – where to buy cheap clomid tablets
http://clomiphene.shop/# clomid no prescription
cytotec abortion pill [url=http://cytotec.xyz/#]п»їcytotec pills online[/url] buy cytotec
lisinopril 10 mg tablet: prinivil generic – lisinopril 5mg
http://propeciaf.online/# get propecia pills
buy brand neurontin: neurontin 400 mg tablets – neurontin prices
UEFA Euro 2024 Sân Chơi Bóng Đá Hấp Dẫn Nhất Của Châu Âu
Euro 2024 là sự kiện bóng đá lớn nhất của châu Âu, không chỉ là một giải đấu mà còn là một cơ hội để các quốc gia thể hiện tài năng, sự đoàn kết và tinh thần cạnh tranh.
Euro 2024 hứa hẹn sẽ mang lại những trận cầu đỉnh cao và kịch tính cho người hâm mộ trên khắp thế giới. Cùng tìm hiểu các thêm thông tin hấp dẫn về giải đấu này tại bài viết dưới đây, gồm:
Nước chủ nhà
Đội tuyển tham dự
Thể thức thi đấu
Thời gian diễn ra
Sân vận động
Euro 2024 sẽ được tổ chức tại Đức, một quốc gia có truyền thống vàng của bóng đá châu Âu.
Đức là một đất nước giàu có lịch sử bóng đá với nhiều thành công quốc tế và trong những năm gần đây, họ đã thể hiện sức mạnh của mình ở cả mặt trận quốc tế và câu lạc bộ.
Việc tổ chức Euro 2024 tại Đức không chỉ là một cơ hội để thể hiện năng lực tổ chức tuyệt vời mà còn là một dịp để giới thiệu văn hóa và sức mạnh thể thao của quốc gia này.
Đội tuyển tham dự giải đấu Euro 2024
Euro 2024 sẽ quy tụ 24 đội tuyển hàng đầu từ châu Âu. Các đội tuyển này sẽ là những đại diện cho sự đa dạng văn hóa và phong cách chơi bóng đá trên khắp châu lục.
Các đội tuyển hàng đầu như Đức, Pháp, Tây Ban Nha, Bỉ, Italy, Anh và Hà Lan sẽ là những ứng viên nặng ký cho chức vô địch.
Trong khi đó, các đội tuyển nhỏ hơn như Iceland, Wales hay Áo cũng sẽ mang đến những bất ngờ và thách thức cho các đối thủ.
Các đội tuyển tham dự được chia thành 6 bảng đấu, gồm:
Bảng A: Đức, Scotland, Hungary và Thuỵ Sĩ
Bảng B: Tây Ban Nha, Croatia, Ý và Albania
Bảng C: Slovenia, Đan Mạch, Serbia và Anh
Bảng D: Ba Lan, Hà Lan, Áo và Pháp
Bảng E: Bỉ, Slovakia, Romania và Ukraina
Bảng F: Thổ Nhĩ Kỳ, Gruzia, Bồ Đào Nha và Cộng hoà Séc
선물옵션
국외선물의 출발 골드리치증권와 동참하세요.
골드리치증권는 오랜기간 고객님들과 더불어 선물마켓의 행로을 공동으로 걸어왔으며, 투자자분들의 안전한 자금운용 및 높은 수익률을 향해 계속해서 전력을 기울이고 있습니다.
왜 20,000+명 이상이 골드리치증권와 함께할까요?
신속한 서비스: 쉽고 빠른속도의 프로세스를 제공하여 모두 수월하게 사용할 수 있습니다.
안전 프로토콜: 국가당국에서 사용하는 높은 등급의 보안시스템을 도입하고 있습니다.
스마트 인증: 전체 거래정보은 암호처리 보호되어 본인 외에는 그 누구도 내용을 접근할 수 없습니다.
안전 수익률 제공: 리스크 요소를 감소시켜, 더욱 한층 안전한 수익률을 제시하며 이에 따른 리포트를 제공합니다.
24 / 7 상시 고객센터: 연중무휴 24시간 신속한 지원을 통해 투자자분들을 전체 뒷받침합니다.
함께하는 파트너사: 골드리치증권는 공기업은 물론 금융기관들 및 다수의 협력사와 공동으로 여정을 했습니다.
해외선물이란?
다양한 정보를 참고하세요.
해외선물은 해외에서 거래되는 파생금융상품 중 하나로, 명시된 기반자산(예시: 주식, 화폐, 상품 등)을 바탕로 한 옵션계약 계약을 의미합니다. 근본적으로 옵션은 지정된 기초자산을 미래의 어떤 시기에 정해진 가격에 사거나 팔 수 있는 자격을 허락합니다. 국외선물옵션은 이러한 옵션 계약이 외국 마켓에서 거래되는 것을 지칭합니다.
국외선물은 크게 매수 옵션과 풋 옵션으로 나뉩니다. 매수 옵션은 지정된 기초자산을 미래에 정해진 가격에 매수하는 권리를 부여하는 반면, 풋 옵션은 지정된 기초자산을 미래에 일정 금액에 팔 수 있는 권리를 허락합니다.
옵션 계약에서는 미래의 명시된 날짜에 (종료일이라 칭하는) 일정 가격에 기초자산을 사거나 매도할 수 있는 권리를 보유하고 있습니다. 이러한 가격을 실행 금액이라고 하며, 만기일에는 해당 권리를 실행할지 여부를 선택할 수 있습니다. 따라서 옵션 계약은 투자자에게 미래의 시세 변화에 대한 보호나 수익 창출의 기회를 제공합니다.
해외선물은 마켓 참가자들에게 다양한 운용 및 차익거래 기회를 제공, 환율, 상품, 주식 등 다양한 자산유형에 대한 옵션 계약을 포함할 수 있습니다. 투자자는 매도 옵션을 통해 기초자산의 하락에 대한 보호를 받을 수 있고, 콜 옵션을 통해 상승장에서의 수익을 노릴 수 있습니다.
외국선물 거래의 원리
실행 가격(Exercise Price): 해외선물에서 실행 금액은 옵션 계약에 따라 지정된 가격으로 계약됩니다. 만기일에 이 가격을 기준으로 옵션을 실행할 수 있습니다.
만기일(Expiration Date): 옵션 계약의 만기일은 옵션의 실행이 허용되지않는 최종 날짜를 뜻합니다. 이 날짜 이후에는 옵션 계약이 만료되며, 더 이상 거래할 수 없습니다.
매도 옵션(Put Option)과 매수 옵션(Call Option): 매도 옵션은 기초자산을 특정 가격에 매도할 수 있는 권리를 제공하며, 콜 옵션은 기초자산을 지정된 금액에 사는 권리를 허락합니다.
계약료(Premium): 외국선물 거래에서는 옵션 계약에 대한 프리미엄을 지불해야 합니다. 이는 옵션 계약에 대한 비용으로, 시장에서의 수요와 공급량에 따라 변화됩니다.
행사 방안(Exercise Strategy): 투자자는 만기일에 옵션을 실행할지 여부를 판단할 수 있습니다. 이는 시장 상황 및 거래 플랜에 따라 상이하며, 옵션 계약의 이익을 최대화하거나 손실을 감소하기 위해 선택됩니다.
마켓 리스크(Market Risk): 해외선물 거래는 시장의 변화추이에 작용을 받습니다. 시세 변동이 예상치 못한 진로으로 발생할 경우 손해이 발생할 수 있으며, 이러한 마켓 위험요인를 축소하기 위해 거래자는 계획을 수립하고 투자를 계획해야 합니다.
골드리치와 동반하는 해외선물은 보장된 확신할 수 있는 운용을 위한 최적의 대안입니다. 고객님들의 투자를 뒷받침하고 안내하기 위해 우리는 전력을 다하고 있습니다. 함께 더 나은 미래를 지향하여 나아가요.
http://cytotec.xyz/# cytotec pills online
where can i buy generic clomid without prescription how can i get cheap clomid without insurance or can you buy generic clomid
https://www.google.com.ng/url?q=https://clomiphene.shop can i order generic clomid for sale
[url=https://www.google.bj/url?sa=t&url=https://clomiphene.shop]where to get generic clomid price[/url] where can i buy generic clomid without a prescription and [url=https://masterbationtube.com/user/yunkeacmhh/videos]where to buy generic clomid online[/url] how to get clomid without rx
lisinopril price without insurance [url=http://lisinopril.club/#]lisinopril 12.5 mg price[/url] rx lisinopril 10mg
buy generic clomid: where to buy generic clomid without insurance – where to buy cheap clomid tablets
cost propecia price: get generic propecia without insurance – cost of propecia without a prescription
http://clomiphene.shop/# how to get clomid pills
lisinopril mexico [url=http://lisinopril.club/#]lisinopril 10 mg for sale[/url] lisinopril for sale
http://cytotec.xyz/# Abortion pills online
order generic propecia pill: buy cheap propecia without insurance – buy generic propecia without prescription
where to buy clomid without a prescription: where can i buy generic clomid – can i order generic clomid without rx
http://propeciaf.online/# buying generic propecia
I just like the helpful information you provide in your articles
http://cytotec.xyz/# cytotec online
[url=https://sildenafilps.online/]viagra usa buy[/url]
can i buy generic clomid without a prescription [url=https://clomiphene.shop/#]can i buy clomid prices[/url] buy generic clomid pill
zestoretic 20-25 mg lisinopril comparison or lisinopril 20 mg coupon
https://maps.google.lu/url?q=https://lisinopril.club lisinopril 120mg
[url=http://maps.google.it/url?q=https://lisinopril.club]can you buy lisinopril over the counter[/url] lisinopril 20 and [url=http://dw.hezhou520.com/home.php?mod=space&uid=43114]208 lisinopril[/url] lisinopril 20 mg best price
can i buy generic clomid: where to get clomid without insurance – order cheap clomid for sale
http://cytotec.xyz/# buy cytotec online
There’s noticeably a bundle to find out about this. I assume you made certain good points in features also.
lisinopril 1.25 [url=https://lisinopril.club/#]order lisinopril online from canada[/url] buy lisinopril 2.5 mg
1xbet promo code today: 1XBOX777. By using the 1xBet bonus code 2024, you can take advantage of a 100% bonus of up to €/$130. This bonus can be claimed when you register at the sportsbook. Make sure to enter this exclusive code when creating a new account on 1xBet to receive the most VIP welcome bonus available. The bonus funds you receive can be used in various sections of 1xBet, including Sports, Live Cricket, Live Casino, 1XGames, ESports, TV Games, and Bingo.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://littlepeople.com.my/wp-content/pgs/1xbet_promo_code___sign_up_bonus.html
neurontin buy generic neurontin online or neurontin cap
https://images.google.co.zm/url?sa=t&url=https://gabapentin.club neurontin brand name
[url=http://4vn.eu/forum/vcheckvirus.php?url=http://gabapentin.club]neurontin 300 mg tablets[/url] neurontin 2018 and [url=http://wnt1688.cn/home.php?mod=space&uid=8421327]buy cheap neurontin[/url] neurontin 50mg cost
buying cheap propecia prices: buy propecia without rx – cost propecia without a prescription
buy propecia price generic propecia pill or order generic propecia price
https://www.google.co.il/url?sa=t&url=https://propeciaf.online generic propecia pill
[url=https://images.google.nr/url?sa=t&url=https://propeciaf.online]buying propecia without prescription[/url] cost propecia without insurance and [url=http://www.41ml.com/home.php?mod=space&uid=6414]order generic propecia without insurance[/url] get propecia without insurance
http://cytotec.xyz/# buy cytotec online
cytotec buy online usa [url=http://cytotec.xyz/#]cytotec abortion pill[/url] buy cytotec pills
Your blog is an excellent resource for anyone looking for useful information. Keep up the good work.
АКТУАЛЬНЫЙ ПРОМОКОД 1x_1791223 НА 2024г
Промокоды 1xbet – это неотъемлемая часть современной жизни. Мы все стремимся сэкономить деньги и получить наибольшую выгоду от своих покупок. Исходя из этого, я хотел бы предложить вам уникальный промокод от компании 1xbet, который поможет вам насладиться азартом и выйти в плюс.
1xbet – это ведущая мировая букмекерская контора, предлагающая широкий спектр спортивных ставок и увлекательный игровой опыт. С недавних пор, компания также предлагает возможность играть в виртуальные онлайн-казино, что делает её еще более привлекательной для азартных игроков.
Итак, промокод от компании 1xbet дает вам возможность получить бонус при регистрации на сайте. Просто введите этот уникальный код при создании своего аккаунта, и вам будет начислен бонусный баланс, который вы можете использовать для различных видов ставок и игр.
Промокоды 1ХБЕТ На что вы можете потратить свой бонусный баланс? Возможностей здесь предостаточно. Вы можете делать ставки на спортивные события – футбол, теннис, хоккей, баскетбол и многое другое. Независимо от того, являетесь ли вы фанатом больших лиг или предпочитаете теннисные матчи мирового уровня, 1xbet предлагает обширный выбор категорий и событий, на которые можно сделать ставку.
Если вы больше склонны к игровым автоматам и карточным играм, то также найдете множество вариантов на сайте 1xbet. Яркие слоты, популярные игры, лотереи и многое другое – все это доступно вам с помощью бонусного баланса, который вы получите с промокодом.
Что еще привлекательно в использовании промокода? Это великолепная возможность испытать свою удачу, не тратя при этом деньги из своего собственного кошелька. Бонусный баланс предоставляет вам льготу играть на деньги конторы без риска потери личных средств. Это прекрасный способ познакомиться с азартным миром и понять, на какие игры и виды ставок вы хотите делать наибольший акцент.
Помимо этого, компания 1xbet предлагает регулярные акции и бонусы для своих постоянных игроков, что делает её еще более привлекательной для всех поклонников азартных игр.
Не упустите возможность получить уникальный промокод от 1xbet и начать свой путь в мир азартных игр с удвоенными шансами на успех! Зарегистрируйтесь прямо сейчас, используя промокод, и откройте для себя увлекательный и захватывающий мир ставок и игр на сайте 1xbet. Вам понравится!
Источник: https://mmocenter.ru/blog/promokod-1xbet/
Your article is very articulate. I appreciate the effort the author put into it. Thank you for posting.
lisinopril 12.5: zestril 25 mg – 40 mg lisinopril for sale
http://gabapentin.club/# generic neurontin pill
I could tell you’ve done your research, thanks.
Your blog illuminates my day like a beam of sunshine. Thank you for sharing positivity through your words.
Your blog is an excellent resource for anyone curious in learning about a variety of subjects. Thanks for all that you do.
I always enjoy reading your articles. Thanks for sharing your knowledge and expertise with us.
order lisinopril online from canada: lisinopril 20 pills – lisinopril 2.5 mg price
Your writing is so impactful; it has the power to change perspectives.
Wow, this article really resonated with me! You have a wonderful approach of capturing readers’ interest.
I’m captivated by your natural ability to turn mundane topics into riveting content. Keep it up!
I’ve been hunting answers to this issue, and your post answered it.
I really appreciate your enthusiasm for sharing information with your readers. Thanks for all that you do.
Thank you for sharing your knowledge; it helps us grow better individuals of ourselves.
Your prose paints colorful pictures, allowing readers to immediately immerse themselves in your captivating descriptions.
ordering neurontin online: neurontin 300 mg – buy neurontin online
This website is a priceless source of knowledge. I appreciate the quality of your posts.
Your blog offers valuable information on a variety of subjects. Thanks for sharing your wisdom with us.
I never imagined that before; your point of view is thought-provoking.
I love how your unique character shines through in your writing. It feels like we’re engaging in a insightful conversation.
Your blog consistently captivates me from start to finish. I simply can’t reading without absorbing every individual word you write.
I like your approach of writing. Your blog is well-written and engaging.
This blog post has opened my eyes to a whole new perspective; thanks.
neurontin india [url=http://gabapentin.club/#]neurontin for sale online[/url] neurontin online usa
Your zeal is contagious, which makes it difficult not to be enthralled by the topics you explore.
blackweb official website [url=https://mydarkmarket.com/ ]dark web markets [/url] darkmarkets
zestril canada: zestril 20 mg price canadian pharmacy – lisinopril price uk
https://cheapestindia.shop/# indian pharmacy paypal
http://cheapestandfast.com/# mexico prescription drugs online
canadian prescription drugstore reviews: online drugs without prescription – how to get a prescription in canada
http://36and6health.com/# canada pharmacy not requiring prescription
indian pharmacy no prescription: cheapest and fast – order prescription from canada
1xbet promo code today pakistan: 1XBOX777 enter the code during registration and receive a welcome bonus of up to $130 for sports betting and a casino bonus of €1,950 + 150 free spin. Register now at 1xBet to take advantage of this incredible offer. 1xBet Promotion 2024 offers a range of exciting incentives for players. With bonus codes, you can unlock additional benefits and enhance your gaming experience. Get your hands on free money and enjoy the thrill of playing with bonus free bets. Take advantage of this opportunity to play for free and make the most out of your time at 1xBet.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — http://centroculturalrecoleta.org/blog/pages/1xbet_registration_promo_code.html
https://cheapestcanada.com/# canadian neighbor pharmacy
Online medicine order [url=http://cheapestindia.com/#]indian pharmacies safe[/url] best online pharmacy india
I like the efforts you have put in this, regards for all the great content.
This was beautiful Admin. Thank you for your reflections.
I really like reading through a post that can make men and women think. Also, thank you for allowing me to comment!
hani sektor senindi anasini gotten siktigim?
Great information shared.. really enjoyed reading this post thank you author for sharing this post .. appreciated
You’re so awesome! I don’t believe I have read a single thing like that before. So great to find someone with some original thoughts on this topic. Really.. thank you for starting this up. This website is something that is needed on the internet, someone with a little originality!
I’m often to blogging and i really appreciate your content. The article has actually peaks my interest. I’m going to bookmark your web site and maintain checking for brand spanking new information.
This was beautiful Admin. Thank you for your reflections.
This is my first time pay a quick visit at here and i am really happy to read everthing at one place
I very delighted to find this internet site on bing, just what I was searching for as well saved to fav
You’re so awesome! I don’t believe I have read a single thing like that before. So great to find someone with some original thoughts on this topic. Really.. thank you for starting this up. This website is something that is needed on the internet, someone with a little originality!
I am truly thankful to the owner of this web site who has shared this fantastic piece of writing at at this place.
Pretty! This has been a really wonderful post. Many thanks for providing these details.
You’re so awesome! I don’t believe I have read a single thing like that before. So great to find someone with some original thoughts on this topic. Really.. thank you for starting this up. This website is something that is needed on the internet, someone with a little originality!
https://cheapestandfast.shop/# no prescription online pharmacies
This is really interesting, You’re a very skilled blogger. I’ve joined your feed and look forward to seeking more of your magnificent post. Also, I’ve shared your site in my social networks!
Great information shared.. really enjoyed reading this post thank you author for sharing this post .. appreciated
canada drugs no prescription: cheapest and fast – can you buy prescription drugs in canada
https://cheapestandfast.com/# no prescription pharmacy
canadian online pharmacy no prescription [url=https://36and6health.shop/#]36 & 6 health[/url] buying prescription drugs from canada
https://cheapestcanada.shop/# canada drug pharmacy
https://cheapestcanada.shop/# safe canadian pharmacy
canadian pharmacy world coupon [url=https://36and6health.com/#]best online pharmacy no prescription[/url] online pharmacy non prescription drugs
Список бесплатных промокодов 1xBet. Получи максимальный бонус при регистрации на сайте и в приложении! +100% к первому депозиту для всех новых игроков. Указанный выше промо-код дает новым игрокам возможность получить повышенный на 30% bonus. Как получить и использовать бонус 32500 рублей по промо-коду букмекерской компании 1хБет? Рабочие промокоды 1xBet при регистрации на официальном сайте компании. 1хбет промокод при регистрации. Актуальный Промо-Коды 1 Икс Бет на 2024 год – это возможность сделать бесплатную ставку на сумму, которая указана в промокоде. Содержание: Где найти промокод 1xbet на сегодня бесплатно. Букмекерская контора 1 Икс Бет только новым людям дает бонус при пополнени. Чем полезный промокод на 1xbet. На какие виды спорта можно взять промокоды в 1 xbet. Как проверить промокод на 1хбет. Использовать его необходимо при регистрации на официальном сайте конторы 1xbet (а промокоды для купона при пари, находятся в самом низу статьи) – более подробно в этом материале https://ws-stroi.ru/image/pages/1xbet_promokod_pri_registracii_15.html
https://cheapestandfast.com/# pharmacy with no prescription
canada drugs: cheapestcanada.com – canadian pharmacy tampa
http://cheapestindia.com/# cheapest online pharmacy india
world pharmacy india india pharmacy mail order or online pharmacy india
https://www.google.com.ai/url?q=https://cheapestindia.com india pharmacy mail order
[url=https://cse.google.hu/url?sa=t&url=https://cheapestindia.com]reputable indian pharmacies[/url] online pharmacy india and [url=http://moujmasti.com/member.php?8510-joaqcqvgrr]indian pharmacies safe[/url] buy prescription drugs from india
https://cheapestandfast.com/# canada pharmacy no prescription
online drugs without prescription [url=http://cheapestandfast.com/#]cheapest and fast[/url] online medicine without prescription
http://cheapestindia.com/# Online medicine order
canadapharmacyonline com: cheapest canada – canadian pharmacy reviews
http://cheapestandfast.com/# buy prescription online
1xbet promo code free spins: 1XBOX777. Avail a complimentary free bets bonus up to $/€130. Register using the bonus code and claim your bonus 100%. You can utilize the received bonus funds in sports or casino. By utilizing the promotional code, you can relish in a multitude of advantages, including deposit bonuses that match your initial investment, complimentary wagers, cashback incentives, and much more. These enticing bonuses grant you extra chances to triumph and enhance the thrill of your betting experience.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://www.ganz-la.ch/content/pags/1xbet_promo_code___sign_up_bonus.html
pharmacy no prescription required: 36 and 6 pharmacy – rx pharmacy coupons
legitimate canadian pharmacies canadian valley pharmacy or canadian family pharmacy
https://maps.google.com.sg/url?sa=t&url=https://cheapestcanada.com canada pharmacy online
[url=http://www.grandhotelnizza.it/gallery/imagevue/phpinfo.php?a[]=tadalafil without a doctor’s prescription]trustworthy canadian pharmacy[/url] northern pharmacy canada and [url=https://forex-bitcoin.com/members/348485-kasxodqcmk]canadianpharmacymeds[/url] canadianpharmacyworld
https://cheapestandfast.com/# online pharmacy that does not require a prescription
no prescription needed pharmacy [url=https://36and6health.com/#]cheapest pharmacy[/url] no prescription needed canadian pharmacy
http://cheapestcanada.com/# canadian pharmacy cheap
canadianpharmacy com [url=http://cheapestcanada.com/#]cheapest canada[/url] best online canadian pharmacy
buying prescription drugs in mexico mexico pharmacies prescription drugs or mexico drug stores pharmacies
http://www.sandonatoripacandida.net/iframe.php?file=http://cheapestmexico.com/ best online pharmacies in mexico
[url=http://nunet.ca/link_r.php?fn=cheapestmexico.com&]mexico drug stores pharmacies[/url] purple pharmacy mexico price list and [url=http://80tt1.com/home.php?mod=space&uid=994332]mexican online pharmacies prescription drugs[/url] pharmacies in mexico that ship to usa
https://cheapestandfast.com/# online prescription canada
legitimate online pharmacy no prescription: cheapest and fast – best online pharmacy that does not require a prescription in india
http://36and6health.com/# rxpharmacycoupons
cheapest prescription pharmacy cheapest pharmacy for prescription drugs or online pharmacy without prescription
https://maps.google.gy/url?sa=t&url=https://36and6health.com cheapest pharmacy for prescriptions without insurance
[url=https://maps.google.td/url?q=https://36and6health.com]prescription drugs online[/url] prescription free canadian pharmacy and [url=http://80tt1.com/home.php?mod=space&uid=995187]cheapest prescription pharmacy[/url] cheapest pharmacy to get prescriptions filled
https://36and6health.com/# international pharmacy no prescription
cheapest online pharmacy india [url=http://cheapestindia.com/#]top online pharmacy india[/url] reputable indian pharmacies
https://cheapestandfast.com/# canadian pharmacy no prescription
pharmacy wholesalers canada: cross border pharmacy canada – buy prescription drugs from canada cheap
https://cheapestmexico.com/# buying from online mexican pharmacy
https://cheapestmexico.shop/# mexico pharmacy
buying from online mexican pharmacy [url=https://cheapestmexico.com/#]mexico drug stores pharmacies[/url] reputable mexican pharmacies online
1xbet best promo code: 1XBOX777 offers a VIP bonus of 100% up to $130 for sports betting and a casino package of €1,950 + 150 free spins. This bonus is valid until December 31, 2024. The promotion is valid for new customers only. The bonus promo code must be used during the registration process.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://blog.geohoney.com/js/pgs/promo_code_1xbet.html
https://cheapestindia.com/# india pharmacy mail order
canadian prescription drugstore reviews: canada prescription – buy prescription drugs online without doctor
https://cheapestindia.shop/# online pharmacy india
http://cheapestcanada.com/# canadian pharmacy victoza
cheapest pharmacy to fill prescriptions without insurance [url=http://36and6health.com/#]36 and 6 pharmacy[/url] canadian pharmacy coupon
https://cheapestmexico.com/# best online pharmacies in mexico
cheapest pharmacy to get prescriptions filled canadian pharmacy coupon or prescription drugs from canada
https://toolbarqueries.google.com.mx/url?q=http://36and6health.com canadian pharmacy no prescription needed
[url=http://36and6health.com.isdownorblocked.com/]drugstore com online pharmacy prescription drugs[/url] pharmacy discount coupons and [url=http://bbs.xinhaolian.com/home.php?mod=space&uid=3901018]cheapest pharmacy for prescriptions[/url] canadian pharmacy without prescription
pharmacy online 365 discount code: 36 and 6 health online pharmacy – cheapest pharmacy to fill prescriptions without insurance
mexican mail order pharmacies: buying prescription drugs in mexico – buying prescription drugs in mexico online
https://36and6health.shop/# us pharmacy no prescription
https://cheapestmexico.shop/# medication from mexico pharmacy
buy pills without prescription [url=https://cheapestandfast.com/#]cheapest and fast[/url] canadian pharmacy without prescription
Gerakl24: Профессиональная Смена Фундамента, Венцов, Настилов и Передвижение Строений
Фирма Геракл24 специализируется на выполнении комплексных сервисов по смене основания, венцов, полов и переносу домов в городе Красноярском регионе и в окрестностях. Наша команда опытных экспертов гарантирует высокое качество выполнения различных типов ремонтных работ, будь то деревянные, каркасного типа, кирпичные постройки или из бетона здания.
Достоинства работы с Gerakl24
Навыки и знания:
Все работы проводятся исключительно опытными мастерами, с многолетним многолетний стаж в области строительства и ремонта зданий. Наши мастера профессионалы в своем деле и выполняют задачи с максимальной точностью и вниманием к мелочам.
Всесторонний подход:
Мы предоставляем полный спектр услуг по ремонту и восстановлению зданий:
Реставрация фундамента: замена и укрепление фундамента, что гарантирует долговечность вашего дома и устранить проблемы, связанные с оседанием и деформацией.
Замена венцов: восстановление нижних венцов деревянных зданий, которые чаще всего гниют и разрушаются.
Замена полов: установка новых полов, что кардинально улучшает визуальное восприятие и функциональные характеристики.
Перенос строений: безопасное и качественное передвижение домов на новые локации, что обеспечивает сохранение строения и избежать дополнительных затрат на возведение нового.
Работа с различными типами строений:
Древесные строения: реставрация и усиление деревянных элементов, обработка от гниения и насекомых.
Каркасные дома: укрепление каркасов и замена поврежденных элементов.
Кирпичные строения: восстановление кирпичной кладки и укрепление конструкций.
Бетонные дома: восстановление и укрепление бетонных структур, ремонт трещин и дефектов.
Качество и прочность:
Мы применяем только высококачественные материалы и передовые технологии, что гарантирует долговечность и прочность всех выполненных задач. Все наши проекты подвергаются строгому контролю качества на всех этапах выполнения.
Персонализированный подход:
Каждому клиенту мы предлагаем персонализированные решения, с учетом всех особенностей и пожеланий. Мы стремимся к тому, чтобы конечный результат полностью соответствовал вашим ожиданиям и требованиям.
Почему стоит выбрать Геракл24?
Работая с нами, вы найдете надежного партнера, который берет на себя все заботы по ремонту и реконструкции вашего строения. Мы обеспечиваем выполнение всех работ в сроки, оговоренные заранее и с в соответствии с нормами и стандартами. Выбрав Геракл24, вы можете быть уверены, что ваше здание в надежных руках.
Мы готовы предоставить консультацию и ответить на ваши вопросы. Свяжитесь с нами, чтобы обсудить детали и узнать о наших сервисах. Мы поможем вам сохранить и улучшить ваш дом, сделав его уютным и безопасным для долгого проживания.
Геракл24 – ваш партнер по реставрации и ремонту домов в Красноярске и окрестностях.
https://cheapestcanada.com/# canadian pharmacy ltd
pharmacy no prescription required [url=https://cheapestandfast.shop/#]quality prescription drugs canada[/url] buying prescription medicine online
the dark internet [url=https://mydarknetmarketlinks.com/ ]darknet drug store [/url] darknet markets 2024
canadian pharmacy no prescription needed: 36 and 6 health online pharmacy – cheap pharmacy no prescription
http://cheapestcanada.com/# canadian neighbor pharmacy
http://cheapestandfast.com/# non prescription online pharmacy
online pharmacy india [url=https://cheapestindia.com/#]indian pharmacy[/url] world pharmacy india
1xbet promo code free bet: 1XBOX777 offers a VIP bonus of 100% up to $130 for sports betting and a casino package of €1,950 + 150 free spins. This bonus is valid until December 31, 2024. The promotion is valid for new customers only. The bonus promo code must be used during the registration process.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://www.compassboxwhisky.com/icon/pags/1xbet_promo_code_2020.html
black internet [url=https://mydarknetmarketlinks.com/ ]best darknet markets [/url] dark web links
internet apotheke: online apotheke günstig – günstigste online apotheke
http://eufarmaciaonline.com/# farmacia online barata
acheter mГ©dicament en ligne sans ordonnance [url=https://eumedicamentenligne.com/#]vente de mГ©dicament en ligne[/url] Pharmacie en ligne livraison Europe
pharmacies en ligne certifiГ©es: pharmacie en ligne livraison europe – Pharmacie Internationale en ligne
Pharmacie sans ordonnance: pharmacies en ligne certifi̩es Рpharmacie en ligne avec ordonnance
п»їshop apotheke gutschein: internet apotheke – gГјnstigste online apotheke
pharmacie en ligne fiable: pharmacie en ligne sans ordonnance – Achat mГ©dicament en ligne fiable
1xBet Bonus Package for Indian Casino Customers
Experience the ultimate excitement of online casino gaming with the exclusive Casino Welcome Offer at 1xBet India 2024. Get ready for an immersive and thrilling journey filled with a wide variety of live dealer games and a vast selection of captivating slots. Unlock this amazing offer by using the 1xBet promo code and take your casino adventure to new heights.
1xBet casino promo code: 1XBOX777, bonus 100% up to $1950 and 150 free spins at the casino. Gain access to an exceptional casino welcome package worth ?130,000. This bonus can be claimed across four separate deposits, allowing you to maximize your rewards and extend your gaming sessions. Prepare to be enthralled by the exhilarating gameplay, stunning graphics, and immersive sound effects that will transport you to the heart of the casino action.
Whether you’re a fan of classic table games or prefer the excitement of spinning the reels on slots, 1xBet has you covered. Explore an extensive collection of live dealer games, where you can interact with professional dealers in real-time for an authentic casino experience. Additionally, the slots section boasts a diverse range of games, ensuring there’s something to suit every preference and style.
Attention all casino enthusiasts! You definitely don’t want to miss out on this incredible opportunity to elevate your casino journey. By using the exclusive free promo codes for 1xbet: 1XBOX777, you can unlock a remarkable ?169,000 welcome package along with 150 free spins for the year 2024. Immerse yourself in the excitement of the casino, make the most of the bonuses, and embark on a gaming adventure like no other at 1xBet India.
For our valued Indian customers who have a keen interest in the casino section, 1xBet presents an enticing alternative welcome package. This package is designed to enhance your gaming experience across your first four deposits, allowing you to receive a whopping ?169,000 in addition to 150 free spins.
Here’s how the bonus package is divided:
1st deposit: 100% matched bonus + 30 free spins on Reliquary of Ra
2nd deposit: 50% matched bonus + 35 free spins on Chieftain Buffalo
3rd deposit: 25% matched bonus + 40 free spins on Stampede Buffalo
4th deposit: 25% matched bonus + 45 free spins on Rich of the Mermaid Hold and Spin
Embrace the Excitement at 1xBet
With these enticing promo codes and bonus offers, 1xBet ensures that new customers can kickstart their betting journey with a thrilling advantage. Whether you prefer sports betting or exploring the casino games, 1xBet has something for everyone. Don’t miss out on the opportunity to elevate your gaming experience—join 1xBet today and unlock a world of excitement.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — http://hyik.fi/uudet/inc/1xbet_ghana_promo_code_on_100__first_deposit.html
I am so happy to read this. This is the type of manual that needs to be given and not the random misinformation that’s at the other blogs. Appreciate your sharing this greatest doc.
trouver un mГ©dicament en pharmacie [url=http://eumedicamentenligne.com/#]pharmacie en ligne fiable[/url] pharmacie en ligne avec ordonnance
online apotheke online apotheke or gГјnstigste online apotheke
https://www.google.ps/url?sa=t&url=https://euapothekeohnerezept.com online apotheke deutschland
[url=http://clients1.google.cat/url?sa=i&url=https://euapothekeohnerezept.com]eu apotheke ohne rezept[/url] internet apotheke and [url=http://talk.dofun.cc/home.php?mod=space&uid=951786]internet apotheke[/url] europa apotheke
Промокод при регистрации 1xbet на 32500 рублей. Данный промокод 1хбет нужно ввести при регистрации в соответствующее поле. 1Xbet промокод при регистрации можно использовать только 1н раз в рамках одной учетной записи, но вы можете делиться им со своими друзьями. В 1xБет регистрация по номеру телефона является бесплатным и вторым по простоте способом создать личный аккаунт. Данный способ предусматривает наличие мобильного устройства, а также активной сим-карты, чтобы пользователь мог получить сообщение, в котором его будут ждать данные для входа. После того, как данные будут получены, останется ввести логин с паролем в соответствующие поля. Воспользуйся рабочий промокод 1xbet на сегодня, получи бесплатную возможность увеличить свой первый депозит до 32500 рублей в БК 1xBet. Промокоды 1xBET актуальные сегодня. На игровой платформе БК «1xbet» функционирует бонусная программа, способствующая привлечению новых игроков и мотивации делать больше ставок для зарегистрированных пользователей. Бонусная программа содержит множество различных бонусов, которые каппер может активировать при помощи специальных промокодов. 130% бонус от первого депозита на ставки. Получай бонус до 130%, но не превышающий 32500 рублей на ставки от 1xbet. Переходим на сайт букмекера – более подробно в этом материале http://ruptur.com/libs/photo/promokod_259.html
טלגראס כיוונים
הפלטפורמה הינה אפליקציה מקובלת בישראל לקנייה של צמח הקנאביס בצורה וירטואלי. זו מספקת ממשק נוח ובטוח לרכישה ולקבלת שילוחים של פריטי צמח הקנאביס מגוונים. בסקירה זו נבחן עם העיקרון מאחורי טלגראס, כיצד זו עובדת ומהם היתרים מ השימוש בזו.
מהי האפליקציה?
האפליקציה היא דרך לקנייה של מריחואנה דרך היישומון טלגראם. זו נשענת מעל ערוצים וקהילות טלגרם ספציפיות הקרויות ״כיווני טלגראס״, שבהם ניתן להרכיב מרחב פריטי מריחואנה ולקבלת אלו ישירות לשילוח. ערוצי התקשורת האלה מסודרים על פי אזורים גיאוגרפיים, במטרה לשפר את קבלתם של השילוחים.
כיצד זה עובד?
התהליך קל למדי. ראשית, יש להצטרף לערוץ הטלגראס הרלוונטי לאזור המגורים. שם אפשר לצפות בתפריטי המוצרים המגוונים ולהזמין עם המוצרים הרצויים. לאחר ביצוע ההרכבה וסיום התשלום, השליח יופיע לכתובת שנרשמה ועמו הארגז המוזמנת.
רוב ערוצי הטלגראס מציעים טווח רחב מ מוצרים – זנים של מריחואנה, עוגיות, שתייה ועוד. בנוסף, אפשר לראות ביקורות של לקוחות קודמים על רמת הפריטים והשירות.
יתרונות השימוש בפלטפורמה
יתרון עיקרי של טלגראס הינו הנוחות והפרטיות. ההזמנה וההכנות מתבצעות ממרחק מכל מיקום, בלי צורך במפגש פיזי. בנוסף, הפלטפורמה מאובטחת היטב ומבטיחה חיסיון גבוה.
מלבד אל זאת, עלויות המוצרים בפלטפורמה נוטות לבוא זולים, והמשלוחים מגיעים במהירות ובמסירות רבה. יש אף מוקד תמיכה זמין לכל שאלה או בעיה.
לסיכום
האפליקציה מהווה שיטה חדשנית ויעילה לרכוש פריטי מריחואנה בארץ. זו משלבת את הנוחיות הטכנולוגית מ האפליקציה הפופולרית, לבין הזריזות והדיסקרטיות של שיטת השילוח הישירות. ככל שהביקוש לצמח הקנאביס גובר, אפליקציות בדוגמת זו צפויות להמשיך ולהתפתח.
pharmacie en ligne france fiable: pharmacie en ligne pas cher – Pharmacie Internationale en ligne
farmacia barata: farmacias online seguras – farmacia online envÃo gratis
b29
Bản cài đặt B29 IOS – Giải pháp vượt trội cho các tín đồ iOS
Trong thế giới công nghệ đầy sôi động hiện nay, trải nghiệm người dùng luôn là yếu tố then chốt. Với sự ra đời của Bản cài đặt B29 IOS, người dùng sẽ được hưởng trọn vẹn những tính năng ưu việt, mang đến sự hài lòng tuyệt đối. Hãy cùng khám phá những ưu điểm vượt trội của bản cài đặt này!
Tính bảo mật tối đa
Bản cài đặt B29 IOS được thiết kế với mục tiêu đảm bảo an toàn dữ liệu tuyệt đối cho người dùng. Nhờ hệ thống mã hóa hiện đại, thông tin cá nhân và dữ liệu nhạy cảm của bạn luôn được bảo vệ an toàn khỏi những kẻ xâm nhập trái phép.
Trải nghiệm người dùng đỉnh cao
Giao diện thân thiện, đơn giản nhưng không kém phần hiện đại, B29 IOS mang đến cho người dùng trải nghiệm duyệt web, truy cập ứng dụng và sử dụng thiết bị một cách trôi chảy, mượt mà. Các tính năng thông minh được tối ưu hóa, giúp nâng cao hiệu suất và tiết kiệm pin đáng kể.
Tính tương thích rộng rãi
Bản cài đặt B29 IOS được phát triển với mục tiêu tương thích với mọi thiết bị iOS từ các dòng iPhone, iPad cho đến iPod Touch. Dù là người dùng mới hay lâu năm của hệ điều hành iOS, B29 đều mang đến sự hài lòng tuyệt đối.
Quá trình cài đặt đơn giản
Với những hướng dẫn chi tiết, việc cài đặt B29 IOS trở nên nhanh chóng và dễ dàng. Chỉ với vài thao tác đơn giản, bạn đã có thể trải nghiệm ngay tất cả những tính năng tuyệt vời mà bản cài đặt này mang lại.
Bản cài đặt B29 IOS không chỉ là một bản cài đặt đơn thuần, mà còn là giải pháp công nghệ hiện đại, nâng tầm trải nghiệm người dùng lên một tầm cao mới. Hãy trở thành một phần của cộng đồng sử dụng B29 IOS để khám phá những tiện ích tuyệt vời mà nó có thể mang lại!
http://euapothekeohnerezept.com/# online apotheke gГјnstig
trouver un mГ©dicament en pharmacie [url=https://eumedicamentenligne.com/#]Achat mГ©dicament en ligne fiable[/url] pharmacie en ligne france pas cher
farmacia online envГo gratis farmacias online seguras or farmacia online barata
https://www.google.ps/url?q=https://eufarmaciaonline.com п»їfarmacia online espaГ±a
[url=http://www.kinderverhaltenstherapie.eu/url?q=https://eufarmaciaonline.com]п»їfarmacia online espaГ±a[/url] farmacia online 24 horas and [url=http://ckxken.synology.me/discuz/home.php?mod=space&uid=34087]farmacias online seguras en espaГ±a[/url] farmacias online seguras
проверка usdt trc20
Как защитить свои личные данные: берегитесь утечек информации в интернете. Сегодня охрана своих данных становится всё больше важной задачей. Одним из наиболее популярных способов утечки личной информации является слив «сит фраз» в интернете. Что такое сит фразы и как сберечься от их утечки? Что такое «сит фразы»? «Сит фразы» — это комбинации слов или фраз, которые часто используются для доступа к различным онлайн-аккаунтам. Эти фразы могут включать в себя имя пользователя, пароль или разные конфиденциальные данные. Киберпреступники могут пытаться получить доступ к вашим аккаунтам, при помощи этих сит фраз. Как охранить свои личные данные? Используйте сложные пароли. Избегайте использования очевидных паролей, которые мгновенно угадать. Лучше всего использовать комбинацию букв, цифр и символов. Используйте уникальные пароли для всего аккаунта. Не пользуйтесь один и тот же пароль для разных сервисов. Используйте двухфакторную проверку (2FA). Это вводит дополнительный уровень безопасности, требуя подтверждение входа на ваш аккаунт по другое устройство или метод. Будьте осторожны с онлайн-сервисами. Не доверяйте свою информацию ненадежным сайтам и сервисам. Обновляйте программное обеспечение. Установите обновления для вашего операционной системы и программ, чтобы уберечь свои данные от вредоносного ПО. Вывод Слив сит фраз в интернете может привести к серьезным последствиям, таким как кража личной информации и финансовых потерь. Чтобы сохранить себя, следует принимать меры предосторожности и использовать надежные методы для хранения и управления своими личными данными в сети
pharmacie en ligne france fiable: pharmacie en ligne france pas cher Рtrouver un m̩dicament en pharmacie
online apotheke preisvergleich: beste online-apotheke ohne rezept – medikamente rezeptfrei
comprare farmaci online all’estero comprare farmaci online all’estero or Farmacie on line spedizione gratuita
https://toolbarqueries.google.com.qa/url?q=https://eufarmacieonline.com comprare farmaci online con ricetta
[url=https://maps.google.com.do/url?q=https://eufarmacieonline.com]comprare farmaci online con ricetta[/url] top farmacia online and [url=http://bbs.zhizhuyx.com/home.php?mod=space&uid=10370169]Farmacie on line spedizione gratuita[/url] farmacie online affidabili
п»їFarmacia online migliore [url=https://eufarmacieonline.shop/#]Farmacie on line spedizione gratuita[/url] farmacia online senza ricetta
Achat mГ©dicament en ligne fiable acheter mГ©dicament en ligne sans ordonnance or pharmacie en ligne sans ordonnance
https://maps.google.com.pg/url?sa=t&url=https://eumedicamentenligne.com pharmacie en ligne france pas cher
[url=http://sat-plus.net/ext_link?url=https://eumedicamentenligne.com]Achat mГ©dicament en ligne fiable[/url] pharmacie en ligne fiable and [url=http://xn--0lq70ey8yz1b.com/home.php?mod=space&uid=41685]pharmacie en ligne france pas cher[/url] pharmacie en ligne pas cher
Telegrass
טלגראס הווה תוכנה נפוצה בישראל לרכישת מריחואנה בצורה מקוון. זו מספקת ממשק נוח ומאובטח לרכישה וקבלת שילוחים מ מוצרי צמח הקנאביס מגוונים. במאמר זו נבחן את הרעיון שמאחורי טלגראס, איך זו עובדת ומהם המעלות של השימוש בזו.
מה זו האפליקציה?
האפליקציה הווה דרך לקנייה של קנאביס באמצעות האפליקציה טלגרם. היא מבוססת על ערוצי תקשורת וקהילות טלגרם ספציפיות הנקראות ״טלגראס כיוונים, שם ניתן להרכיב מרחב מוצרי קנאביס ולקבלת אלו ישירותית לשילוח. ערוצי התקשורת אלו מסודרים לפי אזורים גיאוגרפיים, כדי להקל על קבלת המשלוחים.
איך זאת עובד?
התהליך פשוט יחסית. ראשית, יש להצטרף לערוץ הטלגראס הנוגע לאזור המגורים. שם ניתן לעיין בתפריטי הפריטים המגוונים ולהזמין את הפריטים המבוקשים. לאחר ביצוע ההרכבה וסיום התשלום, השליח יופיע בכתובת שנרשמה ועמו החבילה שהוזמן.
רוב ערוצי טלגראס מציעים מגוון רחב של מוצרים – זנים של מריחואנה, ממתקים, שתייה ועוד. כמו כן, אפשר למצוא ביקורות של לקוחות שעברו על איכות הפריטים והשירות.
מעלות השימוש באפליקציה
יתרון מרכזי של האפליקציה הינו הנוחות והדיסקרטיות. ההרכבה והתהליך מתבצעות מרחוק מאיזשהו מיקום, בלי צורך בהתכנסות פנים אל פנים. כמו כן, האפליקציה מוגנת היטב ומבטיחה חיסיון גבוה.
מלבד אל כך, עלויות הפריטים בטלגראס נוטות להיות תחרותיים, והמשלוחים מגיעים במהירות ובהשקעה רבה. קיים גם מרכז תמיכה זמין לכל שאלה או בעיה.
סיכום
הפלטפורמה הינה דרך חדשנית ויעילה לרכוש פריטי מריחואנה במדינה. היא משלבת את הנוחיות הדיגיטלית של היישומון הפופולרית, לבין המהירות והפרטיות מ דרך השילוח הישירות. ככל שהביקוש לקנאביס גדלה, אפליקציות בדוגמת זו צפויות להמשיך ולצמוח.
europa apotheke: beste online-apotheke ohne rezept – beste online-apotheke ohne rezept
farmacias online baratas: farmacia online barata y fiable – farmacia online envГo gratis
Как обезопасить свои данные: страхуйтесь от утечек информации в интернете. Сегодня обеспечение безопасности своих данных становится более насущной важной задачей. Одним из наиболее распространенных способов утечки личной информации является слив «сит фраз» в интернете. Что такое сит фразы и как защититься от их утечки? Что такое «сит фразы»? «Сит фразы» — это смеси слов или фраз, которые часто используются для получения доступа к различным онлайн-аккаунтам. Эти фразы могут включать в себя имя пользователя, пароль или другие конфиденциальные данные. Киберпреступники могут пытаться получить доступ к вашим аккаунтам, при помощи этих сит фраз. Как защитить свои личные данные? Используйте непростые пароли. Избегайте использования легких паролей, которые просто угадать. Лучше всего использовать комбинацию букв, цифр и символов. Используйте уникальные пароли для всего аккаунта. Не применяйте один и тот же пароль для разных сервисов. Используйте двухступенчатую аутентификацию (2FA). Это добавляет дополнительный уровень безопасности, требуя подтверждение входа на ваш аккаунт посредством другое устройство или метод. Будьте осторожны с онлайн-сервисами. Не доверяйте личную информацию ненадежным сайтам и сервисам. Обновляйте программное обеспечение. Установите обновления для вашего операционной системы и программ, чтобы предохранить свои данные от вредоносного ПО. Вывод Слив сит фраз в интернете может повлечь за собой серьезным последствиям, таким как кража личной информации и финансовых потерь. Чтобы обезопасить себя, следует принимать меры предосторожности и использовать надежные методы для хранения и управления своими личными данными в сети
farmacias online seguras: farmacias online baratas – farmacia online barata y fiable
1xbet free bet promo code: 1XBOX777. By using the 1xBet bonus code 2024, you can take advantage of a 100% bonus of up to €/$130. This bonus can be claimed when you register at the sportsbook. Make sure to enter this exclusive code when creating a new account on 1xBet to receive the most VIP welcome bonus available. The bonus funds you receive can be used in various sections of 1xBet, including Sports, Live Cricket, Live Casino, 1XGames, ESports, TV Games, and Bingo.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://compgamer.com/activities/pages/?1xbet_promo_code_419.html
Проверить кошелёк usdt trc20
В мире криптовалют присутствует действительная угроза получения так именуемых “нелегальных” средств – токенов, связанных с незаконной деятельностью, такого рода вроде отмывание средств, жульничество либо кибератаки. Владельцы кошельков USDT на распределенном реестре TRON (TRC20) тоже склонны этому риску. По этой причине очень важно систематически удостоверяться свой кошелек для криптовалют на присутствие “нелегальных” переводов для оберегания своих средств а также репутации.
Угроза “грязных” транзакций заключается во том, чтобы оные смогут быть прослеживаемы силовыми органами и валютными регуляторами. В случае если станет установлена соотношение с незаконной деятельностью, твой кошелек для криптовалют сможет быть заблокирован, и активы – изъяты. Кроме того, это имеет возможность повлечь к юридические результаты а также повредить твою репутацию.
Существуют специальные инструменты, дающие возможность проверить историю переводов в рамках твоём кошельке USDT TRC20 в отношении наличие сомнительных операций. Эти инструменты анализируют сведения транзакций, сравнивая оные с известными случаями жульничества, кибер-атак, и отбеливания денег.
Примером из числа таких служб служит https://telegra.ph/Servisy-AML-proverka-USDT-05-19 дающий возможность отслеживать полную архив транзакций твоего USDT TRC20 кошелька для криптовалют. Служба обнаруживает возможно угрожающие переводы а также представляет подробные данные об оных.
Не пренебрегайте контролем своего кошелька для криптовалют USDT TRC20 на присутствие “грязных” переводов. Своевременное мониторинг поможет устранить угроз, относящихся со противозаконной деятельностью на цифровой сфере. Задействуйте надежные сервисы для проверки собственных USDT переводов, дабы обеспечить защиту ваши криптоактивы и репутацию.
Оградите собственные USDT: Проверьте транзакцию TRC20 перед пересылкой
Виртуальные деньги, такие вроде USDT (Tether) в блокчейне TRON (TRC20), становятся все более востребованными в области децентрализованных финансовых услуг. Однако совместно с ростом распространенности растет и риск ошибок или обмана во время транзакции денег. Именно поэтому важно контролировать транзакцию USDT TRC20 до её пересылкой.
Ошибка при вводе данных адреса получателя получателя или перевод на ошибочный адрес сможет привести к безвозвратной утрате ваших USDT. Злоумышленники также смогут стараться одурачить вас, отправляя фальшивые адреса для отправки. Потеря цифровой валюты из-за подобных ошибок может повлечь крупными финансовыми убытками.
К радости, существуют специализированные сервисы, позволяющие проверить перевод USDT TRC20 перед ее отправкой. Один из числа подобных служб дает опцию отслеживать и изучать переводы в блокчейне TRON.
В данном сервисе вам можете ввести адрес получателя адресата и получить детальную данные об нем, включая историю транзакций, баланс а также статус счета. Это поможет установить, является ли адрес подлинным а также надежным на отправки финансов.
Другие службы также предоставляют сходные возможности для удостоверения операций USDT TRC20. Определенные кошельки для криптовалют по цифровых валют имеют инкорпорированные возможности для верификации адресов а также переводов.
Не пропускайте проверкой перевода USDT TRC20 до ее отправкой. Крохотная осмотрительность может сэкономить вам много финансов и не допустить утрату твоих важных криптовалютных ресурсов. Используйте заслуживающие доверия службы с целью обеспечения защищенности твоих переводов а также целостности ваших USDT на распределенном реестре TRON.
farmacia online espaГ±a envГo internacional [url=https://eufarmaciaonline.shop/#]farmacia barata[/url] farmacia online espaГ±a envГo internacional
В процессе взаимодействии с цифровой валютой USDT на распределенном реестре TRON (TRC20) чрезвычайно существенно не только верифицировать реквизиты получателя до отправкой денег, а также тоже регулярно контролировать остаток своего кошелька, плюс источники входящих переводов. Это даст возможность вовремя идентифицировать всевозможные нежданные транзакции и предотвратить возможные потери.
Сначала, нужно проверить на точности отображаемого баланса USDT TRC20 на собственном криптокошельке. Советуется сравнивать данные с данными открытых обозревателей блокчейна, для того чтобы не допустить возможность хакерской атаки или скомпрометирования этого крипто-кошелька.
Тем не менее лишь мониторинга баланса не хватает. Чрезвычайно существенно изучать историю входящих переводов а также их источники. Если Вы найдете транзакции USDT от неизвестных или подозрительных адресов, немедленно остановите эти средства. Существует угроза, что данные монеты были получены.
Наше сервис предоставляет средства с целью углубленного анализа входящих USDT TRC20 переводов касательно этой законности а также неимения связи с криминальной деятельностью. Мы поможем вам безопасно работать с этим популярным стейблкоином.
Плюс к этому нужно систематически выводить USDT TRC20 в проверенные неконтролируемые крипто-кошельки под вашим тотальным присмотром. Хранение монет на сторонних площадках всегда связано с угрозами взломов и потери средств вследствие технических ошибок или несостоятельности сервиса.
Следуйте элементарные меры безопасности, будьте бдительны а также своевременно контролируйте остаток а также происхождение поступлений кошелька для USDT TRC20. Данные действия позволит защитить Ваши цифровые активы от незаконного присвоения и возможных правовых последствий впоследствии.
gГјnstige online apotheke: internet apotheke – online apotheke rezept
Farmacia online migliore: farmacie online sicure – Farmacie on line spedizione gratuita
http://eufarmacieonline.com/# acquistare farmaci senza ricetta
farmacia online barata y fiable: farmacia barata – п»їfarmacia online espaГ±a
АКТУАЛЬНЫЙ ПРОМОКОД 1x_1791223 НА 2024г
Промокод 1хбет – это неотъемлемая часть современной жизни. Мы все стремимся сэкономить деньги и получить наибольшую выгоду от своих покупок. Исходя из этого, я хотел бы предложить вам уникальный промокод от компании 1xbet, который поможет вам насладиться азартом и выйти в плюс.
1xbet – это ведущая мировая букмекерская контора, предлагающая широкий спектр спортивных ставок и увлекательный игровой опыт. С недавних пор, компания также предлагает возможность играть в виртуальные онлайн-казино, что делает её еще более привлекательной для азартных игроков.
Итак, промокод от компании 1xbet дает вам возможность получить бонус при регистрации на сайте. Просто введите этот уникальный код при создании своего аккаунта, и вам будет начислен бонусный баланс, который вы можете использовать для различных видов ставок и игр.Промокод 1XBET На что вы можете потратить свой бонусный баланс? Возможностей здесь предостаточно. Вы можете делать ставки на спортивные события – футбол, теннис, хоккей, баскетбол и многое другое. Независимо от того, являетесь ли вы фанатом больших лиг или предпочитаете теннисные матчи мирового уровня, 1xbet предлагает обширный выбор категорий и событий, на которые можно сделать ставку.
Если вы больше склонны к игровым автоматам и карточным играм, то также найдете множество вариантов на сайте 1xbet. Яркие слоты, популярные игры, лотереи и многое другое – все это доступно вам с помощью бонусного баланса, который вы получите с промокодом.
Что еще привлекательно в использовании промокода? Это великолепная возможность испытать свою удачу, не тратя при этом деньги из своего собственного кошелька. Бонусный баланс предоставляет вам льготу играть на деньги конторы без риска потери личных средств. Это прекрасный способ познакомиться с азартным миром и понять, на какие игры и виды ставок вы хотите делать наибольший акцент.
Помимо этого, компания 1xbet предлагает регулярные акции и бонусы для своих постоянных игроков, что делает её еще более привлекательной для всех поклонников азартных игр.
Не упустите возможность получить уникальный промокод от 1xbet и начать свой путь в мир азартных игр с удвоенными шансами на успех! Зарегистрируйтесь прямо сейчас, используя промокод, и откройте для себя увлекательный и захватывающий мир ставок и игр на сайте 1xbet. Вам понравится!
Источник: https://mmocenter.ru/blog/promokod-1xbet/
ohne rezept apotheke [url=http://euapothekeohnerezept.com/#]internet apotheke[/url] gГјnstigste online apotheke
pharmacies en ligne certifiГ©es pharmacie en ligne france livraison internationale or pharmacie en ligne france livraison belgique
http://worldconnx.net/phpinfo.php?a%5B%5D=cialis+generika trouver un mГ©dicament en pharmacie
[url=http://anonim.co.ro/?http://eumedicamentenligne.com]Pharmacie en ligne livraison Europe[/url] vente de mГ©dicament en ligne and [url=http://bbs.cheaa.com/home.php?mod=space&uid=3131137]pharmacie en ligne france fiable[/url] pharmacie en ligne france pas cher
Farmacia online più conveniente: acquistare farmaci senza ricetta – Farmacie on line spedizione gratuita
Bản cài đặt B29 IOS – Giải pháp vượt trội cho các tín đồ iOS
Trong thế giới công nghệ đầy sôi động hiện nay, trải nghiệm người dùng luôn là yếu tố then chốt. Với sự ra đời của Bản cài đặt B29 IOS, người dùng sẽ được hưởng trọn vẹn những tính năng ưu việt, mang đến sự hài lòng tuyệt đối. Hãy cùng khám phá những ưu điểm vượt trội của bản cài đặt này!
Tính bảo mật tối đa
Bản cài đặt B29 IOS được thiết kế với mục tiêu đảm bảo an toàn dữ liệu tuyệt đối cho người dùng. Nhờ hệ thống mã hóa hiện đại, thông tin cá nhân và dữ liệu nhạy cảm của bạn luôn được bảo vệ an toàn khỏi những kẻ xâm nhập trái phép.
Trải nghiệm người dùng đỉnh cao
Giao diện thân thiện, đơn giản nhưng không kém phần hiện đại, B29 IOS mang đến cho người dùng trải nghiệm duyệt web, truy cập ứng dụng và sử dụng thiết bị một cách trôi chảy, mượt mà. Các tính năng thông minh được tối ưu hóa, giúp nâng cao hiệu suất và tiết kiệm pin đáng kể.
Tính tương thích rộng rãi
Bản cài đặt B29 IOS được phát triển với mục tiêu tương thích với mọi thiết bị iOS từ các dòng iPhone, iPad cho đến iPod Touch. Dù là người dùng mới hay lâu năm của hệ điều hành iOS, B29 đều mang đến sự hài lòng tuyệt đối.
Quá trình cài đặt đơn giản
Với những hướng dẫn chi tiết, việc cài đặt B29 IOS trở nên nhanh chóng và dễ dàng. Chỉ với vài thao tác đơn giản, bạn đã có thể trải nghiệm ngay tất cả những tính năng tuyệt vời mà bản cài đặt này mang lại.
Bản cài đặt B29 IOS không chỉ là một bản cài đặt đơn thuần, mà còn là giải pháp công nghệ hiện đại, nâng tầm trải nghiệm người dùng lên một tầm cao mới. Hãy trở thành một phần của cộng đồng sử dụng B29 IOS để khám phá những tiện ích tuyệt vời mà nó có thể mang lại!
gГјnstige online apotheke: п»їshop apotheke gutschein – online apotheke deutschland
Проверить перевод usdt trc20
Важность анализа трансфера USDT TRC20
Переводы USDT через технологии TRC20 демонстрируют растущую спрос, тем не менее необходимо являться крайне бдительными в процессе их зачислении.
Такой форма переводов нередко применяется с целью очищения активов, добытых криминальным способом.
Один из угроз зачисления USDT TRC20 – это данные средства вероятно будут получены вследствие разнообразных моделей вымогательства, включая кражи персональных сведений, шантаж, кибератаки а также прочие противоправные манипуляции. Принимая подобные платежи, пользователь неизбежно становитесь пособником преступной деятельности.
Поэтому особенно необходимо детально анализировать происхождение любых приходящего транзакции с использованием USDT в сети TRC20. Важно требовать с отправителя сведения относительно чистоте активов, при малейших сомнениях – воздерживаться от транзакций.
Учитывайте, в случае, когда при выявления противоправных природы денежных средств, клиент скорее всего будете подвергнуты мерам со наказанию вместе одновременно с плательщиком. Таким образом целесообразнее принять меры предосторожности как и детально изучать всевозможный перевод, чем рисковать своей репутацией и быть втянутым под значительные судебные неприятности.
Соблюдение бдительности во время сделках с USDT TRC-20 – выступает основа вашей материальной сохранности и избежание от нелегальные практики. Проявляйте осторожны наряду с всегда проверяйте происхождение электронных валютных денежных средств.
farmacia online barcelona: farmacia online madrid – farmacias direct
farmacia online madrid [url=http://eufarmaciaonline.com/#]farmacias online seguras en espaГ±a[/url] п»їfarmacia online espaГ±a
farmacia online madrid: farmacia online madrid – farmacia online envÃo gratis
farmacia en casa online descuento: farmacias online seguras en espaГ±a – farmacia online barata y fiable
Plinko 1WIN Игра Plinko на платформе 1Win – увлекательное развлечение, которое притягивает внимание множества игроков со всех уголков мира. Plinko – классическая аркадная игра, в которой игроки пускают шарик сверху на специально размеченное поле, состоящее из рядов крючков и препятствий. Шарик, скатываясь вниз, прыгает от крючка к крючку и попадает в различные ячейки на дне поля, каждая из которых имеет свою выигрышную стоимость.
Однако Plinko на 1Win – это не только развлекательная аркада, но и способ получить реальный выигрыш. В игровом поле присутствуют различные выигрышные ячейки с разными коэффициентами, что позволяет игроку получать крупные деньги при успешном попадании.
Aviator 1WIN Aviator is an exhilarating and immersive game that takes players on a thrilling aerial adventure. Set in a visually stunning world, the game combines the thrill of flying with strategic gameplay elements, making it a captivating experience for both casual gamers and hardcore enthusiasts alike.
One of the key aspects that sets Aviator apart from other games in its genre is its realistic and dynamic flight mechanics. The game utilizes advanced physics to simulate the real-world dynamics of flying, allowing players to feel the wind in their hair and the adrenaline coursing through their veins as they soar through the sky. Whether it’s performing daring stunts or engaging in intense dogfights, the flight experience in Aviator is unparalleled.
In Aviator, players have the opportunity to take on various missions and challenges, each with its own unique objectives and rewards. From delivering important cargo to engaging in aerial combat, each mission provides a different set of challenges that require strategic thinking and precision flying skills. The game also offers a wide range of customizable aircraft, allowing players to personalize their flying experience and optimize their performance in the skies.
Lucky Jet 1WIN Мир изменился. Времена устройства постепенно ушли в прошлое, и сегодня важным является скорость и мобильность. Именно поэтому компания Lucky Jet разработала уникальный продукт – 1win.
1win – это новое поколение реальных и виртуальных развлечений, объединенных в одной платформе. Будь то спортивные ставки, казино, слоты или электронный покер, 1win предлагает всемирно известные игры в одном месте. Пользователи больше не нуждаются в установке отдельных приложений или посещении различных сайтов, все решения доступны сразу на платформе 1win.
Выбирайте из бесконечного списка событий и спортивных матчей и делайте ставки на любимых команд или игроков. Следите за результатами в режиме реального времени и получайте радость от победы. И все это в одно касание на вашем смартфоне или планшете.
Mines 1WIN Mines 1win is a thrilling game that combines the excitement of mining and the thrill of winning. In this immersive virtual world, players have the opportunity to explore an underground mine filled with precious gems and valuable resources.
As you descend deeper into the mine, you’ll encounter various challenges and obstacles that test your skills and strategy. From navigating treacherous pathways to avoiding deadly traps, every step you take is crucial and could lead to glorious riches or unfortunate demise.
The objective of the game is to mine as many gems as possible while carefully managing your resources and avoiding any potential dangers. With each successful mining expedition, you’ll earn valuable points and rewards that can be used to upgrade your equipment and improve your chances of striking it big.
But Mines 1win is not just about mining; it’s also about outsmarting your competitors. As you progress through the game, you’ll encounter rival miners who will stop at nothing to claim the gems for themselves. Engage in intense strategic battles as you compete to secure the most valuable resources and emerge as the ultimate master of the mines.
Aviator 1WIN Авиатор – захватывающая и увлекательная игра, которая позволяет погрузиться в мир авиации и стать настоящим пилотом. Разработанная командой профессиональных разработчиков, игра Aviator предлагает игрокам уникальную возможность испытать себя в роли пилота самолета.
Основное преимущество игры заключается в ее реалистичности. Все аспекты авиации, начиная от управления самолетом до выполнения сложных маневров, воссозданы с большой точностью. Реалистичная физика полета, динамические погодные условия и плавное управление делают игру максимально реалистичной.
В игре представлены разнообразные виды самолетов, от классических истребителей до грузовых и пассажирских лайнеров. Каждый самолет имеет свои характеристики и особенности, что добавляет глубины и разнообразия геймплею.
Speed Cash 1WIN Speed Cash – инновационная платформа онлайн-гемблинга, которая предлагает своим пользователям уникальный опыт игры и высокие шансы на выигрыш. Благодаря передовым технологиям и максимально удобному интерфейсу, 1win становится идеальным выбором как для новичков, так и для опытных игроков.
Сервис предлагает широкий ассортимент популярных игр, включая слоты, рулетку, покер, блэкджек и многие другие. Главное преимущество Speed Cash в том, что он предлагает мгновенное начисление выигрышей на счет игрока, что гарантирует мгновенный доступ к заработанным средствам.
Безопасность и надежность игры – основные принципы, на которых базируется Speed Cash. Платформа использует передовые технологии шифрования данных, чтобы гарантировать конфиденциальность и защиту личной информации пользователей. Кроме того, 1win сотрудничает только с проверенными провайдерами игрового контента, чтобы обеспечить честную и непредвзятую игру.
1WIN официальный сайт Ставки на спорт — увлекательное и захватывающее занятие, которое привлекает множество людей по всему миру. И одной из платформ, где можно оказаться в центре спортивных событий и испытать адреналин от угадывания исходов матчей, является 1win.
1win – это онлайн-букмекерская контора, которая предоставляет возможность ставить на самые популярные и востребованные виды спорта. Будь то футбол, хоккей, баскетбол или теннис, на 1win каждый найдет что-то, что вызовет его интерес.
Ключевым преимуществом 1win является удобство пользования и широкий выбор ставок. Платформа предоставляет возможность сделать как простые, так и комбинированные ставки, в зависимости от предпочтений и стратегии пользователя. Кроме того, 1win предлагает привлекательные коэффициенты, которые повышают шансы на победу и увеличивают возможные выигрыши.
Одним из важных аспектов, на который обращают внимание пользователи 1win, является безопасность и надежность платформы. 1win осуществляет лицензионную деятельность и соблюдает все необходимые стандарты безопасности, чтобы гарантировать честную игру и защиту данных клиентов.
Кроме того, 1win предлагает своим пользователям различные бонусы и акции. Новым клиентам доступен приветственный бонус, который позволяет получить дополнительные средства для ставок. Также на 1win проводятся регулярные акции, которые позволяют участникам получить дополнительные вознаграждения и повысить свои шансы на выигрыш.
Источник https://1wmri.com/
1xbet promo codes: Unlock Bonuses for New Customers
The promo code for 1xBet is 1XBOX777. When creating an account, players in India can utilize this code to receive a bonus of 100% up to ?42,900 or $/€130. As a new customer at 1xBet, you have the opportunity to enhance your betting experience by using our special promo code. By entering the code during registration, you will gain access to an exclusive welcome bonus of 100% up to $100 on your first deposit. The bonus amount will be equivalent to your local currency if you choose to play in a different currency.
To claim this enticing offer, there are a few steps you need to follow. Firstly, create your account using the provided 1xBet promo code and ensure the validation of your account through the “My Profile” menu. Once that’s done, enable the feature that enables you to participate in the welcome bonus. Finally, make your initial deposit and start enjoying the benefits.
The terms and conditions for the welcome bonus are similar across all countries where 1xBet operates. However, each country may have specific requirements, so it’s essential to familiarize yourself with the details specific to your location.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://mytheme.ir/themes/pages/1xbet_promo_code_2020.html
eu apotheke ohne rezept [url=http://euapothekeohnerezept.com/#]medikament ohne rezept notfall[/url] europa apotheke
http://eumedicamentenligne.com/# Pharmacie sans ordonnance
online apotheke deutschland: online apotheke versandkostenfrei – ohne rezept apotheke
проверить адрес usdt trc20
Тема: Необходимо контролируйте адресе получателя при операции USDT TRC20
При взаимодействии со цифровыми валютами, в частности с USDT в распределенном реестре TRON (TRC20), чрезвычайно необходимо демонстрировать бдительность а также аккуратность. Одна среди самых обычных ошибок, которую допускают юзеры – передача денег на неверный адресу. Чтобы устранить утрату своих USDT, требуется постоянно внимательно контролировать адрес реципиента перед передачей операции.
Крипто адреса представляют из себя длинные наборы литер а также чисел, например, TRX9QahiFUYfHffieZThuzHbkndWvvfzThB8U. Даже малая ошибка иль ошибка при копировании адреса может повлечь к тому, что твои крипто будут безвозвратно лишены, поскольку оные попадут на неконтролируемый вами криптокошелек.
Существуют разные методы проверки адресов кошельков USDT TRC20:
1. Визуальная проверка. Внимательно сверьте адрес кошелька во твоём кошельке со адресом кошелька реципиента. В случае малейшем расхождении – не производите перевод.
2. Применение интернет-служб удостоверения.
3. Дублирующая верификация со адресатом. Попросите адресату заверить корректность адреса кошелька перед посылкой транзакции.
4. Тестовый перевод. В случае значительной величине перевода, можно вначале передать небольшое количество USDT для удостоверения адреса.
Кроме того советуется хранить цифровые деньги в собственных кошельках, но не на биржах или посреднических сервисах, чтобы обладать абсолютный контроль по отношению к своими средствами.
Не пренебрегайте проверкой адресов при осуществлении деятельности с USDT TRC20. Эта обычная мера превенции окажет помощь защитить твои средства от нежелательной лишения. Имейте в виду, что на мире крипто операции необратимы, а переданные цифровые деньги на неправильный адрес вернуть практически невозможно. Будьте внимательны а также тщательны, чтобы охранить свои инвестиции.
pharmacie en ligne france pas cher pharmacie en ligne avec ordonnance or pharmacie en ligne france fiable
https://cse.google.cd/url?q=https://eumedicamentenligne.com pharmacie en ligne livraison europe
[url=http://www.publicanalyst.com/?URL=eumedicamentenligne.com]Pharmacie sans ordonnance[/url] pharmacies en ligne certifiГ©es and [url=http://www.dllaoma.com/home.php?mod=space&uid=370859]п»їpharmacie en ligne france[/url] pharmacie en ligne france pas cher
farmacia online espaГ±a envГo internacional: farmacias online seguras en espaГ±a – farmacia online barata
farmacia online barata [url=https://eufarmaciaonline.shop/#]farmacias online seguras en espaГ±a[/url] farmacias online baratas
trouver un mГ©dicament en pharmacie: pharmacie en ligne france livraison internationale – Achat mГ©dicament en ligne fiable
acquisto farmaci con ricetta: farmacie online affidabili – Farmacie online sicure
farmacia online barata y fiable farmacia online barata or farmacia online espaГ±a envГo internacional
https://toolbarqueries.google.sr/url?q=https://eufarmaciaonline.com farmacia online madrid
[url=https://maps.google.cz/url?sa=t&url=https://eufarmaciaonline.com]farmacia online madrid[/url] farmacia en casa online descuento and [url=https://www.xiaoditech.com/bbs/home.php?mod=space&uid=1723353]farmacia online barata[/url] farmacia barata
online apotheke deutschland: gГјnstigste online apotheke – п»їshop apotheke gutschein
Good day very cool site!! Guy .. Excellent .. Amazing .. I will bookmark your web site and take the feeds also?KI am satisfied to find a lot of helpful information here within the put up, we need develop extra techniques on this regard, thank you for sharing. . . . . .
הפלטפורמה מהווה פלטפורמה נפוצה בארץ לקנייה של קנאביס בצורה מקוון. היא מעניקה ממשק נוח ובטוח לרכישה ולקבלת שילוחים של פריטי קנאביס שונים. במאמר זו נבחן את הרעיון מאחורי טלגראס, איך זו עובדת ומה היתרונות של השימוש בזו.
מה זו האפליקציה?
טלגראס היא דרך לרכישת צמח הקנאביס באמצעות היישומון טלגראם. היא נשענת על ערוצים וקהילות טלגראם ספציפיות הנקראות ״כיווני טלגראס״, שם ניתן להרכיב מרחב פריטי מריחואנה ולקבלת אותם ישירות למשלוח. ערוצי התקשורת אלו מסודרים לפי אזורים גאוגרפיים, במטרה להקל על קבלת השילוחים.
איך זאת עובד?
התהליך קל למדי. ראשית, יש להצטרף לערוץ טלגראס הנוגע לאזור המחיה. שם ניתן לצפות בתפריטי הפריטים השונים ולהרכיב את המוצרים הרצויים. לאחר ביצוע ההזמנה וסיום התשלום, השליח יגיע בכתובת שצוינה עם החבילה שהוזמן.
רוב ערוצי הטלגראס מספקים טווח נרחב של מוצרים – סוגי צמח הקנאביס, ממתקים, משקאות ועוד. בנוסף, ניתן לראות חוות דעת מ לקוחות קודמים לגבי איכות הפריטים והשירות.
יתרונות השימוש באפליקציה
יתרון עיקרי של טלגראס הוא הנוחות והדיסקרטיות. ההרכבה וההכנות מתקיימים ממרחק מאיזשהו מקום, ללא צורך במפגש פיזי. כמו כן, הפלטפורמה מוגנת היטב ומבטיחה חיסיון גבוהה.
מלבד על כך, עלויות הפריטים בטלגראס נוטות להיות תחרותיים, והשילוחים מגיעים במהירות ובהשקעה גבוהה. קיים גם מוקד תמיכה פתוח לכל שאלה או בעיית.
סיכום
האפליקציה היא שיטה מקורית ויעילה לרכוש מוצרי קנאביס בארץ. זו משלבת את הנוחיות הדיגיטלית מ האפליקציה הפופולרית, ועם המהירות והפרטיות מ שיטת המשלוח הישירות. ככל שהדרישה לצמח הקנאביס גדלה, אפליקציות כמו טלגראס צפויות להמשיך ולהתפתח.
Farmacie on line spedizione gratuita top farmacia online or farmaci senza ricetta elenco
https://images.google.bj/url?q=https://eufarmacieonline.com farmacia online
[url=https://cse.google.ne/url?sa=t&url=https://eufarmacieonline.com]farmacie online sicure[/url] farmacia online and [url=http://bbs.cheaa.com/home.php?mod=space&uid=3131291]Farmacie online sicure[/url] acquisto farmaci con ricetta
promo code of 1x bet: 1XBOX777. Avail a complimentary free bets bonus up to $/€130. Register using the bonus code and claim your bonus 100%. You can utilize the received bonus funds in sports or casino. By utilizing the promotional code, you can relish in a multitude of advantages, including deposit bonuses that match your initial investment, complimentary wagers, cashback incentives, and much more. These enticing bonuses grant you extra chances to triumph and enhance the thrill of your betting experience.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://agriness.com/articles/1xbet_promo_code_420.html
online apotheke [url=http://euapothekeohnerezept.com/#]п»їshop apotheke gutschein[/url] medikamente rezeptfrei
Промокоды играют важную роль в мире онлайн-шопинга и развлечений, и 1win не является исключением. 1win – это платформа для ставок, казино и онлайн-игр, которая предлагает ряд уникальных возможностей для своих пользователей. Одной из этих возможностей являются промокоды, которые предоставляются пользователям для получения различных преимуществ и бонусов.
Промокоды 1Win представляют собой уникальные комбинации символов, которые могут быть введены на платформе для активации различных акций и бонусов. Они позволяют пользователям получить дополнительные средства на свой игровой счет, повысить свой уровень лояльности или получить доступ к эксклюзивным предложениям и мероприятиям.
Одним из популярных промокодов, предоставляемых 1win, является “m1WIN2024”. Вводя этот промокод при регистрации, новые пользователи получают бонус на свой первый депозит. Это отличная возможность начать свой опыт на платформе с дополнительными средствами и увеличить свои шансы на успех.
Кроме того, 1win предоставляет регулярные промокоды для своих зарегистрированных пользователей. Такие промокоды могут приходить через электронную почту или быть опубликованы на официальных каналах 1win в социальных сетях. Они предлагают возможность получить дополнительные бонусы при пополнении счета, участии в определенных играх или просто за активность на платформе.
Пользуясь промокодами 1win, пользователи могут значительно обогатить свой игровой опыт и получить дополнительные возможности для выигрыша. Важно помнить, что каждый промокод имеет свои условия использования, поэтому рекомендуется внимательно ознакомиться с правилами и требованиями, прежде чем использовать какой-либо промокод.
В целом, использование промокодов 1win – это удобный и простой способ получить дополнительные бонусы и преимущества на платформе. Независимо от того, вы новый пользователь или постоянный клиент, промокоды могут стать отличной возможностью для улучшения вашего опыта игры. Убедитесь в том, что вы следите за обновлениями и акциями, чтобы не упустить свою возможность воспользоваться промокодами 1win и повысить свои шансы на выигрыш.
Источник: https://mmocenter.ru/blog/promokod-1win-promokody-1vin-pri-registracii-na-segodnya/
https://cenligne.com/# trouver un médicament en pharmacie
pharmacie en ligne sans ordonnance [url=http://levitraenligne.com/#]Levitra acheter[/url] vente de mГ©dicament en ligne
Как похудеть
Слов про « лишний сахар» девочка не поняла. Какая разница, если еда вкусная? Мужчина в это время молча уплетал омлет и представлял что-то повкуснее. После трапезы все отправились по своим делам, в школу или на работу. Татьяна была, по всей видимости, счастливее всех, что нельзя было сказать про её близких. Через пару часов у станка Павел уже был голодным, овощи и яйца не смогли набить его большой желудок. От голода сводились пальцы на ногах, голова пульсировала и разум мутнел. Пришлось экстренно уйти на обед:
—Мужики, я в буфет! Жена удумала худеть, так всех нас этой пытке подвергла. Поел я этой травы, а смысл, если голодный?
—Ну, Петрович, крепись! Зато потом атлетами будете все. Только моей Маринке даже не заикайтесь, а то и меня на голод посадит.
Михалыч – коллега Павла и просто хороший мужик – лишь посмеялся с его высказываний, даже не осознав всей серьезности этого дела. В это время представитель сильного пола стоял возле стойки с десертами. Чего там только не было! А пирожное картошка особо привлекала его взгляд, так и манила к себе. Немедля Павел обратился к буфетчице:
—Дайте мне пять пирожных…. А нет, стойте. Не буду брать.
индивид вовсе не ожидал со стороны любимой половины Татианы. На территории их собственной династии сложение тела совсем отличалась от типовой также утвердившейся – страдать предожирением непреложная правило.
Замена венцов красноярск
Геракл24: Опытная Смена Основания, Венцов, Настилов и Перенос Домов
Компания Gerakl24 специализируется на выполнении комплексных услуг по реставрации фундамента, венцов, полов и перемещению строений в городе Красноярске и в окрестностях. Наша группа опытных мастеров гарантирует превосходное качество исполнения всех видов ремонтных работ, будь то из дерева, с каркасом, кирпичные постройки или бетонные здания.
Плюсы сотрудничества с Gerakl24
Профессионализм и опыт:
Весь процесс выполняются исключительно опытными экспертами, с обладанием многолетний стаж в области создания и ремонта зданий. Наши мастера профессионалы в своем деле и реализуют работу с безупречной точностью и вниманием к деталям.
Полный спектр услуг:
Мы предоставляем полный спектр услуг по ремонту и ремонту домов:
Замена фундамента: замена и укрепление фундамента, что обеспечивает долгий срок службы вашего здания и устранить проблемы, вызванные оседанием и деформацией.
Реставрация венцов: восстановление нижних венцов деревянных зданий, которые наиболее часто подвержены гниению и разрушению.
Смена настилов: установка новых полов, что значительно улучшает внешний вид и функциональные характеристики.
Перенос строений: безопасное и качественное передвижение домов на новые локации, что позволяет сохранить ваше строение и избежать дополнительных затрат на возведение нового.
Работа с любыми типами домов:
Деревянные дома: реставрация и усиление деревянных элементов, защита от разрушения и вредителей.
Каркасные строения: усиление каркасных конструкций и реставрация поврежденных элементов.
Кирпичные дома: реставрация кирпичной кладки и укрепление стен.
Бетонные строения: восстановление и укрепление бетонных структур, ремонт трещин и дефектов.
Надежность и долговечность:
Мы используем лишь качественные материалы и новейшее оборудование, что гарантирует долгий срок службы и надежность всех выполненных работ. Все наши проекты подвергаются строгому контролю качества на каждом этапе выполнения.
Персонализированный подход:
Каждому клиенту мы предлагаем подходящие решения, с учетом всех особенностей и пожеланий. Мы стараемся, чтобы конечный результат полностью соответствовал ваши ожидания и требования.
Зачем обращаться в Геракл24?
Сотрудничая с нами, вы найдете надежного партнера, который возьмет на себя все хлопоты по ремонту и реконструкции вашего строения. Мы обеспечиваем выполнение всех работ в сроки, оговоренные заранее и с соблюдением всех правил и норм. Обратившись в Геракл24, вы можете быть спокойны, что ваш дом в надежных руках.
Мы предлагаем консультацию и дать ответы на все вопросы. Звоните нам, чтобы обсудить детали и узнать больше о наших услугах. Мы обеспечим сохранение и улучшение вашего дома, сделав его безопасным и комфортным для проживания на долгие годы.
Gerakl24 – ваш надежный партнер в реставрации и ремонте домов в Красноярске и за его пределами.
pharmacie en ligne france livraison belgique: Levitra pharmacie en ligne – acheter mГ©dicament en ligne sans ordonnance
I have recently started a site, the information you offer on this web site has helped me tremendously. Thank you for all of your time & work.
The daughter stood in surprise and fidgeted with the hem of her dress, occasionally lifting her eyes to her father. She didn’t really understand the meaning of the words, but reading her father’s emotions, it made her feel uneasy. The chips from the cart were returned to the shelf, followed by the sad gaze of the man:
— Okay… So are we really dieting? And what made you decide so suddenly? We were living just fine…
— We’ll discuss it later. Not now.
п»їpharmacie en ligne france: kamagra 100mg prix – trouver un mГ©dicament en pharmacie
Pharmacie sans ordonnance: levitra generique sites surs – pharmacie en ligne livraison europe
Viagra homme sans ordonnance belgique Acheter viagra en ligne livraison 24h or SildГ©nafil 100 mg prix en pharmacie en France
http://www.irac.pe.ca/redirect.asp?url=https://viaenligne.com Viagra pas cher livraison rapide france
[url=https://www.google.td/url?q=https://viaenligne.com]Viagra Pfizer sans ordonnance[/url] Viagra homme prix en pharmacie sans ordonnance and [url=http://wuyuebanzou.com/home.php?mod=space&uid=539499]SildГ©nafil 100 mg prix en pharmacie en France[/url] Viagra homme prix en pharmacie sans ordonnance
Pharmacie en ligne livraison Europe: Pharmacies en ligne certifiees – pharmacie en ligne sans ordonnance
vente de mГ©dicament en ligne: Medicaments en ligne livres en 24h – vente de mГ©dicament en ligne
Viagra homme prix en pharmacie sans ordonnance: Meilleur Viagra sans ordonnance 24h – Viagra en france livraison rapide
טלגראס כיוונים
נתברכו המגיעים לפורטל המידע והנתונים והתמיכה הרשמי והמוסמך מטעם טלגרמות כיוונים! במקום תוכלו למצוא את מלוא הנתונים והמידע העדכני הזמין והרלוונטי בעניין פלטפורמה טלגרמות ואופני ליישום שלה כראוי.
מהו טלגרם נתיבים?
טלגרף כיוונים מציינת תשתית המבוססת על תקשורת המשמשת לתפוצה ויישום מסביב קנאביס וקנבי בישראל. דרך ההודעות והפורומים בטלגראס, משתמשים רשאים להשיג ולקבל אל מוצרי מריחואנה בצורה קל ומהיר.
באיזה אופן להשתלב בטלגרם?
לשם להתחיל בשימוש בטלגרם, עליכם להיות חברים ב לשיחות ולפורומים האיכותיים. כאן באתר תוכלו לאתר סיכום עבור לינקים לערוצים פעילים ומהימנים. במקביל לכך, ניתן להיכנס בפעילות האספקה והקבלה עבור מוצרי הדשא.
הדרכות וכללים
בפורטל המסוים ניתן לקבל סוגים מבין הוראות וכללים מפורטים לגבי השילוב בפלטפורמת טלגרם, בין היתר:
– ההצטרפות לערוצים מומלצים
– שלבי הקבלה
– ביטחון ואבטחה בשימוש בטלגרם
– ומגוון נתונים נוסף
צירים מאומתים
במקום זה צירים לקבוצות ולפורומים מאומתים בפלטפורמת טלגרם:
– מקום הפרטים והעדכונים הרשמי
– פורום התמיכה והליווי לצרכנים
– מקום לקבלת אספקת קנבי מוטבחים
– סקירת אתרים קנבי מובטחות
אנחנו מאחלים אתם על הצטרפותכם לאזור המידע והידע מאת טלגרף אופקים ומתקווים לכולם חוויית קנייה נעימה ומובטחת!
pharmacie en ligne france pas cher: pharmacie en ligne pas cher – vente de mГ©dicament en ligne
acheter mГ©dicament en ligne sans ordonnance [url=https://cenligne.com/#]Acheter Cialis 20 mg pas cher[/url] vente de mГ©dicament en ligne
pharmacie en ligne france livraison internationale: cialis generique – п»їpharmacie en ligne france
Промокод при регистрации в 1xbet сегодня. Этой акцией может воспользоваться каждый новый клиент при регистрации на сайте букмекера. Это ваше преимущество со старта, и у 1xbet есть эксклюзивное предложение. промокод 1хбет 2024. В форме регистрации есть всего одно необязательное поле — как раз для ввода промокода. Как получить промокод на бесплатную ставку. Магазин находится во вкладке xBonus (в перечне вкладок верхнего блока). Вам предложат несколько вариантов для обмена баллов на промокоды 1xbet kz. Код можно получить для ставки ординар, для ставки экспресс, а также для лотерей от «1хБет». На сегодня промокод 1xbet бесплатно найти можно без особых затрат энергии, при этом сделать это следующим образом: Путем поиска в сети интернет; На сайтах, специализирующихся на спортивных ставках (Не ресурсы БК); В официальных сообществах 1хБет (соцсети). Представители БК часто выкладывают в группах или же просто в сети промокоды на 1xbet бесплатно в честь какого-то праздника либо же грядущего крупного спортивного турнира. Все промокоды 1xbet 2024. На официальном сайте букмекера в соответствующей рубрике находится полный перечень промокодов 1xbet 2024, бесплатно получить которые можно обменяв на них бонусные баллы – более подробно в этом материале http://webladies.ru/cron/pgs/1xbet.html
pharmacie en ligne france fiable trouver un mГ©dicament en pharmacie or pharmacie en ligne france livraison internationale
http://redirect.wooptydoo.com/?r=http://cenligne.com Pharmacie Internationale en ligne
[url=https://images.google.com.ag/url?q=https://cenligne.com]vente de mГ©dicament en ligne[/url] п»їpharmacie en ligne france and [url=https://slovakia-forex.com/members/267619-mqnyfnmciv]acheter mГ©dicament en ligne sans ordonnance[/url] trouver un mГ©dicament en pharmacie
1xBet Bonus Package for Indian Casino Customers
Experience the ultimate excitement of online casino gaming with the exclusive Casino Welcome Offer at 1xBet India 2024. Get ready for an immersive and thrilling journey filled with a wide variety of live dealer games and a vast selection of captivating slots. Unlock this amazing offer by using the 1xBet promo code and take your casino adventure to new heights.
1xBet casino promo code: 1XBOX777, bonus 100% up to $1950 and 150 free spins at the casino. Gain access to an exceptional casino welcome package worth ?130,000. This bonus can be claimed across four separate deposits, allowing you to maximize your rewards and extend your gaming sessions. Prepare to be enthralled by the exhilarating gameplay, stunning graphics, and immersive sound effects that will transport you to the heart of the casino action.
Whether you’re a fan of classic table games or prefer the excitement of spinning the reels on slots, 1xBet has you covered. Explore an extensive collection of live dealer games, where you can interact with professional dealers in real-time for an authentic casino experience. Additionally, the slots section boasts a diverse range of games, ensuring there’s something to suit every preference and style.
Attention all casino enthusiasts! You definitely don’t want to miss out on this incredible opportunity to elevate your casino journey. By using the exclusive 1xbet pakistan promo code: 1XBOX777, you can unlock a remarkable ?169,000 welcome package along with 150 free spins for the year 2024. Immerse yourself in the excitement of the casino, make the most of the bonuses, and embark on a gaming adventure like no other at 1xBet India.
For our valued Indian customers who have a keen interest in the casino section, 1xBet presents an enticing alternative welcome package. This package is designed to enhance your gaming experience across your first four deposits, allowing you to receive a whopping ?169,000 in addition to 150 free spins.
Here’s how the bonus package is divided:
1st deposit: 100% matched bonus + 30 free spins on Reliquary of Ra
2nd deposit: 50% matched bonus + 35 free spins on Chieftain Buffalo
3rd deposit: 25% matched bonus + 40 free spins on Stampede Buffalo
4th deposit: 25% matched bonus + 45 free spins on Rich of the Mermaid Hold and Spin
Embrace the Excitement at 1xBet
With these enticing promo codes and bonus offers, 1xBet ensures that new customers can kickstart their betting journey with a thrilling advantage. Whether you prefer sports betting or exploring the casino games, 1xBet has something for everyone. Don’t miss out on the opportunity to elevate your gaming experience—join 1xBet today and unlock a world of excitement.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://pratamalistrik.com/wp-content/pages/1xbet_promo_code_nepal___30__extra_bonus_with_our_code.html
https://levitraenligne.com/# Pharmacie sans ordonnance
п»їpharmacie en ligne france: pharmacie en ligne pas cher – vente de mГ©dicament en ligne
Hello!
This post was created with XRumer 23 StrongAI.
Good luck 🙂
pharmacie en ligne france livraison belgique: Pharmacie en ligne livraison Europe – Pharmacie sans ordonnance
pharmacie en ligne livraison europe pharmacie en ligne sans ordonnance or pharmacie en ligne france pas cher
http://www.villacapriani.com/redirect.aspx?destination=https://phenligne.com pharmacie en ligne avec ordonnance
[url=http://fotos24.org/url?q=https://phenligne.com]Achat mГ©dicament en ligne fiable[/url] pharmacie en ligne avec ordonnance and [url=http://lsdsng.com/user/545967]acheter mГ©dicament en ligne sans ordonnance[/url] Pharmacie en ligne livraison Europe
Замена венцов красноярск
Gerakl24: Опытная Смена Основания, Венцов, Настилов и Перемещение Домов
Организация Gerakl24 профессионально занимается на оказании полных работ по замене фундамента, венцов, покрытий и передвижению домов в городе Красноярск и за пределами города. Наш коллектив опытных мастеров обещает превосходное качество выполнения всех типов восстановительных работ, будь то деревянные, каркасного типа, из кирпича или из бетона дома.
Достоинства работы с Gerakl24
Навыки и знания:
Весь процесс выполняются только профессиональными мастерами, имеющими большой стаж в области строительства и ремонта зданий. Наши специалисты знают свое дело и осуществляют задачи с максимальной точностью и учетом всех деталей.
Полный спектр услуг:
Мы предоставляем полный спектр услуг по восстановлению и реконструкции строений:
Реставрация фундамента: замена и укрепление фундамента, что обеспечивает долгий срок службы вашего здания и предотвратить проблемы, связанные с оседанием и деформацией строения.
Замена венцов: замена нижних венцов деревянных домов, которые обычно гниют и разрушаются.
Установка новых покрытий: установка новых полов, что существенно улучшает внешний облик и функциональность помещения.
Перемещение зданий: безопасное и качественное передвижение домов на другие участки, что позволяет сохранить ваше строение и избегает дополнительных затрат на строительство нового.
Работа с любыми видами зданий:
Древесные строения: восстановление и укрепление деревянных конструкций, защита от гниения и вредителей.
Каркасные строения: реставрация каркасов и смена поврежденных частей.
Кирпичные строения: реставрация кирпичной кладки и усиление стен.
Бетонные дома: восстановление и укрепление бетонных структур, ремонт трещин и дефектов.
Качество и надежность:
Мы работаем с лишь качественные материалы и новейшее оборудование, что обеспечивает долгий срок службы и надежность всех выполненных работ. Все проекты проходят строгий контроль качества на каждой стадии реализации.
Личный подход:
Каждому клиенту мы предлагаем индивидуальные решения, учитывающие все особенности и пожелания. Наша цель – чтобы конечный результат полностью соответствовал ваши ожидания и требования.
Почему стоит выбрать Геракл24?
Сотрудничая с нами, вы найдете надежного партнера, который берет на себя все заботы по восстановлению и ремонту вашего здания. Мы гарантируем выполнение всех задач в сроки, установленные договором и с в соответствии с нормами и стандартами. Обратившись в Геракл24, вы можете не сомневаться, что ваш дом в надежных руках.
Мы предлагаем консультацию и ответить на все ваши вопросы. Свяжитесь с нами, чтобы обсудить ваш проект и узнать больше о наших услугах. Мы сохраним и улучшим ваш дом, сделав его уютным и безопасным для долгого проживания.
Gerakl24 – ваш выбор для реставрации и ремонта домов в Красноярске и области.
pharmacie en ligne fiable: levitra generique sites surs – pharmacie en ligne livraison europe
1xBet free promo code: 1XBOX777, get vip sports bonus of 100% up to €/$130 (or the equivalent in your local currency). Our website is a treasure trove of the most up-to-date promotions and bonus codes for the year 2024. Moreover, when you register at 1xBet casino using this bonus code, you’ll be greeted with a welcome bonus of €/$1950 and 150 free spins. These incredible bonuses enhance every new player’s winning potential, allowing them to indulge in thrilling gameplay with bonus funds.
pharmacie en ligne sans ordonnance: Acheter Cialis 20 mg pas cher – acheter mГ©dicament en ligne sans ordonnance
child porn
Pharmacie Internationale en ligne pharmacie en ligne france fiable or pharmacie en ligne sans ordonnance
https://maps.google.co.ls/url?q=https://phenligne.com pharmacie en ligne sans ordonnance
[url=https://www.google.bt/url?sa=t&url=https://phenligne.com]pharmacie en ligne fiable[/url] п»їpharmacie en ligne france and [url=http://jzmetin.cn/bbs/home.php?mod=space&uid=448436]vente de mГ©dicament en ligne[/url] acheter mГ©dicament en ligne sans ordonnance
pharmacie en ligne fiable: pharmacie en ligne pas cher – pharmacie en ligne
Ramenbet промокод при регистрации
В мире онлайн-ставок, Ramenbet промокод представляет собой великолепную возможность для новых пользователей начать свой путь с дополнительными бонусами. Этот промокод не только улучшает первоначальный опыт на платформе, но и увеличивает шансы на успех.
Ramenbet промокод
Что такое Ramenbet промокод?
Промокоды – это специальные коды, которые игроки могут использовать при регистрации или внесении депозита, чтобы получить доступ к эксклюзивным предложениям и бонусам – https://by.tribuna.com/casino/blogs/3104381-ramenbet-besplatnyj-promokod-pri-registraczii-2024/. Ramenbet промокод BONUSMEN открывает перед игроками множество выгодных возможностей, включая увеличенные бонусы на депозиты и фриспины.
Введение такого кода в процессе создания аккаунта или пополнения счета является своего рода мостом, соединяющим пользователей с лучшими игровыми предложениями от казино. Ramenbet промокод BONUSMEN не только расширяет игровые горизонты новичков, предоставляя им дополнительные средства для ставок и бесплатные вращения в популярных слотах, но и подчеркивает стремление казино вознаградить их за выбор именно этой платформы для азартных развлечений.
Преимущества Ramenbet промокода
Использование Ramenbet промокода приносит игрокам целый ряд преимуществ:
Получение дополнительных средств для ставок: Благодаря привлекательным процентам на депозиты, игроки могут значительно увеличить свой начальный капитал, что позволяет им делать более крупные ставки и увеличивать продолжительность игры.
Возможность испытать новые слоты без риска: Фриспины, предоставляемые в рамках промокода, дают уникальную возможность ознакомиться с новыми и популярными играми без необходимости тратить собственные средства, тем самым повышая шансы на обнаружение новых любимых слотов.
Усиление игрового опыта через специальные предложения: Фрибеты и ваучеры для использования в различных играх казино не только расширяют спектр возможностей для развлечения, но и предоставляют дополнительные шансы на выигрыш, делая каждую игру еще более захватывающей и прибыльной.
Регистрация с Ramenbet промокодом
Процедура создания учетной записи на платформе Ramenbet с активацией промокода представляет собой интуитивно понятный и удобный процесс, который делает начало игрового пути максимально приятным и выгодным. Вот детализированный план действий:
Открыть официальный веб-сайт Ramenbet: Первый шаг заключается в посещении портала Ramenbet, где будущий пользователь сталкивается с приветливым интерфейсом и легко обнаруживает раздел регистрации.
Переход к форме регистрации: На главной странице или в меню сайта расположена кнопка регистрации, которая направит пользователя на страницу с формой для заполнения.
Заполнение формы регистрационными данными: На этом этапе требуется внести основную информацию о себе, включая имя, адрес электронной почты, пароль для будущего входа в систему, а также другие важные сведения, необходимые для создания аккаунта.
Ввод Ramenbet промокода BONUSMEN: В форме регистрации предусмотрено специальное поле для промокода, куда следует аккуратно ввести код BONUSMEN. Это действие гарантирует получение всех бонусов, предусмотренных для новых игроков, включая дополнительные средства на счет и фриспины.
Завершение процесса регистрации: После заполнения всех необходимых полей и ввода промокода пользователю остается лишь подтвердить создание учетной записи, согласившись с условиями использования и политикой конфиденциальности казино. Обычно это требует верификации через электронную почту или мобильный телефон.
По завершении этих шагов аккаунт становится активным, а игрок получает доступ к своим бонусам, активированным промокодом BONUSMEN, что позволяет немедленно начать исследование игрового мира Ramenbet с дополнительными преимуществами.
Раменбет промокод
Бонусы по Ramenbet промокоду
Активация Ramenbet промокода BONUSMEN открывает для новых участников платформы доступ к серии щедрых бонусов, каждый из которых специально разработан, чтобы усилить их начальный опыт в мире онлайн-ставок и казино. Вот более детальный обзор предложений:
фриспины промокод включает 200% увеличение депозитной суммы и до 30 фриспинов. Это означает, что первоначальный депозит утраивается, предоставляя игрокам значительно больше средств для использования в ставках и играх. Добавление до 30 фриспинов усиливает возможности для выигрыша, давая шанс испытать ещё больше игровых автоматов.
Дополнительные бонусы включают фрибет на сумму 500 и ваучер на 500 для игры в рулетку. Фрибет может быть использован в спортивных ставках, позволяя игрокам делать ставки на выбранные спортивные события без использования средств с их основного счета. Ваучер на 500 для рулетки дает дополнительные средства для использования в одной из самых популярных казино игр, увеличивая шансы на выигрыш.
Эти бонусы, активированные промокодом BONUSMEN, создают привлекательные условия для новых игроков, мотивируя их исследовать различные аспекты платформы Ramenbet и увеличивая их шансы на успешное начало игровой деятельности.
Hello.
This post was created with XRumer 23 StrongAI.
Good luck 🙂
pharmacie en ligne fiable: cialis prix – Pharmacie sans ordonnance
1xbet promo code for bonus: 1XBOX777. Avail a complimentary free bets bonus up to $/€130. Register using the bonus code and claim your bonus 100%. You can utilize the received bonus funds in sports or casino. By utilizing the promotional code, you can relish in a multitude of advantages, including deposit bonuses that match your initial investment, complimentary wagers, cashback incentives, and much more. These enticing bonuses grant you extra chances to triumph and enhance the thrill of your betting experience.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://mytheme.ir/themes/pages/1xbet_promo_code_2020.html
acheter mГ©dicament en ligne sans ordonnance: Levitra sans ordonnance 24h – trouver un mГ©dicament en pharmacie
1xbet promo code sri lanka: 1XBOX777 bonus for new players up to €/$130. The bonus code must be entered during registration, and then you will receive a best welcome bonus in 2024. 1xBet is a well-known and reliable bookmaker, recognized for its wide selection of sports betting choices and attractive promotions. By utilizing the top-notch 1xBet promotional code, you can unlock an outstanding bonus that enables you to wager on a multitude of sports events and potentially rake in significant profits. Seize this opportunity and relish the thrill of risk-free betting.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://www.compassboxwhisky.com/icon/pags/1xbet_promo_code_2020.html
Психология в рассказах, истории из жизни.
Prix du Viagra 100mg en France Viagra pas cher livraison rapide france or Prix du Viagra 100mg en France
https://images.google.co.kr/url?q=https://viaenligne.com Viagra homme prix en pharmacie sans ordonnance
[url=https://www.google.td/url?q=https://viaenligne.com]Viagra prix pharmacie paris[/url] Viagra vente libre pays and [url=https://masterbationtube.com/user/xwodbviqlt/videos]Viagra pas cher livraison rapide france[/url] Meilleur Viagra sans ordonnance 24h
Ramenbet промокод при регистрации
В мире онлайн-ставок, Ramenbet промокод представляет собой великолепную возможность для новых пользователей начать свой путь с дополнительными бонусами. Этот промокод не только улучшает первоначальный опыт на платформе, но и увеличивает шансы на успех.
Ramenbet промокод
Что такое Ramenbet промокод?
Промокоды – это специальные коды, которые игроки могут использовать при регистрации или внесении депозита, чтобы получить доступ к эксклюзивным предложениям и бонусам – http://vgb4.ru/wp-content/pgs/promokod_ramenbet_pri_registracii.html. Ramenbet промокод BONUSMEN открывает перед игроками множество выгодных возможностей, включая увеличенные бонусы на депозиты и фриспины.
Введение такого кода в процессе создания аккаунта или пополнения счета является своего рода мостом, соединяющим пользователей с лучшими игровыми предложениями от казино. Ramenbet промокод BONUSMEN не только расширяет игровые горизонты новичков, предоставляя им дополнительные средства для ставок и бесплатные вращения в популярных слотах, но и подчеркивает стремление казино вознаградить их за выбор именно этой платформы для азартных развлечений.
Преимущества Ramenbet промокода
Использование Ramenbet промокода приносит игрокам целый ряд преимуществ:
Получение дополнительных средств для ставок: Благодаря привлекательным процентам на депозиты, игроки могут значительно увеличить свой начальный капитал, что позволяет им делать более крупные ставки и увеличивать продолжительность игры.
Возможность испытать новые слоты без риска: Фриспины, предоставляемые в рамках промокода, дают уникальную возможность ознакомиться с новыми и популярными играми без необходимости тратить собственные средства, тем самым повышая шансы на обнаружение новых любимых слотов.
Усиление игрового опыта через специальные предложения: Фрибеты и ваучеры для использования в различных играх казино не только расширяют спектр возможностей для развлечения, но и предоставляют дополнительные шансы на выигрыш, делая каждую игру еще более захватывающей и прибыльной.
Регистрация с Ramenbet промокодом
Процедура создания учетной записи на платформе Ramenbet с активацией промокода представляет собой интуитивно понятный и удобный процесс, который делает начало игрового пути максимально приятным и выгодным. Вот детализированный план действий:
Открыть официальный веб-сайт Ramenbet: Первый шаг заключается в посещении портала Ramenbet, где будущий пользователь сталкивается с приветливым интерфейсом и легко обнаруживает раздел регистрации.
Переход к форме регистрации: На главной странице или в меню сайта расположена кнопка регистрации, которая направит пользователя на страницу с формой для заполнения.
Заполнение формы регистрационными данными: На этом этапе требуется внести основную информацию о себе, включая имя, адрес электронной почты, пароль для будущего входа в систему, а также другие важные сведения, необходимые для создания аккаунта.
Ввод Ramenbet промокода BONUSMEN: В форме регистрации предусмотрено специальное поле для промокода, куда следует аккуратно ввести код BONUSMEN. Это действие гарантирует получение всех бонусов, предусмотренных для новых игроков, включая дополнительные средства на счет и фриспины.
Завершение процесса регистрации: После заполнения всех необходимых полей и ввода промокода пользователю остается лишь подтвердить создание учетной записи, согласившись с условиями использования и политикой конфиденциальности казино. Обычно это требует верификации через электронную почту или мобильный телефон.
По завершении этих шагов аккаунт становится активным, а игрок получает доступ к своим бонусам, активированным промокодом BONUSMEN, что позволяет немедленно начать исследование игрового мира Ramenbet с дополнительными преимуществами.
промокод Ramenbet
Бонусы по Ramenbet промокоду
Активация Ramenbet промокода BONUSMEN открывает для новых участников платформы доступ к серии щедрых бонусов, каждый из которых специально разработан, чтобы усилить их начальный опыт в мире онлайн-ставок и казино. Вот более детальный обзор предложений:
промокод к дню рождения включает 200% увеличение депозитной суммы и до 30 фриспинов. Это означает, что первоначальный депозит утраивается, предоставляя игрокам значительно больше средств для использования в ставках и играх. Добавление до 30 фриспинов усиливает возможности для выигрыша, давая шанс испытать ещё больше игровых автоматов.
Дополнительные бонусы включают фрибет на сумму 500 и ваучер на 500 для игры в рулетку. Фрибет может быть использован в спортивных ставках, позволяя игрокам делать ставки на выбранные спортивные события без использования средств с их основного счета. Ваучер на 500 для рулетки дает дополнительные средства для использования в одной из самых популярных казино игр, увеличивая шансы на выигрыш.
Эти бонусы, активированные промокодом BONUSMEN, создают привлекательные условия для новых игроков, мотивируя их исследовать различные аспекты платформы Ramenbet и увеличивая их шансы на успешное начало игровой деятельности.
Психолог
pharmacie en ligne france livraison internationale: levitra generique sites surs – pharmacie en ligne france livraison belgique
pharmacie en ligne france pas cher pharmacie en ligne avec ordonnance or pharmacie en ligne fiable
https://www.google.com.cy/url?sa=t&url=https://phenligne.com acheter mГ©dicament en ligne sans ordonnance
[url=http://www.google.com.mt/url?q=https://phenligne.com::]pharmacie en ligne[/url] pharmacie en ligne france livraison internationale and [url=https://98e.fun/space-uid-7794773.html]acheter mГ©dicament en ligne sans ordonnance[/url] pharmacie en ligne fiable
pharmacie en ligne france pas cher pharmacie en ligne livraison europe or Pharmacie sans ordonnance
http://www.guitar.import-sales.com/cgi/cala/indi.cgi?spot=7&agst=http://cenligne.com Pharmacie en ligne livraison Europe
[url=https://www.google.co.bw/url?q=https://cenligne.com]pharmacie en ligne pas cher[/url] trouver un mГ©dicament en pharmacie and [url=http://wnt1688.cn/home.php?mod=space&uid=8622058]pharmacie en ligne[/url] pharmacie en ligne pas cher
What Is ZenCortex? ZenCortex is an ear health booster that protects ears from potential damage and improves your hearing health.
pharmacie en ligne: cialis prix – pharmacie en ligne france livraison internationale
pharmacie en ligne avec ordonnance: Pharmacies en ligne certifiees – Pharmacie Internationale en ligne
pharmacie en ligne pas cher: Pharmacies en ligne certifiees – pharmacie en ligne avec ordonnance
pharmacie en ligne avec ordonnance Achat mГ©dicament en ligne fiable or Pharmacie en ligne livraison Europe
http://www.hot-th.com/link/outs.php?url=https://phenligne.com/ pharmacie en ligne france livraison internationale
[url=https://clients1.google.com.bn/url?q=http://phenligne.com]pharmacie en ligne sans ordonnance[/url] pharmacie en ligne avec ordonnance and [url=https://xiazai7.com/home.php?mod=space&uid=12822]Pharmacie sans ordonnance[/url] pharmacies en ligne certifiГ©es
This is really interesting, You are a very skilled blogger. I’ve joined your feed and look forward to seeking more of your magnificent post. Also, I have shared your site in my social networks!
Чат рулит! иливсе таки не рулит? давайте разберемся как стит поступать в систуации что бы вас не заблокировали. Мой вам совет заходите в онлайн порно чат азиатки и там вы сможете писать и говорить все что за хтитеи при этом вам не стоит бояться что вас заблокируют. Записывайте адрес сайте https://ru.beautygocams.com/ можете даже себе сделать закладку что бы не потерять сайт на котором есть голые девушки онлайн.
Более подробно ознакомиться с вебкам чатом можно тут – https://ru.beautygocams.com/
Viagra homme prix en pharmacie: Viagra sans ordonnance 24h – Viagra prix pharmacie paris
Ramenbet промокод при регистрации
В мире онлайн-ставок, Ramenbet промокод представляет собой великолепную возможность для новых пользователей начать свой путь с дополнительными бонусами. Этот промокод не только улучшает первоначальный опыт на платформе, но и увеличивает шансы на успех.
Ramenbet промокод
Что такое Ramenbet промокод?
Промокоды – это специальные коды, которые игроки могут использовать при регистрации или внесении депозита, чтобы получить доступ к эксклюзивным предложениям и бонусам – http://www.moshomes.ru/stat/artcls/?promokod_ramenbet_pri_registracii.html. Ramenbet промокод BONUSMEN открывает перед игроками множество выгодных возможностей, включая увеличенные бонусы на депозиты и фриспины.
Введение такого кода в процессе создания аккаунта или пополнения счета является своего рода мостом, соединяющим пользователей с лучшими игровыми предложениями от казино. Ramenbet промокод BONUSMEN не только расширяет игровые горизонты новичков, предоставляя им дополнительные средства для ставок и бесплатные вращения в популярных слотах, но и подчеркивает стремление казино вознаградить их за выбор именно этой платформы для азартных развлечений.
Преимущества Ramenbet промокода
Использование Ramenbet промокода приносит игрокам целый ряд преимуществ:
Получение дополнительных средств для ставок: Благодаря привлекательным процентам на депозиты, игроки могут значительно увеличить свой начальный капитал, что позволяет им делать более крупные ставки и увеличивать продолжительность игры.
Возможность испытать новые слоты без риска: Фриспины, предоставляемые в рамках промокода, дают уникальную возможность ознакомиться с новыми и популярными играми без необходимости тратить собственные средства, тем самым повышая шансы на обнаружение новых любимых слотов.
Усиление игрового опыта через специальные предложения: Фрибеты и ваучеры для использования в различных играх казино не только расширяют спектр возможностей для развлечения, но и предоставляют дополнительные шансы на выигрыш, делая каждую игру еще более захватывающей и прибыльной.
Регистрация с Ramenbet промокодом
Процедура создания учетной записи на платформе Ramenbet с активацией промокода представляет собой интуитивно понятный и удобный процесс, который делает начало игрового пути максимально приятным и выгодным. Вот детализированный план действий:
Открыть официальный веб-сайт Ramenbet: Первый шаг заключается в посещении портала Ramenbet, где будущий пользователь сталкивается с приветливым интерфейсом и легко обнаруживает раздел регистрации.
Переход к форме регистрации: На главной странице или в меню сайта расположена кнопка регистрации, которая направит пользователя на страницу с формой для заполнения.
Заполнение формы регистрационными данными: На этом этапе требуется внести основную информацию о себе, включая имя, адрес электронной почты, пароль для будущего входа в систему, а также другие важные сведения, необходимые для создания аккаунта.
Ввод Ramenbet промокода BONUSMEN: В форме регистрации предусмотрено специальное поле для промокода, куда следует аккуратно ввести код BONUSMEN. Это действие гарантирует получение всех бонусов, предусмотренных для новых игроков, включая дополнительные средства на счет и фриспины.
Завершение процесса регистрации: После заполнения всех необходимых полей и ввода промокода пользователю остается лишь подтвердить создание учетной записи, согласившись с условиями использования и политикой конфиденциальности казино. Обычно это требует верификации через электронную почту или мобильный телефон.
По завершении этих шагов аккаунт становится активным, а игрок получает доступ к своим бонусам, активированным промокодом BONUSMEN, что позволяет немедленно начать исследование игрового мира Ramenbet с дополнительными преимуществами.
Раменбет промокод на сегодня
Бонусы по Ramenbet промокоду
Активация Ramenbet промокода BONUSMEN открывает для новых участников платформы доступ к серии щедрых бонусов, каждый из которых специально разработан, чтобы усилить их начальный опыт в мире онлайн-ставок и казино. Вот более детальный обзор предложений:
промокод ординар включает 200% увеличение депозитной суммы и до 30 фриспинов. Это означает, что первоначальный депозит утраивается, предоставляя игрокам значительно больше средств для использования в ставках и играх. Добавление до 30 фриспинов усиливает возможности для выигрыша, давая шанс испытать ещё больше игровых автоматов.
Дополнительные бонусы включают фрибет на сумму 500 и ваучер на 500 для игры в рулетку. Фрибет может быть использован в спортивных ставках, позволяя игрокам делать ставки на выбранные спортивные события без использования средств с их основного счета. Ваучер на 500 для рулетки дает дополнительные средства для использования в одной из самых популярных казино игр, увеличивая шансы на выигрыш.
Эти бонусы, активированные промокодом BONUSMEN, создают привлекательные условия для новых игроков, мотивируя их исследовать различные аспекты платформы Ramenbet и увеличивая их шансы на успешное начало игровой деятельности.
Самый популяырный онлайн порно чаты с девушками ты можешь провести незабываемые моменты и вкусить всё очарование страстного вебкам-секса в режиме онлайн с зацепившей тебя цыпочкой.
Более подробно ознакомиться с вебкам чатом можно тут – https://ru.beautygocams.com/
pharmacie en ligne france pas cher: Acheter Cialis – pharmacie en ligne france fiable
pharmacie en ligne france livraison internationale: achat kamagra – п»їpharmacie en ligne france
сеть сайтов pbn
Работая в поисковой оптимизации, нужно знать, что не получится одним способом продвинуть сайт в верхние позиции поисковиков, поскольку поисковики это как трек с финишной линией, а сайты это автомобили для гонок, которые все стремятся быть первыми.
Так вот:
Перечень – Для того чтобы веб-сайт был адаптивным и скоростным, важна
улучшение
Сайт обязан иметь только уникальное содержимое, это тексты и картинки
НЕОБХОДИМО ссылочная масса через сайты статейники и непосредственно на главную
Усиление обратных ссылок с использованием дополнительных сайтов
Ссылочная пирамида, это ссылки Tier-1, Tier-2, Tier-3
Ну и главное это собственная сеть сайтов PBN, которая линкуется на деньговый сайт
Все сайты PBN должны быть без отпечатков, т.е. поисковики не должны знать, что это один собственник всех интернет-ресурсов, поэтому очень важно соблюдать все эти указания.
Hi there very nice site!! Guy .. Beautiful .. Wonderful .. I’ll bookmark your web site and take the feeds additionally�I am satisfied to search out a lot of useful info here within the post, we need develop more techniques on this regard, thank you for sharing.
My web blog: https://Www.Waste-ndc.pro/community/profile/tressa79906983/
You have a real gift for writing. Your posts are always so engaging and full of valuable information. Keep up the great work!nexusnook
Pharmacie Internationale en ligne: Levitra sans ordonnance 24h – Achat mГ©dicament en ligne fiable
pharmacie en ligne livraison europe: levitra generique – pharmacies en ligne certifiГ©es
Замена венцов красноярск
Gerakl24: Опытная Реставрация Фундамента, Венцов, Настилов и Перенос Строений
Компания Геракл24 профессионально занимается на предоставлении всесторонних сервисов по замене основания, венцов, настилов и перемещению зданий в месте Красноярск и в окрестностях. Наша группа профессиональных специалистов обеспечивает превосходное качество реализации всех видов восстановительных работ, будь то древесные, каркасного типа, из кирпича или из бетона строения.
Преимущества сотрудничества с Геракл24
Профессионализм и опыт:
Каждая задача осуществляются только высококвалифицированными специалистами, имеющими долгий стаж в сфере создания и ремонта зданий. Наши специалисты профессионалы в своем деле и реализуют работу с безупречной точностью и учетом всех деталей.
Всесторонний подход:
Мы предлагаем все виды работ по восстановлению и ремонту домов:
Замена фундамента: усиление и реставрация старого основания, что обеспечивает долгий срок службы вашего строения и предотвратить проблемы, вызванные оседанием и деформацией.
Смена венцов: реставрация нижних венцов из дерева, которые наиболее часто гниют и разрушаются.
Замена полов: монтаж новых настилов, что значительно улучшает визуальное восприятие и практическую полезность.
Перемещение зданий: безопасное и качественное передвижение домов на новые локации, что позволяет сохранить ваше строение и предотвращает лишние расходы на создание нового.
Работа с различными типами строений:
Древесные строения: восстановление и укрепление деревянных конструкций, защита от гниения и вредителей.
Каркасные строения: реставрация каркасов и реставрация поврежденных элементов.
Кирпичные строения: реставрация кирпичной кладки и усиление стен.
Дома из бетона: восстановление и укрепление бетонных структур, устранение трещин и повреждений.
Надежность и долговечность:
Мы работаем с только проверенные материалы и современное оборудование, что гарантирует долговечность и надежность всех выполненных работ. Все проекты подвергаются строгому контролю качества на каждом этапе выполнения.
Персонализированный подход:
Каждому клиенту мы предлагаем индивидуальные решения, с учетом всех особенностей и пожеланий. Мы стараемся, чтобы результат нашей работы полностью удовлетворял вашим ожиданиям и требованиям.
Зачем обращаться в Геракл24?
Обратившись к нам, вы найдете надежного партнера, который возьмет на себя все заботы по восстановлению и ремонту вашего здания. Мы обеспечиваем выполнение всех работ в установленные сроки и с соблюдением всех строительных норм и стандартов. Выбрав Геракл24, вы можете быть спокойны, что ваше строение в надежных руках.
Мы всегда готовы проконсультировать и дать ответы на все вопросы. Звоните нам, чтобы обсудить ваш проект и узнать о наших сервисах. Мы сохраним и улучшим ваш дом, сделав его уютным и безопасным для долгого проживания.
Геракл24 – ваш партнер по реставрации и ремонту домов в Красноярске и окрестностях.
pharmacie en ligne france pas cher: pharmacie en ligne sans ordonnance – acheter mГ©dicament en ligne sans ordonnance
pharmacie en ligne sans ordonnance pharmacies en ligne certifiГ©es or pharmacie en ligne france livraison belgique
https://maps.google.is/url?sa=t&url=https://phenligne.com acheter mГ©dicament en ligne sans ordonnance
[url=http://images.google.kg/url?q=http://phenligne.com]pharmacie en ligne france livraison internationale[/url] pharmacie en ligne france livraison belgique and [url=http://bbs.cheaa.com/home.php?mod=space&uid=3132875]pharmacie en ligne avec ordonnance[/url] pharmacie en ligne sans ordonnance
娛樂城
在線娛樂城的世界
隨著網際網路的飛速發展,線上娛樂城(在線賭場)已經成為許多人消遣的新選擇。在線娛樂城不僅提供多樣化的遊戲選擇,還能讓玩家在家中就能體驗到賭場的樂趣和樂趣。本文將探討線上娛樂城的特色、利益以及一些常見的游戲。
什麼叫在線娛樂城?
線上娛樂城是一種經由互聯網提供賭博遊戲的平台。玩家可以經由計算機、智能手機或平板進入這些網站,參與各種賭博活動,如德州撲克、輪盤賭、二十一點和老虎机等。這些平台通常由專業的的程序公司開發,確保遊戲的公正和安全。
網上娛樂城的利益
便利性:玩家無需離開家,就能體驗博彩的興奮。這對於那些居住在偏遠實體賭場地區的人來說尤其方便。
多元化的游戲選擇:線上娛樂城通常提供比實體賭場更多的游戲選擇,並且經常改進遊戲內容,保持新鮮感。
優惠和獎勵:許多網上娛樂城提供多樣的獎金計劃,包括註冊獎勵、存款獎勵和忠誠計劃,吸引新新玩家並激勵老玩家繼續遊戲。
穩定性和隱私:正規的在線娛樂城使用高端的加密技術來保護玩家的個人信息和交易,確保游戲過程的安全和公正。
常見的的在線娛樂城遊戲
撲克:撲克牌是最受歡迎的賭博游戲之一。在線娛樂城提供各種德州撲克變體,如德州撲克、奧馬哈撲克和七張撲克等。
賭盤:輪盤賭是一種傳統的賭博遊戲,玩家可以投注在單個數字、數字組合或顏色上,然後看小球落在哪個位置。
黑傑克:又稱為二十一點,這是一種比拼玩家和莊家點數的游戲,目標是讓手牌點數點數盡量接近21點但不超過。
老虎機:老虎机是最簡單也是最受歡迎的賭博游戲之一,玩家只需旋轉捲軸,等待圖案圖案排列出獲勝的組合。
結尾
網上娛樂城為當代賭博愛好者提供了一個方便的、興奮且豐富的娛樂活動。不論是撲克牌愛好者還是吃角子老虎迷,大家都能在這些平台上找到適合自己的遊戲。同時,隨著科技的不斷提升,網上娛樂城的游戲體驗將變得越來越越來越逼真和引人入勝。然而,玩家在享受游戲的同時,也應該保持,避免沉迷於博彩活動,保持健康的娛樂心態。
pharmacies en ligne certifiГ©es pharmacie en ligne france livraison internationale or acheter mГ©dicament en ligne sans ordonnance
https://www.ahewar.org/links/dform.asp?url=https://cenligne.com pharmacie en ligne sans ordonnance
[url=http://www.courtprep.ca/includes/asp/redirect.asp?site=http://cenligne.com/]Pharmacie sans ordonnance[/url] Pharmacie sans ordonnance and [url=http://lsdsng.com/user/545899]pharmacie en ligne avec ordonnance[/url] pharmacie en ligne pas cher
Viagra prix pharmacie paris Viagra homme prix en pharmacie sans ordonnance or Viagra Pfizer sans ordonnance
https://image.google.gp/url?q=https://viaenligne.com Quand une femme prend du Viagra homme
[url=https://cse.google.co.ke/url?q=https://viaenligne.com]Viagra gГ©nГ©rique sans ordonnance en pharmacie[/url] Viagra homme prix en pharmacie sans ordonnance and [url=http://bbs.xinhaolian.com/home.php?mod=space&uid=3957167]Viagra 100 mg sans ordonnance[/url] Viagra pas cher livraison rapide france
線上娛樂城的天地
隨著互聯網的飛速發展,網上娛樂城(在線賭場)已經成為許多人娛樂的新選擇。線上娛樂城不僅提供多元化的遊戲選擇,還能讓玩家在家中就能體驗到賭場的刺激和樂趣。本文將研究在線娛樂城的特點、好處以及一些常見的的遊戲。
什麼線上娛樂城?
網上娛樂城是一種通過互聯網提供賭博游戲的平台。玩家可以透過電腦設備、智能手機或平板進入這些網站,參與各種賭博活動,如撲克牌、輪盤賭、二十一點和老虎機等。這些平台通常由專業的的軟件公司開發,確保游戲的公平性和安全。
在線娛樂城的利益
方便性:玩家不用離開家,就能享受賭錢的快感。這對於那些生活在遠離的實體賭場地區的人來說特別方便。
多種的游戲選擇:在線娛樂城通常提供比實體賭場更豐富的遊戲選擇,並且經常更新遊戲內容,保持新鮮。
福利和獎勵:許多在線娛樂城提供豐厚的獎勵計劃,包括註冊獎金、存款獎金和忠誠計劃,引誘新玩家並激勵老玩家繼續遊戲。
安全性和隱私性:正規的在線娛樂城使用先進的的加密來保護玩家的個人資料和金融交易,確保遊戲過程的公平和公平。
常見的線上娛樂城游戲
德州撲克:撲克牌是最受歡迎賭博游戲之一。線上娛樂城提供多樣撲克變體,如德州扑克、奧馬哈撲克和七張牌撲克等。
輪盤賭:輪盤是一種古老的賭博遊戲,玩家可以投注在單數、數字排列或顏色上上,然後看球落在哪個地方。
黑傑克:又稱為二十一點,這是一種競爭玩家和莊家點數的游戲,目標是讓手牌點數點數盡量接近21點但不超過。
吃角子老虎:老虎机是最受歡迎也是最流行的賭錢游戲之一,玩家只需轉動捲軸,等待圖案排列出中獎的組合。
總結
線上娛樂城為當代賭博愛好者提供了一個便捷、刺激且豐富的娛樂方式。無論是撲克迷還是老虎机愛好者,大家都能在這些平台上找到適合自己的游戲。同時,隨著科技的不斷發展,線上娛樂城的游戲體驗將變化越來越現實和有趣。然而,玩家在享用遊戲的同時,也應該保持自律,避免沉溺於賭博活動,保持健康的心態。
Viagra vente libre pays: Meilleur Viagra sans ordonnance 24h – Viagra Pfizer sans ordonnance
Ramenbet промокод при регистрации
В мире онлайн-ставок, Ramenbet промокод представляет собой великолепную возможность для новых пользователей начать свой путь с дополнительными бонусами. Этот промокод не только улучшает первоначальный опыт на платформе, но и увеличивает шансы на успех.
Ramenbet промокод
Что такое Ramenbet промокод?
Промокоды – это специальные коды, которые игроки могут использовать при регистрации или внесении депозита, чтобы получить доступ к эксклюзивным предложениям и бонусам – http://www.avtokladovka.ru/include/pgs/promokod_ramenbet_pri_registracii.html. Ramenbet промокод BONUSMEN открывает перед игроками множество выгодных возможностей, включая увеличенные бонусы на депозиты и фриспины.
Введение такого кода в процессе создания аккаунта или пополнения счета является своего рода мостом, соединяющим пользователей с лучшими игровыми предложениями от казино. Ramenbet промокод BONUSMEN не только расширяет игровые горизонты новичков, предоставляя им дополнительные средства для ставок и бесплатные вращения в популярных слотах, но и подчеркивает стремление казино вознаградить их за выбор именно этой платформы для азартных развлечений.
Преимущества Ramenbet промокода
Использование Ramenbet промокода приносит игрокам целый ряд преимуществ:
Получение дополнительных средств для ставок: Благодаря привлекательным процентам на депозиты, игроки могут значительно увеличить свой начальный капитал, что позволяет им делать более крупные ставки и увеличивать продолжительность игры.
Возможность испытать новые слоты без риска: Фриспины, предоставляемые в рамках промокода, дают уникальную возможность ознакомиться с новыми и популярными играми без необходимости тратить собственные средства, тем самым повышая шансы на обнаружение новых любимых слотов.
Усиление игрового опыта через специальные предложения: Фрибеты и ваучеры для использования в различных играх казино не только расширяют спектр возможностей для развлечения, но и предоставляют дополнительные шансы на выигрыш, делая каждую игру еще более захватывающей и прибыльной.
Регистрация с Ramenbet промокодом
Процедура создания учетной записи на платформе Ramenbet с активацией промокода представляет собой интуитивно понятный и удобный процесс, который делает начало игрового пути максимально приятным и выгодным. Вот детализированный план действий:
Открыть официальный веб-сайт Ramenbet: Первый шаг заключается в посещении портала Ramenbet, где будущий пользователь сталкивается с приветливым интерфейсом и легко обнаруживает раздел регистрации.
Переход к форме регистрации: На главной странице или в меню сайта расположена кнопка регистрации, которая направит пользователя на страницу с формой для заполнения.
Заполнение формы регистрационными данными: На этом этапе требуется внести основную информацию о себе, включая имя, адрес электронной почты, пароль для будущего входа в систему, а также другие важные сведения, необходимые для создания аккаунта.
Ввод Ramenbet промокода BONUSMEN: В форме регистрации предусмотрено специальное поле для промокода, куда следует аккуратно ввести код BONUSMEN. Это действие гарантирует получение всех бонусов, предусмотренных для новых игроков, включая дополнительные средства на счет и фриспины.
Завершение процесса регистрации: После заполнения всех необходимых полей и ввода промокода пользователю остается лишь подтвердить создание учетной записи, согласившись с условиями использования и политикой конфиденциальности казино. Обычно это требует верификации через электронную почту или мобильный телефон.
По завершении этих шагов аккаунт становится активным, а игрок получает доступ к своим бонусам, активированным промокодом BONUSMEN, что позволяет немедленно начать исследование игрового мира Ramenbet с дополнительными преимуществами.
промокод на Ramenbet
Бонусы по Ramenbet промокоду
Активация Ramenbet промокода BONUSMEN открывает для новых участников платформы доступ к серии щедрых бонусов, каждый из которых специально разработан, чтобы усилить их начальный опыт в мире онлайн-ставок и казино. Вот более детальный обзор предложений:
промокод скачать включает 200% увеличение депозитной суммы и до 30 фриспинов. Это означает, что первоначальный депозит утраивается, предоставляя игрокам значительно больше средств для использования в ставках и играх. Добавление до 30 фриспинов усиливает возможности для выигрыша, давая шанс испытать ещё больше игровых автоматов.
Дополнительные бонусы включают фрибет на сумму 500 и ваучер на 500 для игры в рулетку. Фрибет может быть использован в спортивных ставках, позволяя игрокам делать ставки на выбранные спортивные события без использования средств с их основного счета. Ваучер на 500 для рулетки дает дополнительные средства для использования в одной из самых популярных казино игр, увеличивая шансы на выигрыш.
Эти бонусы, активированные промокодом BONUSMEN, создают привлекательные условия для новых игроков, мотивируя их исследовать различные аспекты платформы Ramenbet и увеличивая их шансы на успешное начало игровой деятельности.
acheter mГ©dicament en ligne sans ordonnance: kamagra pas cher – pharmacie en ligne france fiable
Pharmacie sans ordonnance pharmacie en ligne avec ordonnance or Pharmacie sans ordonnance
https://toolbarqueries.google.co.bw/url?q=https://phenligne.com pharmacies en ligne certifiГ©es
[url=https://www.ocmdhotels.com/?URL=https://phenligne.com]pharmacie en ligne france livraison belgique[/url] pharmacie en ligne france livraison internationale and [url=http://ckxken.synology.me/discuz/home.php?mod=space&uid=34945]pharmacie en ligne france pas cher[/url] Pharmacie Internationale en ligne
Самый популярный сайт видео знакомств в Рунете, считается американские порно чаты онлайн, все потому что там есть чат секс и флирт общение с девушками и женщинами со всех уголков России. Вам не когда не будет скучно когда вы зайдете на этот портал, простое и не принужденное общение на любые темы которые вам нарвятся, это не может надоесть, это приносит лишь наслождение от общения и новых впечетлений.
Более подробно ознакомиться с вебкам чатом можно тут – https://ru.beautygocams.com/
pharmacie en ligne france fiable: cialis sans ordonnance – pharmacie en ligne france livraison internationale
SildГ©nafil 100 mg prix en pharmacie en France: viagra sans ordonnance – Prix du Viagra 100mg en France
Just desire to say your article is as amazing. The clarity on your submit is just cool and i could think you’re an expert on this subject. Fine along with your permission let me to clutch your feed to stay updated with drawing close post. Thank you one million and please continue the gratifying work.
Viagra Pfizer sans ordonnance: Viagra generique en pharmacie – Acheter viagra en ligne livraison 24h
[url=http://baclofem.com/]generic lioresal[/url]
sapporo88
sapporo88
Discover Exciting Offers and Free Rounds: Your Complete Guide
At our gaming platform, we are dedicated to providing you with the best gaming experience possible. Our range of bonuses and free spins ensures that every player has the chance to enhance their gameplay and increase their chances of winning. Here’s how you can take advantage of our fantastic promotions and what makes them so special.
Lavish Bonus Spins and Cashback Promotions
One of our standout offers is the opportunity to earn up to 200 bonus spins and a 75% cashback with a deposit of just $20 or more. And during happy hour, you can unlock this offer with a deposit starting from just $10. This amazing promotion allows you to enjoy extended playtime and more opportunities to win without breaking the bank.
Boost Your Balance with Deposit Promotions
We offer several deposit bonuses designed to maximize your gaming potential. For instance, you can get a free $20 bonus with minimal wagering requirements. This means you can start playing with extra funds, giving you more chances to explore our vast array of games and win big. Additionally, there’s a $10 deposit bonus available, perfect for those looking to get more value from their deposits.
Multiply Your Deposits for Bigger Wins
Our “Play Big!” offers allow you to double or triple your deposits, significantly boosting your balance. Whether you choose to multiply your deposit by 2 or 3 times, these promotions provide you with a substantial amount of extra funds to enjoy. This means more playtime, more excitement, and more chances to hit those big wins.
Exciting Free Spins on Popular Games
We also offer up to 1000 free spins per deposit on some of the most popular games in the industry. Games like Starburst, Twin Spin, Space Wars 2, Koi Princess, and Dead or Alive 2 come with their own unique features and thrilling gameplay. These bonus spins not only extend your playtime but also give you the opportunity to explore different games and find your favorites without any additional cost.
Why Choose Our Platform?
Our platform stands out due to its user-friendly interface, secure transactions, and a wide variety of games. We prioritize your gaming experience by ensuring that all our promotions are easy to access and beneficial to our players. Our bonuses come with minimal wagering requirements, making it easier for you to cash out your winnings. Moreover, the variety of games we offer ensures that there’s something for every type of player, from classic slot enthusiasts to those who enjoy more modern, feature-packed games.
Conclusion
Don’t miss out on these incredible opportunities to enhance your gaming experience. Whether you’re looking to enjoy bonus spins, refund, or bountiful deposit bonuses, we have something for everyone. Join us today, take advantage of these awesome offers, and start your journey to big wins and endless fun. Happy gaming!
Exciting Developments and Renowned Franchises in the Sphere of Interactive Entertainment
In the constantly-changing environment of videogames, there’s perpetually something groundbreaking and exciting on the forefront. From customizations elevating cherished classics to new releases in legendary brands, the videogame industry is prospering as ever.
Let’s take a glimpse into the most recent news and specific the iconic games engrossing fans internationally.
Most Recent Developments
1. Innovative Customization for Skyrim Improves NPC Look
A newly-released mod for Skyrim has attracted the focus of enthusiasts. This enhancement introduces realistic faces and realistic hair for all non-player characters, elevating the title’s visual appeal and depth.
2. Total War Series Title Located in Star Wars Realm In the Works
The Creative Assembly, famous for their Total War collection, is allegedly developing a anticipated game set in the Star Wars galaxy. This captivating integration has fans looking forward to the strategic and compelling journey that Total War Games titles are acclaimed for, now placed in a galaxy far, far away.
3. Grand Theft Auto VI Debut Announced for Late 2025
Take-Two Interactive’s Leader has communicated that Grand Theft Auto VI is planned to debut in Late 2025. With the enormous popularity of its earlier title, Grand Theft Auto V, enthusiasts are excited to explore what the forthcoming iteration of this celebrated universe will offer.
4. Growth Initiatives for Skull and Bones Sophomore Season
Studios of Skull & Bones have disclosed expanded plans for the experience’s sophomore season. This swashbuckling adventure provides fresh updates and updates, sustaining enthusiasts engaged and enthralled in the universe of nautical seafaring.
5. Phoenix Labs Developer Faces Staff Cuts
Regrettably, not all news is positive. Phoenix Labs Studio, the developer behind Dauntless Game, has announced large-scale workforce reductions. Notwithstanding this challenge, the title keeps to be a renowned selection within gamers, and the company continues to be focused on its community.
Beloved Titles
1. The Witcher 3
With its compelling plot, captivating realm, and enthralling adventure, Wild Hunt continues to be a beloved title across enthusiasts. Its rich narrative and wide-ranging free-roaming environment remain to engage players in.
2. Cyberpunk
Despite a tumultuous release, Cyberpunk Game keeps a highly anticipated release. With persistent enhancements and adjustments, the release persists in evolve, delivering gamers a perspective into a high-tech setting abundant with mystery.
3. Grand Theft Auto V
Even years after its original launch, Grand Theft Auto V keeps a popular selection among gamers. Its expansive nonlinear world, enthralling experience, and multiplayer mode keep enthusiasts returning for more explorations.
4. Portal 2 Game
A classic brain-teasing title, Portal 2 Game is celebrated for its innovative systems and ingenious level design. Its complex conundrums and witty narrative have solidified it as a exceptional experience in the interactive entertainment landscape.
5. Far Cry
Far Cry 3 is acclaimed as a standout installments in the universe, offering players an nonlinear adventure rife with adventure. Its compelling experience and memorable figures have established its place as a fan favorite title.
6. Dishonored Universe
Dishonored Game is celebrated for its sneaky gameplay and distinctive realm. Fans embrace the identity of a extraordinary executioner, exploring a metropolitan area abundant with political peril.
7. Assassin’s Creed II
As a component of the renowned Assassin’s Creed collection, Assassin’s Creed is cherished for its compelling narrative, enthralling systems, and period worlds. It keeps a exceptional release in the universe and a favorite among gamers.
In closing, the domain of videogames is prospering and fluid, with groundbreaking advan
pharmacie en ligne livraison europe: levitra en ligne – Pharmacie en ligne livraison Europe
crickex affiliate login
এক রোমাঞ্চকর খেলা এবং জনপ্রিয় বোনাস
বিশ্ববিদ্যালয় ক্রিকেট ফেডারেশন এর সম্মুখীন অংশগ্রহণের প্রস্তাবনা পান, আমরা আনন্দিত এবং অপেক্ষায় আছি যে সম্মুখীন খেলা এবং অনেক সুযোগ প্রদান করা হয়েছে। আমরা আপনাকে একটি অদ্ভুত স্বাগত বোনাসের সুযোগ প্রদান করতে চাই, যা আপনি প্রথম আমানতে 200% পাবেন। এছাড়াও, আমরা সাপ্তাহিক এফবি শেয়ার করে ১০০ টাকা বোনাস প্রদান করি এবং প্রতিদিন ১০০% বোনাস প্রদান করা হয়। এই সময়ে আমরা আমাদের সবচেয়ে বেশি খেলা এবং জনপ্রিয় খেলা – ব্যাকারাট, লাইভশো, ফিশিং, এবং স্লট আমাদের নিখুঁতভাবে চেষ্টা করি।
আমাদের ক্রিকেট এক্সচেঞ্জ অংশগ্রহণ করে আপনি এই সব আনন্দ এবং বোনাস থেকে উপভোগ করতে পারেন। আমাদের অনেক উচ্চমানের খেলা এবং সাথেই জনপ্রিয় খেলা সহ বিভিন্ন বোনাস প্রদান করা হয়েছে এবং সাথেই অনেক আরও আকর্ষণীয় বোনাস আপনাকে আশা করছি।
আমাদের সাথে যোগাযোগ করুন cricket affiliate প্রোগ্রামে অংশগ্রহণ করতে এবং সরাসরি crickex affiliate login এবং crickex login করুন। সাথেই আপনি 9wicket খেলার অনুভব করতে পারেন এবং এটি অপূর্ব এবং রোমাঞ্চকর হয়ে উঠবে। তাহলে, আপনি কি অপেক্ষা করছেন? এখনই যোগ দিন এবং সবচেয়ে জনপ্রিয় খেলা এবং স্বাগত বোনাস পেতে শুরু করুন!
Welcome to Cricket Affiliate | Kick off with a smashing Welcome Bonus !
First Deposit Fiesta! | Make your debut at Cricket Exchange with a 200% bonus.
Daily Doubles! | Keep the scoreboard ticking with a 100% daily bonus at 9wicket!
#cricketaffiliate
IPL 2024 Jackpot! | Stand to win ₹50,000 in the mega IPL draw at cricket world!
Social Sharer Rewards! | Post and earn 100 tk weekly through Crickex affiliate login.
https://www.cricket-affiliate.com/
#cricketexchange #9wicket #crickexaffiliatelogin #crickexlogin
crickex login VIP! | Step up as a VIP and enjoy weekly bonuses!
Join the Action! | Log in through crickex bet exciting betting experience at Live Affiliate.
Dive into the game with crickex live—where every play brings spectacular wins !
acheter mГ©dicament en ligne sans ordonnance pharmacie en ligne france fiable or pharmacie en ligne france livraison internationale
http://vmus.adu.org.za/vm_search.php?database=vimma&prj_acronym=MammalMAP&db=vimma&URL=http://phenligne.com&Logo=images/vimma_logo.png&Headline=Virtual pharmacie en ligne avec ordonnance
[url=http://www.tanadakenzai.co.jp/feed2js/feed2js.php?src=http://phenligne.com]pharmacie en ligne fiable[/url] Pharmacie en ligne livraison Europe and [url=http://www.donggoudi.com/home.php?mod=space&uid=616350]acheter mГ©dicament en ligne sans ordonnance[/url] Achat mГ©dicament en ligne fiable
Пообщаться можно и на русском языке, для этого можно воспользоваться специальным порно чат маил онлайн с возможностью видеосвязи. Такой способ общения полностью уберет все помехи для бесед и поможет провести время русская рулетка видеочат секс Темы для разговора могут быть самыми обычными или же наоборот понятными только собеседникам – преград нет.
Более подробно ознакомиться с вебкам чатом можно тут – https://ru.beautygocams.com/
Daily bonuses
Discover Invigorating Offers and Extra Spins: Your Ultimate Guide
At our gaming platform, we are committed to providing you with the best gaming experience possible. Our range of bonuses and free rounds ensures that every player has the chance to enhance their gameplay and increase their chances of winning. Here’s how you can take advantage of our incredible offers and what makes them so special.
Bountiful Free Spins and Cashback Deals
One of our standout offers is the opportunity to earn up to 200 bonus spins and a 75% rebate with a deposit of just $20 or more. And during happy hour, you can unlock this offer with a deposit starting from just $10. This fantastic offer allows you to enjoy extended playtime and more opportunities to win without breaking the bank.
Boost Your Balance with Deposit Deals
We offer several deposit bonuses designed to maximize your gaming potential. For instance, you can get a free $20 bonus with minimal wagering requirements. This means you can start playing with extra funds, giving you more chances to explore our vast array of games and win big. Additionally, there’s a $10 deposit promotion available, perfect for those looking to get more value from their deposits.
Multiply Your Deposits for Bigger Wins
Our “Play Big!” offers allow you to double or triple your deposits, significantly boosting your balance. Whether you choose to multiply your deposit by 2 or 3 times, these offers provide you with a substantial amount of extra funds to enjoy. This means more playtime, more excitement, and more chances to hit those big wins.
Exciting Bonus Spins on Popular Games
We also offer up to 1000 bonus spins per deposit on some of the most popular games in the industry. Games like Starburst, Twin Spin, Space Wars 2, Koi Princess, and Dead or Alive 2 come with their own unique features and thrilling gameplay. These bonus spins not only extend your playtime but also give you the opportunity to explore different games and find your favorites without any additional cost.
Why Choose Our Platform?
Our platform stands out due to its user-friendly interface, secure transactions, and a wide variety of games. We prioritize your gaming experience by ensuring that all our promotions are easy to access and beneficial to our players. Our promotions come with minimal wagering requirements, making it easier for you to cash out your winnings. Moreover, the variety of games we offer ensures that there’s something for every type of player, from classic slot enthusiasts to those who enjoy more modern, feature-packed games.
Conclusion
Don’t miss out on these unbelievable opportunities to enhance your gaming experience. Whether you’re looking to enjoy free spins, rebate, or lavish deposit bonuses, we have something for everyone. Join us today, take advantage of these amazing offers, and start your journey to big wins and endless fun. Happy gaming!
भारत में ऑनलाइन क्रिकेट सट्टेबाजी की बढ़ती लोकप्रियता
भारत में क्रिकेट को एक धर्म के रूप में देखा जाता है। क्रिकेट के प्रति भारतीयों की अटूट प्रेम और उत्साह को देखते हुए, ऑनलाइन क्रिकेट सट्टेबाजी ने पिछले कुछ वर्षों में जबरदस्त लोकप्रियता हासिल की है।
इस लोकप्रियता के पीछे कुछ प्रमुख कारण हैं। सबसे पहले, बेटवीसा जैसे विश्वसनीय ऑनलाइन कैसीनो और खेल प्लेटफॉर्मों के आगमन ने ऑनलाइन क्रिकेट सट्टेबाजी को एक नया आयाम प्रदान किया है। बेटवीसा भारत में एक प्रमुख खिलाड़ी है, जो अपने कुराकाओ गेमिंग लाइसेंस और 2 मिलियन से अधिक उपयोगकर्ताओं के साथ एक विश्वसनीय और सुरक्षित प्लेटफॉर्म प्रदान करता है।
दूसरा, बेटवीसा ऐप और बेटवीसा लॉगिन प्रक्रिया की सरलता ने उपयोगकर्ताओं को अपने मोबाइल डिवाइसों से क्रिकेट सट्टेबाजी करने में सक्षम बनाया है। इससे उन्हें कहीं से भी खेलने की सुविधा मिलती है।
साथ ही, बेटवीसा जैसे प्लेटफॉर्मों ने विविध भुगतान विकल्प और सुरक्षित लेनदेन की पेशकश की है, जिससे उपयोगकर्ताओं को एक विश्वसनीय और आरामदायक अनुभव प्राप्त होता है।
समग्र रूप से, भारत में ऑनलाइन क्रिकेट सट्टेबाजी की बढ़ती लोकप्रियता में बेटवीसा जैसे प्रमुख ऑनलाइन कैसीनो और खेल प्लेटफॉर्मों की महत्वपूर्ण भूमिका है। इनके आसान, सुरक्षित और विश्वसनीय प्लेटफॉर्म ने क्रिकेट प्रेमियों को एक नया और उत्साहजनक गेमिंग अनुभव प्रदान किया है।
Betvisa Bet
Betvisa Bet | Catch the BPL Excitement with Betvisa!
Hunt for ₹10million! | Enter the BPL at Betvisa and chase a staggering Bounty.
Valentine’s Boost at Visa Bet! | Feel the rush of a 143% Love Mania Bonus .
predict BPL T20 outcomes | score big rewards through Betvisa login!
#betvisa
Betvisa bonus Win! | Leverage your 10 free spins to possibly win $8,888.
Share and Earn! | win ₹500 via the Betvisa app download!
https://www.betvisa-bet.com/hi
#visabet #betvisalogin #betvisaapp #betvisaIndia
Sign-Up Jackpot! | Register at Betvisa India and win ₹8,888.
Double your play! | with a ₹1,000 deposit and get ₹2,000 free at Betvisa online!
Download the Betvisa download today and don’t miss out on the action!
Find Thrilling Deals and Free Spins: Your Complete Guide
At our gaming platform, we are focused to providing you with the best gaming experience possible. Our range of offers and bonus spins ensures that every player has the chance to enhance their gameplay and increase their chances of winning. Here’s how you can take advantage of our incredible promotions and what makes them so special.
Plentiful Free Spins and Rebate Promotions
One of our standout offers is the opportunity to earn up to 200 free spins and a 75% cashback with a deposit of just $20 or more. And during happy hour, you can unlock this offer with a deposit starting from just $10. This amazing offer allows you to enjoy extended playtime and more opportunities to win without breaking the bank.
Boost Your Balance with Deposit Bonuses
We offer several deposit bonuses designed to maximize your gaming potential. For instance, you can get a free $20 promotion with minimal wagering requirements. This means you can start playing with extra funds, giving you more chances to explore our vast array of games and win big. Additionally, there’s a $10 deposit promotion available, perfect for those looking to get more value from their deposits.
Multiply Your Deposits for Bigger Wins
Our “Play Big!” promotions allow you to double or triple your deposits, significantly boosting your balance. Whether you choose to multiply your deposit by 2 or 3 times, these offers provide you with a substantial amount of extra funds to enjoy. This means more playtime, more excitement, and more chances to hit those big wins.
Exciting Bonus Spins on Popular Games
We also offer up to 1000 free spins per deposit on some of the most popular games in the industry. Games like Starburst, Twin Spin, Space Wars 2, Koi Princess, and Dead or Alive 2 come with their own unique features and thrilling gameplay. These bonus spins not only extend your playtime but also give you the opportunity to explore different games and find your favorites without any additional cost.
Why Choose Our Platform?
Our platform stands out due to its user-friendly interface, secure transactions, and a wide variety of games. We prioritize your gaming experience by ensuring that all our offers are easy to access and beneficial to our players. Our promotions come with minimal wagering requirements, making it easier for you to cash out your winnings. Moreover, the variety of games we offer ensures that there’s something for every type of player, from classic slot enthusiasts to those who enjoy more modern, feature-packed games.
Conclusion
Don’t miss out on these unbelievable opportunities to enhance your gaming experience. Whether you’re looking to enjoy free spins, rebate, or generous deposit promotions, we have something for everyone. Join us today, take advantage of these incredible promotions, and start your journey to big wins and endless fun. Happy gaming!
betvisa
Betvisa Casino: Unlocking Unparalleled Bonuses for Philippine Gamblers
The world of online gambling has witnessed a remarkable surge in popularity, and Betvisa Casino has emerged as a premier destination for players in the Philippines. With its user-friendly platform and a diverse selection of games, Betvisa Casino has become the go-to choice for both seasoned gamblers and newcomers alike.
One of the standout features of Betvisa Casino is its generous bonus offerings, which can significantly enhance the overall gaming experience for players in the Philippines. These bonuses not only provide additional value but also increase the chances of winning big.
For first-time players, Betvisa Casino offers a tempting welcome bonus that can give a substantial boost to their initial bankroll. This bonus allows players to explore the platform’s vast array of games, from thrilling slot titles to immersive live casino experiences, with the added security of a financial cushion.
Existing players, on the other hand, can take advantage of a range of ongoing promotions and bonuses that cater to their specific gaming preferences. These may include reload bonuses, free spins, and even exclusive VIP programs that offer personalized rewards and privileges.
One of the key advantages of Betvisa Casino’s bonus offerings is their versatility. Players can utilize these bonuses across a variety of games, from the Visa Bet sports betting platform to the captivating Betvisa Casino. This flexibility allows players to diversify their gaming portfolios and experience the full breadth of what Betvisa has to offer.
Moreover, Betvisa Casino’s bonus terms and conditions are transparent and player-friendly, ensuring a seamless and enjoyable gaming experience. Whether you’re looking to maximize your winnings or simply enhance your overall enjoyment, these bonuses can provide the extra edge you need.
As the online gambling landscape in the Philippines continues to evolve, Betvisa Casino remains at the forefront, offering an unparalleled combination of games, user-friendliness, and unbeatable bonuses. So, why not take a step into the world of Betvisa Casino and unlock a world of exciting possibilities?
Betvisa Bet | Step into the Arena with Betvisa!
Spin to Win Daily at Betvisa PH! | Take a whirl and bag ₱8,888 in big rewards.
Valentine’s 143% Love Boost at Visa Bet! | Celebrate romance and rewards !
Deposit Bonus Magic! | Deposit 50 and get an 88 bonus instantly at Betvisa Casino.
#betvisa
Free Cash & More Spins! | Sign up betvisa login,grab 500 free cash plus 5 free spins.
Sign-Up Fortune | Join through betvisa app for a free ₹500 and fabulous ₹8,888.
https://www.betvisa-bet.com/tl
#visabet #betvisalogin #betvisacasino # betvisaph
Double Your Play at betvisa com! | Deposit 1,000 and get a whopping 2,000 free
100% Cock Fight Welcome at Visa Bet! | Plunge into the exciting world .Bet and win!
Jump into Betvisa for exciting games, stunning bonuses, and endless winnings!
vente de mГ©dicament en ligne: pharmacie en ligne avec ordonnance – vente de mГ©dicament en ligne
Jili ace casino
JiliAce ক্যাসিনোতে ক্র্যাশ এবং বিঙ্গো গেম: অনলাইন জুয়ার নতুন দিগন্ত
অনলাইন গেমিং এবং জুয়ার জগতে JiliAce ক্যাসিনো একটি উল্লেখযোগ্য স্থান দখল করে নিয়েছে। এখানে ব্যবহারকারীরা বিভিন্ন ধরণের গেম উপভোগ করতে পারেন, যার মধ্যে ক্র্যাশ এবং বিঙ্গো গেমগুলি বিশেষভাবে জনপ্রিয়। আজ আমরা এই দুটি গেমের বৈশিষ্ট্য এবং তাদের আকর্ষণীয় দিকগুলি নিয়ে আলোচনা করবো।
ক্র্যাশ গেম: সহজ এবং উত্তেজনাপূর্ণ বাজির অভিজ্ঞতা
ক্র্যাশ গেম হল একটি জনপ্রিয় ধরনের অনলাইন জুয়া খেলা যা বিভিন্ন অনলাইন জুয়া প্ল্যাটফর্মে জনপ্রিয়তা অর্জন করেছে। গেমটি তুলনামূলকভাবে সহজ এবং এতে একটি গুণকের উপর বাজি ধরা জড়িত যা গেমটি ক্র্যাশ না হওয়া পর্যন্ত ক্রমাগত বৃদ্ধি পায়। খেলোয়াড়দের লক্ষ্য হল সঠিক সময়ে বাজি তুলে নেওয়া, যাতে তারা সর্বোচ্চ গুণক পান এবং বড় পুরস্কার জিততে পারেন। Jili ace casino-তে ক্র্যাশ গেম খেলে আপনি এই উত্তেজনাপূর্ণ অভিজ্ঞতা উপভোগ করতে পারবেন এবং আপনার কৌশল ব্যবহার করে বড় জয়ের সুযোগ নিতে পারবেন।
বিঙ্গো গেম: ঐতিহ্যবাহী খেলার ডিজিটাল রূপ
অনলাইন বিঙ্গো হল ঐতিহ্যবাহী বিঙ্গো গেমের একটি ডিজিটাল সংস্করণ, একটি জনপ্রিয় খেলা যা বহু বছর ধরে কমিউনিটি সেন্টার, বিঙ্গো হল এবং সামাজিক সমাবেশে উপভোগ করা হচ্ছে। অনলাইন সংস্করণটি বিঙ্গোর উত্তেজনাকে একটি ভার্চুয়াল প্ল্যাটফর্মে নিয়ে আসে, যা খেলোয়াড়দের তাদের ঘরে বসেই অংশগ্রহণ করতে দেয়। JiliAce ক্যাসিনোতে অনলাইন বিঙ্গো খেলে আপনি ঐতিহ্যবাহী বিঙ্গোর মজা এবং উত্তেজনা উপভোগ করতে পারবেন, যা আপনার বাড়ির আরাম থেকে খেলা যায়। Jili ace login করে সহজেই বিঙ্গো গেমে যোগ দিন এবং আপনার বন্ধুদের সাথে প্রতিযোগিতা করে মজা করুন।
JiliAce ক্যাসিনোতে লগইন এবং গেমিং সুবিধা
Jili ace login প্রক্রিয়া অত্যন্ত সহজ এবং ব্যবহারকারীদের জন্য সুবিধাজনক। একবার লগইন করলে, আপনি সহজেই বিভিন্ন গেমের অ্যাক্সেস পাবেন এবং আপনার পছন্দসই গেম খেলার জন্য প্রস্তুত হয়ে যাবেন। Jiliace login করার পর, আপনি আপনার গেমিং যাত্রা শুরু করতে পারবেন এবং বিভিন্ন ধরনের বোনাস ও পুরস্কার উপভোগ করতে পারবেন।
Jita Bet: বড় পুরস্কারের সুযোগ
JiliAce ক্যাসিনোতে Jita Bet-এর সাথে আপনার গেমিং অভিজ্ঞতা আরও সমৃদ্ধ করুন। এখানে আপনি বিভিন্ন ধরণের বাজি ধরতে পারেন এবং বড় পুরস্কার জিততে পারেন। Jita Bet প্ল্যাটফর্মটি ব্যবহারকারীদের জন্য সহজ এবং সুরক্ষিত বাজি ধরার সুযোগ প্রদান করে।
যোগদান করুন এবং উপভোগ করুন
JiliAce〡JitaBet-এর অংশ হয়ে আজই আপনার গেমিং যাত্রা শুরু করুন। Jili ace casino এবং Jita Bet-এ লগইন করে ক্র্যাশ এবং বিঙ্গো গেমের মত আকর্ষণীয় গেম উপভোগ করুন। এখনই যোগ দিন এবং অনলাইন গেমিংয়ের এক নতুন জগতে প্রবেশ করুন!
Jiliacet casino
Jiliacet casino |
Warm welcome! | Get a 200% Welcome Bonus when you log in jiliace casino.
IPL Tournament! | Join the IPL fever with Jita Bet. Win big prizes!
Epic JILI Tournaments! | Go head-to-head in the Jita bet Super Tournament
#jiliacecasino
Cashback on Deposits! | Get cash back on every deposit. At Jili ace casino
Uninterrupted bonuses at JITAACE! | Stay logged in Jiliace login!
https://www.jiliace-casino.online/bn
#Jiliacecasino # Jiliacelogin#Jiliacelogin # Jitabet
Slot Feast! | Spin to win 100% up to 20,000 ৳. at Jili ace login!
Big Fishing Bonus! | Get a 100% bonus up to ৳20,000 in the Fishing Game.
JiliAce Casino’s top choice for great bonuses. login, play, and win big today!
betvisa login
ডিজিটাল যুগে স্লট খেলার অভূতপূর্ব অভিজ্ঞতা: BetVisa-র মাধ্যমে অ্যাক্সেস উপভোগ করুন
ডিজিটাল যুগের এই যুগে, সুবিধাসমূহ সর্বত্র রাজত্ব করছে, যেখানে অনলাইন গেমিং বিশ্বব্যাপী উত্সাহীদের জন্য একটি জনপ্রিয় বিনোদনরূপে স্থান করে নিয়েছে৷ বড় জয়ের লোভ হোক বা বিনোদনের জগতে নিজেকে নিমজ্জিত করা হোক, অনলাইন স্লটগুলি গেমিং সম্প্রদায়ের একটি প্রধান বিষয় হয়ে উঠেছে৷
এই বিষয়ে, BetVisa একটি অগ্রণী ভূমিকা পালন করে৷ BetVisa ডাউনলোড প্রক্রিয়া খেলোয়াড়দের তাদের প্রিয় স্লট গেমগুলি অ্যাক্সেস করার পদ্ধতিতে বিপ্লব ঘটিয়েছে। ভিসা বেট প্ল্যাটফর্মটি খেলোয়াড়দের তাদের মোবাইল ডিভাইসে BetVisa অ্যাপ ডাউনলোড এবং ইনস্টল করতে সক্ষম করে, তাদের নখদর্পণে স্লট গেমগুলির একটি বিশাল অ্যারেতে তাত্ক্ষণিক অ্যাক্সেস প্রদান করে।
BetVisa বাংলাদেশ ব্যবহারকারীদের জন্য বিশেষ সুবিধা রয়েছে। আপনি সহজেই BetVisa বাংলাদেশ লগইন করে আপনার পছন্দের খেলাগুলি খেলতে পারেন। একই সাথে, নিরাপদ এবং সহজ অর্থপ্রদানের পদ্ধতির মাধ্যমে, BetVisa আপনার গেমিং অভিজ্ঞতাকে আরও উন্নত করে তোলে।
অনলাইন স্লট গেমগুলি বিশ্বব্যাপী গেমারদের আকর্ষণ করে, কিন্তু সেগুলি অ্যাক্সেস করার সুযোগ এখন আগের চেয়ে আরও বেশি৷ BetVisa প্ল্যাটফর্ম এই ক্ষেত্রে একটি বড় ভূমিকা পালন করে, যেখানে খেলোয়াড়রা তাদের প্রিয় স্লট গেমগুলিতে যেকোনও সময়, যেকোনও জায়গায় লিপ্ত হতে পারেন৷
এই উন্নত এবং সুবিধাময় অ্যাক্সেসের মাধ্যমে, BetVisa উত্সাহী গেমারদের জন্য একটি অনন্য অভিজ্ঞতা সৃষ্টি করেছে৷ আপনার প্রিয় স্লট গেমগুলিতে BetVisa ডাউনলোড এবং লগইন করে, এই উদ্ভাবনী প্ল্যাটফর্মের সুবিধাসমূহ উপভোগ করুন।
Betvisa Bet | Hit it Big This IPL Season with Betvisa!
Betvisa login! | Every deposit during IPL matches earns a 2% bonus .
Betvisa Bangladesh! | IPL 2024 action heats up, your bets get more rewarding!
Crash Game returns! | huge ₹10 million jackpot. Take the lead on the Betvisa app !
#betvisa
Start Winning Now! | Sign up through Betvisa affiliate login, claim ₹500 free cash.
Grab Your Winning Ticket! | Register login and win ₹8,888 at visa bet!
https://www.betvisa-bet.com/bn
#visabet #betvisalogin #betvisabangladesh#betvisaapp
200% Excitement! | Enjoy slots and fishing games at Betvisa লগইন করুন!
Big Sports Bonuses! | Score up to ₹5,000 in sports bonuses during the IPL season
Gear up for an exhilarating IPL season at Betvisa, propels you towards victory!
vente de mГ©dicament en ligne: Levitra acheter – pharmacie en ligne livraison europe
Viagra sans ordonnance pharmacie France: viagra sans ordonnance – Viagra Pfizer sans ordonnance
Pharmacie Internationale en ligne: pharmacie en ligne pas cher – pharmacie en ligne france pas cher
game reviews
Engaging Developments and Renowned Titles in the Sphere of Gaming
In the constantly-changing domain of digital entertainment, there’s always something innovative and engaging on the brink. From enhancements enhancing cherished classics to new arrivals in celebrated franchises, the interactive entertainment industry is as vibrant as in current times.
This is a look into the latest developments and some of the beloved experiences engrossing enthusiasts worldwide.
Newest Updates
1. Innovative Modification for The Elder Scrolls V: Skyrim Improves NPC Look
A recent mod for The Elder Scrolls V: Skyrim has grabbed the interest of fans. This mod brings lifelike heads and hair physics for all (NPCs), optimizing the title’s visuals and immersiveness.
2. Total War Experience Set in Star Wars Galaxy Realm Being Developed
The Creative Assembly, acclaimed for their Total War Series series, is reportedly working on a anticipated experience located in the Star Wars Galaxy universe. This captivating crossover has fans awaiting the tactical and engaging experience that Total War Games games are known for, at last set in a realm expansive.
3. GTA VI Release Confirmed for Fall 2025
Take-Two’s Head has communicated that Grand Theft Auto VI is scheduled to launch in Q4 2025. With the massive acclaim of its prior release, Grand Theft Auto V, players are excited to witness what the future iteration of this celebrated series will deliver.
4. Extension Initiatives for Skull & Bones Second Season
Designers of Skull & Bones have revealed expanded plans for the experience’s next season. This high-seas journey offers new updates and updates, maintaining fans captivated and engrossed in the realm of oceanic piracy.
5. Phoenix Labs Experiences Workforce Reductions
Unfortunately, not everything developments is uplifting. Phoenix Labs, the creator developing Dauntless Experience, has disclosed large-scale workforce reductions. Regardless of this obstacle, the experience keeps to be a iconic choice across gamers, and the developer continues to be attentive to its community.
Popular Experiences
1. Wild Hunt
With its engaging narrative, captivating world, and compelling experience, The Witcher 3 Game keeps a beloved game within gamers. Its rich story and wide-ranging open world remain to engage fans in.
2. Cyberpunk
Regardless of a rocky debut, Cyberpunk remains a much-anticipated game. With continuous updates and adjustments, the release keeps advance, presenting enthusiasts a perspective into a cyberpunk environment abundant with mystery.
3. Grand Theft Auto V
Yet years after its original release, GTA 5 keeps a renowned option within enthusiasts. Its vast free-roaming environment, compelling plot, and multiplayer features keep players returning for more explorations.
4. Portal 2
A iconic puzzle game, Portal is praised for its pioneering mechanics and ingenious map design. Its challenging challenges and humorous writing have established it as a remarkable game in the videogame landscape.
5. Far Cry
Far Cry 3 Game is hailed as a standout installments in the brand, presenting players an nonlinear journey teeming with adventure. Its engrossing narrative and iconic figures have confirmed its place as a iconic game.
6. Dishonored Universe
Dishonored Universe is acclaimed for its sneaky features and unique realm. Gamers embrace the role of a otherworldly assassin, experiencing a metropolis teeming with governmental intrigue.
7. Assassin’s Creed 2
As part of the renowned Assassin’s Creed Series series, Assassin’s Creed 2 is cherished for its compelling plot, compelling features, and period worlds. It continues to be a remarkable experience in the franchise and a favorite amidst fans.
In closing, the domain of digital entertainment is thriving and dynamic, with fresh developments
pharmacie en ligne livraison europe п»їpharmacie en ligne france or Pharmacie Internationale en ligne
https://www.human-d.co.jp/seminar/contact.html?title=Web%C3%A3%C6%E2%80%99%C2%BBDTP%C3%A3%C6%E2%80%99%E2%80%A1%C3%A3%E2%80%9A%C2%B6%C3%A3%E2%80%9A%C2%A4%C3%A3%C6%E2%80%99%C2%B3%C3%A7%C2%A7%E2%80%98%C3%AF%C2%BC%CB%86%C3%A5%E2%80%A6%C2%AC%C3%A5%E2%80%A6%C2%B1%C3%A8%C2%81%C2%B7%C3%A6%C2%A5%C2%AD%C3%A8%C2%A8%E2%80%9C%C3%A7%C2%B7%C2%B4%C3%AF%C2%BC%E2%80%B0&url=https://phenligne.com:: pharmacie en ligne avec ordonnance
[url=https://www.ecodibergamo.it/newsletter/interstitial/?url=http://phenligne.com]п»їpharmacie en ligne france[/url] acheter mГ©dicament en ligne sans ordonnance and [url=https://bbs.zzxfsd.com/home.php?mod=space&uid=54335]pharmacie en ligne france livraison belgique[/url] pharmacie en ligne france livraison belgique
п»їpharmacie en ligne france: pharmacie en ligne sans ordonnance – vente de mГ©dicament en ligne
child teen
vente de mГ©dicament en ligne Achat mГ©dicament en ligne fiable or pharmacie en ligne france pas cher
https://images.google.sc/url?q=https://cenligne.com trouver un mГ©dicament en pharmacie
[url=https://maps.google.dm/url?q=https://cenligne.com]pharmacie en ligne france fiable[/url] pharmacie en ligne fiable and [url=https://m.414500.cc/home.php?mod=space&uid=3557561]pharmacie en ligne sans ordonnance[/url] п»їpharmacie en ligne france
Pharmacie sans ordonnance: Acheter Cialis 20 mg pas cher – pharmacies en ligne certifiГ©es
crickex affiliate login
ক্রিকেট অ্যাফিলিয়েট প্রোগ্রাম – একটি উত্তেজনাপূর্ণ অফার
ক্রিকেট অ্যাফিলিয়েট প্রোগ্রাম সম্পর্কে আপনি কখনও শুনেছেন? আপনি ক্রিকেট উপকরণ, খেলাধুলা বা সংগ্রহগুলির জন্য পছন্দ করেন? তাহলে আপনার জন্য সেরা অফার আসছে!
ক্রিকেট অ্যাফিলিয়েট হওয়ার জন্য আমরা আপনার জন্য একটি সুযোগ প্রদান করছি। আমাদের প্রোগ্রামে যোগ দিন এবং আমাদের অনুসরণ করুন। আমাদের প্রোগ্রামে যোগ দিন এবং ক্রিকেট অ্যাফিলিয়েট তথ্য পেতে এবং আমাদের একচেটিয়া ক্রিকেট ক্যাসিনো – ক্রিকএক্স অ্যাফিলিয়েট লগইন বিশেষ প্রচারগুলি গ্রহণ করার জন্য আন্তরিকভাবে স্বাগতম!
ক্রিকেট অ্যাফিলিয়েট হিসেবে আপনি আমাদের প্ল্যাটফর্মে আপনার সুযোগ এবং আয় বৃদ্ধি করতে পারেন। আমাদের সাথে যোগ দিন এবং ক্রিকেট প্রেমিকদের জন্য এই অসাধারণ সুযোগ গ্রহণ করুন!
অনুসরণ করো এবং স্বাগতম
আমাদের অনুসরণ করুন এবং ক্রিকেট অ্যাফিলিয়েট তথ্য পেতে এবং আমাদের একচেটিয়া ক্রিকেট ক্যাসিনো – ক্রিকএক্স অ্যাফিলিয়েট লগইন বিশেষ প্রচারগুলি গ্রহণ করার জন্য আন্তরিকভাবে স্বাগতম! আমাদের প্রোগ্রামে যোগ দিন এবং ক্রিকেট প্রেমিকদের জন্য এই অসাধারণ সুযোগ গ্রহণ করুন!
Welcome to Cricket Affiliate | Kick off with a smashing Welcome Bonus !
First Deposit Fiesta! | Make your debut at Cricket Exchange with a 200% bonus.
Daily Doubles! | Keep the scoreboard ticking with a 100% daily bonus at 9wicket!
#cricketaffiliate
IPL 2024 Jackpot! | Stand to win ₹50,000 in the mega IPL draw at cricket world!
Social Sharer Rewards! | Post and earn 100 tk weekly through Crickex affiliate login.
https://www.cricket-affiliate.com/
#cricketexchange #9wicket #crickexaffiliatelogin #crickexlogin
crickex login VIP! | Step up as a VIP and enjoy weekly bonuses!
Join the Action! | Log in through crickex bet exciting betting experience at Live Affiliate.
Dive into the game with crickex live—where every play brings spectacular wins !
pharmacie en ligne sans ordonnance: kamagra livraison 24h – п»їpharmacie en ligne france
Viagra homme sans prescription Viagra pas cher livraison rapide france or SildГ©nafil 100 mg sans ordonnance
https://maps.google.ne/url?q=https://viaenligne.com Viagra Pfizer sans ordonnance
[url=https://wuangus.cc/go.php?url=https://viaenligne.com]Viagra Pfizer sans ordonnance[/url] Viagra pas cher paris and [url=http://www.0551gay.com/space-uid-106825.html]Prix du Viagra en pharmacie en France[/url] Viagra vente libre pays
Ramenbet промокод при регистрации
В мире онлайн-ставок, Ramenbet промокод представляет собой великолепную возможность для новых пользователей начать свой путь с дополнительными бонусами. Этот промокод не только улучшает первоначальный опыт на платформе, но и увеличивает шансы на успех.
Ramenbet промокод
Что такое Ramenbet промокод?
Промокоды – это специальные коды, которые игроки могут использовать при регистрации или внесении депозита, чтобы получить доступ к эксклюзивным предложениям и бонусам – https://kedrstom.ru/calc/pgs/?promokod_ramenbet_pri_registracii.html. Ramenbet промокод BONUSMEN открывает перед игроками множество выгодных возможностей, включая увеличенные бонусы на депозиты и фриспины.
Введение такого кода в процессе создания аккаунта или пополнения счета является своего рода мостом, соединяющим пользователей с лучшими игровыми предложениями от казино. Ramenbet промокод BONUSMEN не только расширяет игровые горизонты новичков, предоставляя им дополнительные средства для ставок и бесплатные вращения в популярных слотах, но и подчеркивает стремление казино вознаградить их за выбор именно этой платформы для азартных развлечений.
Преимущества Ramenbet промокода
Использование Ramenbet промокода приносит игрокам целый ряд преимуществ:
Получение дополнительных средств для ставок: Благодаря привлекательным процентам на депозиты, игроки могут значительно увеличить свой начальный капитал, что позволяет им делать более крупные ставки и увеличивать продолжительность игры.
Возможность испытать новые слоты без риска: Фриспины, предоставляемые в рамках промокода, дают уникальную возможность ознакомиться с новыми и популярными играми без необходимости тратить собственные средства, тем самым повышая шансы на обнаружение новых любимых слотов.
Усиление игрового опыта через специальные предложения: Фрибеты и ваучеры для использования в различных играх казино не только расширяют спектр возможностей для развлечения, но и предоставляют дополнительные шансы на выигрыш, делая каждую игру еще более захватывающей и прибыльной.
Регистрация с Ramenbet промокодом
Процедура создания учетной записи на платформе Ramenbet с активацией промокода представляет собой интуитивно понятный и удобный процесс, который делает начало игрового пути максимально приятным и выгодным. Вот детализированный план действий:
Открыть официальный веб-сайт Ramenbet: Первый шаг заключается в посещении портала Ramenbet, где будущий пользователь сталкивается с приветливым интерфейсом и легко обнаруживает раздел регистрации.
Переход к форме регистрации: На главной странице или в меню сайта расположена кнопка регистрации, которая направит пользователя на страницу с формой для заполнения.
Заполнение формы регистрационными данными: На этом этапе требуется внести основную информацию о себе, включая имя, адрес электронной почты, пароль для будущего входа в систему, а также другие важные сведения, необходимые для создания аккаунта.
Ввод Ramenbet промокода BONUSMEN: В форме регистрации предусмотрено специальное поле для промокода, куда следует аккуратно ввести код BONUSMEN. Это действие гарантирует получение всех бонусов, предусмотренных для новых игроков, включая дополнительные средства на счет и фриспины.
Завершение процесса регистрации: После заполнения всех необходимых полей и ввода промокода пользователю остается лишь подтвердить создание учетной записи, согласившись с условиями использования и политикой конфиденциальности казино. Обычно это требует верификации через электронную почту или мобильный телефон.
По завершении этих шагов аккаунт становится активным, а игрок получает доступ к своим бонусам, активированным промокодом BONUSMEN, что позволяет немедленно начать исследование игрового мира Ramenbet с дополнительными преимуществами.
рабочий промокод Ramenbet на депозит
Бонусы по Ramenbet промокоду
Активация Ramenbet промокода BONUSMEN открывает для новых участников платформы доступ к серии щедрых бонусов, каждый из которых специально разработан, чтобы усилить их начальный опыт в мире онлайн-ставок и казино. Вот более детальный обзор предложений:
где вводить промокод включает 200% увеличение депозитной суммы и до 30 фриспинов. Это означает, что первоначальный депозит утраивается, предоставляя игрокам значительно больше средств для использования в ставках и играх. Добавление до 30 фриспинов усиливает возможности для выигрыша, давая шанс испытать ещё больше игровых автоматов.
Дополнительные бонусы включают фрибет на сумму 500 и ваучер на 500 для игры в рулетку. Фрибет может быть использован в спортивных ставках, позволяя игрокам делать ставки на выбранные спортивные события без использования средств с их основного счета. Ваучер на 500 для рулетки дает дополнительные средства для использования в одной из самых популярных казино игр, увеличивая шансы на выигрыш.
Эти бонусы, активированные промокодом BONUSMEN, создают привлекательные условия для новых игроков, мотивируя их исследовать различные аспекты платформы Ramenbet и увеличивая их шансы на успешное начало игровой деятельности.
Achat mГ©dicament en ligne fiable: kamagra livraison 24h – Pharmacie sans ordonnance
Exciting Advancements and Popular Franchises in the World of Videogames
In the fluid landscape of digital entertainment, there’s always something new and captivating on the forefront. From enhancements enhancing cherished classics to anticipated launches in renowned series, the videogame landscape is prospering as before.
This is a overview into the most recent updates and certain the renowned releases captivating enthusiasts globally.
Newest Announcements
1. Innovative Customization for The Elder Scrolls V: Skyrim Improves NPC Appearance
A freshly-launched mod for Skyrim has attracted the interest of enthusiasts. This enhancement introduces realistic heads and dynamic hair for each non-player entities, enhancing the game’s aesthetics and immersiveness.
2. Total War Game Located in Star Wars Setting Universe In the Works
Creative Assembly, renowned for their Total War Games collection, is reportedly crafting a forthcoming title located in the Star Wars Universe world. This exciting integration has enthusiasts eagerly anticipating the analytical and captivating adventure that Total War Series experiences are acclaimed for, ultimately located in a galaxy distant.
3. Grand Theft Auto VI Release Confirmed for Fall 2025
Take-Two’s Leader has confirmed that Grand Theft Auto VI is planned to debut in Fall 2025. With the overwhelming acclaim of its predecessor, GTA V, players are excited to witness what the next iteration of this renowned franchise will bring.
4. Extension Initiatives for Skull and Bones Sophomore Season
Developers of Skull and Bones have communicated enhanced plans for the game’s next season. This nautical journey offers upcoming content and updates, engaging fans invested and enthralled in the world of nautical seafaring.
5. Phoenix Labs Experiences Personnel Cuts
Sadly, not every updates is positive. Phoenix Labs Studio, the creator in charge of Dauntless, has communicated massive layoffs. In spite of this setback, the title keeps to be a iconic preference across enthusiasts, and the studio keeps focused on its playerbase.
Beloved Releases
1. The Witcher 3: Wild Hunt Game
With its immersive story, absorbing realm, and compelling adventure, The Witcher 3 Game stays a revered release within players. Its deep plot and expansive open world continue to captivate enthusiasts in.
2. Cyberpunk 2077 Game
Despite a challenging arrival, Cyberpunk Game keeps a long-awaited title. With persistent updates and adjustments, the title persists in evolve, offering fans a glimpse into a dystopian future abundant with intrigue.
3. GTA V
Still decades subsequent to its first release, Grand Theft Auto V keeps a iconic option amidst enthusiasts. Its wide-ranging free-roaming environment, captivating plot, and co-op features keep fans revisiting for ongoing experiences.
4. Portal
A legendary puzzle experience, Portal 2 is renowned for its pioneering features and clever spatial design. Its demanding conundrums and witty writing have cemented it as a exceptional release in the gaming realm.
5. Far Cry 3 Game
Far Cry 3 is celebrated as exceptional entries in the universe, offering fans an sandbox journey teeming with excitement. Its captivating experience and legendary personalities have confirmed its status as a cherished title.
6. Dishonored Series
Dishonored Game is celebrated for its stealth gameplay and exceptional world. Enthusiasts assume the persona of a otherworldly killer, exploring a metropolitan area abundant with institutional peril.
7. Assassin’s Creed
As a segment of the iconic Assassin’s Creed collection, Assassin’s Creed II is adored for its compelling story, enthralling mechanics, and period realms. It continues to be a standout game in the universe and a cherished among gamers.
In final remarks, the world of gaming is vibrant and fluid, with groundbreaking advan
Найдите любовь на всю жизнь. Миллион анкет красивых и свободных девушек хотят с вами познакомиться, заходите в web чат онлайн порно моделями Смотри БЕСПЛАТНО и без регистрации. 1000+ вебкам моделей и парочек готовы общаться. Забудьте сайты знакомств заполненные ботами. Люди, которых вы видите в нашем бесплатном секс чате, реальные, и смотреть, общаться с ними для вас бесплатно.
Более подробно ознакомиться с вебкам чатом можно тут – https://ru.beautygocams.com/
pharmacie en ligne avec ordonnance: kamagra en ligne – pharmacie en ligne sans ordonnance
п»їpharmacie en ligne france Pharmacie en ligne livraison Europe or pharmacie en ligne france pas cher
http://www.google.st/url?q=http://phenligne.com pharmacie en ligne
[url=https://images.google.je/url?q=https://phenligne.com]pharmacie en ligne france pas cher[/url] pharmacie en ligne sans ordonnance and [url=http://bbs.cheaa.com/home.php?mod=space&uid=3132782]Achat mГ©dicament en ligne fiable[/url] Pharmacie en ligne livraison Europe
acheter mГ©dicament en ligne sans ordonnance: Levitra pharmacie en ligne – pharmacie en ligne pas cher
vente de mГ©dicament en ligne: acheter kamagra site fiable – pharmacie en ligne fiable
sunmory33
sunmory33
Ramenbet промокод при регистрации
В мире онлайн-ставок, Ramenbet промокод представляет собой великолепную возможность для новых пользователей начать свой путь с дополнительными бонусами. Этот промокод не только улучшает первоначальный опыт на платформе, но и увеличивает шансы на успех.
Ramenbet промокод
Что такое Ramenbet промокод?
Промокоды – это специальные коды, которые игроки могут использовать при регистрации или внесении депозита, чтобы получить доступ к эксклюзивным предложениям и бонусам – https://uralmarka.ru/netcat/inc/?promokod_ramenbet_pri_registracii.html. Ramenbet промокод BONUSMEN открывает перед игроками множество выгодных возможностей, включая увеличенные бонусы на депозиты и фриспины.
Введение такого кода в процессе создания аккаунта или пополнения счета является своего рода мостом, соединяющим пользователей с лучшими игровыми предложениями от казино. Ramenbet промокод BONUSMEN не только расширяет игровые горизонты новичков, предоставляя им дополнительные средства для ставок и бесплатные вращения в популярных слотах, но и подчеркивает стремление казино вознаградить их за выбор именно этой платформы для азартных развлечений.
Преимущества Ramenbet промокода
Использование Ramenbet промокода приносит игрокам целый ряд преимуществ:
Получение дополнительных средств для ставок: Благодаря привлекательным процентам на депозиты, игроки могут значительно увеличить свой начальный капитал, что позволяет им делать более крупные ставки и увеличивать продолжительность игры.
Возможность испытать новые слоты без риска: Фриспины, предоставляемые в рамках промокода, дают уникальную возможность ознакомиться с новыми и популярными играми без необходимости тратить собственные средства, тем самым повышая шансы на обнаружение новых любимых слотов.
Усиление игрового опыта через специальные предложения: Фрибеты и ваучеры для использования в различных играх казино не только расширяют спектр возможностей для развлечения, но и предоставляют дополнительные шансы на выигрыш, делая каждую игру еще более захватывающей и прибыльной.
Регистрация с Ramenbet промокодом
Процедура создания учетной записи на платформе Ramenbet с активацией промокода представляет собой интуитивно понятный и удобный процесс, который делает начало игрового пути максимально приятным и выгодным. Вот детализированный план действий:
Открыть официальный веб-сайт Ramenbet: Первый шаг заключается в посещении портала Ramenbet, где будущий пользователь сталкивается с приветливым интерфейсом и легко обнаруживает раздел регистрации.
Переход к форме регистрации: На главной странице или в меню сайта расположена кнопка регистрации, которая направит пользователя на страницу с формой для заполнения.
Заполнение формы регистрационными данными: На этом этапе требуется внести основную информацию о себе, включая имя, адрес электронной почты, пароль для будущего входа в систему, а также другие важные сведения, необходимые для создания аккаунта.
Ввод Ramenbet промокода BONUSMEN: В форме регистрации предусмотрено специальное поле для промокода, куда следует аккуратно ввести код BONUSMEN. Это действие гарантирует получение всех бонусов, предусмотренных для новых игроков, включая дополнительные средства на счет и фриспины.
Завершение процесса регистрации: После заполнения всех необходимых полей и ввода промокода пользователю остается лишь подтвердить создание учетной записи, согласившись с условиями использования и политикой конфиденциальности казино. Обычно это требует верификации через электронную почту или мобильный телефон.
По завершении этих шагов аккаунт становится активным, а игрок получает доступ к своим бонусам, активированным промокодом BONUSMEN, что позволяет немедленно начать исследование игрового мира Ramenbet с дополнительными преимуществами.
рабочий промокод Ramenbet при регистрации
Бонусы по Ramenbet промокоду
Активация Ramenbet промокода BONUSMEN открывает для новых участников платформы доступ к серии щедрых бонусов, каждый из которых специально разработан, чтобы усилить их начальный опыт в мире онлайн-ставок и казино. Вот более детальный обзор предложений:
тото промокод включает 200% увеличение депозитной суммы и до 30 фриспинов. Это означает, что первоначальный депозит утраивается, предоставляя игрокам значительно больше средств для использования в ставках и играх. Добавление до 30 фриспинов усиливает возможности для выигрыша, давая шанс испытать ещё больше игровых автоматов.
Дополнительные бонусы включают фрибет на сумму 500 и ваучер на 500 для игры в рулетку. Фрибет может быть использован в спортивных ставках, позволяя игрокам делать ставки на выбранные спортивные события без использования средств с их основного счета. Ваучер на 500 для рулетки дает дополнительные средства для использования в одной из самых популярных казино игр, увеличивая шансы на выигрыш.
Эти бонусы, активированные промокодом BONUSMEN, создают привлекательные условия для новых игроков, мотивируя их исследовать различные аспекты платформы Ramenbet и увеличивая их шансы на успешное начало игровой деятельности.
Key Factors for Success: Enhancing Your Experience on Betvisa Login Sites in 2024
As the world of online gambling continues to evolve at a rapid pace, it’s essential for players to stay ahead of the curve and adapt their strategies accordingly. Whether you’re a seasoned player or just starting your journey, keeping a keen eye on the key factors that can enhance your online gambling experience is crucial, especially when navigating platforms like Betvisa Login.
Prioritizing Secure and Trusted Platforms
In the ever-changing landscape of online gambling, selecting a reputable and trustworthy platform is the foundation for a successful and enjoyable experience. Betvisa Login has established itself as a leading destination, renowned for its commitment to player safety, secure transactions, and robust licensing and regulation. By choosing platforms like Betvisa Login, you can rest assured that your personal and financial information is protected, allowing you to focus on the thrill of the game.
Mastering Game Strategies
The diverse range of games available on Betvisa Login platforms requires a deeper understanding of the underlying strategies and mechanics. From the nuances of Visa Bet to the intricacies of the Betvisa Casino offerings, taking the time to familiarize yourself with the rules, payouts, and winning techniques can significantly improve your chances of success. Utilize free demo versions and educational resources to hone your skills before diving into real-money play.
Capitalizing on Bonuses and Promotions
Online gambling platforms, including Betvisa Login, often offer a range of bonuses and promotions to attract and retain players. From welcome bonuses to free spins and reload offers, these incentives can provide you with valuable extra funds to explore the platform’s offerings. However, it’s crucial to read the terms and conditions carefully to ensure you maximize the potential benefits and avoid any unintended consequences.
Maintaining a Balanced Approach
Responsible gambling practices are essential for a sustainable and enjoyable online gambling experience. Betvisa Login encourages players to set and adhere to personal limits on both time and financial resources. By maintaining a balanced approach, you can ensure that your online gambling activities remain a source of entertainment rather than a source of stress or financial burden.
Staying Informed and Adaptable
The online gambling landscape is constantly evolving, with new games, regulations, and industry trends emerging on a regular basis. To stay ahead of the curve, it’s crucial to stay informed about the latest developments. Follow industry news, join online communities, and subscribe to Betvisa Login’s communication channels to ensure you’re always up-to-date on the latest opportunities and best practices.
Leveraging Customer Support
When navigating the complexities of online gambling, having access to reliable and responsive customer support can make a significant difference. Betvisa Login’s support team is dedicated to addressing player inquiries and resolving any issues that may arise, ensuring a seamless and stress-free experience.
As we usher in the new year, 2024 promises to be an exciting time for online gambling enthusiasts. By focusing on the key factors outlined above and leveraging the robust offerings of platforms like Betvisa Login, players can elevate their online gambling experience, maximize their chances of success, and embrace the thrilling opportunities that lie ahead.
Betvisa Bet | Step into the Arena with Betvisa!
Spin to Win Daily at Betvisa PH! | Take a whirl and bag ?8,888 in big rewards.
Valentine’s 143% Love Boost at Visa Bet! | Celebrate romance and rewards !
Deposit Bonus Magic! | Deposit 50 and get an 88 bonus instantly at Betvisa Casino.
#betvisa
Free Cash & More Spins! | Sign up betvisa login,grab 500 free cash plus 5 free spins.
Sign-Up Fortune | Join through betvisa app for a free ?500 and fabulous ?8,888.
https://www.betvisa-bet.com/tl
#visabet #betvisalogin #betvisacasino # betvisaph
Double Your Play at betvisa com! | Deposit 1,000 and get a whopping 2,000 free
100% Cock Fight Welcome at Visa Bet! | Plunge into the exciting world .Bet and win!
Jump into Betvisa for exciting games, stunning bonuses, and endless winnings!
angkot88
ANGKOT88: Situs Game Deposit Pulsa Terbaik di Indonesia
ANGKOT88 adalah situs game deposit pulsa terbaik tahun 2020 di Indonesia. Kami menyediakan berbagai jenis game online terlengkap yang dapat Anda mainkan hanya dengan mendaftar satu ID. Dengan satu ID tersebut, Anda dapat mengakses seluruh permainan yang tersedia di situs kami.
Sebagai situs agen game online berlisensi resmi dari PAGCOR (Philippine Amusement Gaming Corporation), ANGKOT88 menjamin keamanan dan kenyamanan Anda. Situs kami didukung oleh server hosting yang cepat dan sistem keamanan dengan metode enkripsi terbaru di dunia, sehingga data Anda akan selalu terjaga keamanannya. Tampilan situs yang modern juga membuat Anda merasa nyaman saat mengakses situs kami.
Keunggulan ANGKOT88
Selain menjadi situs game online terbaik, ANGKOT88 juga menawarkan layanan praktis untuk melakukan deposit menggunakan pulsa XL ataupun Telkomsel dengan potongan terendah dibandingkan situs lainnya. Ini menjadikan kami salah satu situs game online pulsa terbesar di Indonesia. Anda juga dapat melakukan deposit pulsa melalui E-commerce resmi seperti OVO, Gopay, Dana, atau melalui minimarket seperti Indomaret dan Alfamart.
Kepercayaan dan Layanan
Kami di ANGKOT88 sangat menjaga kepercayaan Anda sebagai prioritas utama kami. Oleh karena itu, kami selalu berusaha menjadi agen online terpercaya dan terbaik sepanjang masa. Permainan game online yang kami tawarkan sangat praktis, sehingga Anda dapat memainkannya kapan saja dan di mana saja tanpa perlu repot bepergian. Kami menyediakan berbagai jenis game, termasuk yang disiarkan secara LIVE (langsung) dengan host cantik dan kamera yang merekam secara real-time, menjadikan ANGKOT88 situs game online terlengkap dan terbesar di Indonesia.
Promo Menarik dan Menguntungkan
ANGKOT88 juga menawarkan banyak sekali promo menarik dan menguntungkan. Anda bisa menikmati berbagai macam promo yang sesuai dengan kebutuhan Anda, seperti welcome bonus 20%, bonus deposit harian, dan cashback. Semua promo ini tersedia di situs ANGKOT88. Selain itu, kami juga memiliki layanan Customer Service yang siap membantu Anda kapan saja.
Jadi, tunggu apa lagi? Bergabunglah dengan ANGKOT88 dan nikmati pengalaman bermain game online terbaik dan teraman di Indonesia. Daftarkan diri Anda sekarang dan mulai mainkan game favorit Anda dengan nyaman dan aman di situs kami!
pharmacie en ligne france livraison belgique: pharmacie en ligne – Achat mГ©dicament en ligne fiable
trouver un mГ©dicament en pharmacie: Levitra sans ordonnance 24h – pharmacie en ligne france pas cher
https://phenligne.com/# Pharmacie en ligne livraison Europe
sunmory33
https://sunmory33jitu.com
Данный сайт предоставляет доступ к материалу, информации, контенту и комментариям откровенно сексуального характера, вход на официальный сайт бьютигокамс чат предназначен для общения с девушками, парнями и семейными парами. Они снимают свой секс на видео и показывают его на сайте онлайн чат порно сайт. Самым популярным является порно видеочат с голыми девушками, которые показывают свое обнаженные тела. Поэтому вход на порно видеочат без регистраци
Более подробно ознакомиться с вебкам чатом можно тут – https://ru.beautygocams.com/
Pharmacie sans ordonnance pharmacie en ligne avec ordonnance or Achat mГ©dicament en ligne fiable
https://posts.google.com/url?sa=t&url=https://phenligne.com pharmacie en ligne france pas cher
[url=http://albasu.jp/kyoto-quiz/_m/index.php?a=free_page/goto_mobile&referer=https://phenligne.com]Pharmacie sans ordonnance[/url] acheter mГ©dicament en ligne sans ordonnance and [url=https://www.warshipsfaq.ru/user/nmyndkxooo]п»їpharmacie en ligne france[/url] pharmacie en ligne pas cher
supermoney88
SUPERMONEY88: Situs Game Online Deposit Pulsa Terbaik di Indonesia
SUPERMONEY88 adalah situs game online deposit pulsa terbaik tahun 2020 di Indonesia. Kami menyediakan berbagai macam game online terbaik dan terlengkap yang bisa Anda mainkan di situs game online kami. Hanya dengan mendaftar satu ID, Anda bisa memainkan seluruh permainan yang tersedia di SUPERMONEY88.
Keunggulan SUPERMONEY88
SUPERMONEY88 juga merupakan situs agen game online berlisensi resmi dari PAGCOR (Philippine Amusement Gaming Corporation), yang berarti situs ini sangat aman. Kami didukung dengan server hosting yang cepat dan sistem keamanan dengan metode enkripsi termutakhir di dunia untuk menjaga keamanan database Anda. Selain itu, tampilan situs kami yang sangat modern membuat Anda nyaman mengakses situs kami.
Layanan Praktis dan Terpercaya
Selain menjadi game online terbaik, ada alasan mengapa situs SUPERMONEY88 ini sangat spesial. Kami memberikan layanan praktis untuk melakukan deposit yaitu dengan melakukan deposit pulsa XL ataupun Telkomsel dengan potongan terendah dari situs game online lainnya. Ini membuat situs kami menjadi salah satu situs game online pulsa terbesar di Indonesia. Anda bisa melakukan deposit pulsa menggunakan E-commerce resmi seperti OVO, Gopay, Dana, atau melalui minimarket seperti Indomaret dan Alfamart.
Kami juga terkenal sebagai agen game online terpercaya. Kepercayaan Anda adalah prioritas kami, dan itulah yang membuat kami menjadi agen game online terbaik sepanjang masa.
Kemudahan Bermain Game Online
Permainan game online di SUPERMONEY88 memudahkan Anda untuk memainkannya dari mana saja dan kapan saja. Anda tidak perlu repot bepergian lagi, karena SUPERMONEY88 menyediakan beragam jenis game online. Kami juga memiliki jenis game online yang dipandu oleh host cantik, sehingga Anda tidak akan merasa bosan.
pharmacie en ligne france pas cher: pharmacie en ligne – Pharmacie en ligne livraison Europe
Betvisa: বেটিং এর উন্নত অভিজ্ঞতা
অনলাইন বেটিংয়ের বিস্ময়কর বিশ্বে, আপনার বেটিং পার্টনার হিসাবে Betvisa বেছে নেওয়া সর্বোত্তম বিকল্প। কেন?
বৈচিত্র্যময় বেটিং অপশন: Betvisa স্পোর্টস বেটিং থেকে শুরু করে ক্যাসিনো গেমস, ভার্চুয়াল স্পোর্টস এবং আরও অনেক কিছুর একটি বিস্তৃত পরিসর অফার করে। আপনার প্রিয় স্পোর্টস টিমগুলিতে বাজি রাখা হোক বা রুলেট টেবিলে আপনার ভাগ্য চেষ্টা করা হোক না কেন, Betvisa এর সাথে কখনই নিস্তেজ মুহূর্ত হয় না।
অত্যাধুনিক প্রযুক্তি: Betvisa তার ব্যবহারকারীদের কাছে একটি নিরবিচ্ছিন্ন এবং নিমগ্ন বেটিং অভিজ্ঞতা প্রদান করতে অত্যাধুনিক প্রযুক্তির ব্যবহার করে। ব্যবহারকারী-বান্ধব ইন্টারফেস, নিরাপদ অর্থপ্রদানের গেটওয়ে এবং অত্যাধুনিক বৈশিষ্ট্য সহ, Betvisa নিশ্চিত করে যে খেলোয়াড়রা তাদের ঘরে বসে বা যেতে যেতে ঝামেলা-মুক্ত বেটিং সেশন উপভোগ করতে পারে।
বিস্তৃত বাজার সমৃদ্ধি: ক্রীড়া উত্সাহীদের জন্য, Betvisa বিশ্বজুড়ে জনপ্রিয় ক্রীড়া ইভেন্টগুলিকে কভার করে বিস্তৃত বাজারে প্রবেশাধিকার প্রদান করে। ফুটবল, ক্রিকেট, বাস্কেটবল বা টেনিস যাই হোক না কেন, খেলোয়াড়রা তাদের প্রিয় দল এবং প্রতিযোগিতায় বাজি রাখতে পারে সহজেই।
উদার বোনাস এবং প্রচার: Betvisa তার উদার বোনাস এবং প্রচারের জন্য বিখ্যাত, যা নতুন এবং বিদ্যমান উভয় খেলোয়াড়কে লোভনীয় অফার যেমন স্বাগত বোনাস, বিনামূল্যে বেট, ক্যাশব্যাক পুরস্কার এবং আরও অনেক কিছু দিয়ে পুরস্কৃত করে। এই প্রচারগুলি শুধুমাত্র গেমিং অভিজ্ঞতাই বাড়ায় না বরং খেলোয়াড়দের তাদের অর্থের জন্য অতিরিক্ত মূল্যও প্রদান করে।
বেটভিসা বাংলাদেশ ব্যবহারকারীদের জন্য বিশেষ সুবিধা রয়েছে। তারা সহজেই Betvisa বাংলাদেশ লগইন করে গেমগুলি খেলতে পারেন।
অনলাইন বেটিংয়ের এই বিস্ময়কর বিশ্বে, Betvisa একটি বিশ্বস্ত এবং বরেণ্য অংশীদার যা আপনার সকল প্রত্যাশা পূরণ করতে সক্ষম। আপনার বেটিং অভিজ্ঞতার উন্নয়ন এবং আনন্দ বৃদ্ধির জন্য, Betvisa-এর সাথে যোগাযোগ করা উপযুক্ত পছন্দ।
Betvisa Bet | Hit it Big This IPL Season with Betvisa!
Betvisa login! | Every deposit during IPL matches earns a 2% bonus .
Betvisa Bangladesh! | IPL 2024 action heats up, your bets get more rewarding!
Crash Game returns! | huge ₹10 million jackpot. Take the lead on the Betvisa app !
#betvisa
Start Winning Now! | Sign up through Betvisa affiliate login, claim ₹500 free cash.
Grab Your Winning Ticket! | Register login and win ₹8,888 at visa bet!
https://www.betvisa-bet.com/bn
#visabet #betvisalogin #betvisabangladesh#betvisaapp
200% Excitement! | Enjoy slots and fishing games at Betvisa লগইন করুন!
Big Sports Bonuses! | Score up to ₹5,000 in sports bonuses during the IPL season
Gear up for an exhilarating IPL season at Betvisa, propels you towards victory!
visa bet
BetVisa: মোবাইল গেমিংয়ের নতুন রূপ
ডিজিটাল যুগে, খেলোয়াড়রা আর ডেস্কটপ গেমিংয়ের সীমিততা সহ্য করতে চান না। তাদের চাহিদা হল, যেকোন সময় যেকোন জায়গায় তাদের প্রিয় স্লট গেমগুলি খেলতে পারা। এই চাহিদা লক্ষ্য করে, BetVisa মোবাইল গেমিংয়ের নতুন মাত্রা উন্মোচন করেছে।
বেটভিসা ডাউনলোড: খেলোয়াড়রা বাড়িতে বসে থাক বা চলার পথে থাকুক না কেন, তাদের স্মার্টফোন বা ট্যাবলেট বের করে BetVisa অ্যাপ চালু করতে পারে এবং সেকেন্ডের মধ্যে স্লটের জগতে ডুব দিতে পারে। এই সুবিধার মাধ্যমে, খেলোয়াড়রা ডেস্কটপ গেমিংয়ের সীমাবদ্ধতা থেকে বিদায় নিতে পারেন।
রিচ গেমিং বৈচিত্র্য: Betvisa তাদের সৃজনশীলতা এবং উদ্ভাবনের জন্য বিখ্যাত গেম ডেভেলপারদের কাছ থেকে শিরোনাম সমন্বিত স্লট গেমগুলির একটি বিস্তৃত লাইব্রেরি নিয়ে গর্বিত। ক্লাসিক ফ্রুট মেশিন থেকে শুরু করে অত্যাধুনিক গ্রাফিক্স এবং অ্যানিমেশন গর্বিত নিমজ্জিত ভিডিও স্লট পর্যন্ত, প্রত্যেক খেলোয়াড়ের পছন্দ ও স্বাদ মেটাতে কিছু না কিছু রয়েছে।
সুচারু গেমপ্লে: বেটিভিসা ডাউনলোড মোবাইল ডিভাইসের জন্য তৈরি অপ্টিমাইজড পারফরম্যান্স এবং স্বজ্ঞাত নিয়ন্ত্রণ সহ একটি নিরবচ্ছিন্ন গেমিং অভিজ্ঞতা নিশ্চিত করে৷ প্লেয়াররা অ্যাপের মাধ্যমে অনায়াসে নেভিগেট করতে পারে, বিভিন্ন গেম অন্বেষণ করতে পারে, এবং কোনো প্রকার ল্যাগ বা গ্লিচ ছাড়াই নিরবচ্ছিন্ন গেমপ্লে উপভোগ করতে পারে।
বিশেষ প্রচার সুযোগ: BetVisa প্রায়শই Betvisa ডাউনলোড অ্যাপের মাধ্যমে প্ল্যাটফর্মে প্রবেশকারী খেলোয়াড়দের জন্য একচেটিয়া প্রচার এবং বোনাস রোল আউট করে। স্বাগত বোনাস থেকে শুরু করে ফ্রি স্পিন এবং লয়্যালটি পুরষ্কার পর্যন্ত, একজনের ব্যাঙ্করোল বাড়ানো এবং গেমিং অভিজ্ঞতা বাড়ানোর প্রচুর সুযোগ রয়েছে।
BetVisa বাংলাদেশ ব্যবহারকারীদের জন্য বিশেষ সুবিধা প্রদান করে। BetVisa বাংলাদেশ লগইন করে খেলোয়াড়রা সহজে তাদের প্রিয় স্লট গেমগুলি খেলতে পারেন।
মোবাইল ডিভাইসের উন্নত অ্যাক্সেসের সুযোগ, রিচ গেমিং বৈচিত্র্য এবং বিশেষ প্রচার সুবিধার মাধ্যমে, BetVisa মোবাইল গেমিংয়ের নতুন বিস্ময় সৃষ্টি করেছে।
Betvisa Bet | Hit it Big This IPL Season with Betvisa!
Betvisa login! | Every deposit during IPL matches earns a 2% bonus .
Betvisa Bangladesh! | IPL 2024 action heats up, your bets get more rewarding!
Crash Game returns! | huge ₹10 million jackpot. Take the lead on the Betvisa app !
#betvisa
Start Winning Now! | Sign up through Betvisa affiliate login, claim ₹500 free cash.
Grab Your Winning Ticket! | Register login and win ₹8,888 at visa bet!
https://www.betvisa-bet.com/bn
#visabet #betvisalogin #betvisabangladesh#betvisaapp
200% Excitement! | Enjoy slots and fishing games at Betvisa লগইন করুন!
Big Sports Bonuses! | Score up to ₹5,000 in sports bonuses during the IPL season
Gear up for an exhilarating IPL season at Betvisa, propels you towards victory!
sapporo88
SUPERMONEY88: Situs Game Online Deposit Pulsa Terbaik di Indonesia
SUPERMONEY88 adalah situs game online deposit pulsa terbaik tahun 2020 di Indonesia. Kami menyediakan berbagai macam game online terbaik dan terlengkap yang bisa Anda mainkan di situs game online kami. Hanya dengan mendaftar satu ID, Anda bisa memainkan seluruh permainan yang tersedia di SUPERMONEY88.
Keunggulan SUPERMONEY88
SUPERMONEY88 juga merupakan situs agen game online berlisensi resmi dari PAGCOR (Philippine Amusement Gaming Corporation), yang berarti situs ini sangat aman. Kami didukung dengan server hosting yang cepat dan sistem keamanan dengan metode enkripsi termutakhir di dunia untuk menjaga keamanan database Anda. Selain itu, tampilan situs kami yang sangat modern membuat Anda nyaman mengakses situs kami.
Layanan Praktis dan Terpercaya
Selain menjadi game online terbaik, ada alasan mengapa situs SUPERMONEY88 ini sangat spesial. Kami memberikan layanan praktis untuk melakukan deposit yaitu dengan melakukan deposit pulsa XL ataupun Telkomsel dengan potongan terendah dari situs game online lainnya. Ini membuat situs kami menjadi salah satu situs game online pulsa terbesar di Indonesia. Anda bisa melakukan deposit pulsa menggunakan E-commerce resmi seperti OVO, Gopay, Dana, atau melalui minimarket seperti Indomaret dan Alfamart.
Kami juga terkenal sebagai agen game online terpercaya. Kepercayaan Anda adalah prioritas kami, dan itulah yang membuat kami menjadi agen game online terbaik sepanjang masa.
Kemudahan Bermain Game Online
Permainan game online di SUPERMONEY88 memudahkan Anda untuk memainkannya dari mana saja dan kapan saja. Anda tidak perlu repot bepergian lagi, karena SUPERMONEY88 menyediakan beragam jenis game online. Kami juga memiliki jenis game online yang dipandu oleh host cantik, sehingga Anda tidak akan merasa bosan.
PRO88: Situs Game Online Deposit Pulsa Terbaik di Indonesia
PRO88 adalah situs game online deposit pulsa terbaik tahun 2020 di Indonesia. Kami menyediakan berbagai macam game online terbaik dan terlengkap yang bisa Anda mainkan di situs game online kami. Hanya dengan mendaftar satu ID, Anda bisa memainkan seluruh permainan yang tersedia di PRO88.
Keunggulan PRO88
PRO88 juga merupakan situs agen game online berlisensi resmi dari PAGCOR (Philippine Amusement Gaming Corporation), yang berarti situs ini sangat aman. Kami didukung dengan server hosting yang cepat dan sistem keamanan dengan metode enkripsi termutakhir di dunia untuk menjaga keamanan database Anda. Selain itu, tampilan situs kami yang sangat modern membuat Anda nyaman mengakses situs kami.
Berbagai Macam Game Online
Kami menyediakan berbagai macam game online terbaik yang bisa Anda mainkan kapan saja dan di mana saja. Dengan satu ID, Anda bisa menikmati semua permainan yang tersedia, mulai dari permainan kartu, slot, hingga taruhan olahraga. PRO88 memastikan semua game yang kami sediakan adalah yang terbaik dan terlengkap di Indonesia.
Keamanan dan Kenyamanan
Kami memahami betapa pentingnya keamanan dan kenyamanan bagi para pemain. Oleh karena itu, PRO88 menggunakan server hosting yang cepat dan sistem keamanan dengan metode enkripsi termutakhir di dunia. Ini memastikan bahwa data pribadi dan transaksi Anda selalu aman bersama kami. Tampilan situs yang modern juga dirancang untuk memberikan pengalaman bermain yang nyaman dan menyenangkan.
Kesimpulan
PRO88 adalah pilihan terbaik untuk Anda yang mencari situs game online deposit pulsa yang aman dan terpercaya. Dengan berbagai macam game online terbaik dan terlengkap, serta dukungan keamanan yang canggih, PRO88 siap memberikan pengalaman bermain game yang tak terlupakan. Daftar sekarang juga di PRO88 dan nikmati semua permainan yang tersedia hanya dengan satu ID.
Kunjungi kami di PRO88 dan mulailah petualangan game online Anda bersama kami!
You have a real gift for writing. Your posts are always so engaging and full of valuable information. Keep up the great work!nexusnook
Viagra prix pharmacie paris: Acheter du Viagra sans ordonnance – Meilleur Viagra sans ordonnance 24h
Ramenbet промокод при регистрации
В мире онлайн-ставок, Ramenbet промокод представляет собой великолепную возможность для новых пользователей начать свой путь с дополнительными бонусами. Этот промокод не только улучшает первоначальный опыт на платформе, но и увеличивает шансы на успех.
Ramenbet промокод
Что такое Ramenbet промокод?
Промокоды – это специальные коды, которые игроки могут использовать при регистрации или внесении депозита, чтобы получить доступ к эксклюзивным предложениям и бонусам – http://officeagency.ru/assets/inc/promokod_ramenbet_pri_registracii.html. Ramenbet промокод BONUSMEN открывает перед игроками множество выгодных возможностей, включая увеличенные бонусы на депозиты и фриспины.
Введение такого кода в процессе создания аккаунта или пополнения счета является своего рода мостом, соединяющим пользователей с лучшими игровыми предложениями от казино. Ramenbet промокод BONUSMEN не только расширяет игровые горизонты новичков, предоставляя им дополнительные средства для ставок и бесплатные вращения в популярных слотах, но и подчеркивает стремление казино вознаградить их за выбор именно этой платформы для азартных развлечений.
Преимущества Ramenbet промокода
Использование Ramenbet промокода приносит игрокам целый ряд преимуществ:
Получение дополнительных средств для ставок: Благодаря привлекательным процентам на депозиты, игроки могут значительно увеличить свой начальный капитал, что позволяет им делать более крупные ставки и увеличивать продолжительность игры.
Возможность испытать новые слоты без риска: Фриспины, предоставляемые в рамках промокода, дают уникальную возможность ознакомиться с новыми и популярными играми без необходимости тратить собственные средства, тем самым повышая шансы на обнаружение новых любимых слотов.
Усиление игрового опыта через специальные предложения: Фрибеты и ваучеры для использования в различных играх казино не только расширяют спектр возможностей для развлечения, но и предоставляют дополнительные шансы на выигрыш, делая каждую игру еще более захватывающей и прибыльной.
Регистрация с Ramenbet промокодом
Процедура создания учетной записи на платформе Ramenbet с активацией промокода представляет собой интуитивно понятный и удобный процесс, который делает начало игрового пути максимально приятным и выгодным. Вот детализированный план действий:
Открыть официальный веб-сайт Ramenbet: Первый шаг заключается в посещении портала Ramenbet, где будущий пользователь сталкивается с приветливым интерфейсом и легко обнаруживает раздел регистрации.
Переход к форме регистрации: На главной странице или в меню сайта расположена кнопка регистрации, которая направит пользователя на страницу с формой для заполнения.
Заполнение формы регистрационными данными: На этом этапе требуется внести основную информацию о себе, включая имя, адрес электронной почты, пароль для будущего входа в систему, а также другие важные сведения, необходимые для создания аккаунта.
Ввод Ramenbet промокода BONUSMEN: В форме регистрации предусмотрено специальное поле для промокода, куда следует аккуратно ввести код BONUSMEN. Это действие гарантирует получение всех бонусов, предусмотренных для новых игроков, включая дополнительные средства на счет и фриспины.
Завершение процесса регистрации: После заполнения всех необходимых полей и ввода промокода пользователю остается лишь подтвердить создание учетной записи, согласившись с условиями использования и политикой конфиденциальности казино. Обычно это требует верификации через электронную почту или мобильный телефон.
По завершении этих шагов аккаунт становится активным, а игрок получает доступ к своим бонусам, активированным промокодом BONUSMEN, что позволяет немедленно начать исследование игрового мира Ramenbet с дополнительными преимуществами.
Раменбет промокод
Бонусы по Ramenbet промокоду
Активация Ramenbet промокода BONUSMEN открывает для новых участников платформы доступ к серии щедрых бонусов, каждый из которых специально разработан, чтобы усилить их начальный опыт в мире онлайн-ставок и казино. Вот более детальный обзор предложений:
лучший промокод на включает 200% увеличение депозитной суммы и до 30 фриспинов. Это означает, что первоначальный депозит утраивается, предоставляя игрокам значительно больше средств для использования в ставках и играх. Добавление до 30 фриспинов усиливает возможности для выигрыша, давая шанс испытать ещё больше игровых автоматов.
Дополнительные бонусы включают фрибет на сумму 500 и ваучер на 500 для игры в рулетку. Фрибет может быть использован в спортивных ставках, позволяя игрокам делать ставки на выбранные спортивные события без использования средств с их основного счета. Ваучер на 500 для рулетки дает дополнительные средства для использования в одной из самых популярных казино игр, увеличивая шансы на выигрыш.
Эти бонусы, активированные промокодом BONUSMEN, создают привлекательные условия для новых игроков, мотивируя их исследовать различные аспекты платформы Ramenbet и увеличивая их шансы на успешное начало игровой деятельности.
बेटवीसा ऑनलाइन कैसीनो पर स्लॉट गेम्स का आनंद
ऑनलाइन कैसीनो में स्लॉट्स सबसे पसंदीदा और मजेदार खेलों में से एक हैं। बेटवीसा ऑनलाइन कैसीनो विभिन्न प्रकार के स्लॉट गेम्स की एक विस्तृत श्रृंखला प्रदान करता है, जिनमें क्लासिक स्लॉट्स, वीडियो स्लॉट्स, और प्रोग्रेसिव जैकपॉट्स शामिल हैं।
क्लासिक स्लॉट्स:
बेटवीसा में उपलब्ध क्लासिक स्लॉट्स तीन-रील हैं और पारंपरिक लुक और फील के साथ आते हैं। ये खेल सरल हैं और नए खिलाड़ियों के लिए आदर्श हैं। खिलाड़ी अपने भाग्य का परीक्षण कर सकते हैं और सरल नियमों के साथ बड़े पैसों की जीत का सपना देख सकते हैं।
वीडियो स्लॉट्स:
बेटवीसा ऑनलाइन कैसीनो में उपलब्ध वीडियो स्लॉट्स पांच-रील हैं और आकर्षक ग्राफिक्स, एनिमेशन और थीम्स के साथ आते हैं। इनमें अक्सर बोनस राउंड और फ्री स्पिन्स जैसे फीचर्स भी होते हैं, जो खेल के अनुभव को और भी रोचक बना देते हैं।
प्रोग्रेसिव जैकपॉट्स:
इन स्लॉट्स में बड़ा जैकपॉट होता है जो प्रत्येक खिलाड़ी की शर्त के साथ बढ़ता जाता है। बेटवीसा में उपलब्ध प्रोग्रेसिव जैकपॉट स्लॉट्स में आप अपने भाग्य का परीक्षण कर सकते हैं और जीतने के मौके और भी रोमांचक हो जाते हैं।
बेटवीसा लॉगिन करके या बेटवीसा ऐप का उपयोग करके आप इन मजेदार स्लॉट गेम्स का आनंद ले सकते हैं। चाहे आप क्लासिक स्लॉट्स की सरलता पसंद करते हों या वीडियो स्लॉट्स के रोमांच का मजा लेना चाहते हों, बेटवीसा ऑनलाइन कैसीनो में आपके लिए कुछ न कुछ है।
समग्र रूप से, बेटवीसा आपको स्लॉट गेम्स का पूरा आनंद लेने का अवसर प्रदान करता है। आप अपने पसंदीदा गेम खेलकर और जैकपॉट जीतकर अविस्मरणीय ऑनलाइन कैसीनो अनुभव प्राप्त कर सकते हैं। इसलिए, बेटवीसा ऑनलाइन कैसीनो पर हाथ आजमाकर देखें और अपने खेल का स्तर ऊंचा उठाएं!
Betvisa Bet
Betvisa Bet | Catch the BPL Excitement with Betvisa!
Hunt for ₹10million! | Enter the BPL at Betvisa and chase a staggering Bounty.
Valentine’s Boost at Visa Bet! | Feel the rush of a 143% Love Mania Bonus .
predict BPL T20 outcomes | score big rewards through Betvisa login!
#betvisa
Betvisa bonus Win! | Leverage your 10 free spins to possibly win $8,888.
Share and Earn! | win ₹500 via the Betvisa app download!
https://www.betvisa-bet.com/hi
#visabet #betvisalogin #betvisaapp #betvisaIndia
Sign-Up Jackpot! | Register at Betvisa India and win ₹8,888.
Double your play! | with a ₹1,000 deposit and get ₹2,000 free at Betvisa online!
Download the Betvisa download today and don’t miss out on the action!
Бля на дворе 21 век, все уже знают что онлайн порно чат с девушками это офигительное место где можно смотреть порнушку и эро шоу.
Более подробно ознакомиться с вебкам чатом можно тут – https://ru.beautygocams.com/
Viagra sans ordonnance livraison 24h: Acheter du Viagra sans ordonnance – Viagra sans ordonnance 24h Amazon
п»їpharmacie en ligne france pharmacie en ligne sans ordonnance or Pharmacie Internationale en ligne
https://www.google.cd/url?sa=t&url=https://phenligne.com pharmacie en ligne avec ordonnance
[url=https://kyl.guru/forum/away.php?s=http://phenligne.com]Achat mГ©dicament en ligne fiable[/url] pharmacie en ligne pas cher and [url=http://www.9kuan9.com/home.php?mod=space&uid=837111]pharmacie en ligne[/url] pharmacie en ligne france pas cher
п»їpharmacie en ligne france pharmacie en ligne or trouver un mГ©dicament en pharmacie
http://www.everettpost.com/Redirect.aspx?destination=http://cenligne.com/ pharmacie en ligne
[url=https://cse.google.nr/url?sa=t&url=https://cenligne.com]vente de mГ©dicament en ligne[/url] pharmacie en ligne and [url=http://www.donggoudi.com/home.php?mod=space&uid=615935]Achat mГ©dicament en ligne fiable[/url] pharmacie en ligne sans ordonnance
acheter mГ©dicament en ligne sans ordonnance: levitra generique – pharmacie en ligne
Консультация по оптимизации продвижению.
Информация о том как работать с низкочастотными запросами и как их определять
Стратегия по деятельности в соперничающей нише.
У меня есть регулярных работаю с несколькими организациями, есть что сообщить.
Изучите мой аккаунт, на 31 мая 2024г
общий объём успешных проектов 2181 только здесь.
Консультация только устно, без снимков с экрана и отчётов.
Продолжительность консультации указано 2 часа, но по сути всегда на доступен без строгой привязки ко времени.
Как работать с софтом это уже отдельная история, консультация по работе с программами обсуждаем отдельно в специальном кворке, определяем что требуется при разговоре.
Всё без суеты на расслабленно не в спешке
To get started, the seller needs:
Мне нужны контакты от Telegram чата для контакта.
коммуникация только в устной форме, общаться письменно нету времени.
Сб и Воскресенье нерабочие дни
Ramenbet промокод при регистрации
В мире онлайн-ставок, Ramenbet промокод представляет собой великолепную возможность для новых пользователей начать свой путь с дополнительными бонусами. Этот промокод не только улучшает первоначальный опыт на платформе, но и увеличивает шансы на успех.
Ramenbet промокод
Что такое Ramenbet промокод?
Промокоды – это специальные коды, которые игроки могут использовать при регистрации или внесении депозита, чтобы получить доступ к эксклюзивным предложениям и бонусам – https://cut4you.ru/projects/pgs/?promokod_ramenbet_2024_bonus_200_230_fs.html. Ramenbet промокод BONUSMEN открывает перед игроками множество выгодных возможностей, включая увеличенные бонусы на депозиты и фриспины.
Введение такого кода в процессе создания аккаунта или пополнения счета является своего рода мостом, соединяющим пользователей с лучшими игровыми предложениями от казино. Ramenbet промокод BONUSMEN не только расширяет игровые горизонты новичков, предоставляя им дополнительные средства для ставок и бесплатные вращения в популярных слотах, но и подчеркивает стремление казино вознаградить их за выбор именно этой платформы для азартных развлечений.
Преимущества Ramenbet промокода
Использование Ramenbet промокода приносит игрокам целый ряд преимуществ:
Получение дополнительных средств для ставок: Благодаря привлекательным процентам на депозиты, игроки могут значительно увеличить свой начальный капитал, что позволяет им делать более крупные ставки и увеличивать продолжительность игры.
Возможность испытать новые слоты без риска: Фриспины, предоставляемые в рамках промокода, дают уникальную возможность ознакомиться с новыми и популярными играми без необходимости тратить собственные средства, тем самым повышая шансы на обнаружение новых любимых слотов.
Усиление игрового опыта через специальные предложения: Фрибеты и ваучеры для использования в различных играх казино не только расширяют спектр возможностей для развлечения, но и предоставляют дополнительные шансы на выигрыш, делая каждую игру еще более захватывающей и прибыльной.
Регистрация с Ramenbet промокодом
Процедура создания учетной записи на платформе Ramenbet с активацией промокода представляет собой интуитивно понятный и удобный процесс, который делает начало игрового пути максимально приятным и выгодным. Вот детализированный план действий:
Открыть официальный веб-сайт Ramenbet: Первый шаг заключается в посещении портала Ramenbet, где будущий пользователь сталкивается с приветливым интерфейсом и легко обнаруживает раздел регистрации.
Переход к форме регистрации: На главной странице или в меню сайта расположена кнопка регистрации, которая направит пользователя на страницу с формой для заполнения.
Заполнение формы регистрационными данными: На этом этапе требуется внести основную информацию о себе, включая имя, адрес электронной почты, пароль для будущего входа в систему, а также другие важные сведения, необходимые для создания аккаунта.
Ввод Ramenbet промокода BONUSMEN: В форме регистрации предусмотрено специальное поле для промокода, куда следует аккуратно ввести код BONUSMEN. Это действие гарантирует получение всех бонусов, предусмотренных для новых игроков, включая дополнительные средства на счет и фриспины.
Завершение процесса регистрации: После заполнения всех необходимых полей и ввода промокода пользователю остается лишь подтвердить создание учетной записи, согласившись с условиями использования и политикой конфиденциальности казино. Обычно это требует верификации через электронную почту или мобильный телефон.
По завершении этих шагов аккаунт становится активным, а игрок получает доступ к своим бонусам, активированным промокодом BONUSMEN, что позволяет немедленно начать исследование игрового мира Ramenbet с дополнительными преимуществами.
промокод Раменбет
Бонусы по Ramenbet промокоду
Активация Ramenbet промокода BONUSMEN открывает для новых участников платформы доступ к серии щедрых бонусов, каждый из которых специально разработан, чтобы усилить их начальный опыт в мире онлайн-ставок и казино. Вот более детальный обзор предложений:
рабочие промокоды включает 200% увеличение депозитной суммы и до 30 фриспинов. Это означает, что первоначальный депозит утраивается, предоставляя игрокам значительно больше средств для использования в ставках и играх. Добавление до 30 фриспинов усиливает возможности для выигрыша, давая шанс испытать ещё больше игровых автоматов.
Дополнительные бонусы включают фрибет на сумму 500 и ваучер на 500 для игры в рулетку. Фрибет может быть использован в спортивных ставках, позволяя игрокам делать ставки на выбранные спортивные события без использования средств с их основного счета. Ваучер на 500 для рулетки дает дополнительные средства для использования в одной из самых популярных казино игр, увеличивая шансы на выигрыш.
Эти бонусы, активированные промокодом BONUSMEN, создают привлекательные условия для новых игроков, мотивируя их исследовать различные аспекты платформы Ramenbet и увеличивая их шансы на успешное начало игровой деятельности.
Viagra homme prix en pharmacie sans ordonnance: viagra sans ordonnance – Viagra 100mg prix
Great write-up, I?¦m normal visitor of one?¦s website, maintain up the excellent operate, and It’s going to be a regular visitor for a lengthy time.
sunmory33
sunmory33
1xBet Promo Code and Betting Offers 2024
The 1XBET India Promo Code “1XBOX777” allows you to unlock an exclusive bonus of up to 66,000 INR when you sign up at the sportsbook. This offer is valid throughout the year 2024. Immerse yourself in the world of sports betting and take advantage of this incredible opportunity to boost your winnings. Join 1XBET today, enter the promo code during registration, and elevate your betting experience to new heights! 1xBet offers enticing betting offers to its users in India.
Here are the main offers available with the 1xBet promo code:
Sports Welcome Bonus: New users can receive a 100% bonus on their first deposit, up to INR 26,000, using the promo code. The bonus can be used for any sports betting market.
Lucky Friday Offer: Every Friday, 1xBet presents a 100% bonus on deposits made that day, up to INR 10,000. To take advantage of this offer, users need to deposit on Friday and enter the promo code “LuckyFriday.”
Accumulator of the Day: 1xBet selects a daily accumulator bet with high odds and offers an additional 10% bonus on potential winnings. To participate, users must place a bet on the selected accumulator, and if it wins, they receive the bonus.
These offers aim to enhance users’ betting experience on 1xBet. Remember to use the 1xbet promo code casino when making your first deposit to enjoy the sports welcome bonus as a new customer.
Year-Round Promotional Offers
Throughout the year, 1xBet India presents various promotional offers for both new and existing customers. These can include free bets, cashback, reload bonuses, and more. Some popular promotions include the Lucky Friday offer, providing up to INR 10,000 in bonus funds, and the Wednesday promotion, offering a free bet worth INR 500 for bets on specific sports events.
Furthermore, 1xBet India organizes special promotions during major sporting events like the Indian Premier League (IPL) and the Cricket World Cup. These promotions often feature enhanced odds, free bets, and other exciting perks. Keep an eye on the promotions page on the 1xBet India website or subscribe to the newsletter to stay updated on the latest offers.
Don’t miss out on the opportunity to enhance your betting experience by using the 1xBet promo code and taking advantage of these incredible offers on the platform.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://ogloszenia.bialystokonline.pl/pliki/index.php?1xbet_promo_code_420.html
bocor88
bocor88
trouver un mГ©dicament en pharmacie: Acheter Cialis 20 mg pas cher – pharmacie en ligne
Pharmacie Internationale en ligne: Levitra 20mg prix en pharmacie – pharmacie en ligne avec ordonnance
pharmacie en ligne france fiable vente de mГ©dicament en ligne or Pharmacie en ligne livraison Europe
http://images.google.ac/url?q=https://phenligne.com trouver un mГ©dicament en pharmacie
[url=https://maps.google.gr/url?q=https://phenligne.com]pharmacie en ligne[/url] pharmacie en ligne france livraison belgique and [url=https://slovakia-forex.com/members/267440-vbdrxxouwb]pharmacie en ligne fiable[/url] п»їpharmacie en ligne france
Ramenbet промокод при регистрации
В мире онлайн-ставок, Ramenbet промокод представляет собой великолепную возможность для новых пользователей начать свой путь с дополнительными бонусами. Этот промокод не только улучшает первоначальный опыт на платформе, но и увеличивает шансы на успех.
Ramenbet промокод
Что такое Ramenbet промокод?
Промокоды – это специальные коды, которые игроки могут использовать при регистрации или внесении депозита, чтобы получить доступ к эксклюзивным предложениям и бонусам – http://ds1spb.ru/contacts/pgs/?promokod_ramenbet_2024_bonus_200_230_fs.html. Ramenbet промокод BONUSMEN открывает перед игроками множество выгодных возможностей, включая увеличенные бонусы на депозиты и фриспины.
Введение такого кода в процессе создания аккаунта или пополнения счета является своего рода мостом, соединяющим пользователей с лучшими игровыми предложениями от казино. Ramenbet промокод BONUSMEN не только расширяет игровые горизонты новичков, предоставляя им дополнительные средства для ставок и бесплатные вращения в популярных слотах, но и подчеркивает стремление казино вознаградить их за выбор именно этой платформы для азартных развлечений.
Преимущества Ramenbet промокода
Использование Ramenbet промокода приносит игрокам целый ряд преимуществ:
Получение дополнительных средств для ставок: Благодаря привлекательным процентам на депозиты, игроки могут значительно увеличить свой начальный капитал, что позволяет им делать более крупные ставки и увеличивать продолжительность игры.
Возможность испытать новые слоты без риска: Фриспины, предоставляемые в рамках промокода, дают уникальную возможность ознакомиться с новыми и популярными играми без необходимости тратить собственные средства, тем самым повышая шансы на обнаружение новых любимых слотов.
Усиление игрового опыта через специальные предложения: Фрибеты и ваучеры для использования в различных играх казино не только расширяют спектр возможностей для развлечения, но и предоставляют дополнительные шансы на выигрыш, делая каждую игру еще более захватывающей и прибыльной.
Регистрация с Ramenbet промокодом
Процедура создания учетной записи на платформе Ramenbet с активацией промокода представляет собой интуитивно понятный и удобный процесс, который делает начало игрового пути максимально приятным и выгодным. Вот детализированный план действий:
Открыть официальный веб-сайт Ramenbet: Первый шаг заключается в посещении портала Ramenbet, где будущий пользователь сталкивается с приветливым интерфейсом и легко обнаруживает раздел регистрации.
Переход к форме регистрации: На главной странице или в меню сайта расположена кнопка регистрации, которая направит пользователя на страницу с формой для заполнения.
Заполнение формы регистрационными данными: На этом этапе требуется внести основную информацию о себе, включая имя, адрес электронной почты, пароль для будущего входа в систему, а также другие важные сведения, необходимые для создания аккаунта.
Ввод Ramenbet промокода BONUSMEN: В форме регистрации предусмотрено специальное поле для промокода, куда следует аккуратно ввести код BONUSMEN. Это действие гарантирует получение всех бонусов, предусмотренных для новых игроков, включая дополнительные средства на счет и фриспины.
Завершение процесса регистрации: После заполнения всех необходимых полей и ввода промокода пользователю остается лишь подтвердить создание учетной записи, согласившись с условиями использования и политикой конфиденциальности казино. Обычно это требует верификации через электронную почту или мобильный телефон.
По завершении этих шагов аккаунт становится активным, а игрок получает доступ к своим бонусам, активированным промокодом BONUSMEN, что позволяет немедленно начать исследование игрового мира Ramenbet с дополнительными преимуществами.
промокод на Ramenbet при регистрации
Бонусы по Ramenbet промокоду
Активация Ramenbet промокода BONUSMEN открывает для новых участников платформы доступ к серии щедрых бонусов, каждый из которых специально разработан, чтобы усилить их начальный опыт в мире онлайн-ставок и казино. Вот более детальный обзор предложений:
регистрация промокод включает 200% увеличение депозитной суммы и до 30 фриспинов. Это означает, что первоначальный депозит утраивается, предоставляя игрокам значительно больше средств для использования в ставках и играх. Добавление до 30 фриспинов усиливает возможности для выигрыша, давая шанс испытать ещё больше игровых автоматов.
Дополнительные бонусы включают фрибет на сумму 500 и ваучер на 500 для игры в рулетку. Фрибет может быть использован в спортивных ставках, позволяя игрокам делать ставки на выбранные спортивные события без использования средств с их основного счета. Ваучер на 500 для рулетки дает дополнительные средства для использования в одной из самых популярных казино игр, увеличивая шансы на выигрыш.
Эти бонусы, активированные промокодом BONUSMEN, создают привлекательные условия для новых игроков, мотивируя их исследовать различные аспекты платформы Ramenbet и увеличивая их шансы на успешное начало игровой деятельности.
Pharmacie sans ordonnance: Levitra acheter – pharmacie en ligne livraison europe
заказать курсовую онлайн https://kursovyebankovskoe.ru/
線上娛樂城的世界
隨著網際網路的迅速發展,線上娛樂城(在線賭場)已經成為許多人休閒的新選擇。線上娛樂城不僅提供多樣化的游戲選擇,還能讓玩家在家中就能體驗到賭場的刺激和快感。本文將討論在線娛樂城的特點、好處以及一些常有的游戲。
什麼網上娛樂城?
在線娛樂城是一種透過互聯網提供賭錢游戲的平台。玩家可以通過計算機、智慧型手機或平板進入這些網站,參與各種博彩活動,如德州撲克、輪盤賭、黑傑克和老虎機等。這些平台通常由專業的軟體公司開發,確保游戲的公平性和安全性。
在線娛樂城的優勢
便利性:玩家不用離開家,就能體驗賭博的樂趣。這對於那些生活在遠離的實體賭場區域的人來說特別方便。
多種的游戲選擇:線上娛樂城通常提供比實體賭場更豐富的游戲選擇,並且經常更新游戲內容,保持新鮮感。
福利和獎金:許多網上娛樂城提供多樣的獎勵計劃,包括註冊獎金、存款獎勵和忠誠度計劃,吸引新新玩家並鼓勵老玩家繼續遊戲。
安全和保密性:正規的網上娛樂城使用高端的加密方法來保護玩家的個人信息和金融交易,確保游戲過程的穩定和公平。
常見的的網上娛樂城游戲
撲克:德州撲克是最受歡迎賭錢游戲之一。線上娛樂城提供各種撲克變體,如德州扑克、奧馬哈和七張牌等。
賭盤:輪盤是一種經典的賭博遊戲,玩家可以下注在數字、數字組合上或顏色上上,然後看小球落在哪個位置。
二十一點:又稱為黑傑克,這是一種比拼玩家和莊家點數的遊戲,目標是讓手牌點數點數盡量接近21點但不超過。
老虎机:老虎机是最容易且是最流行的賭博遊戲之一,玩家只需轉捲軸,看圖案排列出中獎的組合。
結尾
在線娛樂城為當代賭博愛好者提供了一個便捷、刺激的且多樣化的娛樂選擇。不論是撲克牌愛好者還是老虎机愛好者,大家都能在這些平台上找到適合自己的游戲。同時,隨著科技的不斷提升,網上娛樂城的遊戲體驗將變得越來越越來越逼真和引人入勝。然而,玩家在體驗遊戲的同時,也應該保持自律,避免沉溺於賭博活動,保持健康健康的娛樂心態。
在線娛樂城的天地
隨著互聯網的迅速發展,在線娛樂城(網上賭場)已經成為許多人消遣的新選擇。線上娛樂城不僅提供多元化的遊戲選擇,還能讓玩家在家中就能體驗到賭場的樂趣和樂趣。本文將討論線上娛樂城的特徵、利益以及一些常見的游戲。
什麼叫在線娛樂城?
線上娛樂城是一種透過互聯網提供博彩遊戲的平台。玩家可以通過計算機、智慧型手機或平板電腦進入這些網站,參與各種賭博活動,如撲克、輪盤、21點和老虎机等。這些平台通常由專業的的軟件公司開發,確保遊戲的公正性和安全性。
線上娛樂城的優勢
便利性:玩家無需離開家,就能體驗賭博的快感。這對於那些住在在遠離實體賭場區域的人來說尤為方便。
多樣化的游戲選擇:網上娛樂城通常提供比實體賭場更豐富的遊戲選擇,並且經常升級遊戲內容,保持新鮮感。
好處和獎勵計劃:許多在線娛樂城提供多樣的獎勵計劃,包括註冊獎金、存款獎金和忠誠度計劃,引誘新玩家並促使老玩家繼續遊戲。
安全和保密性:正當的線上娛樂城使用高端的加密來保護玩家的個人資料和交易,確保遊戲過程的安全和公正。
常有的在線娛樂城游戲
撲克:撲克牌是最受歡迎的博彩游戲之一。線上娛樂城提供多樣德州撲克變體,如德州扑克、奧馬哈撲克和七張牌等。
賭盤:賭盤是一種古老的賭場遊戲,玩家可以下注在單個數字、數字組合或顏色選擇上,然後看轉球落在哪個區域。
二十一點:又稱為黑傑克,這是一種比拼玩家和莊家點數的遊戲,目標是讓手牌點數儘量接近21點但不超過。
老虎机:老虎机是最容易也是最流行的博彩游戲之一,玩家只需轉動捲軸,等待圖案圖案排列出獲勝的組合。
結論
在線娛樂城為現代的賭博愛好者提供了一個便捷、興奮且豐富的娛樂選擇。不管是撲克愛好者還是老虎機迷,大家都能在這些平台上找到適合自己的遊戲。同時,隨著技術的的不斷發展,線上娛樂城的遊戲體驗將變得越來越越來越真實和引人入勝。然而,玩家在享受遊戲的同時,也應該自律,避免沉溺於賭錢活動,保持健康的娛樂心態。
Promo code for 1xBet India: 1XBOX777 in 2024. Join 1xBet and register an account to avail yourself of a special welcome bonus of up to ?10400 (or its equivalent in another currency, $130), which surpasses the regular bonus limit of $100. If you are a resident of India, you will be pleased to know that the 1xbet singapore is accessible to Indian players, enabling them to enjoy a wide variety of sports games. Additionally, players can utilize the promo code to take advantage of an exclusive offer. These extra funds can be utilized for betting on your preferred sports categories. Furthermore, on the 1xBet India website, players can now use Indian currency for placing bets, eliminating concerns about exchange rates.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://www.u-ma.co.jp/pag/?code_promo_1.html
Консультация по стратегии продвижения сайтов продвижению.
Информация о том как управлять с низкочастотными запросами запросами и как их подбирать
Подход по действиям в конкурентоспособной нише.
У меня есть регулярных взаимодействую с 3 организациями, есть что рассказать.
Посмотрите мой профиль, на 31 мая 2024г
число выполненных работ 2181 только в этом профиле.
Консультация проходит в устной форме, никаких скриншотов и документов.
Длительность консультации указано 2 часа, и факту всегда на доступен без строгой привязки к графику.
Как взаимодействовать с софтом это уже отдельная история, консультация по использованию ПО обсуждаем отдельно в другом кворке, выясняем что необходимо при коммуникации.
Всё без суеты на расслабленно не спеша
To get started, the seller needs:
Мне нужны контакты от телеграм канала для связи.
разговор только вербально, общаться письменно нету времени.
Суббота и воскресенья выходные
뉴스 마약
빠른 입출금 서비스와 더불어 대형업체의 안전성
토토사이트 사용 시 가장 중요한 요소는 빠릿한 입출금 절차입니다. 일반적으로 세 분 이내에 충전, 십 분 내에 환충이 완수되어야 합니다. 메이저 대형업체들은 넉넉한 스태프 채용으로 이와 같은 빠른 입출금 프로세스를 보증하며, 이로써 고객들에게 안도감을 드립니다. 대형사이트를 사용하면서 스피드 있는 체감을 즐겨보세요. 우리 여러분들이 보안성 있게 토토사이트를 사용할 수 있도록 지원하는 먹튀해결사입니다.
보증금을 내고 배너를 운영
먹튀 해결 전문가는 적어도 삼천만 원에서 1억 원의 보증 금액을 예탁한 업체들의 배너 광고를 운영 중입니다. 만일 먹튀 문제가 발생할 시, 베팅 규정에 어긋나지 않은 배팅 내역을 스크린샷을 찍어 먹튀 해결 전문가에게 연락 주시면, 확인 후 보증 자금으로 즉시 피해 보상을 처리합니다. 피해 발생 시 즉시 캡처해서 손해 내용을 저장해두시고 제출해 주세요.
오랫동안 안전하게 운영된 업체 확인
먹튀 해결 전문가는 적어도 4년 이상 먹튀 이력 없이 안전하게 운영하고 있는 사이트만을 검증하여 배너 입점을 허용합니다. 이로 인해 누구나 잘 알려진 주요사이트를 안심하고 접속할 수 있는 기회를 제공합니다. 엄격한 검사 작업을 통해 인증된 사이트를 놓치지 마시고, 보안된 배팅을 체험해보세요.
투명하고 공정한 먹튀 검토
먹튀 해결 전문가의 먹튀 확인은 투명성과 공평성을 기반으로 합니다. 언제나 이용자들의 의견을 우선시하며, 업체의 이익이나 이익에 흔들리지 않고 한 건의 삭제 없이 진실만을 기반으로 검토해왔습니다. 먹튀 문제를 당하고 후회하지 않도록, 지금 시작해보세요.
먹튀검증사이트 목록
먹튀 해결 전문가가 선별한 안전한 토토사이트 검증업체 목록 입니다. 현재 등록되어 있는 인증된 업체들은 먹튀 문제가 발생 시 100% 보장을 도와드립니다. 그러나, 제휴 기간이 만료된 업체에서 발생한 피해에 대해서는 책임이 없습니다.
탁월한 먹튀 검증 알고리즘
먹튀 해결 전문가는 공정한 베팅 환경을 형성하기 위해 항상 노력합니다. 우리가 권장하는 스포츠토토사이트에서 안전하게 베팅하시기 바랍니다. 회원님의 먹튀 제보는 먹튀 목록에 등록되어 그 해당 스포츠토토 사이트에 심각한 영향을 미칩니다. 먹튀 리스트를 작성할 때 먹튀블러드만의 검증 지식을 최대한 활용하여 정확한 검증을 할 수 있도록 하겠습니다.
안전한 베팅 환경을 제공하기 위해 끊임없이 애쓰는 먹튀 해결 팀과 동반하여 안전하게 즐기시기 바랍니다.
Excellent web site. Plenty of useful information here. I am sending it to several buddies ans additionally sharing in delicious. And naturally, thanks on your effort!
1xBet Bonus Package for Indian Casino Customers
Experience the ultimate excitement of online casino gaming with the exclusive Casino Welcome Offer at 1xBet India 2024. Get ready for an immersive and thrilling journey filled with a wide variety of live dealer games and a vast selection of captivating slots. Unlock this amazing offer by using the 1xBet promo code and take your casino adventure to new heights.
1xBet casino promo code: 1XBOX777, bonus 100% up to $1950 and 150 free spins at the casino. Gain access to an exceptional casino welcome package worth ?130,000. This bonus can be claimed across four separate deposits, allowing you to maximize your rewards and extend your gaming sessions. Prepare to be enthralled by the exhilarating gameplay, stunning graphics, and immersive sound effects that will transport you to the heart of the casino action.
Whether you’re a fan of classic table games or prefer the excitement of spinning the reels on slots, 1xBet has you covered. Explore an extensive collection of live dealer games, where you can interact with professional dealers in real-time for an authentic casino experience. Additionally, the slots section boasts a diverse range of games, ensuring there’s something to suit every preference and style.
Attention all casino enthusiasts! You definitely don’t want to miss out on this incredible opportunity to elevate your casino journey. By using the exclusive 1xbet promotion code: 1XBOX777, you can unlock a remarkable ?169,000 welcome package along with 150 free spins for the year 2024. Immerse yourself in the excitement of the casino, make the most of the bonuses, and embark on a gaming adventure like no other at 1xBet India.
For our valued Indian customers who have a keen interest in the casino section, 1xBet presents an enticing alternative welcome package. This package is designed to enhance your gaming experience across your first four deposits, allowing you to receive a whopping ?169,000 in addition to 150 free spins.
Here’s how the bonus package is divided:
1st deposit: 100% matched bonus + 30 free spins on Reliquary of Ra
2nd deposit: 50% matched bonus + 35 free spins on Chieftain Buffalo
3rd deposit: 25% matched bonus + 40 free spins on Stampede Buffalo
4th deposit: 25% matched bonus + 45 free spins on Rich of the Mermaid Hold and Spin
Embrace the Excitement at 1xBet
With these enticing promo codes and bonus offers, 1xBet ensures that new customers can kickstart their betting journey with a thrilling advantage. Whether you prefer sports betting or exploring the casino games, 1xBet has something for everyone. Don’t miss out on the opportunity to elevate your gaming experience—join 1xBet today and unlock a world of excitement.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://arenafan.com/ads/list/?1xbet_promo_code_ghana_is_144___for_registration.html
designer shoes are of course very expensive but i like their style,
методы продвижения сайта
Советы по сео продвижению.
Информация о том как работать с низкочастотными запросами ключевыми словами и как их подбирать
Стратегия по действиям в конкурентоспособной нише.
У меня есть регулярных взаимодействую с тремя организациями, есть что рассказать.
Изучите мой аккаунт, на 31 мая 2024г
общий объём завершённых задач 2181 только в этом профиле.
Консультация проходит в устной форме, никаких скринов и документов.
Время консультации указано 2 ч, но по сути всегда на доступен без строгой привязки ко времени.
Как управлять с ПО это уже отдельная история, консультация по использованию ПО обсуждаем отдельно в отдельном услуге, узнаем что нужно при коммуникации.
Всё спокойно на расслабленно не спеша
To get started, the seller needs:
Мне нужны контакты от Telegram чата для коммуникации.
разговор только вербально, переписываться не хватает времени.
субботы и Воскресенье выходной
Больше интересной информации о строительстве и ремонте можно прочитать на сайте https://stroyka-gid.ru. Только самые популярные статьи и обзоры процесса ремонта помещений и строительства зданий.
some hair straighteners that use chemicals are very harsh to the hair, that is why you should be careful with those.,
Keep up the good piece of work, I read few content on this website and I believe that your web site is rattling interesting and holds lots of superb information.
porn
porn
porn
cheapest smm panel cheapest smm panel
Hi, simply found your own weblog via Search engines, and located so that it’s genuinely educational. I am gonna stay attuned to this tool. Cheers!
Thank you for yet another great informative post, I’m a loyal visitor to this blog and I can’t tell you how much valuable information I’ve learned from reading your content. I really appreciate all the hard work you put into this great blog.
Spot lets start work on this write-up, I honestly feel this web site needs a great deal more consideration. I’ll more likely once more to study additional, thank you for that information.
music marketing agencies music promotion services
1xbt promo code: 1XBOX777 – enjoy a special welcome offer of 100% up to €/$130. This exclusive bonus code grants you an enhanced bonus when used during registration at 1xBet casino, with a bonus of up to €1500 and 150 free spins.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://www.meyermachine.com/wp-content/pgs/1xbet_promo_code____388.html
paito hk
Motivasi dari Kutipan Taylor Swift: Harapan dan Kasih dalam Lagu-Lagunya
Taylor Swift, seorang artis dan komposer terkemuka, tidak hanya dikenal oleh karena melodi yang indah dan suara yang merdu, tetapi juga karena syair-syair lagunya yang bermakna. Pada lirik-liriknya, Swift sering melukiskan beraneka ragam aspek eksistensi, dimulai dari cinta sampai tantangan hidup. Di bawah ini adalah beberapa petikan inspiratif dari lagu-lagu, beserta maknanya.
“Mungkin yang terhebat belum hadir.” – “All Too Well”
Penjelasan: Bahkan di masa-masa sulit, tetap ada secercah harapan dan kemungkinan untuk masa depan yang lebih baik.
Lirik ini dari lagu “All Too Well” mengingatkan kita bahwa biarpun kita bisa jadi menghadapi masa-masa sulit pada saat ini, tetap ada kemungkinan jika masa depan akan membawa sesuatu yang lebih baik. Hal ini adalah amanat pengharapan yang menguatkan, mendorong kita untuk tetap bertahan dan tidak putus asa, karena yang terhebat mungkin belum tiba.
“Aku akan terus bertahan lantaran aku tidak bisa mengerjakan apapun tanpamu.” – “You Belong with Me”
Arti: Menemukan asmara dan dukungan dari orang lain dapat memberi kita daya dan tekad untuk bertahan melalui kesulitan.
madetoto
Ashley JKT48: Bintang yang Bersinar Terang di Langit Idol
Siapakah Ashley JKT48?
Siapa tokoh muda berbakat yang menarik perhatian banyak penyuka musik di Indonesia dan Asia Tenggara? Itulah Ashley Courtney Shintia, atau yang dikenal dengan nama bekennya, Ashley JKT48. Bergabung dengan grup idol JKT48 pada tahun 2018, Ashley dengan cepat menjadi salah satu anggota paling terkenal.
Profil
Dilahirkan di Jakarta pada tanggal 13 Maret 2000, Ashley memiliki keturunan Tionghoa-Indonesia. Ia mengawali kariernya di bidang entertainment sebagai peraga dan aktris, sebelum selanjutnya bergabung dengan JKT48. Personanya yang periang, suara yang kuat, dan keterampilan menari yang mengagumkan membuatnya idola yang sangat dicintai.
Penghargaan dan Pengakuan
Popularitas Ashley telah diakui melalui aneka award dan nominasi. Pada tahun 2021, beliau memenangkan award “Member Terpopuler JKT48” di ajang Penghargaan Musik JKT48. Ashley juga dinobatkan sebagai “Idol Terindah di Asia” oleh sebuah majalah daring pada tahun 2020.
Posisi dalam JKT48
Ashley memainkan posisi penting dalam grup JKT48. Beliau adalah member Tim KIII dan berfungsi sebagai penari utama dan vokal utama. Ashley juga terlibat sebagai bagian dari sub-unit “J3K” bersama Jessica Veranda dan Jennifer Rachel Natasya.
Perjalanan Mandiri
Selain kegiatan bersama JKT48, Ashley juga merintis perjalanan solo. Ashley telah mengeluarkan beberapa single, diantaranya “Myself” (2021) dan “Falling Down” (2022). Ashley juga telah berkolaborasi bareng musisi lain, seperti Afgan dan Rossa.
Hidup Pribadi
Di luar bidang pertunjukan, Ashley dikenal sebagai sebagai orang yang rendah hati dan friendly. Beliau suka menghabiskan waktu bareng keluarga dan kawan-kawannya. Ashley juga memiliki hobi menggambar dan fotografi.
Проверка кошелька криптовалюты
Контроль криптовалюты на сети TRC20 и различных цифровых переводов
На данном сайте вы сможете детальные описания разнообразных сервисов для анализа операций и кошельков, охватывая AML анализы для USDT и различных криптовалют. Вот главные опции, которые в наших описаниях:
Анализ монет TRC20
Некоторые сервисы обеспечивают полную верификацию операций криптовалюты в блокчейн-сети TRC20 сети. Это позволяет обнаруживать сомнительную активность и удовлетворять нормативным правилам.
Контроль платежей монет
В подробных ревью представлены платформы для комплексного проверки и контроля транзакций криптовалюты, что гарантирует сохранять ясность и надежность транзакций.
антиотмывочного закона анализ криптовалюты
Некоторые платформы поддерживают антиотмывочного закона анализ криптовалюты, обеспечивая выявлять и предотвращать случаи неправомерных действий и денежных незаконных действий.
Проверка аккаунта токенов
Наши описания содержат инструменты, позволяющие позволяют контролировать кошельки USDT на предмет блокировок и подозреваемых активностей, гарантируя повышенный уровень защиты.
Верификация операций криптовалюты на сети TRC20
Вы найдете доступны ресурсы, обеспечивающие верификацию переводов USDT в сети TRC20 блокчейна, что соответствие соблюдение всем стандартам стандартам правилам.
Анализ адреса кошелька USDT
В оценках описаны платформы для проверки адресов счетов монет на потенциальных опасностей угроз.
Анализ счета монет TRC20
Наши обзоры представляют ресурсы, предоставляющие проверку счетов монет на платформе TRC20 блокчейна, что помогает предотвратить мошенничество и финансовых нарушений.
Контроль токенов на чистоту
Описанные инструменты позволяют верифицировать переводы и аккаунты на легитимность, обнаруживая подозрительную операции.
антиотмывочная контроль USDT на платформе TRC20
В описаниях вы найдете сервисы, поддерживающие антиотмывочного закона контроль для монет в сети TRC20 платформы, что позволяет вашему бизнесу соблюдать глобальным стандартам.
Контроль токенов ERC20
Наши оценки включают сервисы, предлагающие анализ криптовалюты в сети ERC20 сети, что обеспечивает проведение детальный анализ операций и адресов.
Проверка криптовалютного кошелька
Мы изучаем ресурсы, предлагающие опции по проверке криптовалютных кошельков, включая наблюдение транзакций и определение необычной деятельности.
Контроль кошелька виртуального кошелька
Наши ревью представляют инструменты, предназначенные для анализировать аккаунты криптовалютных кошельков для поддержания повышенной надежности.
Проверка цифрового кошелька на переводы
В наших обзорах описаны платформы для проверки виртуальных кошельков на платежи, что помогает помогает сохранять прозрачность переводов.
Проверка виртуального кошелька на отсутствие подозрительных действий
Наши обзоры содержат инструменты, обеспечивающие контролировать виртуальные кошельки на чистоту, фиксируя все подозреваемые активности.
Изучая подробные описания, вы сможете подберете оптимальные платформы для анализа и наблюдения виртуальных операций, для поддерживать надежный степень безопасности безопасности и соответствовать необходимым регуляторным требованиям.
My wife and i got quite delighted that Peter could complete his homework through your precious recommendations he acquired through the weblog. It is now and again perplexing to simply find yourself giving freely tips and hints a number of people might have been making money from. And now we do know we have the website owner to give thanks to for that. Those illustrations you made, the easy blog navigation, the relationships you can aid to create – it’s all spectacular, and it is letting our son and us imagine that that theme is thrilling, and that is extremely serious. Thanks for all!
How to Use the 1xBet Promo Code?
1xbet: 1XBOX777, Get a 100% VIP sports bonus up to €/$130, plus a welcome bonus of $1950 and 150 free spins at the casino. This offer is available in your local currency and is perfect for sports betting and gambling fans. Enjoy a complimentary bet on 1xBet with no extra fees.
To avail the welcome bonus and other offers on 1xBet India, use promo code during registration. Follow these steps:
1. Visit 1xBet India website and click the green button.
2. Choose your registration option (email, one-click, phone, or social media).
3. Fill in all required fields with your information.
4. Create a strong password.
5. Enter the promo code during registration for Sports or Casino.
6. Failure to enter the promo code may result in missing out on exclusive bonuses.
Take advantage of this amazing chance to elevate your betting experience at 1xBet using the exclusive promo code. Register now and embark on a thrilling adventure packed with exhilarating sports betting and captivating casino games. Always remember to gamble responsibly and indulge in the top-notch entertainment offered by 1xBet.
1XBET offers a welcome bonus of 26,000 INR to its bettors in India. This bonus will be credited to your account after your first deposit, and it cannot exceed the amount of 26,000 INR. However, if you use a promo code during registration, your one-time deposit bonus can increase to 49,000 INR.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://ogloszenia.bialystokonline.pl/pliki/index.php?1xbet_promo_code_420.html
Spot on with this write-up, I truly assume this web site wants much more consideration. probably be again to learn rather more, thanks for that info.
An interesting discussion is worth comment. I believe that you should write on this topic, it might not often be a taboo subject but normally folks are insufficient to communicate in on such topics. To another location. Cheers
такси город заказ такси недорого
hello!,I like your writing so a lot! proportion we keep in touch more approximately your article on AOL? I require a specialist in this space to unravel my problem. May be that’s you! Looking ahead to peer you.
Your home is valueble for me. Thanks!? This site can be a walk-through for the entire info you wished about this and didn know who to ask. Glimpse right here, and you l undoubtedly discover it.
Digital Gambling Sites: Innovation and Advantages for Contemporary Society
Introduction
Online gambling platforms are virtual platforms that offer users the opportunity to engage in betting games such as poker, roulette, blackjack, and slot machines. Over the past few years, they have turned into an essential component of online entertainment, offering numerous benefits and opportunities for players globally.
Accessibility and Convenience
One of the primary benefits of online gambling sites is their accessibility. Users can play their preferred activities from anywhere in the world using a PC, iPad, or smartphone. This conserves time and money that would otherwise be used going to traditional casinos. Additionally, 24/7 availability to games makes internet gambling sites a easy choice for individuals with busy schedules.
Range of Games and Entertainment
Digital casinos provide a wide range of games, allowing everyone to find something they enjoy. From classic card games and board games to slots with diverse concepts and increasing jackpots, the diversity of activities guarantees there is an option for every taste. The option to engage at various proficiencies also makes online casinos an perfect location for both novices and seasoned players.
Economic Benefits
The digital casino sector contributes greatly to the economy by generating jobs and producing revenue. It backs a diverse range of professions, including software developers, client assistance representatives, and advertising professionals. The revenue produced by digital casinos also adds to government funds, which can be allocated to support public services and infrastructure initiatives.
Advancements in Technology
Digital casinos are at the forefront of tech innovation, continuously integrating new innovations to improve the gaming entertainment. High-quality visuals, live dealer games, and VR casinos provide engaging and realistic playing entertainment. These advancements not only improve player experience but also push the limits of what is achievable in online entertainment.
Responsible Gambling and Assistance
Many online gambling sites encourage safe betting by providing resources and assistance to help players control their betting activities. Options such as deposit limits, self-ban choices, and access to support services ensure that players can enjoy gaming in a secure and monitored setting. These measures show the industry’s commitment to encouraging healthy betting practices.
Community Engagement and Community
Online casinos often offer interactive options that enable users to connect with each other, forming a feeling of community. Group activities, chat functions, and social media integration allow players to network, share stories, and form friendships. This social aspect improves the entire gaming experience and can be particularly helpful for those looking for community engagement.
Summary
Digital gambling sites provide a diverse range of benefits, from accessibility and convenience to economic contributions and technological advancements. They offer diverse gaming choices, encourage responsible gambling, and promote community engagement. As the sector continues to grow, online casinos will likely stay a major and positive force in the world of digital leisure.
Free Slot Games: Pleasure and Perks for All
Free slot games have become a in-demand form of online entertainment, offering players the rush of slot machines without any financial stake.
The chief purpose of free slot games is to provide a fun and engaging way for people to experience the thrill of slot machines absent any economic liability. They are designed to mimic the sensation of for-profit slots, giving players to trigger the reels, relish various concepts, and receive electronic prizes.
Pleasure: Gratis slot games are an fantastic avenue of fun, granting spans of fun. They display lively illustrations, immersive soundtracks, and varied concepts that serve a broad selection of inclinations.
Proficiency Improvement: For inexperienced, free slot games present a risk-free environment to learn the operations of slot machines. Players can become familiar with multiple options, winning combinations, and extras free from the apprehension of relinquishing cash.
Unwinding: Playing no-cost slot games can be a excellent way to unwind. The simple gameplay and the possibility for electronic rewards make it an fulfilling activity.
Shared Experiences: Many complimentary slot games integrate collaborative functions such as leaderboards and the opportunity to connect with peers. These aspects bring a social facet to the gaming experience, motivating players to measure up against one another.
Rewards of Free Slot Games
1. Accessibility and Ease
Gratis slot games are effortlessly accessible to anyone with an web connection. They can be accessed on various platforms including PCs, tablets, and cellphones. This simplicity permits players to experience their most liked pursuits regardless of time and from any place.
2. Monetary Innocuousness
One of the principal perks of no-cost slot games is that they eliminate the monetary risks associated with betting. Players can relish the thrill of spinning the reels and receiving big wins devoid of spending any funds.
3. Diversity of Options
No-Cost slot games come in a extensive selection of themes and styles, from traditional fruit-based slots to contemporary video slots with sophisticated narratives and imagery. This range ensures that there is an alternative for anyone, irrespective of their inclinations.
4. Improving Mental Capabilities
Playing free slot games can lead to improve thinking abilities such as anticipatory planning. The need to pursue win lines, comprehend functional concepts, and predict results can offer a cognitive challenge that is equally satisfying and advantageous.
5. Safe Testing Ground for Paid-Participation
For those contemplating shifting to paid slots, gratis slot games provide a beneficial testing ground. Players can experiment with diverse games, develop approaches, and build self-belief ahead of opting to invest actual cash. This readiness can result in a more knowledgeable and satisfying real-money gaming encounter.
Key Takeaways
Gratis slot games grant a multitude of rewards, from unadulterated entertainment to proficiency improvement and community engagement. They grant a risk-free and free-of-charge way to enjoy the suspense of slot machines, constituting them a worthwhile complement to the landscape of virtual entertainment. Whether you’re seeking to de-stress, improve your intellectual faculties, or simply have fun, complimentary slot games are a fantastic alternative that steadfastly delight players worldwide.
Ramenbet промокод при регистрации
В мире онлайн-ставок, Ramenbet промокод представляет собой великолепную возможность для новых пользователей начать свой путь с дополнительными бонусами. Этот промокод не только улучшает первоначальный опыт на платформе, но и увеличивает шансы на успех.
Ramenbet промокод
Что такое Ramenbet промокод?
Промокоды – это специальные коды, которые игроки могут использовать при регистрации или внесении депозита, чтобы получить доступ к эксклюзивным предложениям и бонусам – https://rolmax.ru/wp-includes/pages/?promokod_ramenbet_2024_bonus_200_230_fs.html. Ramenbet промокод BONUSMEN открывает перед игроками множество выгодных возможностей, включая увеличенные бонусы на депозиты и фриспины.
Введение такого кода в процессе создания аккаунта или пополнения счета является своего рода мостом, соединяющим пользователей с лучшими игровыми предложениями от казино. Ramenbet промокод BONUSMEN не только расширяет игровые горизонты новичков, предоставляя им дополнительные средства для ставок и бесплатные вращения в популярных слотах, но и подчеркивает стремление казино вознаградить их за выбор именно этой платформы для азартных развлечений.
Преимущества Ramenbet промокода
Использование Ramenbet промокода приносит игрокам целый ряд преимуществ:
Получение дополнительных средств для ставок: Благодаря привлекательным процентам на депозиты, игроки могут значительно увеличить свой начальный капитал, что позволяет им делать более крупные ставки и увеличивать продолжительность игры.
Возможность испытать новые слоты без риска: Фриспины, предоставляемые в рамках промокода, дают уникальную возможность ознакомиться с новыми и популярными играми без необходимости тратить собственные средства, тем самым повышая шансы на обнаружение новых любимых слотов.
Усиление игрового опыта через специальные предложения: Фрибеты и ваучеры для использования в различных играх казино не только расширяют спектр возможностей для развлечения, но и предоставляют дополнительные шансы на выигрыш, делая каждую игру еще более захватывающей и прибыльной.
Регистрация с Ramenbet промокодом
Процедура создания учетной записи на платформе Ramenbet с активацией промокода представляет собой интуитивно понятный и удобный процесс, который делает начало игрового пути максимально приятным и выгодным. Вот детализированный план действий:
Открыть официальный веб-сайт Ramenbet: Первый шаг заключается в посещении портала Ramenbet, где будущий пользователь сталкивается с приветливым интерфейсом и легко обнаруживает раздел регистрации.
Переход к форме регистрации: На главной странице или в меню сайта расположена кнопка регистрации, которая направит пользователя на страницу с формой для заполнения.
Заполнение формы регистрационными данными: На этом этапе требуется внести основную информацию о себе, включая имя, адрес электронной почты, пароль для будущего входа в систему, а также другие важные сведения, необходимые для создания аккаунта.
Ввод Ramenbet промокода BONUSMEN: В форме регистрации предусмотрено специальное поле для промокода, куда следует аккуратно ввести код BONUSMEN. Это действие гарантирует получение всех бонусов, предусмотренных для новых игроков, включая дополнительные средства на счет и фриспины.
Завершение процесса регистрации: После заполнения всех необходимых полей и ввода промокода пользователю остается лишь подтвердить создание учетной записи, согласившись с условиями использования и политикой конфиденциальности казино. Обычно это требует верификации через электронную почту или мобильный телефон.
По завершении этих шагов аккаунт становится активным, а игрок получает доступ к своим бонусам, активированным промокодом BONUSMEN, что позволяет немедленно начать исследование игрового мира Ramenbet с дополнительными преимуществами.
промокод на Ramenbet
Бонусы по Ramenbet промокоду
Активация Ramenbet промокода BONUSMEN открывает для новых участников платформы доступ к серии щедрых бонусов, каждый из которых специально разработан, чтобы усилить их начальный опыт в мире онлайн-ставок и казино. Вот более детальный обзор предложений:
промокоды на пополнение включает 200% увеличение депозитной суммы и до 30 фриспинов. Это означает, что первоначальный депозит утраивается, предоставляя игрокам значительно больше средств для использования в ставках и играх. Добавление до 30 фриспинов усиливает возможности для выигрыша, давая шанс испытать ещё больше игровых автоматов.
Дополнительные бонусы включают фрибет на сумму 500 и ваучер на 500 для игры в рулетку. Фрибет может быть использован в спортивных ставках, позволяя игрокам делать ставки на выбранные спортивные события без использования средств с их основного счета. Ваучер на 500 для рулетки дает дополнительные средства для использования в одной из самых популярных казино игр, увеличивая шансы на выигрыш.
Эти бонусы, активированные промокодом BONUSMEN, создают привлекательные условия для новых игроков, мотивируя их исследовать различные аспекты платформы Ramenbet и увеличивая их шансы на успешное начало игровой деятельности.
Hey! QuiteRather insightful post you have there. This actually assisted us a tremendous amount!
online casino real money
Online Casino For-Profit: Rewards for Players
Preface
Online gaming sites granting paid games have gained significant widespread adoption, delivering customers with the prospect to win financial prizes while savoring their favorite wagering experiences from home. This text explores the upsides of virtual wagering environment real money offerings, highlighting their positive effect on the gaming domain.
Ease of Access and Reachability
Online casino real money games present user-friendliness by enabling players to reach a comprehensive selection of experiences from any location with an network connection. This removes the obligation to travel to a physical gaming venue, saving time. Online casinos are likewise accessible at all times, allowing players to partake in at their convenience.
Breadth of Offerings
Virtual wagering environments grant a more extensive diversity of offerings than physical casinos, incorporating slot-related offerings, blackjack, ball-and-number game, and casino-style games. This variety enables participants to investigate unfamiliar activities and discover new favorites, bolstering their holistic gaming sensation.
Incentives and Special Offers
Online casinos grant considerable rewards and discounts to draw in and hold onto users. These rewards can incorporate welcome incentives, complimentary rounds, and rebate promotions, offering extra value for users. Loyalty initiatives in addition compensate players for their uninterrupted support.
Capability Building
Interacting with for-profit offerings online can assist users refine abilities such as critical analysis. Games like vingt-et-un and table games demand customers to make determinations that can influence the end of the experience, facilitating them acquire problem-solving skills.
Interpersonal Connections
ChatGPT l Валли, [06.06.2024 4:08]
Virtual wagering environments deliver avenues for communal interaction through discussion forums, interactive platforms, and real-time croupier activities. Players can engage with fellow users, share recommendations and approaches, and sometimes establish friendships.
Economic Benefits
The virtual wagering domain generates opportunities and provides for the fiscal landscape through budgetary incomes and authorization charges. This fiscal consequence advantages a broad selection of professions, from game creators to client aid agents.
Summary
Online casino actual currency experiences present numerous upsides for customers, incorporating ease, range, incentives, competency enhancement, interpersonal connections, and financial advantages. As the industry persistently transform, the widespread adoption of virtual wagering environments is anticipated to rise.
заказать такси по телефону недорого https://zakaz-taxionline.ru
Luck Gaming Site: Where Pleasure Combines With Prosperity
Prosperity Gambling Platform is a well-liked online destination identified for its extensive variety of games and thrilling bonuses. Let’s investigate the motivations behind so many people savor playing at Prosperity Casino and in what way it upsides them.
Entertainment Value
Prosperity Wagering Environment offers a diversity of experiences, involving traditional casino games like blackjack and wheel of fortune, as together with cutting-edge slot-based activities. This breadth guarantees that there is something for everyone, rendering every experience to Fortune Gaming Site pleasurable and fun.
Large Prizes
One of the principal draws of Wealth Casino is the chance to win big. With considerable jackpots and benefits, participants have the chance to turn their luck around with a individual round or hand. Many players have obtained significant prizes, augmenting the thrill of engaging with Luck Casino.
Ease of Access and Reachability
Fortune Gambling Platform’s digital system makes it accessible for players to savor their most preferred activities from anywhere. Regardless of whether at residence or in transit, participants can access Wealth Wagering Environment from their desktop or smartphone. This availability ensures that participants can enjoy the suspense of the gaming regardless of when they desire, absent the requirement to commute.
Breadth of Offerings
Prosperity Casino provides a wide choice of offerings, securing that there is something for every form of participant. From classic casino games to story-based slot-related offerings, the breadth retains players engaged and amused. This choice as well gives users to investigate unfamiliar experiences and identify new most cherished.
Incentives and Special Offers
Luck Gambling Platform rewards its users with bonuses and advantages, including introductory promotional benefits and reward schemes. These special offers not only bolster the leisure interaction but also raise the likelihoods of winning big. Users are steadfastly incentivized to maintain participation, making Wealth Gambling Platform even more appealing.
Group-Based Participation and Collaboration
ChatGPT l Валли, [06.06.2024 4:30]
Wealth Gambling Platform provides a sense of collective engagement and group-based participation for customers. Through discussion forums and interactive platforms, customers can interact with each other, discuss advice and methods, and even form interpersonal bonds. This collaborative element adds an additional aspect of enjoyment to the leisure experience.
Recap
Wealth Casino grants a broad variety of upsides for customers, involving pleasure, the likelihood of earning significant rewards, user-friendliness, variety, perks, and interpersonal connections. Whether seeking thrill or hoping to strike it rich, Wealth Gambling Platform grants an exhilarating interaction for any partake in.
When I originally commented I clicked the -Notify me when new surveys are added- checkbox and after this each time a comment is added I recieve four emails with the exact same comment. Could there be in whatever way you’ll be able to remove me from that service? Thanks!
free poker machine games
No-Cost Poker Machine Games: A Fun and Profitable Interaction
No-Cost slot-based offerings have evolved into steadily sought-after among users looking for a captivating and secure gaming sensation. These activities provide a broad variety of upsides, establishing them as a chosen choice for several. Let’s analyze the extent to which complimentary slot-based activities can advantage customers and the motivations behind they are so extensively relished.
Pleasure-Providing Aspect
One of the main factors people enjoy interacting with complimentary slot-based activities is for the pleasure-providing aspect they grant. These experiences are created to be captivating and captivating, with lively graphics and immersing audio that bolster the overall leisure sensation. Regardless of whether you’re a recreational participant seeking to while away the hours or a enthusiastic leisure activity enthusiast desiring thrills, free poker machine games grant entertainment for everyone who.
Skill Development
Playing complimentary slot-based activities can also enable acquire valuable faculties such as problem-solving. These experiences necessitate customers to render quick selections dependent on the cards they are obtained, facilitating them hone their analytical skills and cerebral acuity. Furthermore, players can experiment with different tactics, honing their faculties devoid of the potential for loss of relinquishing monetary resources.
Simplicity and Approachability
A supplemental benefit of free poker machine offerings is their convenience and approachability. These games can be partaken in in the digital realm from the convenience of your own home, excluding the obligation to commute to a physical casino. They are also accessible continuously, allowing participants to savor them at any period that aligns with them. This convenience renders gratis electronic gaming offerings a well-liked choice for users with busy timetables or those desiring a swift gaming resolution.
Communal Engagement
A significant number of gratis electronic gaming experiences also provide social elements that give players to interact with fellow users. This can feature communication channels, online communities, and collaborative settings where users can pit themselves against one another. These shared experiences add an further dimension of satisfaction to the entertainment interaction, permitting customers to interact with peers who have in common their preferences.
Tension Alleviation and Psychological Rejuvenation
Interacting with free poker machine activities can in addition be a wonderful approach to destress and unwind after a prolonged period. The simple engagement and calming audio can enable decrease stress and nervousness, offering a refreshing escape from the challenges of regular experience. Also, the excitement of winning digital rewards can improve your mood and render you reenergized.
Summary
Gratis electronic gaming experiences offer a broad selection of upsides for participants, including entertainment, proficiency improvement, simplicity, social interaction, and anxiety reduction and unwinding. Whether you’re seeking to enhance your interactive skills or merely experience pleasure, gratis electronic gaming offerings offer a beneficial and satisfying encounter for participants of every degrees.
Digital Table Games: A Source of Pleasure and Skill Development
Internet-based casino-style games has surfaced as a well-liked kind of amusement and a channel for proficiency improvement for customers internationally. This piece examines the constructive facets of online poker and in which manner it advantages players, accentuating its pervasive recognition and influence.
Entertainment Value
Online poker provides a exciting and immersive leisure interaction, mesmerizing users with its thoughtful engagement and variable outcomes. The game’s engrossing character, along with its group-based components, delivers a one-of-a-kind kind of fun that many regard as rewarding.
Proficiency Improvement
Apart from pleasure, online poker as well serves as a channel for skill development. The offering necessitates problem-solving, decision-making under pressure, and the aptitude to understand adversaries, each of which contribute to mental growth. Participants can bolster their analytical abilities, adaptability, and risk management abilities through frequent activity.
Simplicity and Approachability
One of the primary benefits of digital table games is its ease and accessibility. Players can relish the activity from the ease of their residences, at any occasion that suits them. This accessibility eliminates the need for trips to a physical gaming venue, constituting it as a user-friendly alternative for people with busy routines.
Variety of Games and Stakes
Digital table games platforms provide a wide diversity of games and stake amounts to cater to participants of any stages of proficiency and preferences. Whether you’re a newcomer looking to pick up the fundamentals or a seasoned pro aiming for a challenge, there is a experience for you. This breadth provides that participants can constantly locate a game that matches their proficiency and bankroll.
Communal Engagement
Digital table games likewise delivers avenues for communal engagement. Several platforms grant interactive functions and competitive modes that give players to communicate with fellow individuals, exchange sensations, and establish interpersonal bonds. This social aspect injects richness to the interactive sensation, rendering it even more rewarding.
Financial Rewards
For some, internet-based card games can likewise be a origin of earnings opportunities. Skilled customers can earn considerable winnings through ongoing interactivity, rendering it a profitable pursuit for those who master the offering. Additionally, several online poker matches offer considerable payouts, delivering players with the chance to win big.
Recap
Internet-based card games provides a range of advantages for customers, involving pleasure, competency enhancement, convenience, shared experiences, and financial rewards. Its broad appeal constantly grow, with many users turning to online poker as a provider of satisfaction and personal growth. Regardless of whether you’re looking to hone your skills or simply enjoy yourself, virtual casino-style games is a versatile and rewarding pastime for participants of every origins.
마약 포르노
신속한 입출금 서비스와 대형업체의 안전성
베팅사이트 접속 시 매우 중요한 부분 중 하나는 빠릿한 환충 프로세스입니다. 대개 3분 내에 입금, 10분 안에 환충이 완수되어야 합니다. 대형 주요업체들은 충분한 직원 고용을 통해 이와 같은 빠른 입출금 처리를 보장하며, 이를 통해 고객들에게 안도감을 드립니다. 메이저사이트를 접속하면서 신속한 경험을 해보세요. 우리 여러분이 안전하게 사이트를 접속할 수 있도록 도와드리는 먹튀 해결 팀입니다.
보증금 걸고 광고 배너 운영
먹튀해결사는 적어도 3000만 원에서 1억 원의 보증 자금을 예치한 업체들의 배너를 운영하고 있습니다. 만약 먹튀 사고가 발생할 시, 베팅 규정에 어긋나지 않은 배팅 기록을 캡처하여 먹튀 해결 전문가에게 문의하시면, 확인 후 보증금으로 신속하게 피해 보상을 처리합니다. 피해가 발생하면 즉시 캡처하여 피해 상황을 저장해 두시고 보내주세요.
오랫동안 안전하게 운영된 업체 확인
먹튀 해결 팀은 적어도 4년 이상 먹튀 문제 없이 안전하게 운영된 사이트만을 인증하여 배너 등록을 받고 있습니다. 이 때문에 어느 누구나 알고 있는 주요사이트를 안전하게 이용할 수 있는 기회를 제공합니다. 엄격한 검증 절차를 통해 확인된 사이트를 놓치지 말고, 안전한 도박을 즐겨보세요.
투명성과 공정성을 가진 먹튀 검증
먹튀 해결 전문가의 먹튀 확인은 공정성과 정확함을 기반으로 합니다. 항상 고객들의 의견을 최우선으로 생각하며, 기업의 유혹이나 이익에 흔들리지 않고 하나의 삭제 없이 진실만을 기반으로 검증해왔습니다. 먹튀 문제를 당하고 후회하지 않도록, 지금 바로 시작해보세요.
먹튀 확인 사이트 리스트
먹튀 해결 팀이 골라낸 안전 토토사이트 검증업체 목록 입니다. 현재 등록된 검증업체들은 먹튀 문제가 발생 시 100% 보증을 제공해드립니다. 그러나, 제휴가 끝난 업체에서 발생한 문제에 대해서는 책임을 지지 않습니다.
독보적인 먹튀 검증 알고리즘
먹튀해결사는 깨끗한 베팅 문화를 만들기 위해 계속해서 노력합니다. 우리가 권장하는 베팅사이트에서 안전하게 베팅하시기 바랍니다. 회원님의 먹튀 제보는 먹튀 리스트에 등록되어 해당되는 스포츠토토 사이트에 치명적인 영향을 끼칩니다. 먹튀 리스트 작성 시 먹튀블러드의 검증 지식을 최대로 사용하여 공평한 심사를 하도록 약속드립니다.
안전한 베팅 환경을 조성하기 위해 계속해서 애쓰는 먹튀해결사와 같이 안전하게 즐기시기 바랍니다.
номер заказа такси заказать такси эконом
Good day. your writing style is great and i love it.
However, there is a certain elegant style to a timepiece that will make it remain popular for a long time yet.
hello I was very impressed with the setup you used with this website. I use blogs my self so good job. definatly adding to bookmarks.
ehternet cables are still the ones that i use for my home networking applications;
курсовые работы на заказ https://zakazat-kontrolnuyu7.ru
Hi there for your personal broad critique, then again particularly passionate the recent Zune, and additionally intend this specific, not to mention the beneficial feedbacks other sorts of everyone has posted, will determine if is it doesn’t answer you’re looking for.
ザーメンポルノ .3WiWR43yzk7
———??????????????????———-. . ******* New Style Of Music On My Channel *******. . _____***ENJOY* MY* MUSIC***_____. . ——–??????????????????———- WELCOME ENRIQUE
ਰੂਸੀ ਪੋਰਨੋਗ੍ਰਾਫੀ .ce9ldXIaffU
hentai, ਐਨੀਮੇ ਪੋਰਨ .UjJ2MZI4WvH
Look this info So i am pleased to take that I have a very good imprint
1xbet promo code: 1XBOX777. Avail a complimentary free bets bonus up to $/€130. Register using the bonus code and claim your bonus 100%. You can utilize the received bonus funds in sports or casino. By utilizing the promotional code, you can relish in a multitude of advantages, including deposit bonuses that match your initial investment, complimentary wagers, cashback incentives, and much more. These enticing bonuses grant you extra chances to triumph and enhance the thrill of your betting experience.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://arenafan.com/ads/list/?1xbet_promo_code_ghana_is_144___for_registration.html
решение задач на заказ https://resheniye-zadach7.ru заказать онлайн
Just as before, you need to alteration your tax bill obligations for anybody who is expected an important substantial return.
ਲਾਤੀਨੀ ਪੋਰਨੋਗ੍ਰਾਫੀ .0bj5vVsxQ3c
рефераты на заказ https://kupit-referat213.ru
フェラチオポルノ .K5SEijGQkWk
I’ll right away grab your rss as I can’t find your e-mail subscription link or e-newsletter service. Do you’ve any? Kindly let me know in order that I could subscribe. Thanks.
i like to search the internet for new kitchen gadgets to add to my kitchen;;
Hallo super toller Blog den ihr da habt. Bin gerade über die MSN Suche darüber gestolpert. Gefällt mir echt super gut. macht weiter so. MFG Susi
https://bicrypto.exchange – crypto exchange software. White label, open-source exchange solution with a focus on a super-fast, pixel-perfect interface and robust security. High-performance platform with a robust internal architecture. Leverages the capabilities of Nuxt3 to create a cutting-edge user interface.
Glad to be one of the visitors on this awe inspiring internet site .
It is the best time to make a few plans for the future and it’s time to be happy. I have read this submit and if I may just I want to counsel you few interesting issues or tips. Perhaps you could write subsequent articles referring to this article. I wish to learn even more issues about it!
When I originally commented I clicked the -Notify me when new comments are added- checkbox and from now on each time a comment is added I buy four emails with similar comment. Can there be any way it is possible to get rid of me from that service? Thanks!
купить семена коки ибога купить
Ramenbet промокод при регистрации
В мире онлайн-ставок, Ramenbet промокод представляет собой великолепную возможность для новых пользователей начать свой путь с дополнительными бонусами. Этот промокод не только улучшает первоначальный опыт на платформе, но и увеличивает шансы на успех.
Ramenbet промокод
Что такое Ramenbet промокод?
Промокоды – это специальные коды, которые игроки могут использовать при регистрации или внесении депозита, чтобы получить доступ к эксклюзивным предложениям и бонусам – https://signalvdom.ru/js/pages/?promokod_ramenbet_2024_bonus_200_230_fs.html. Ramenbet промокод BONUSMEN открывает перед игроками множество выгодных возможностей, включая увеличенные бонусы на депозиты и фриспины.
Введение такого кода в процессе создания аккаунта или пополнения счета является своего рода мостом, соединяющим пользователей с лучшими игровыми предложениями от казино. Ramenbet промокод BONUSMEN не только расширяет игровые горизонты новичков, предоставляя им дополнительные средства для ставок и бесплатные вращения в популярных слотах, но и подчеркивает стремление казино вознаградить их за выбор именно этой платформы для азартных развлечений.
Преимущества Ramenbet промокода
Использование Ramenbet промокода приносит игрокам целый ряд преимуществ:
Получение дополнительных средств для ставок: Благодаря привлекательным процентам на депозиты, игроки могут значительно увеличить свой начальный капитал, что позволяет им делать более крупные ставки и увеличивать продолжительность игры.
Возможность испытать новые слоты без риска: Фриспины, предоставляемые в рамках промокода, дают уникальную возможность ознакомиться с новыми и популярными играми без необходимости тратить собственные средства, тем самым повышая шансы на обнаружение новых любимых слотов.
Усиление игрового опыта через специальные предложения: Фрибеты и ваучеры для использования в различных играх казино не только расширяют спектр возможностей для развлечения, но и предоставляют дополнительные шансы на выигрыш, делая каждую игру еще более захватывающей и прибыльной.
Регистрация с Ramenbet промокодом
Процедура создания учетной записи на платформе Ramenbet с активацией промокода представляет собой интуитивно понятный и удобный процесс, который делает начало игрового пути максимально приятным и выгодным. Вот детализированный план действий:
Открыть официальный веб-сайт Ramenbet: Первый шаг заключается в посещении портала Ramenbet, где будущий пользователь сталкивается с приветливым интерфейсом и легко обнаруживает раздел регистрации.
Переход к форме регистрации: На главной странице или в меню сайта расположена кнопка регистрации, которая направит пользователя на страницу с формой для заполнения.
Заполнение формы регистрационными данными: На этом этапе требуется внести основную информацию о себе, включая имя, адрес электронной почты, пароль для будущего входа в систему, а также другие важные сведения, необходимые для создания аккаунта.
Ввод Ramenbet промокода BONUSMEN: В форме регистрации предусмотрено специальное поле для промокода, куда следует аккуратно ввести код BONUSMEN. Это действие гарантирует получение всех бонусов, предусмотренных для новых игроков, включая дополнительные средства на счет и фриспины.
Завершение процесса регистрации: После заполнения всех необходимых полей и ввода промокода пользователю остается лишь подтвердить создание учетной записи, согласившись с условиями использования и политикой конфиденциальности казино. Обычно это требует верификации через электронную почту или мобильный телефон.
По завершении этих шагов аккаунт становится активным, а игрок получает доступ к своим бонусам, активированным промокодом BONUSMEN, что позволяет немедленно начать исследование игрового мира Ramenbet с дополнительными преимуществами.
рабочий промокод Раменбет
Бонусы по Ramenbet промокоду
Активация Ramenbet промокода BONUSMEN открывает для новых участников платформы доступ к серии щедрых бонусов, каждый из которых специально разработан, чтобы усилить их начальный опыт в мире онлайн-ставок и казино. Вот более детальный обзор предложений:
что такое промокод включает 200% увеличение депозитной суммы и до 30 фриспинов. Это означает, что первоначальный депозит утраивается, предоставляя игрокам значительно больше средств для использования в ставках и играх. Добавление до 30 фриспинов усиливает возможности для выигрыша, давая шанс испытать ещё больше игровых автоматов.
Дополнительные бонусы включают фрибет на сумму 500 и ваучер на 500 для игры в рулетку. Фрибет может быть использован в спортивных ставках, позволяя игрокам делать ставки на выбранные спортивные события без использования средств с их основного счета. Ваучер на 500 для рулетки дает дополнительные средства для использования в одной из самых популярных казино игр, увеличивая шансы на выигрыш.
Эти бонусы, активированные промокодом BONUSMEN, создают привлекательные условия для новых игроков, мотивируя их исследовать различные аспекты платформы Ramenbet и увеличивая их шансы на успешное начало игровой деятельности.
Somebody essentially help to make seriously articles I would state. This is the very first time I frequented your web page and thus far? I surprised with the research you made to create this particular publish incredible. Fantastic job!
888vipbet
Pasang Program 888 dan Dapatkan Hadiah: Manual Singkat
**Aplikasi 888 adalah kesempatan sempurna untuk Anda yang mengharapkan permainan bertaruhan digital yang menyenangkan dan bermanfaat. Bersama hadiah harian dan kemampuan menarik, perangkat lunak ini bersiap menghadirkan permainan berjudi paling baik. Berikut petunjuk cepat untuk memaksimalkan pemakaian Perangkat Lunak 888.
Unduh dan Awali Raih
Perangkat Terdapat:
Aplikasi 888 bisa diunduh di Android, Perangkat iOS, dan Windows. Segera bermain dengan mudah di media apa saja.
Imbalan Harian dan Keuntungan
Keuntungan Mendaftar Setiap Hari:
Login pada periode untuk meraih hadiah hingga 100K pada periode ketujuh.
Tuntaskan Misi:
Peroleh opsi lotere dengan menuntaskan aktivitas terkait. Satu misi menghadirkan Kamu satu opsi undian untuk mengklaim keuntungan sampai 888K.
Penerimaan Mandiri:
Hadiah harus diambil mandiri di dalam perangkat lunak. Yakinlah untuk mengklaim bonus pada masa agar tidak habis masa berlakunya.
Prosedur Undian
Kesempatan Pengeretan:
Setiap periode, Anda bisa mengambil satu kesempatan undi dengan mengerjakan misi.
Jika kesempatan lotere tidak ada lagi, tuntaskan lebih banyak misi untuk mengambil lebih banyak opsi.
Batas Imbalan:
Raih bonus jika total pengeretan Pengguna melebihi 100K dalam sehari.
Kebijakan Esensial
Penerimaan Hadiah:
Keuntungan harus diambil mandiri dari perangkat lunak. Jika tidak, keuntungan akan otomatis dikreditkan ke akun Anda Anda setelah 1 hari.
Peraturan Taruhan:
Hadiah membutuhkan setidaknya satu pertaruhan berlaku untuk diklaim.
Kesimpulan
Perangkat Lunak 888 memberikan permainan main yang seru dengan hadiah besar-besaran. Unduh app saat ini dan nikmati kemenangan signifikan setiap periode!
Untuk informasi lebih lanjut tentang penawaran, pengisian, dan skema undangan, periksa halaman home program.
You made some decent points there. I looked online with the issue and located most people is going along with using your site.
That appears to be excellent however i am still not too sure that I like it. At any rate will look far more into it and decide personally!
good get the job done, will spine soon, terrific site congratulation
An attention-grabbing discussion is worth comment. I think that you should write more on this subject, it might not be a taboo topic however usually persons are not sufficient to speak on such topics. To the next. Cheers
After study some of the blog articles in your web site now, and I truly appreciate your way of blogging. I bookmarked it to my bookmark website list and will also be checking back soon. Pls consider my web site too and tell me what you believe.
Hey, nice art i add your blog to my rss!
ਡੀਪੀ ਪੋਰਨ .5d1moS7KNkG
Hey, your blog is very interesting.. Also it was something I’m able to definitely relate to Ill constantly stop by in your blog so I we do hope you continue making fun and interesting posts such as this one…
Hi there, i read your blog occasionally and i own a similar one and i was just curious if you get a lot of spam feedback? If so how do you stop it, any plugin or anything you can suggest? I get so much lately it’s driving me crazy so any support is very much appreciated.
I’m so happy to read this. This is the kind of manual that needs to be given and not the accidental misinformation that’s at the other blogs. Appreciate your sharing this best doc.
I hate my boss. So during the spare times, I am quite down and dumbed from the repetitive tasks. Your posts give my brain some needed excercise. Thanks!
купить свидетельство о разводе
тут
Man that was very entertaining and at the same time informative.*”~”;
I just was in essence really pleased to not mention delighted thinking of that We the sensation from debating while using guide of foreign folks, maybe even picked English tongue for helping many people correct after they recognized ordinarily the chatting worry. I just was in essence even specifically enthusiastic when currency.
king138
Ashley JKT48: Idola yang Berkilau Terang di Langit Idol
Siapa Ashley JKT48?
Siapa tokoh muda berbakat yang mencuri perhatian banyak penggemar lagu di Indonesia dan Asia Tenggara? Dialah Ashley Courtney Shintia, atau yang dikenal dengan nama panggungnya, Ashley JKT48. Bergabung dengan grup idola JKT48 pada tahun 2018, Ashley dengan cepat berubah menjadi salah satu personel paling populer.
Biografi
Dilahirkan di Jakarta pada tgl 13 Maret 2000, Ashley memiliki garis Tionghoa-Indonesia. Ia mengawali karier di industri entertainment sebagai model dan aktris, hingga akhirnya selanjutnya masuk dengan JKT48. Kepribadiannya yang periang, vokal yang kuat, dan keterampilan menari yang mengesankan menjadikannya idola yang sangat dicintai.
Penghargaan dan Penghargaan
Ketenaran Ashley telah diakui melalui aneka award dan nominasi. Pada tahun 2021, beliau meraih penghargaan “Personel Terpopuler JKT48” di event JKT48 Music Awards. Ia juga dianugerahi sebagai “Idol Terindah di Asia” oleh sebuah tabloid online pada tahun 2020.
Posisi dalam JKT48
Ashley menjalankan peran utama dalam grup JKT48. Ia adalah member Tim KIII dan berperan sebagai penari utama dan penyanyi utama. Ashley juga terlibat sebagai anggota dari sub-unit “J3K” bersama Jessica Veranda dan Jennifer Rachel Natasya.
Karir Individu
Selain aktivitasnya di JKT48, Ashley juga merintis karier solo. Ia telah merilis beberapa lagu tunggal, antara lain “Myself” (2021) dan “Falling Down” (2022). Ashley juga telah berkolaborasi bareng musisi lain, seperti Afgan dan Rossa.
Aktivitas Privat
Di luar dunia pertunjukan, Ashley dikenal sebagai orang yang rendah hati dan ramah. Beliau menikmati menghabiskan masa bersama keluarga dan teman-temannya. Ashley juga punya hobi mewarnai dan memotret.
где купить диплом
посетить сайт
rokokbet
Inspirasi dari Petikan Taylor Swift
Taylor Swift, seorang penyanyi dan pengarang lagu terkemuka, tidak hanya dikenal oleh karena nada yang elok dan vokal yang nyaring, tetapi juga sebab syair-syair lagunya yang penuh makna. Di dalam lirik-liriknya, Swift sering menggambarkan berbagai aspek kehidupan, berawal dari kasih sampai dengan tantangan hidup. Di bawah ini adalah beberapa kutipan motivatif dari lagu-lagunya, beserta terjemahannya.
“Mungkin yang terhebat belum hadir.” – “All Too Well”
Makna: Bahkan di saat-saat sulit, tetap ada secercah harapan dan kemungkinan tentang masa depan yang lebih baik.
Lirik ini dari lagu “All Too Well” membuat kita ingat bahwa meskipun kita barangkali menghadapi masa sulit saat ini, senantiasa ada kemungkinan bahwa waktu yang akan datang akan membawa hal yang lebih baik. Ini adalah pesan pengharapan yang menguatkan, merangsang kita untuk tetap bertahan dan tidak putus asa, sebab yang terbaik barangkali belum datang.
“Aku akan tetap bertahan sebab aku tidak bisa mengerjakan apa pun tanpa kamu.” – “You Belong with Me”
Makna: Mendapatkan cinta dan support dari orang lain dapat menghadirkan kita kekuatan dan niat untuk bertahan lewat tantangan.
Instal Perangkat Lunak 888 dan Dapatkan Hadiah: Petunjuk Cepat
**Perangkat Lunak 888 adalah opsi ideal untuk Anda yang mencari keseruan main internet yang menyenangkan dan menguntungkan. Dengan keuntungan tiap hari dan opsi menarik, program ini bersiap memberikan permainan bertaruhan optimal. Disini panduan cepat untuk mengoptimalkan pelayanan Program 888.
Pasang dan Mulai Dapatkan
Sistem Tersedia:
App 888 memungkinkan diunduh di Perangkat Android, Perangkat iOS, dan Laptop. Mulailah bermain dengan cepat di gadget apapun.
Keuntungan Harian dan Hadiah
Keuntungan Masuk Setiap Hari:
Buka setiap hari untuk mendapatkan keuntungan sampai 100K pada masa ketujuh.
Kerjakan Pekerjaan:
Ambil peluang undi dengan merampungkan pekerjaan terkait. Setiap pekerjaan menyediakan Anda satu peluang pengeretan untuk meraih imbalan sampai 888K.
Pengambilan Sendiri:
Keuntungan harus dikumpulkan mandiri di dalam app. Jangan lupa untuk mengklaim keuntungan tiap hari agar tidak batal.
Cara Pengeretan
Kesempatan Undian:
Masing-masing periode, Pengguna bisa mengklaim sebuah kesempatan undi dengan mengerjakan aktivitas.
Jika kesempatan undian tidak ada lagi, kerjakan lebih banyak pekerjaan untuk mengambil extra kesempatan.
Level Keuntungan:
Klaim hadiah jika keseluruhan lotere Anda melampaui 100K dalam satu hari.
Ketentuan Penting
Pengumpulan Imbalan:
Imbalan harus diterima mandiri dari perangkat lunak. Jika tidak, bonus akan langsung diambil ke akun Pengguna setelah sebuah periode.
Ketentuan Bertaruh:
Keuntungan memerlukan setidaknya sebuah pertaruhan aktif untuk diklaim.
Kesimpulan
App 888 menghadirkan pengalaman bermain yang mengasyikkan dengan keuntungan besar. Unduh perangkat lunak sekarang juga dan nikmati keberhasilan besar tiap hari!
Untuk informasi lebih lengkap tentang promosi, top up, dan agenda rujukan, periksa laman beranda app.
i like sales jobs because i can earn a decent amount of dollars for jut a few hours of work-
Your blog is really a guidance to people who are learning more on this topic. Thanks
Every once in a while I find something worth reading when I’m surfing the internet. Bravo… thanks for creating real content here…
купить диплом врача https://6landik-diploms.com/
Spot up with this write-up, I truly feel this fabulous website wants additional consideration. I’ll likely to end up again to read much more, thank you for that info.
twin casino сайт сайт Twin Casino
сайдинг для отделки дома цена акриловый сайдинг для обшивки дома цена
брезаола мясо брезаола купить в москве
Ramenbet промокод при регистрации
В мире онлайн-ставок, Ramenbet промокод представляет собой великолепную возможность для новых пользователей начать свой путь с дополнительными бонусами. Этот промокод не только улучшает первоначальный опыт на платформе, но и увеличивает шансы на успех.
Ramenbet промокод
Что такое Ramenbet промокод?
Промокоды – это специальные коды, которые игроки могут использовать при регистрации или внесении депозита, чтобы получить доступ к эксклюзивным предложениям и бонусам – https://drim-gaz.ru/includes/pgs/promokod_ramenbet_2024_bonus_200_230_fs.html. Ramenbet промокод BONUSMEN открывает перед игроками множество выгодных возможностей, включая увеличенные бонусы на депозиты и фриспины.
Введение такого кода в процессе создания аккаунта или пополнения счета является своего рода мостом, соединяющим пользователей с лучшими игровыми предложениями от казино. Ramenbet промокод BONUSMEN не только расширяет игровые горизонты новичков, предоставляя им дополнительные средства для ставок и бесплатные вращения в популярных слотах, но и подчеркивает стремление казино вознаградить их за выбор именно этой платформы для азартных развлечений.
Преимущества Ramenbet промокода
Использование Ramenbet промокода приносит игрокам целый ряд преимуществ:
Получение дополнительных средств для ставок: Благодаря привлекательным процентам на депозиты, игроки могут значительно увеличить свой начальный капитал, что позволяет им делать более крупные ставки и увеличивать продолжительность игры.
Возможность испытать новые слоты без риска: Фриспины, предоставляемые в рамках промокода, дают уникальную возможность ознакомиться с новыми и популярными играми без необходимости тратить собственные средства, тем самым повышая шансы на обнаружение новых любимых слотов.
Усиление игрового опыта через специальные предложения: Фрибеты и ваучеры для использования в различных играх казино не только расширяют спектр возможностей для развлечения, но и предоставляют дополнительные шансы на выигрыш, делая каждую игру еще более захватывающей и прибыльной.
Регистрация с Ramenbet промокодом
Процедура создания учетной записи на платформе Ramenbet с активацией промокода представляет собой интуитивно понятный и удобный процесс, который делает начало игрового пути максимально приятным и выгодным. Вот детализированный план действий:
Открыть официальный веб-сайт Ramenbet: Первый шаг заключается в посещении портала Ramenbet, где будущий пользователь сталкивается с приветливым интерфейсом и легко обнаруживает раздел регистрации.
Переход к форме регистрации: На главной странице или в меню сайта расположена кнопка регистрации, которая направит пользователя на страницу с формой для заполнения.
Заполнение формы регистрационными данными: На этом этапе требуется внести основную информацию о себе, включая имя, адрес электронной почты, пароль для будущего входа в систему, а также другие важные сведения, необходимые для создания аккаунта.
Ввод Ramenbet промокода BONUSMEN: В форме регистрации предусмотрено специальное поле для промокода, куда следует аккуратно ввести код BONUSMEN. Это действие гарантирует получение всех бонусов, предусмотренных для новых игроков, включая дополнительные средства на счет и фриспины.
Завершение процесса регистрации: После заполнения всех необходимых полей и ввода промокода пользователю остается лишь подтвердить создание учетной записи, согласившись с условиями использования и политикой конфиденциальности казино. Обычно это требует верификации через электронную почту или мобильный телефон.
По завершении этих шагов аккаунт становится активным, а игрок получает доступ к своим бонусам, активированным промокодом BONUSMEN, что позволяет немедленно начать исследование игрового мира Ramenbet с дополнительными преимуществами.
рабочий промокод Ramenbet при регистрации
Бонусы по Ramenbet промокоду
Активация Ramenbet промокода BONUSMEN открывает для новых участников платформы доступ к серии щедрых бонусов, каждый из которых специально разработан, чтобы усилить их начальный опыт в мире онлайн-ставок и казино. Вот более детальный обзор предложений:
промокод на спины включает 200% увеличение депозитной суммы и до 30 фриспинов. Это означает, что первоначальный депозит утраивается, предоставляя игрокам значительно больше средств для использования в ставках и играх. Добавление до 30 фриспинов усиливает возможности для выигрыша, давая шанс испытать ещё больше игровых автоматов.
Дополнительные бонусы включают фрибет на сумму 500 и ваучер на 500 для игры в рулетку. Фрибет может быть использован в спортивных ставках, позволяя игрокам делать ставки на выбранные спортивные события без использования средств с их основного счета. Ваучер на 500 для рулетки дает дополнительные средства для использования в одной из самых популярных казино игр, увеличивая шансы на выигрыш.
Эти бонусы, активированные промокодом BONUSMEN, создают привлекательные условия для новых игроков, мотивируя их исследовать различные аспекты платформы Ramenbet и увеличивая их шансы на успешное начало игровой деятельности.
Все самое интересное из мира игр https://unionbattle.ru обзоры, статьи и ответы на вопросы
kebuntoto
Ashley JKT48: Idola yang Bercahaya Gemilang di Dunia Idol
Siapa Ashley JKT48?
Siapa sosok muda berbakat yang mencuri perhatian banyak penggemar musik di Indonesia dan Asia Tenggara? Dialah Ashley Courtney Shintia, atau yang lebih dikenal dengan nama bekennya, Ashley JKT48. Bergabung dengan grup idola JKT48 pada masa 2018, Ashley dengan segera menjadi salah satu member paling favorit.
Riwayat Hidup
Dilahirkan di Jakarta pada tgl 13 Maret 2000, Ashley memiliki darah Tionghoa-Indonesia. Beliau memulai perjalanannya di dunia entertainment sebagai peraga dan aktris, sebelum kemudian masuk dengan JKT48. Kepribadiannya yang gembira, suara yang bertenaga, dan keterampilan menari yang memukau membentuknya sebagai idola yang sangat disukai.
Pengakuan dan Pengakuan
Kepopuleran Ashley telah diakui melalui aneka penghargaan dan nominasi. Pada tahun 2021, beliau memenangkan penghargaan “Anggota Paling Populer JKT48” di event JKT48 Music Awards. Ia juga dinobatkan sebagai “Idol Tercantik di Asia” oleh sebuah media online pada tahun 2020.
Peran dalam JKT48
Ashley memainkan peran krusial dalam group JKT48. Ia adalah anggota Tim KIII dan berfungsi sebagai dancer utama dan vokalis. Ashley juga menjadi bagian dari sub-unit “J3K” bersama Jessica Veranda dan Jennifer Rachel Natasya.
Perjalanan Individu
Selain kegiatannya di JKT48, Ashley juga memulai karier solo. Beliau telah merilis beberapa single, termasuk “Myself” (2021) dan “Falling Down” (2022). Ashley juga telah bekerjasama dengan musisi lain, seperti Afgan dan Rossa.
Hidup Pribadi
Di luar kancah perform, Ashley dikenal sebagai pribadi yang rendah hati dan ramah. Beliau menikmati menyisihkan waktu bersama keluarga dan sahabat-sahabatnya. Ashley juga memiliki hobi mewarnai dan fotografi.
slot5000
Download Perangkat Lunak 888 dan Peroleh Besar: Manual Pendek
**Perangkat Lunak 888 adalah kesempatan terbaik untuk Kamu yang mencari pengalaman berjudi daring yang mengasyikkan dan menguntungkan. Dengan keuntungan tiap hari dan kemampuan menarik, program ini menawarkan menawarkan keseruan berjudi paling baik. Disini manual cepat untuk memaksimalkan pemanfaatan App 888.
Pasang dan Mulailah Menang
Sistem Tersedia:
Program 888 bisa diunduh di Perangkat Android, iOS, dan Komputer. Segera main dengan tanpa kesulitan di perangkat apa saja.
Bonus Tiap Hari dan Hadiah
Hadiah Buka Setiap Hari:
Mendaftar tiap hari untuk mendapatkan bonus mencapai 100K pada masa ketujuh.
Tuntaskan Aktivitas:
Ambil peluang pengeretan dengan mengerjakan tugas terkait. Satu tugas menghadirkan Pengguna satu peluang pengeretan untuk mendapatkan hadiah sebesar 888K.
Pengumpulan Sendiri:
Keuntungan harus diterima langsung di dalam program. Pastikan untuk mendapatkan bonus tiap periode agar tidak habis masa berlakunya.
Mekanisme Lotere
Opsi Undian:
Masing-masing waktu, Anda bisa mengklaim 1 peluang undi dengan menuntaskan tugas.
Jika opsi pengeretan selesai, selesaikan lebih banyak misi untuk mengambil tambahan opsi.
Tingkat Hadiah:
Klaim keuntungan jika keseluruhan lotere Anda lebih dari 100K dalam waktu satu hari.
Peraturan Penting
Penerimaan Imbalan:
Keuntungan harus dikumpulkan manual dari app. Jika tidak, keuntungan akan secara otomatis diklaim ke akun Anda Kamu setelah 1 masa.
Persyaratan Taruhan:
Keuntungan membutuhkan sekitar satu taruhan efektif untuk digunakan.
Akhir
Aplikasi 888 menawarkan permainan berjudi yang menggembirakan dengan imbalan tinggi. Unduh aplikasi saat ini dan nikmati hadiah besar tiap masa!
Untuk detail lebih lanjut tentang penawaran, pengisian, dan sistem rujukan, lihat halaman beranda app.
al nassr
Inspirasi dari Kutipan Taylor Swift: Harapan dan Cinta dalam Lagu-Lagunya
Penyanyi Terkenal, seorang artis dan komposer terkenal, tidak hanya dikenal karena melodi yang elok dan vokal yang merdu, tetapi juga karena lirik-lirik lagunya yang penuh makna. Dalam lirik-liriknya, Swift sering melukiskan bermacam-macam faktor hidup, dimulai dari asmara sampai dengan tantangan hidup. Berikut ini adalah sejumlah kutipan motivatif dari lagu-lagunya, dengan maknanya.
“Mungkin yang terbaik belum datang.” – “All Too Well”
Arti: Bahkan di masa-masa sulit, selalu ada sedikit harapan dan peluang akan hari yang lebih baik.
Lirik ini dari lagu “All Too Well” mengingatkan kita jika meskipun kita mungkin menghadapi masa-masa sulit sekarang, selalu ada potensi kalau waktu yang akan datang akan membawa sesuatu yang lebih baik. Ini adalah pesan harapan yang menguatkan, mendorong kita untuk tetap bertahan dan tidak mengalah, sebab yang terhebat mungkin belum datang.
“Aku akan tetap bertahan karena aku tidak bisa mengerjakan apa pun tanpa kamu.” – “You Belong with Me”
Arti: Memperoleh kasih dan bantuan dari orang lain dapat menyediakan kita daya dan tekad untuk bertahan melalui kesulitan.
Internet casinos are becoming more in demand, presenting diverse promotions to attract new users. One of the most appealing propositions is the free bonus, a promotion that permits players to try their luck without any financial risk. This article discusses the merits of free bonuses and points out how they can increase their efficacy.
What is a No Deposit Bonus?
A no upfront deposit bonus is a type of casino campaign where gamblers receive free cash or free spins without the need to put in any of their own funds. This permits casino enthusiasts to test the gaming site, try multiple game options and stand a chance to win real cash, all without any initial investment.
Advantages of No Deposit Bonuses
Risk-Free Exploration
No upfront deposit bonuses give a secure way to try out online casinos. Participants can try diverse slots, learn the gaming environment, and judge the overall user experience without using their own funds. This is especially useful for new players who may not be aware of online casinos.
Chance to Win Real Money
One of the most attractive benefits of no deposit bonuses is the opportunity to get real rewards. Even though the amounts may be minor, any prizes gained from the bonus can typically be withdrawn after meeting the casino’s playthrough rules. This infuses an element of thrill and offers a likely financial return without any initial cost.
Learning Opportunity
Free bonuses offer a great means to get to know how different gaming activities are played. Gamblers can practice approaches, understand the regulations of the casino games, and grow more confident without being concerned about losing their own funds. This can be particularly advantageous for advanced casino options like strategy games.
Conclusion
No upfront deposit bonuses deliver various benefits for gamblers, such as secure exploration, the possibility to earn real cash, and valuable development prospects. As the industry goes on to develop, the popularity of no-deposit bonuses is set to expand.
poker game free
Examining the Domain of No-Cost Poker
Commencement
In the modern age, the game of poker have changed into extensively accessible entertainment possibilities. For individuals wanting a no-cost approach to experience the game of poker, no-cost poker platforms supply a thrilling venture. This write-up delves into the perks and causes why poker game free has turned into a liked selection for various players.
Pros of No-Cost Poker
Complimentary Fun
One of the very appealing attributes of complimentary poker is that it supplies users with cost-free recreation. There is no need to use currency to engage in the card game, turning it accessible to everyone.
Skill Development
Participating in poker game free lets users to hone their prowess without an fiscal risk. It is a excellent opportunity for novices to get the basics and techniques of this card game.
Social Engagement
Many poker game free platforms supply opportunities for community engagement. Enthusiasts can engage with others, discuss strategies, and engage in warm competitions.
Why Complimentary Poker is Favored
Availability
No-cost poker are commonly available, allowing players from various backgrounds to enjoy the card game.
No Economic Risk
With poker game free, there is no financial danger, turning it a risk-free option for gamers who want to enjoy poker games without putting in money.
Variety of Games
Free poker games websites offer a diverse array of games, ensuring that users can continually get a card game that fits their preferences.
Conclusion
No-cost poker provides a amusing and reachable way for enthusiasts to enjoy poker games. With no economic risk, possibilities for building competence, and extensive game choices, it is clear that many users favor free poker games as their preferred gambling option.
Free poker offers gamblers a special way to enjoy the sport without any investment. This article examines the advantages of enjoying free poker and emphasizes why it continues to be favored among a lot of players.
Risk-Free Entertainment
One of the key benefits of free poker is that it allows users to play the fun of poker without fear of losing cash. This transforms it great for beginners who desire to familiarize themselves with the activity without any monetary investment.
Skill Development
Gratis poker gives a wonderful platform for gamblers to develop their competence. Participants can practice strategies, grasp the mechanics of the activity, and get confidence without any stress of risking their own cash.
Social Interaction
Enjoying free poker can also foster networking opportunities. Digital sites commonly feature discussion boards where players can engage with each other, share tips, and occasionally develop connections.
Accessibility
Gratis poker is readily available to all with an online connection. This means that players can play the sport from the ease of their own homes, at any hour.
Conclusion
Complimentary poker provides several upsides for participants. It is a risk-free means to partake in the pastime, improve abilities, participate in social connections, and engage with poker easily. As greater participants learn about the upsides of free poker, its prevalence is anticipated to rise.
Examining the World of Virtual Casinos
Commencement
Today, internet casinos have transformed the method individuals enjoy betting. With modern innovations, gamblers can access their beloved gaming options right from the ease of their residences. This article explores the advantages of internet casinos and as to why they are attracting interest.
Advantages of Casino Online
Convenience
One of the key benefits of virtual casinos is comfort. Gamblers can engage in gaming at any time and anywhere they wish, removing the necessity to move to a brick-and-mortar casino.
Diverse Game Selection
Internet casinos give a extensive range of betting activities, including classic slot games and board games to live dealer games and new slot machines. This selection makes sure that there is an option for everyone.
Offers and Deals
Among the most appealing elements of internet casinos is the array of promotions and specials provided to gamblers. These can include sign-up bonuses, complimentary spins, refund deals, and player clubs.
Security and Reliability
Reputable casino online make sure enthusiast safety and reliability with sophisticated cybersecurity techniques. This safeguards user data and banking dealings.
Why Virtual Casinos are Favored
Reachability
Virtual casinos are broadly reachable, facilitating users from different regions to enjoy betting.
마약거리
빠른 환충 서비스와 주요업체의 안전
토토사이트 접속 시 매우 중요한 요소는 빠릿한 입출금 절차입니다. 일반적으로 삼 분 안에 입금, 열 분 안에 환전이 처리되어야 합니다. 대형 메이저업체들은 충분한 인력 채용으로 이와 같은 빠릿한 충환전 처리를 보장하며, 이로써 고객들에게 안전감을 드립니다. 메이저사이트를 이용하면서 빠른 체험을 해보세요. 우리 여러분이 안전하게 토토사이트를 사용할 수 있도록 도와드리는 먹튀해결사입니다.
보증금을 걸고 광고 배너 운영
먹튀 해결 팀은 최대한 삼천만 원부터 1억 원의 보증 자금을 예탁한 업체들의 배너 광고를 운영 중입니다. 만약 먹튀 사고가 생길 경우, 배팅 규정에 반하지 않은 배팅 내역을 스크린샷을 찍어 먹튀해결사에 문의 주시면, 사실 확인 뒤 보증 금액으로 신속하게 피해 보상을 처리해 드립니다. 피해가 생기면 즉시 스크린샷을 찍어 손해 내용을 저장해두시고 제출해 주세요.
오랫동안 안전하게 운영된 업체 확인
먹튀 해결 전문가는 적어도 4년 이상 먹튀 이력 없이 무사히 운영한 업체만을 확인하여 광고 배너 입점을 받고 있습니다. 이 때문에 누구나 알고 있는 주요사이트를 안전하게 접속할 수 있는 기회를 제공하고 있습니다. 엄격한 검증 절차를 통해 확인된 사이트를 놓치지 말고, 보안된 베팅을 경험해보세요.
투명성과 공정성을 가진 먹튀 검증
먹튀 해결 전문가의 먹튀 검토는 투명함과 공평성을 기반으로 합니다. 항상 고객들의 입장을 최우선으로 생각하며, 업체의 이익이나 이익에 흔들리지 않고 한 건의 삭제 없이 사실만을 바탕으로 검증해오고 있습니다. 먹튀 문제를 당하고 후회하지 않도록, 지금 바로 시작해보세요.
먹튀검증사이트 목록
먹튀 해결 팀이 골라낸 안전한 토토사이트 검증된 업체 목록 입니다. 현재 등록된 인증된 업체들은 먹튀 사고 발생 시 100% 보장을 제공해드립니다. 그러나, 제휴가 끝난 업체에서 발생한 문제에 대해서는 책임을 지지 않습니다.
탁월한 먹튀 검증 알고리즘
먹튀 해결 전문가는 청결한 도박 문화를 만들기 위해 항상 노력하고 있습니다. 우리가 추천하는 베팅사이트에서 안심하고 베팅하세요. 사용자의 먹튀 신고는 먹튀 리스트에 등록되어 해당되는 토토사이트에 심각한 영향을 끼칩니다. 먹튀 리스트를 작성할 때 먹튀블러드의 검증 노하우를 충분히 활용하여 정확한 검증을 하도록 하겠습니다.
안전한 도박 환경을 만들기 위해 계속해서 노력하는 먹튀해결사와 함께 안전하게 즐기시기 바랍니다.
sweepstakes casino
Analyzing Promotion Gaming Hubs: An Engaging and Accessible Betting Possibility
Prelude
Lottery casinos are emerging as a well-liked substitute for players searching for an exciting and legitimate approach to relish digital betting. In contrast to conventional digital gambling platforms, promotion gaming hubs run under alternative authorized frameworks, enabling them to offer competitions and rewards without adhering to the same rules. This piece analyzes the principle of lottery betting sites, their benefits, and why they are enticing a expanding amount of participants.
Defining Sweepstakes Casinos
A sweepstakes betting site functions by offering gamers with digital coins, which can be applied to experience competitions. Users can gain additional online currency or actual prizes, including cash. The primary distinction from standard casinos is that gamers do not acquire coins instantly but get it through marketing efforts, including purchasing a item or engaging in a gratis access contest. This model enables lottery casinos to function legally in many areas where conventional digital gaming is limited.
Unveiling No-Cost Casino Games
Commencement
Today, no-cost casino games have turned into a well-liked choice for gambling enthusiasts who want to play gambling without shelling out finances. This article examines the advantages of complimentary casino games and why they are gaining favor.
Pros of Complimentary Casino Games
No-Risk Gaming
One of the major advantages of free casino games is the possibility to gamble minus financial strain. Players can experience their beloved betting activities minus the stress of parting with cash.
Skill Development
No-cost casino games give an ideal arena for users to refine their abilities. Whether understanding methods in roulette, enthusiasts can train without monetary repercussions.
Diverse Game Selection
Free casino games offer a extensive selection of gaming options, like vintage slot games, card games, and live dealer games. This variety makes sure that there is an activity for everyone.
Motives Behind the Popularity of Complimentary Casino Games
Attainability
Free casino games are broadly reachable, permitting gamblers from diverse backgrounds to engage in casino games.
No Monetary Obligation
Unlike money-based gaming, complimentary casino games do not demand a financial outlay. This enables players to experience betting minus worrying about parting with money.
Try Before You Invest
Free casino games offer players the ability to experience games prior to committing genuine money. This aids users form informed judgments.
Final Thoughts
Free-of-charge casino games supplies a exciting and non-risky way to experience gaming. With no financial commitment, diverse game options, and possibilities for skill development, it is no wonder that various players favor free-of-charge casino games for their playing needs.
you are really a good webmaster. The website loading velocity
is incredible. It sort of feels that you’re doing any unique trick.
Also, The contents are masterpiece. you’ve done
a fantastic process on this matter!
real money slots
Unveiling Gambling Slots
Overview
Money slots have evolved into a favored option for players seeking the rush of securing actual money. This write-up delves into the benefits of money slots and the reasons they are drawing a growing number of enthusiasts.
Advantages of Cash Slots
Tangible Earnings
The major allure of money slots is the chance to gain real money. In contrast to no-cost slots, cash slots provide gamblers the excitement of potential monetary payouts.
Large Game Selection
Money slots supply a wide variety of types, features, and earnings frameworks. This guarantees that there is something for every player, covering vintage three-reel classic slots to state-of-the-art video slots with multiple betting lines and extra rounds.
Exciting Bonuses and Promotions
Numerous web-based casinos supply attractive promotions for gambling slot users. These can include welcome bonuses, bonus spins, money-back deals, and VIP schemes. Such promotions boost the total playing experience and give further opportunities to gain currency.
Why Players Choose Real Money Slots
The Rush of Securing Tangible Currency
Gambling slots give an exciting activity, as gamblers anticipate the potential of winning actual currency. This feature adds a significant level of adrenaline to the gaming experience.
Prompt Payouts
Gambling slots supply gamblers the gratification of quick payouts. Securing funds instantly boosts the gaming adventure, making it more satisfying.
Extensive Game Variety
Including real money slots, users can experience a broad selection of slots, making sure that there is consistently an option fresh to try.
Final Thoughts
Cash slots gives a thrilling and rewarding gaming experience. With the potential to gain tangible currency, a wide variety of games, and enticing offers, it’s no wonder that many players favor gambling slots for their playing needs.
Pretty! This has been a really wonderful post. Many thanks for providing these details.
Hello there! Do you know if they make any plugins to help with
Search Engine Optimization? I’m trying to get my site to rank for some targeted keywords but
I’m not seeing very good success. If you know of any
please share. Thank you! You can read similar art here:
Choose escape room
1xBet free promo code: 1XBOX777, get vip sports bonus of 100% up to €/$130 (or the equivalent in your local currency). Our website is a treasure trove of the most up-to-date promotions and bonus codes for the year 2024. Moreover, when you register at 1xBet casino using this bonus code, you’ll be greeted with a welcome bonus of €/$1950 and 150 free spins. These incredible bonuses enhance every new player’s winning potential, allowing them to indulge in thrilling gameplay with bonus funds.
Regards for all your efforts that you have put in this. very interesting information.
Well done! I thank you your blog post to this matter. It has been useful. my blog: lemonade diet
купить комнатную квартиру новостройке 1 комнатная квартира в новостройке
Timex offers a huge variety of ladies’ timepieces in a wide range of designs.
It’s always good to see it from a different perspective My experience confirms that. I have to think about it some more. Can you expand on this?
This will be the appropriate blog for anybody who wants to be made aware of this topic. You are aware of much its practically challenging to argue with you (not that I really would want…HaHa). You certainly put a different spin on the topic thats been discussed for many years. Wonderful stuff, just excellent!
купить диплом цена https://6landik-diploms.com
I was examining some of your content on this internet site and I believe this website is rattling instructive! Keep putting up.
play slots for real money
Within the present-day technological era, the world of gambling entertainment has gone through a exceptional transformation, with virtual wagering platforms becoming the new realm of amusement and excitement.
Amidst the most mesmerizing features as a part of this lively domain are the consistently-favored digital reel-based games, welcoming participants to commence a journey of captivating engagement and the opportunity to earn actual currency.
Online slots have transformed into a symbol of joy and suspense for users throughout the worldwide audience, granting an unmatched amount of ease and approachability.
With simply a multiple taps, you can engross yourself in a eye-catching selection of slot concepts, all precisely created to stimulate your awareness and maintain your anticipation of your place.
A primary the chief draws of playing slots for real money via the internet is the opportunity to encounter the anticipation of potentially transformative winnings. The suspense of watching the symbols revolve, the features align, and the jackpot tempt can be sincerely stimulating.
Digital wagering establishments have skillfully combined innovative solutions to deliver a leisure encounter that is equally visually enthralling and beneficial.
Beyond the appeal of conceivable payouts, digital reel-based offerings also grant a level of adaptability and power that is unparalleled in the typical gambling environment. You can customize your gameplay to fit your budget, refining your gameplay to find the sweet spot that corresponds to your personal desires and appetite for risk. This level of customization empowers players to strengthen their virtual accounts and optimize their fulfillment, completely from the simplicity of their personal dwellings.
1xBet free promo code: 1XBOX777, get vip sports bonus of 100% up to €/$130 (or the equivalent in your local currency). Our website is a treasure trove of the most up-to-date promotions and bonus codes for the year 2024. Moreover, when you register at 1xBet casino using this bonus code, you’ll be greeted with a welcome bonus of €/$1950 and 150 free spins. These incredible bonuses enhance every new player’s winning potential, allowing them to indulge in thrilling gameplay with bonus funds.
Terrific work! This is the type of information that should be shared around the net. Shame on the search engines for not positioning this post higher! Come on over and visit my website . Thanks =)
Many thanks for sharing this great write-up. Very inspiring! (as always, btw)
Judging by the way you write, you seem like a professional writer..,~.”
You got a very great website, Gladiolus I found it through yahoo.
I really appreciate this post. I’ve been looking everywhere for this! Thank goodness I found it on Bing. You’ve made my day! Thank you again!
Very interesting topic , thankyou for posting .
дешевое такси заказ такси по телефону
Ramenbet промокод при регистрации
В мире онлайн-ставок, Ramenbet промокод представляет собой великолепную возможность для новых пользователей начать свой путь с дополнительными бонусами. Этот промокод не только улучшает первоначальный опыт на платформе, но и увеличивает шансы на успех.
Ramenbet промокод
Что такое Ramenbet промокод?
Промокоды – это специальные коды, которые игроки могут использовать при регистрации или внесении депозита, чтобы получить доступ к эксклюзивным предложениям и бонусам – https://happy-gift.ru/includes/pages/?promokod_ramenbet_2024_bonus_200_230_fs.html. Ramenbet промокод BONUSMEN открывает перед игроками множество выгодных возможностей, включая увеличенные бонусы на депозиты и фриспины.
Введение такого кода в процессе создания аккаунта или пополнения счета является своего рода мостом, соединяющим пользователей с лучшими игровыми предложениями от казино. Ramenbet промокод BONUSMEN не только расширяет игровые горизонты новичков, предоставляя им дополнительные средства для ставок и бесплатные вращения в популярных слотах, но и подчеркивает стремление казино вознаградить их за выбор именно этой платформы для азартных развлечений.
Преимущества Ramenbet промокода
Использование Ramenbet промокода приносит игрокам целый ряд преимуществ:
Получение дополнительных средств для ставок: Благодаря привлекательным процентам на депозиты, игроки могут значительно увеличить свой начальный капитал, что позволяет им делать более крупные ставки и увеличивать продолжительность игры.
Возможность испытать новые слоты без риска: Фриспины, предоставляемые в рамках промокода, дают уникальную возможность ознакомиться с новыми и популярными играми без необходимости тратить собственные средства, тем самым повышая шансы на обнаружение новых любимых слотов.
Усиление игрового опыта через специальные предложения: Фрибеты и ваучеры для использования в различных играх казино не только расширяют спектр возможностей для развлечения, но и предоставляют дополнительные шансы на выигрыш, делая каждую игру еще более захватывающей и прибыльной.
Регистрация с Ramenbet промокодом
Процедура создания учетной записи на платформе Ramenbet с активацией промокода представляет собой интуитивно понятный и удобный процесс, который делает начало игрового пути максимально приятным и выгодным. Вот детализированный план действий:
Открыть официальный веб-сайт Ramenbet: Первый шаг заключается в посещении портала Ramenbet, где будущий пользователь сталкивается с приветливым интерфейсом и легко обнаруживает раздел регистрации.
Переход к форме регистрации: На главной странице или в меню сайта расположена кнопка регистрации, которая направит пользователя на страницу с формой для заполнения.
Заполнение формы регистрационными данными: На этом этапе требуется внести основную информацию о себе, включая имя, адрес электронной почты, пароль для будущего входа в систему, а также другие важные сведения, необходимые для создания аккаунта.
Ввод Ramenbet промокода BONUSMEN: В форме регистрации предусмотрено специальное поле для промокода, куда следует аккуратно ввести код BONUSMEN. Это действие гарантирует получение всех бонусов, предусмотренных для новых игроков, включая дополнительные средства на счет и фриспины.
Завершение процесса регистрации: После заполнения всех необходимых полей и ввода промокода пользователю остается лишь подтвердить создание учетной записи, согласившись с условиями использования и политикой конфиденциальности казино. Обычно это требует верификации через электронную почту или мобильный телефон.
По завершении этих шагов аккаунт становится активным, а игрок получает доступ к своим бонусам, активированным промокодом BONUSMEN, что позволяет немедленно начать исследование игрового мира Ramenbet с дополнительными преимуществами.
промокод Ramenbet при регистрации
Бонусы по Ramenbet промокоду
Активация Ramenbet промокода BONUSMEN открывает для новых участников платформы доступ к серии щедрых бонусов, каждый из которых специально разработан, чтобы усилить их начальный опыт в мире онлайн-ставок и казино. Вот более детальный обзор предложений:
как проверить промокод на включает 200% увеличение депозитной суммы и до 30 фриспинов. Это означает, что первоначальный депозит утраивается, предоставляя игрокам значительно больше средств для использования в ставках и играх. Добавление до 30 фриспинов усиливает возможности для выигрыша, давая шанс испытать ещё больше игровых автоматов.
Дополнительные бонусы включают фрибет на сумму 500 и ваучер на 500 для игры в рулетку. Фрибет может быть использован в спортивных ставках, позволяя игрокам делать ставки на выбранные спортивные события без использования средств с их основного счета. Ваучер на 500 для рулетки дает дополнительные средства для использования в одной из самых популярных казино игр, увеличивая шансы на выигрыш.
Эти бонусы, активированные промокодом BONUSMEN, создают привлекательные условия для новых игроков, мотивируя их исследовать различные аспекты платформы Ramenbet и увеличивая их шансы на успешное начало игровой деятельности.
1xbet promo code: Unlock Bonuses for New Customers
The promo code for 1xBet is 1XBOX777. When creating an account, players in India can utilize this code to receive a bonus of 100% up to ?42,900 or $/€130. As a new customer at 1xBet, you have the opportunity to enhance your betting experience by using our special promo code. By entering the code during registration, you will gain access to an exclusive welcome bonus of 100% up to $100 on your first deposit. The bonus amount will be equivalent to your local currency if you choose to play in a different currency.
To claim this enticing offer, there are a few steps you need to follow. Firstly, create your account using the provided 1xBet promo code and ensure the validation of your account through the “My Profile” menu. Once that’s done, enable the feature that enables you to participate in the welcome bonus. Finally, make your initial deposit and start enjoying the benefits.
The terms and conditions for the welcome bonus are similar across all countries where 1xBet operates. However, each country may have specific requirements, so it’s essential to familiarize yourself with the details specific to your location.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://www.u-ma.co.jp/pag/?code_promo_1.html
An fascinating discussion is worth comment. I think that it’s best to write more on this topic, it won’t be a taboo topic however usually individuals are not enough to speak on such topics. To the next. Cheers
I was suggested this web site by way of my cousin. I’m no longer sure whether this put up is written through him as no one else recognize such distinctive approximately my difficulty. You are incredible! Thank you!
I recognize there exists plenty of spam on this blog. Do you want support cleansing them up? I may help amongst courses!
what’s up how are you ? Your blog is very neat, lots of valuable information and gives me motivation to start my own blog. Do you have any tips you can give me ? Also Which template are you using as your design its very reputable.
Wow, superb blog structure! How long have you been running a blog for? you made running a blog look easy. The total look of your website is fantastic, let alone the content material!
my sister and i loves to read christian books because it inspires us to live life in its fullest“
1xbet code: 1XBOX777. Avail a complimentary free bets bonus up to $/€130. Register using the bonus code and claim your bonus 100%. You can utilize the received bonus funds in sports or casino. By utilizing the promotional code, you can relish in a multitude of advantages, including deposit bonuses that match your initial investment, complimentary wagers, cashback incentives, and much more. These enticing bonuses grant you extra chances to triumph and enhance the thrill of your betting experience.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://arenafan.com/ads/list/?1xbet_promo_code_ghana_is_144___for_registration.html
Pro88
Pro88
Real fantastic info can be found on weblog .
I like what you guys are up too. Such smart work and reporting! Carry on the superb works guys I?ve incorporated you guys to my blogroll. I think it will improve the value of my web site
Aw, this was an incredibly good post. Finding the time and actual effort to generate a very good article… but what can I say… I hesitate a lot and never manage to get anything done.
Ramenbet промокод при регистрации
В мире онлайн-ставок, Ramenbet промокод представляет собой великолепную возможность для новых пользователей начать свой путь с дополнительными бонусами. Этот промокод не только улучшает первоначальный опыт на платформе, но и увеличивает шансы на успех.
Ramenbet промокод
Что такое Ramenbet промокод?
Промокоды – это специальные коды, которые игроки могут использовать при регистрации или внесении депозита, чтобы получить доступ к эксклюзивным предложениям и бонусам – https://etokirpichi.ru/articles/promokod_ramenbet_2024_bonus_200_230_fs.html. Ramenbet промокод BONUSMEN открывает перед игроками множество выгодных возможностей, включая увеличенные бонусы на депозиты и фриспины.
Введение такого кода в процессе создания аккаунта или пополнения счета является своего рода мостом, соединяющим пользователей с лучшими игровыми предложениями от казино. Ramenbet промокод BONUSMEN не только расширяет игровые горизонты новичков, предоставляя им дополнительные средства для ставок и бесплатные вращения в популярных слотах, но и подчеркивает стремление казино вознаградить их за выбор именно этой платформы для азартных развлечений.
Преимущества Ramenbet промокода
Использование Ramenbet промокода приносит игрокам целый ряд преимуществ:
Получение дополнительных средств для ставок: Благодаря привлекательным процентам на депозиты, игроки могут значительно увеличить свой начальный капитал, что позволяет им делать более крупные ставки и увеличивать продолжительность игры.
Возможность испытать новые слоты без риска: Фриспины, предоставляемые в рамках промокода, дают уникальную возможность ознакомиться с новыми и популярными играми без необходимости тратить собственные средства, тем самым повышая шансы на обнаружение новых любимых слотов.
Усиление игрового опыта через специальные предложения: Фрибеты и ваучеры для использования в различных играх казино не только расширяют спектр возможностей для развлечения, но и предоставляют дополнительные шансы на выигрыш, делая каждую игру еще более захватывающей и прибыльной.
Регистрация с Ramenbet промокодом
Процедура создания учетной записи на платформе Ramenbet с активацией промокода представляет собой интуитивно понятный и удобный процесс, который делает начало игрового пути максимально приятным и выгодным. Вот детализированный план действий:
Открыть официальный веб-сайт Ramenbet: Первый шаг заключается в посещении портала Ramenbet, где будущий пользователь сталкивается с приветливым интерфейсом и легко обнаруживает раздел регистрации.
Переход к форме регистрации: На главной странице или в меню сайта расположена кнопка регистрации, которая направит пользователя на страницу с формой для заполнения.
Заполнение формы регистрационными данными: На этом этапе требуется внести основную информацию о себе, включая имя, адрес электронной почты, пароль для будущего входа в систему, а также другие важные сведения, необходимые для создания аккаунта.
Ввод Ramenbet промокода BONUSMEN: В форме регистрации предусмотрено специальное поле для промокода, куда следует аккуратно ввести код BONUSMEN. Это действие гарантирует получение всех бонусов, предусмотренных для новых игроков, включая дополнительные средства на счет и фриспины.
Завершение процесса регистрации: После заполнения всех необходимых полей и ввода промокода пользователю остается лишь подтвердить создание учетной записи, согласившись с условиями использования и политикой конфиденциальности казино. Обычно это требует верификации через электронную почту или мобильный телефон.
По завершении этих шагов аккаунт становится активным, а игрок получает доступ к своим бонусам, активированным промокодом BONUSMEN, что позволяет немедленно начать исследование игрового мира Ramenbet с дополнительными преимуществами.
промокод Раменбет при регистрации
Бонусы по Ramenbet промокоду
Активация Ramenbet промокода BONUSMEN открывает для новых участников платформы доступ к серии щедрых бонусов, каждый из которых специально разработан, чтобы усилить их начальный опыт в мире онлайн-ставок и казино. Вот более детальный обзор предложений:
как использовать промокоды включает 200% увеличение депозитной суммы и до 30 фриспинов. Это означает, что первоначальный депозит утраивается, предоставляя игрокам значительно больше средств для использования в ставках и играх. Добавление до 30 фриспинов усиливает возможности для выигрыша, давая шанс испытать ещё больше игровых автоматов.
Дополнительные бонусы включают фрибет на сумму 500 и ваучер на 500 для игры в рулетку. Фрибет может быть использован в спортивных ставках, позволяя игрокам делать ставки на выбранные спортивные события без использования средств с их основного счета. Ваучер на 500 для рулетки дает дополнительные средства для использования в одной из самых популярных казино игр, увеличивая шансы на выигрыш.
Эти бонусы, активированные промокодом BONUSMEN, создают привлекательные условия для новых игроков, мотивируя их исследовать различные аспекты платформы Ramenbet и увеличивая их шансы на успешное начало игровой деятельности.
The last I checked on this topic was quite some time back. I am more into SEO Company. Nonetheless, fascinating post and I’d check back again soon and get myself much more updated.
порно
1xBet Promo Code and Betting Offers 2024
The 1XBET India Promo Code “1XBOX777” allows you to unlock an exclusive bonus of up to 66,000 INR when you sign up at the sportsbook. This offer is valid throughout the year 2024. Immerse yourself in the world of sports betting and take advantage of this incredible opportunity to boost your winnings. Join 1XBET today, enter the promo code during registration, and elevate your betting experience to new heights! 1xBet offers enticing betting offers to its users in India.
Here are the main offers available with the 1xBet promo code:
Sports Welcome Bonus: New users can receive a 100% bonus on their first deposit, up to INR 26,000, using the promo code. The bonus can be used for any sports betting market.
Lucky Friday Offer: Every Friday, 1xBet presents a 100% bonus on deposits made that day, up to INR 10,000. To take advantage of this offer, users need to deposit on Friday and enter the promo code “LuckyFriday.”
Accumulator of the Day: 1xBet selects a daily accumulator bet with high odds and offers an additional 10% bonus on potential winnings. To participate, users must place a bet on the selected accumulator, and if it wins, they receive the bonus.
These offers aim to enhance users’ betting experience on 1xBet. Remember to use the 1xbt promo code when making your first deposit to enjoy the sports welcome bonus as a new customer.
Year-Round Promotional Offers
Throughout the year, 1xBet India presents various promotional offers for both new and existing customers. These can include free bets, cashback, reload bonuses, and more. Some popular promotions include the Lucky Friday offer, providing up to INR 10,000 in bonus funds, and the Wednesday promotion, offering a free bet worth INR 500 for bets on specific sports events.
Furthermore, 1xBet India organizes special promotions during major sporting events like the Indian Premier League (IPL) and the Cricket World Cup. These promotions often feature enhanced odds, free bets, and other exciting perks. Keep an eye on the promotions page on the 1xBet India website or subscribe to the newsletter to stay updated on the latest offers.
Don’t miss out on the opportunity to enhance your betting experience by using the 1xBet promo code and taking advantage of these incredible offers on the platform.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://www.u-ma.co.jp/pag/?code_promo_1.html
Great information shared.. really enjoyed reading this post thank you author for sharing this post .. appreciated
Found your blog in the Google bulk turtleneck shirts directory, very nice job, thanks.
1xBet Bonus Package for Indian Casino Customers
Experience the ultimate excitement of online casino gaming with the exclusive Casino Welcome Offer at 1xBet India 2024. Get ready for an immersive and thrilling journey filled with a wide variety of live dealer games and a vast selection of captivating slots. Unlock this amazing offer by using the 1xBet promo code and take your casino adventure to new heights.
1xBet casino promo code: 1XBOX777, bonus 100% up to $1950 and 150 free spins at the casino. Gain access to an exceptional casino welcome package worth ?130,000. This bonus can be claimed across four separate deposits, allowing you to maximize your rewards and extend your gaming sessions. Prepare to be enthralled by the exhilarating gameplay, stunning graphics, and immersive sound effects that will transport you to the heart of the casino action.
Whether you’re a fan of classic table games or prefer the excitement of spinning the reels on slots, 1xBet has you covered. Explore an extensive collection of live dealer games, where you can interact with professional dealers in real-time for an authentic casino experience. Additionally, the slots section boasts a diverse range of games, ensuring there’s something to suit every preference and style.
Attention all casino enthusiasts! You definitely don’t want to miss out on this incredible opportunity to elevate your casino journey. By using the exclusive 1xbt promo code: 1XBOX777, you can unlock a remarkable ?169,000 welcome package along with 150 free spins for the year 2024. Immerse yourself in the excitement of the casino, make the most of the bonuses, and embark on a gaming adventure like no other at 1xBet India.
For our valued Indian customers who have a keen interest in the casino section, 1xBet presents an enticing alternative welcome package. This package is designed to enhance your gaming experience across your first four deposits, allowing you to receive a whopping ?169,000 in addition to 150 free spins.
Here’s how the bonus package is divided:
1st deposit: 100% matched bonus + 30 free spins on Reliquary of Ra
2nd deposit: 50% matched bonus + 35 free spins on Chieftain Buffalo
3rd deposit: 25% matched bonus + 40 free spins on Stampede Buffalo
4th deposit: 25% matched bonus + 45 free spins on Rich of the Mermaid Hold and Spin
Embrace the Excitement at 1xBet
With these enticing promo codes and bonus offers, 1xBet ensures that new customers can kickstart their betting journey with a thrilling advantage. Whether you prefer sports betting or exploring the casino games, 1xBet has something for everyone. Don’t miss out on the opportunity to elevate your gaming experience—join 1xBet today and unlock a world of excitement.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://ogloszenia.bialystokonline.pl/pliki/index.php?1xbet_promo_code_420.html
Oh my goodness! an incredible article dude. Thank you However I am experiencing situation with ur rss . Don’t know why Unable to subscribe to it. Is there anyone getting an identical rss problem? Anyone who knows kindly respond. Thnkx
Thanks so much for sharing this great info! I am looking forward to see more posts!
When visiting blogs, i always look for a very nice content like yours “
I really like your writing style, great information, thankyou for putting up : D.
Exactly what I was looking for, appreciate it for posting .
I’ll immediately grab your rss feed as I can not to find your e-mail subscription link or e-newsletter service. Do you have any? Please let me understand so that I may just subscribe. Thanks!
купить диплом в воронеже https://6landik-diploms.com
Консультация по оптимизации продвижению.
Информация о том как работать с низкочастотными ключевыми словами и как их подбирать
Стратегия по работе в соперничающей нише.
Имею регулярных работаю с 3 организациями, есть что сообщить.
Изучите мой аккаунт, на 31 мая 2024г
общий объём завершённых задач 2181 только здесь.
Консультация только устно, без скриншотов и отчётов.
Время консультации указано 2 ч, и факту всегда на контакте без строгой привязки к графику.
Как взаимодействовать с софтом это уже отдельная история, консультация по использованию ПО договариваемся отдельно в специальном услуге, выясняем что необходимо при коммуникации.
Всё без суеты на расслабленно не спеша
To get started, the seller needs:
Мне нужны контакты от телеграм чата для коммуникации.
разговор только вербально, переписываться недостаточно времени.
Суббота и Вс выходные
1xBet Promo Code and Betting Offers 2024
The 1XBET India Promo Code “1XBOX777” allows you to unlock an exclusive bonus of up to 66,000 INR when you sign up at the sportsbook. This offer is valid throughout the year 2024. Immerse yourself in the world of sports betting and take advantage of this incredible opportunity to boost your winnings. Join 1XBET today, enter the promo code during registration, and elevate your betting experience to new heights! 1xBet offers enticing betting offers to its users in India.
Here are the main offers available with the 1xBet promo code:
Sports Welcome Bonus: New users can receive a 100% bonus on their first deposit, up to INR 26,000, using the promo code. The bonus can be used for any sports betting market.
Lucky Friday Offer: Every Friday, 1xBet presents a 100% bonus on deposits made that day, up to INR 10,000. To take advantage of this offer, users need to deposit on Friday and enter the promo code “LuckyFriday.”
Accumulator of the Day: 1xBet selects a daily accumulator bet with high odds and offers an additional 10% bonus on potential winnings. To participate, users must place a bet on the selected accumulator, and if it wins, they receive the bonus.
These offers aim to enhance users’ betting experience on 1xBet. Remember to use the 1xbt promo code when making your first deposit to enjoy the sports welcome bonus as a new customer.
Year-Round Promotional Offers
Throughout the year, 1xBet India presents various promotional offers for both new and existing customers. These can include free bets, cashback, reload bonuses, and more. Some popular promotions include the Lucky Friday offer, providing up to INR 10,000 in bonus funds, and the Wednesday promotion, offering a free bet worth INR 500 for bets on specific sports events.
Furthermore, 1xBet India organizes special promotions during major sporting events like the Indian Premier League (IPL) and the Cricket World Cup. These promotions often feature enhanced odds, free bets, and other exciting perks. Keep an eye on the promotions page on the 1xBet India website or subscribe to the newsletter to stay updated on the latest offers.
Don’t miss out on the opportunity to enhance your betting experience by using the 1xBet promo code and taking advantage of these incredible offers on the platform.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://ogloszenia.bialystokonline.pl/pliki/index.php?1xbet_promo_code_420.html
номер такси в новочеркасске https://taxi-novocherkassk.ru/
мобильное такси https://zakaz-taxionline.ru/
You ought to be a part of a contest for one of the most effective blogs on the net. I’ll suggest this blog!
I think this is one of the most important information for me. And i’m glad reading your article. But want to remark on some general things, The website style is wonderful, the articles is really great : D. Good job, cheers
Ищете способ расслабиться и получить незабываемые впечатления? Мы https://t.me/intim_tmn72 предлагаем эксклюзивные встречи с привлекательными и профессиональными компаньонками. Конфиденциальность, комфорт и безопасность гарантированы. Позвольте себе наслаждение и отдых в приятной компании.
UEFA EURO
Ищете способ расслабиться и получить незабываемые впечатления? Мы https://t.me/intim_tmn72 предлагаем эксклюзивные встречи с привлекательными и профессиональными компаньонками. Конфиденциальность, комфорт и безопасность гарантированы. Позвольте себе наслаждение и отдых в приятной компании.
1xbet promo code: 1XBOX777 enter the code during registration and receive a welcome bonus of up to $130 for sports betting and a casino bonus of €1,950 + 150 free spin. Register now at 1xBet to take advantage of this incredible offer. 1xBet Promotion 2024 offers a range of exciting incentives for players. With bonus codes, you can unlock additional benefits and enhance your gaming experience. Get your hands on free money and enjoy the thrill of playing with bonus free bets. Take advantage of this opportunity to play for free and make the most out of your time at 1xBet.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://www.cbtrends.com/captcha/pages/1xbet_bonus_shartlari_2020.html
I am usually to blogging we really appreciate your website content continuously. The article has truly peaks my interest. I will bookmark your web blog and keep checking for new info.
I absolutely love your blog and find nearly all of your post’s to be precisely what I’m looking for. Would you offer guest writers to write content for you? I wouldn’t mind creating a post or elaborating on many of the subjects you write in relation to here. Again, awesome web site!
Glad to be one of many visitants on this awing internet site : D.
Having read this I thought it was very informative. I appreciate you taking the time and effort to put this article together. I once again find myself spending way to much time both reading and commenting. But so what, it was still worth it!
Thank you for making the honest try to explain this. I feel very strong about it and wish to be informed more. If it’s OK, as you attain extra intensive knowledge, could you thoughts adding more posts similar to this one with more information? It could be extremely helpful and helpful for me and my colleagues.
Rattling wonderful information can be found on website .
Greetings, May I download your page image and make use of it on my own blog site?
Very nice post. I just stumbled upon your blog and wished to say that I have really enjoyed surfing around
your blog posts. In any case I’ll be subscribing to your feed and I hope
you write again very soon!
жк купить квартиру от застройщика https://kupit-kvartirukzn.ru
https://aisory.tech – платформа для создания AI Telegram-ботов. Наделяйте своих ботов способностями к естественному диалогу, генерации уникального контента и решению аналитических задач. Простой конструктор платформы делает создание умных чат-ботов доступным для любой компании.
купить квартиру в новостройке от застройщика купить квартиру от застройщика недорого
купить квартиру в казани от застройщика жк казань купить квартиру от застройщика
Oh my goodness! a fantastic article dude. Appreciate it However My business is experiencing problem with ur rss . Don’t know why Unable to sign up to it. Possibly there is anybody getting identical rss difficulty? Anybody who knows kindly respond. Thnkx
1xbet code: 1XBOX777 enter the code during registration and receive a welcome bonus of up to $130 for sports betting and a casino bonus of €1,950 + 150 free spin. Register now at 1xBet to take advantage of this incredible offer. 1xBet Promotion 2024 offers a range of exciting incentives for players. With bonus codes, you can unlock additional benefits and enhance your gaming experience. Get your hands on free money and enjoy the thrill of playing with bonus free bets. Take advantage of this opportunity to play for free and make the most out of your time at 1xBet.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://www.u-ma.co.jp/pag/?code_promo_1.html
what i can i say, pizza restaurants are really the best and they can really fill my belly**
Rachel Weisz have that mysterious look and she is very appealing to most men and women::
https://stixandstonz.ca/polaslot138
аниме атака титанов атака титанов онлайн
you’re really a good webmaster. The web site loading speed is incredible. It seems that you are doing any unique trick. Also, The contents are masterpiece. you’ve done a wonderful job on this topic!
I start to hate this junk e-mail from writing here figures on the forums… Your journal looks as unoccupied without… Would You like to serve me and show to all the know-how you are using if You’re fighting against the spamers? TX
атака титанов https://ataka-titanov-anime.ru
You should participate in a contest for among the best blogs on the web. I will advocate this website!
купить мебель недорого https://formomebel.ru/krovati
I’m not that much of a internet reader to be honest but your blogs really nice, keep it up! I’ll go ahead and bookmark your website to come back later on. All the best Miss Herbal Vitamins
I was reading some of your content on this internet site and I conceive this internet site is real informative ! Retain putting up.
Hey there! I just wanted to ask if you ever have any issues with hackers? My last blog (wordpress) was hacked and I ended up losing several weeks of hard work due to no data backup. Do you have any solutions to protect against hackers?
online casino no deposit bonus keep what you win australia gaming bets
голяк кубик в кубе бесплатно https://golyak-serial-online.ru
娛樂城官網
娛樂城官網
1xbet: 1XBOX777 bonus for new players up to €/$130. The bonus code must be entered during registration, and then you will receive a best welcome bonus in 2024. 1xBet is a well-known and reliable bookmaker, recognized for its wide selection of sports betting choices and attractive promotions. By utilizing the top-notch 1xBet promotional code, you can unlock an outstanding bonus that enables you to wager on a multitude of sports events and potentially rake in significant profits. Seize this opportunity and relish the thrill of risk-free betting.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://ogloszenia.bialystokonline.pl/pliki/index.php?1xbet_promo_code_420.html
голяк бесплатно https://golyak-serial-online.ru
you are actually a excellent webmaster. The web site loading pace is amazing.
It seems that you’re doing any unique trick. Also, The contents are masterwork.
you’ve done a excellent activity in this topic!
Hmm is anyone else experiencing problems with the images on this blog loading? I’m trying to determine if its a problem on my end or if it’s the blog. Any feed-back would be greatly appreciated.
when it comes to free games, i always look for free flash games because they have small file sizes.,
I believe this internet site has got some rattling superb info for everyone. “The penalty of success is to be bored by the attentions of people who formerly snubbed you.” by Mary Wilson Little.
Really nice pattern and excellent content, very little else we want .
1xBet Promo Code and Betting Offers 2024
The 1XBET India Promo Code “1XBOX777” allows you to unlock an exclusive bonus of up to 66,000 INR when you sign up at the sportsbook. This offer is valid throughout the year 2024. Immerse yourself in the world of sports betting and take advantage of this incredible opportunity to boost your winnings. Join 1XBET today, enter the promo code during registration, and elevate your betting experience to new heights! 1xBet offers enticing betting offers to its users in India.
Here are the main offers available with the 1xBet promo code:
Sports Welcome Bonus: New users can receive a 100% bonus on their first deposit, up to INR 26,000, using the promo code. The bonus can be used for any sports betting market.
Lucky Friday Offer: Every Friday, 1xBet presents a 100% bonus on deposits made that day, up to INR 10,000. To take advantage of this offer, users need to deposit on Friday and enter the promo code “LuckyFriday.”
Accumulator of the Day: 1xBet selects a daily accumulator bet with high odds and offers an additional 10% bonus on potential winnings. To participate, users must place a bet on the selected accumulator, and if it wins, they receive the bonus.
These offers aim to enhance users’ betting experience on 1xBet. Remember to use the 1xbet code when making your first deposit to enjoy the sports welcome bonus as a new customer.
Year-Round Promotional Offers
Throughout the year, 1xBet India presents various promotional offers for both new and existing customers. These can include free bets, cashback, reload bonuses, and more. Some popular promotions include the Lucky Friday offer, providing up to INR 10,000 in bonus funds, and the Wednesday promotion, offering a free bet worth INR 500 for bets on specific sports events.
Furthermore, 1xBet India organizes special promotions during major sporting events like the Indian Premier League (IPL) and the Cricket World Cup. These promotions often feature enhanced odds, free bets, and other exciting perks. Keep an eye on the promotions page on the 1xBet India website or subscribe to the newsletter to stay updated on the latest offers.
Don’t miss out on the opportunity to enhance your betting experience by using the 1xBet promo code and taking advantage of these incredible offers on the platform.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://www.cbtrends.com/captcha/pages/1xbet_bonus_shartlari_2020.html
FitSpresso: An Outline FitSpresso is a weight management formula made using five herbal ingredients.
slot demo pg soft
Slotเว็บตรง – เล่นได้ทุกอุปกรณ์อิเล็กทรอนิกส์ที่เชื่อมต่ออินเทอร์เน็ต
ในปัจจุบันนี้ การเล่นสล็อตมีความไม่ยุ่งยากมากยิ่งขึ้น คุณไม่จำเป็นเดินทางไปยังบ่อนการพนันที่ไหน ๆ เพียงแค่มีอุปกรณ์อิเล็กทรอนิกส์ที่ใช้งานได้เชื่อมต่อกับอินเทอร์เน็ต คุณก็มีโอกาสสนุกกับการปั่นสล็อตออนไลน์กับ PG Slot ได้จากทุกที่
การเสริมสร้างเทคโนโลยีของ PG Slot
ที่ PG Slot เราได้พัฒนาโซลูชั่นสำหรับการดูแลเกมคาสิโนออนไลน์เพื่อตอบสนองความต้องการให้มากที่สุด คุณไม่ต้องติดตั้งซอฟต์แวร์หรือติดตั้งแอปพลิเคชันใด ๆ ให้ซับซ้อนหรือเปลืองพื้นที่ในอุปกรณ์เชื่อมต่อของคุณ การให้บริการเกมสล็อตออนไลน์ของเราใช้งานผ่านเว็บตรงที่ใช้เทคโนโลยี HTML 5 ที่ล้ำสมัย
เล่นเกมสล็อตได้ทุกอุปกรณ์เชื่อมต่อ
คุณอาจเล่นสล็อตออนไลน์กับ PG Slot ได้อย่างสะดวกเพียงเข้าสู่ในเว็บไซต์ของเรา เว็บตรงสล็อตออนไลน์ของเรารองรับทุกแพลตฟอร์มและทุกเครื่องทั้ง Android และ iOS ไม่ว่าคุณจะใช้โทรศัพท์มือถือ แล็ปท็อป หรือไอแพดรุ่นไหน ก็มีโอกาสมั่นใจได้ว่าคุณจะเล่นสล็อตออนไลน์ได้อย่างไม่มีสะดุด ไม่มีอุปสรรคหรือสะดุดใด ๆ
ลองเล่นเกมสล็อตฟรี
เว็บตรงของเราเปิดให้บริการเพียงแค่คุณเข้ามาในเว็บไซต์ของ PG Slot ก็สามารถทดลองเล่นสล็อตฟรีได้ทันที ไม่ต้องเสียค่าธรรมเนียมใด ๆ นี่เป็นโอกาสที่ดีในการทดลองเล่นและศึกษาเกมเกี่ยวกับเกมก่อนที่จะวางเดิมพันด้วยเงินจริง
การเล่นสล็อตออนไลน์กับ PG Slot ช่วยให้คุณสามารถเพลิดเพลินกับการเล่นเกมคาสิโนได้ทุกที่ทุกเวลา ไม่ว่าคุณจะอยู่ที่ไหน เพียงแค่มีเครื่องมือที่ใช้งานอินเทอร์เน็ต คุณก็อาจสนุกกับการเล่นสล็อตได้อย่างไม่มีข้อผูกมัด!
https://instantcarrepairburnaby.ca/grandbet88
1xbet promo code: 1XBOX777. Avail a complimentary free bets bonus up to $/€130. Register using the bonus code and claim your bonus 100%. You can utilize the received bonus funds in sports or casino. By utilizing the promotional code, you can relish in a multitude of advantages, including deposit bonuses that match your initial investment, complimentary wagers, cashback incentives, and much more. These enticing bonuses grant you extra chances to triumph and enhance the thrill of your betting experience.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://www.u-ma.co.jp/pag/?code_promo_1.html
娛樂城
富遊娛樂城評價:2024年最新評價
推薦指數 : ★★★★★ ( 5.0/5 )
富遊娛樂城作為目前最受歡迎的博弈網站之一,在台灣擁有最高的註冊人數。
RG富遊以安全、公正、真實和順暢的品牌保證,贏得了廣大玩家的信賴。富遊線上賭場不僅提供了豐富多樣的遊戲種類,還有眾多吸引人的優惠活動。在出金速度方面,獲得無數網紅和網友的高度評價,確保玩家能享有無憂的博弈體驗。
推薦要點
新手首選: 富遊娛樂城,2024年評選首選,提供專為新手打造的豐富教學和獨家優惠。
一存雙收: 首存1000元,立獲1000元獎金,僅需1倍流水,新手友好。
免費體驗: 新玩家享免費體驗金,暢遊各式遊戲,開啟無限可能。
優惠多元: 活動豐富,流水要求低,適合各類型玩家。
玩家首選: 遊戲多樣,服務優質,是新手與老手的最佳賭場選擇。
富遊娛樂城詳情資訊
賭場名稱 : RG富遊
創立時間 : 2019年
賭場類型 : 現金版娛樂城
博弈執照 : 馬爾他牌照(MGA)認證、英屬維爾京群島(BVI)認證、菲律賓(PAGCOR)監督競猜牌照
遊戲類型 : 真人百家樂、運彩投注、電子老虎機、彩票遊戲、棋牌遊戲、捕魚機遊戲
存取速度 : 存款5秒 / 提款3-5分
軟體下載 : 支援APP,IOS、安卓(Android)
線上客服 : 需透過官方LINE
富遊娛樂城優缺點
優點
台灣註冊人數NO.1線上賭場
首儲1000贈1000只需一倍流水
擁有體驗金免費體驗賭場
網紅部落客推薦保證出金線上娛樂城
缺點
需透過客服申請體驗金
富遊娛樂城存取款方式
存款方式
提供四大超商(全家、7-11、萊爾富、ok超商)
虛擬貨幣ustd存款
銀行轉帳(各大銀行皆可)
取款方式
網站內申請提款及可匯款至綁定帳戶
現金1:1出金
富遊娛樂城平台系統
真人百家 — RG真人、DG真人、歐博真人、DB真人(原亞博/PM)、SA真人、OG真人、WM真人
體育投注 — SUPER體育、鑫寶體育、熊貓體育(原亞博/PM)
彩票遊戲 — 富遊彩票、WIN 539
電子遊戲 —RG電子、ZG電子、BNG電子、BWIN電子、RSG電子、GR電子(好路)
棋牌遊戲 —ZG棋牌、亞博棋牌、好路棋牌、博亞棋牌
電競遊戲 — 熊貓體育
捕魚遊戲 —ZG捕魚、RSG捕魚、好路GR捕魚、DB捕魚
Harry Potter is the best, i really like Daniel Radcliffe because he acts very well.
it is a known fact that baby skin is very delicate despite it’s very smooth and soft appearance-
I always was interested in this topic and still am, thankyou for posting .
Hi, i think that i saw you visited my blog thus i came to
“return the favor”.I am attempting to find things to improve my site!I suppose its ok to use some of your ideas!!
pretty practical stuff, overall I consider this is worth a bookmark, thanks
I do not know the things I could possibly have implemented without these methods shown by you over such a area of interest. T
Conveyancing… […]we like to honor other sites on the web, even if they aren’t related to us, by linking to them. Below are some sites worth checking out[…]…
You created some decent points there. I looked online with the problem and discovered most individuals should go together with with all your website.
howdy, I’m having bad luck trying to rank up for the words “victorias secret coupon codes”… Please approve my comment!!
Bloghopping is really my forte and i like to visit blogs”
I truly appreciate this post. I?ve been looking all over for this! Thank goodness I found it on Bing. You’ve made my day! Thanks again
healthy eating should be our top priority since there are many junk foods and foods with no nutritional value these days~
Super diary! I actually enjoy how it is easygoing on my eyes and also the information are good scripted. I am questioning how I might be notified whenever a newborn post has been successful. I have signed to your rss feed which must make the trick! By!
I’ve been exploring for a little for any high-quality articles or blog posts on this sort of area . Exploring in Yahoo I at last stumbled upon this website. Reading this information So i’m happy to convey that I have an incredibly good uncanny feeling I discovered just what I needed. I most certainly will make certain to do not forget this web site and give it a glance on a constant basis.
I’ve found your blog before, but I’ve never left a comment. Today, I thought to myself, “I should leave a comment.” So here’s my comment! Continue with the awesome work! I enjoy your articles and would hate to see them end.
Wow! This could be one particular of the most helpful blogs We have ever arrive across on this subject. Basically Magnificent. I am also a specialist in this topic therefore I can understand your effort.
hantuslot
娛樂城推薦
2024娛樂城推薦,經過玩家實測結果出爐Top5!
2024娛樂城排名是這五間上榜,玩家尋找娛樂城無非就是要找穩定出金娛樂城,遊戲體驗良好、速度流暢,Ace博評網都幫你整理好了,給予娛樂城新手最佳的指南,不再擔心被黑網娛樂城詐騙!
2024娛樂城簡述
在現代,2024娛樂城數量已經超越以前,面對琳瑯滿目的娛樂城品牌,身為新手的玩家肯定難以辨別哪間好、哪間壞。
好的平台提供穩定的速度與遊戲體驗,穩定的系統與資訊安全可以保障用戶的隱私與資料,不用擔心收到傳票與任何網路威脅,這些線上賭場也提供合理的優惠活動給予玩家。
壞的娛樂城除了會騙取你的金錢之外,也會打著不實的廣告、優惠滿滿,想領卻是一場空!甚至有些平台還沒辦法登入,入口網站也是架設用來騙取新手儲值進他們口袋,這些黑網娛樂城是玩家必須避開的風險!
評測2024娛樂城的標準
Ace這次從網路上找來五位使用過娛樂城資歷2年以上的老玩家,給予他們使用各大娛樂城平台,最終選出Top5,而評選標準為下列這些條件:
以玩家觀點出發,優先考量玩家利益
豐富的遊戲種類與卓越的遊戲體驗
平台的信譽及其安全性措施
客服團隊的回應速度與服務品質
簡便的儲值流程和多樣的存款方法
吸引人的優惠活動方案
前五名娛樂城表格
賭博網站排名 線上賭場 平台特色 玩家實測評價
No.1 富遊娛樂城 遊戲選擇豐富,老玩家優惠多 正面好評
No.2 bet365娛樂城 知名大廠牌,運彩盤口選擇多 介面流暢
No.3 亞博娛樂城 多語言支持,介面簡潔順暢 賽事豐富
No.4 PM娛樂城 撲克牌遊戲豐富,選擇多元 直播順暢
No.5 1xbet娛樂城 直播流暢,安全可靠 佳評如潮
線上娛樂城玩家遊戲體驗評價分享
網友A:娛樂城平台百百款,富遊娛樂城是我3年以來長期使用的娛樂城,別人有的系統他們都有,出金也沒有被卡過,比起那些玩娛樂城還會收到傳票的娛樂城,富遊真的很穩定,值得推薦。
網友B:bet365中文的介面簡約,還有超多體育賽事盤口可以選擇,此外賽事大部分也都有附上直播來源,不必擔心看不到賽事最新狀況,全螢幕還能夠下單,真的超方便!
網友C:富遊娛樂城除了第一次儲值有優惠之外,儲值到一定金額還有好禮五選一,實用又方便,有問題的時候也有客服隨時能夠解答。
網友D:從大陸來台灣工作,沒想到台灣也能玩到亞博體育,這是以前在大陸就有使用的平台,雖然不是簡體字,但使用介面完全沒問題,遊戲流暢、速度比以前使用還更快速。
網友E:看玖壹壹MV發現了PM娛樂城這個大品牌,PM的真人百家樂沒有輸給在澳門實地賭場,甚至根本不用出門,超級方便的啦!
menangbet88
Greetings! This is my first visit to your blog! We are a team of volunteers and starting a new initiative in a community in the same niche. Your blog provided us valuable information to work on. You have done a marvellous job!
The Exponential Curve of Fascist Unconstitutionality is accelerating straight up and cannot be slowed down it can only be beheaded, executed albeit politically rather than as Sultans do it.
Портал о культуре – ваш гид по культурной жизни города. Здесь вы найдёте информацию о театрах, музеях, галереях и исторических достопримечательностях. Откройте для себя яркие события, фестивали и выставки, которые делают Ярославль культурной жемчужиной России.
Some genuinely great info , Glad I found this.
David Bowie is a classic, i like all his songs during the old days.::
регистрация драгон мани казино Dragon Money Casino
I am glad to be one of many visitors on this outstanding web site (:, thanks for posting .
娛樂城
Player台灣線上娛樂城遊戲指南與評測
台灣最佳線上娛樂城遊戲的終極指南!我們提供專業評測,分析熱門老虎機、百家樂、棋牌及其他賭博遊戲。從遊戲規則、策略到選擇最佳娛樂城,我們全方位覆蓋,協助您更安全的遊玩。
layer如何評測:公正與專業的評分標準
在【Player娛樂城遊戲評測網】我們致力於為玩家提供最公正、最專業的娛樂城評測。我們的評測過程涵蓋多個關鍵領域,旨在確保玩家獲得可靠且全面的信息。以下是我們評測娛樂城的主要步驟:
安全與公平性
安全永遠是我們評測的首要標準。我們審查每家娛樂城的執照資訊、監管機構以及使用的隨機數生成器,以確保其遊戲結果的公平性和隨機性。
02.
遊戲品質與多樣性
遊戲的品質和多樣性對於玩家體驗至關重要。我們評估遊戲的圖形、音效、用戶介面和創新性。同時,我們也考量娛樂城提供的遊戲種類,包括老虎機、桌遊、即時遊戲等。
03.
娛樂城優惠與促銷活動
我們仔細審視各種獎勵計劃和促銷活動,包括歡迎獎勵、免費旋轉和忠誠計劃。重要的是,我們也檢查這些優惠的賭注要求和條款條件,以確保它們公平且實用。
04.
客戶支持
優質的客戶支持是娛樂城質量的重要指標。我們評估支持團隊的可用性、響應速度和專業程度。一個好的娛樂城應該提供多種聯繫方式,包括即時聊天、電子郵件和電話支持。
05.
銀行與支付選項
我們檢查娛樂城提供的存款和提款選項,以及相關的處理時間和手續費。多樣化且安全的支付方式對於玩家來說非常重要。
06.
網站易用性、娛樂城APP體驗
一個直觀且易於導航的網站可以顯著提升玩家體驗。我們評估網站的設計、可訪問性和移動兼容性。
07.
玩家評價與反饋
我們考慮真實玩家的評價和反饋。這些資料幫助我們了解娛樂城在實際玩家中的表現。
娛樂城常見問題
娛樂城是什麼?
娛樂城是什麼?娛樂城是台灣對於線上賭場的特別稱呼,線上賭場分為幾種:現金版、信用版、手機娛樂城(娛樂城APP),一般來說,台灣人在稱娛樂城時,是指現金版線上賭場。
線上賭場在別的國家也有別的名稱,美國 – Casino, Gambling、中國 – 线上赌场,娱乐城、日本 – オンラインカジノ、越南 – Nhà cái。
娛樂城會被抓嗎?
在台灣,根據刑法第266條,不論是實體或線上賭博,參與賭博的行為可處最高5萬元罰金。而根據刑法第268條,為賭博提供場所並意圖營利的行為,可能面臨3年以下有期徒刑及最高9萬元罰金。一般賭客若被抓到,通常被視為輕微罪行,原則上不會被判處監禁。
信用版娛樂城是什麼?
信用版娛樂城是一種線上賭博平台,其中的賭博活動不是直接以現金進行交易,而是基於信用系統。在這種模式下,玩家在進行賭博時使用虛擬的信用點數或籌碼,這些點數或籌碼代表了一定的貨幣價值,但實際的金錢交易會在賭博活動結束後進行結算。
現金版娛樂城是什麼?
現金版娛樂城是一種線上博弈平台,其中玩家使用實際的金錢進行賭博活動。玩家需要先存入真實貨幣,這些資金轉化為平台上的遊戲籌碼或信用,用於參與各種賭場遊戲。當玩家贏得賭局時,他們可以將這些籌碼或信用兌換回現金。
娛樂城體驗金是什麼?
娛樂城體驗金是娛樂場所為新客戶提供的一種免費遊玩資金,允許玩家在不需要自己投入任何資金的情況下,可以進行各類遊戲的娛樂城試玩。這種體驗金的數額一般介於100元到1,000元之間,且對於如何使用這些體驗金以達到提款條件,各家娛樂城設有不同的規則。
在现代,在线赌场提供了多种便捷的存款和取款方式。对于较大金额的存款,您可以选择中国信托、台中银行、合作金库、台新银行、国泰银行或中华邮政。这些银行提供的服务覆盖金额范围从$1000到$10万,确保您的资金可以安全高效地转入赌场账户。
如果您需要进行较小金额的存款,可以选择通过便利店充值。7-11、全家、莱尔富和OK超商都提供这种服务,适用于金额范围在$1000到$2万之间的充值。通过这些便利店,您可以轻松快捷地完成资金转账,无需担心银行的营业时间或复杂的操作流程。
在进行娱乐场提款时,您可以选择通过各大银行转账或ATM转账。这些方法不仅安全可靠,而且非常方便,适合各种提款需求。最低提款金额为$1000,而上限则没有限制,确保您可以灵活地管理您的资金。
在选择在线赌场时,玩家评价和推荐也是非常重要的。许多IG网红和部落客,如丽莎、穎柔、猫少女日记-Kitty等,都对一些知名的娱乐场给予了高度评价。这些推荐不仅帮助您找到可靠的娱乐场所,还能确保您在游戏中享受到最佳的用户体验。
总体来说,在线赌场通过提供多样化的存款和取款方式,以及得到广泛认可的服务质量,正在不断吸引更多的玩家。无论您选择通过银行还是便利店进行充值,都能体验到快速便捷的操作。同时,通过查看玩家的真实评价和推荐,您也能更有信心地选择合适的娱乐场,享受安全、公正的游戏环境。
I was looking at some of your blog posts on this site and I believe this website is really informative ! Keep on posting .
2024娛樂城介紹
台灣2024娛樂城越開越多間,新開的線上賭場層出不窮,每間都以獨家的娛樂城優惠和體驗金來吸引玩家,致力於提供一流的賭博遊戲體驗。以下來介紹這幾間娛樂城網友對他們的真實評價,看看哪些娛樂城上榜了吧!
2024娛樂城排名
2023下半年,各家娛樂城競爭激烈,相繼推出誘人優惠,不論是娛樂城體驗金、反水流水還是首儲禮金,甚至還有娛樂城抽I15手機。以下就是2024年網友推薦的娛樂城排名:
NO.1 富遊娛樂城
NO.2 Bet365台灣
NO.3 DG娛樂城
NO.4 九州娛樂城
NO.5 亞博娛樂城
2024娛樂城推薦
根據2024娛樂城排名,以下將富遊娛樂城、BET365、亞博娛樂城、九州娛樂城、王者娛樂城推薦給大家,包含首儲贈點、免費體驗金、存提款速度、流水等等…
娛樂城遊戲種類
線上娛樂城憑藉其廣泛的遊戲種類,成功滿足了各式各樣玩家的喜好和需求。這些娛樂城遊戲不僅多元化且各具特色,能夠為玩家提供無與倫比的娛樂體驗。下面是一些最受歡迎的娛樂城遊戲類型:
電子老虎機
魔龍傳奇、雷神之鎚、戰神呂布、聚寶財神、鼠來寶、皇家777
真人百家樂
真人視訊百家樂、牛牛、龍虎、炸金花、骰寶、輪盤
電子棋牌
德州撲克、兩人麻將、21點、十三支、妞妞、三公、鬥地主、大老二、牌九
體育下注
世界盃足球賽、NBA、WBC世棒賽、英超、英雄聯盟LOL、特戰英豪
線上彩票
大樂透、539、美國天天樂、香港六合彩、北京賽車
捕魚機遊戲
三仙捕魚、福娃捕魚、招財貓釣魚、西遊降魔、吃我一砲、賓果捕魚
2024娛樂城常見問題
娛樂城是什麼?
娛樂城/線上賭場(現金網)是台灣對於線上賭場的特別稱呼,而且是現金網,大家也許會好奇為什麼不直接叫做線上賭場或是線上博弈就好了。
其實這是有原因的,線上賭場這種東西,架站在台灣是違法的,在早期經營線上博弈被抓的風險非常高所以換了一個打模糊仗的代稱「娛樂城」來規避警方的耳目,畢竟以前沒有Google這種東西,這樣的代稱還是多少有些作用的。
信用版娛樂城是什麼?
信用版娛樂城是一種賭博平台,允許玩家在沒有預先充值的情況下參與遊戲。這種模式類似於信用卡,通常以周結或月結的方式結算遊戲費用。因此,如果玩家無法有效管理自己的投注額,可能會在月底面臨巨大的支付壓力。
娛樂城不出金怎麼辦?
釐清原因,如未違反娛樂城機制,可能是遇上黑網娛樂城,請盡快通報165反詐騙。
We still cannot quite assume that Really should have refused often be one of those particular staring at the important points situated on your blog post. Our neighbors we are sincerely thankful for ones generosity as well giving me possibility pursue our chosen profession path. I am glad you important information I managed to get with the web-site.
вход 1go casino вход 1go casino
Hi there! Would you make use of Facebook? My partner and i’d like to adhere to you in the event it would be alright. My partner and i’m totally enjoying your website and appear to brand new revisions.
Excellent! Your blog has quite a few readers. How did you get all of these people to look at your article I’m jealous! I’m still studying all about posting articles on the web. I’m going to click on more articles on your website to get a better understanding how to attract more people. Thanks!
This is very interesting, You are a very skilled blogger. I have joined your feed and look forward to seeking more of your magnificent post. Also, I’ve shared your site in my social networks!
купить 2 комнатную квартиру купить квартиру в новостройке
The way you write, you are really a professional blogger.,;””‘
квартиры от застройщика цены квартира от застройщика
hi!,I love your writing very much! proportion we be in contact more about your post on AOL? I require a specialist on this area to resolve my problem. May be that’s you! Taking a look forward to look you.
Very good post. I’m going through a few of these issues as well..
Player台灣線上娛樂城遊戲指南與評測
台灣最佳線上娛樂城遊戲的終極指南!我們提供專業評測,分析熱門老虎機、百家樂、棋牌及其他賭博遊戲。從遊戲規則、策略到選擇最佳娛樂城,我們全方位覆蓋,協助您更安全的遊玩。
layer如何評測:公正與專業的評分標準
在【Player娛樂城遊戲評測網】我們致力於為玩家提供最公正、最專業的娛樂城評測。我們的評測過程涵蓋多個關鍵領域,旨在確保玩家獲得可靠且全面的信息。以下是我們評測娛樂城的主要步驟:
安全與公平性
安全永遠是我們評測的首要標準。我們審查每家娛樂城的執照資訊、監管機構以及使用的隨機數生成器,以確保其遊戲結果的公平性和隨機性。
02.
遊戲品質與多樣性
遊戲的品質和多樣性對於玩家體驗至關重要。我們評估遊戲的圖形、音效、用戶介面和創新性。同時,我們也考量娛樂城提供的遊戲種類,包括老虎機、桌遊、即時遊戲等。
03.
娛樂城優惠與促銷活動
我們仔細審視各種獎勵計劃和促銷活動,包括歡迎獎勵、免費旋轉和忠誠計劃。重要的是,我們也檢查這些優惠的賭注要求和條款條件,以確保它們公平且實用。
04.
客戶支持
優質的客戶支持是娛樂城質量的重要指標。我們評估支持團隊的可用性、響應速度和專業程度。一個好的娛樂城應該提供多種聯繫方式,包括即時聊天、電子郵件和電話支持。
05.
銀行與支付選項
我們檢查娛樂城提供的存款和提款選項,以及相關的處理時間和手續費。多樣化且安全的支付方式對於玩家來說非常重要。
06.
網站易用性、娛樂城APP體驗
一個直觀且易於導航的網站可以顯著提升玩家體驗。我們評估網站的設計、可訪問性和移動兼容性。
07.
玩家評價與反饋
我們考慮真實玩家的評價和反饋。這些資料幫助我們了解娛樂城在實際玩家中的表現。
娛樂城常見問題
娛樂城是什麼?
娛樂城是什麼?娛樂城是台灣對於線上賭場的特別稱呼,線上賭場分為幾種:現金版、信用版、手機娛樂城(娛樂城APP),一般來說,台灣人在稱娛樂城時,是指現金版線上賭場。
線上賭場在別的國家也有別的名稱,美國 – Casino, Gambling、中國 – 线上赌场,娱乐城、日本 – オンラインカジノ、越南 – Nhà cái。
娛樂城會被抓嗎?
在台灣,根據刑法第266條,不論是實體或線上賭博,參與賭博的行為可處最高5萬元罰金。而根據刑法第268條,為賭博提供場所並意圖營利的行為,可能面臨3年以下有期徒刑及最高9萬元罰金。一般賭客若被抓到,通常被視為輕微罪行,原則上不會被判處監禁。
信用版娛樂城是什麼?
信用版娛樂城是一種線上賭博平台,其中的賭博活動不是直接以現金進行交易,而是基於信用系統。在這種模式下,玩家在進行賭博時使用虛擬的信用點數或籌碼,這些點數或籌碼代表了一定的貨幣價值,但實際的金錢交易會在賭博活動結束後進行結算。
現金版娛樂城是什麼?
現金版娛樂城是一種線上博弈平台,其中玩家使用實際的金錢進行賭博活動。玩家需要先存入真實貨幣,這些資金轉化為平台上的遊戲籌碼或信用,用於參與各種賭場遊戲。當玩家贏得賭局時,他們可以將這些籌碼或信用兌換回現金。
娛樂城體驗金是什麼?
娛樂城體驗金是娛樂場所為新客戶提供的一種免費遊玩資金,允許玩家在不需要自己投入任何資金的情況下,可以進行各類遊戲的娛樂城試玩。這種體驗金的數額一般介於100元到1,000元之間,且對於如何使用這些體驗金以達到提款條件,各家娛樂城設有不同的規則。
在现代,在线赌场提供了多种便捷的存款和取款方式。对于较大金额的存款,您可以选择中国信托、台中银行、合作金库、台新银行、国泰银行或中华邮政。这些银行提供的服务覆盖金额范围从$1000到$10万,确保您的资金可以安全高效地转入赌场账户。
如果您需要进行较小金额的存款,可以选择通过便利店充值。7-11、全家、莱尔富和OK超商都提供这种服务,适用于金额范围在$1000到$2万之间的充值。通过这些便利店,您可以轻松快捷地完成资金转账,无需担心银行的营业时间或复杂的操作流程。
在进行娱乐场提款时,您可以选择通过各大银行转账或ATM转账。这些方法不仅安全可靠,而且非常方便,适合各种提款需求。最低提款金额为$1000,而上限则没有限制,确保您可以灵活地管理您的资金。
在选择在线赌场时,玩家评价和推荐也是非常重要的。许多IG网红和部落客,如丽莎、穎柔、猫少女日记-Kitty等,都对一些知名的娱乐场给予了高度评价。这些推荐不仅帮助您找到可靠的娱乐场所,还能确保您在游戏中享受到最佳的用户体验。
总体来说,在线赌场通过提供多样化的存款和取款方式,以及得到广泛认可的服务质量,正在不断吸引更多的玩家。无论您选择通过银行还是便利店进行充值,都能体验到快速便捷的操作。同时,通过查看玩家的真实评价和推荐,您也能更有信心地选择合适的娱乐场,享受安全、公正的游戏环境。
https://koatframes.com/?keyword=nusabet88
1xbet code: . Avail a complimentary free bets bonus up to $/€130. Register using the bonus code and claim your bonus 100%. You can utilize the received bonus funds in sports or casino. By utilizing the promotional code, you can relish in a multitude of advantages, including deposit bonuses that match your initial investment, complimentary wagers, cashback incentives, and much more. These enticing bonuses grant you extra chances to triumph and enhance the thrill of your betting experience.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://oqver.net/pages/?chto_takoe_elektricheskiy_shtorm.html
квартира от застройщика https://novostroyki-spb78.ru
This site was… how do you say it? Relevant!! Finally I have found something that helped me. Thanks.
Каталог эротических рассказов https://vicmin.ru подарит тебе возможность уйти от рутины и погрузиться в мир секса и безудержного наслаждения. Обширная коллекция рассказов для взрослых разбудит твое воображение и принесет немыслимое удовольствие.
I’ll immediately grab your rss as I can’t find your email subscription link or e-newsletter service. Do you have any? Kindly let me know so that I could subscribe. Thanks.
1xbt promo code: bonus for new players up to €/$130. The bonus code must be entered during registration, and then you will receive a best welcome bonus in 2024. 1xBet is a well-known and reliable bookmaker, recognized for its wide selection of sports betting choices and attractive promotions. By utilizing the top-notch 1xBet promotional code, you can unlock an outstanding bonus that enables you to wager on a multitude of sports events and potentially rake in significant profits. Seize this opportunity and relish the thrill of risk-free betting.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://retroandclassicflixs.com/art/1xbet_promo_code_420.html
Новостройки в Екатеринбурге, купить квартиру в новостройке https://kupit-kvartiruekb.ru от застройщика. Строительство жилой и коммерческой недвижимости. Высокое качество, прозрачность на всех этапах строительства и сделки.
купить диплом о среднем образовании https://diplom-izhevsk.ru
I know this if off topic but I’m looking into starting my own blog and was curious what all is needed to get set up? I’m assuming having a blog like yours would cost a pretty penny? I’m not very web savvy so I’m not 100 certain. Any recommendations or advice would be greatly appreciated. Many thanks
Ramenbet промокод при регистрации
В мире онлайн-ставок, Ramenbet промокод представляет собой великолепную возможность для новых пользователей начать свой путь с дополнительными бонусами. Этот промокод не только улучшает первоначальный опыт на платформе, но и увеличивает шансы на успех.
Ramenbet промокод
Что такое Ramenbet промокод?
Промокоды – это специальные коды, которые игроки могут использовать при регистрации или внесении депозита, чтобы получить доступ к эксклюзивным предложениям и бонусам – https://cut4you.ru/projects/pgs/?promokod_ramenbet_2024_bonus_200_230_fs.html. Ramenbet промокод BONUSMEN открывает перед игроками множество выгодных возможностей, включая увеличенные бонусы на депозиты и фриспины.
Введение такого кода в процессе создания аккаунта или пополнения счета является своего рода мостом, соединяющим пользователей с лучшими игровыми предложениями от казино. Ramenbet промокод BONUSMEN не только расширяет игровые горизонты новичков, предоставляя им дополнительные средства для ставок и бесплатные вращения в популярных слотах, но и подчеркивает стремление казино вознаградить их за выбор именно этой платформы для азартных развлечений.
Преимущества Ramenbet промокода
Использование Ramenbet промокода приносит игрокам целый ряд преимуществ:
Получение дополнительных средств для ставок: Благодаря привлекательным процентам на депозиты, игроки могут значительно увеличить свой начальный капитал, что позволяет им делать более крупные ставки и увеличивать продолжительность игры.
Возможность испытать новые слоты без риска: Фриспины, предоставляемые в рамках промокода, дают уникальную возможность ознакомиться с новыми и популярными играми без необходимости тратить собственные средства, тем самым повышая шансы на обнаружение новых любимых слотов.
Усиление игрового опыта через специальные предложения: Фрибеты и ваучеры для использования в различных играх казино не только расширяют спектр возможностей для развлечения, но и предоставляют дополнительные шансы на выигрыш, делая каждую игру еще более захватывающей и прибыльной.
Регистрация с Ramenbet промокодом
Процедура создания учетной записи на платформе Ramenbet с активацией промокода представляет собой интуитивно понятный и удобный процесс, который делает начало игрового пути максимально приятным и выгодным. Вот детализированный план действий:
Открыть официальный веб-сайт Ramenbet: Первый шаг заключается в посещении портала Ramenbet, где будущий пользователь сталкивается с приветливым интерфейсом и легко обнаруживает раздел регистрации.
Переход к форме регистрации: На главной странице или в меню сайта расположена кнопка регистрации, которая направит пользователя на страницу с формой для заполнения.
Заполнение формы регистрационными данными: На этом этапе требуется внести основную информацию о себе, включая имя, адрес электронной почты, пароль для будущего входа в систему, а также другие важные сведения, необходимые для создания аккаунта.
Ввод Ramenbet промокода BONUSMEN: В форме регистрации предусмотрено специальное поле для промокода, куда следует аккуратно ввести код BONUSMEN. Это действие гарантирует получение всех бонусов, предусмотренных для новых игроков, включая дополнительные средства на счет и фриспины.
Завершение процесса регистрации: После заполнения всех необходимых полей и ввода промокода пользователю остается лишь подтвердить создание учетной записи, согласившись с условиями использования и политикой конфиденциальности казино. Обычно это требует верификации через электронную почту или мобильный телефон.
По завершении этих шагов аккаунт становится активным, а игрок получает доступ к своим бонусам, активированным промокодом BONUSMEN, что позволяет немедленно начать исследование игрового мира Ramenbet с дополнительными преимуществами.
Ramenbet промокод бонус
Бонусы по Ramenbet промокоду
Активация Ramenbet промокода BONUSMEN открывает для новых участников платформы доступ к серии щедрых бонусов, каждый из которых специально разработан, чтобы усилить их начальный опыт в мире онлайн-ставок и казино. Вот более детальный обзор предложений:
свежий промокод для включает 200% увеличение депозитной суммы и до 30 фриспинов. Это означает, что первоначальный депозит утраивается, предоставляя игрокам значительно больше средств для использования в ставках и играх. Добавление до 30 фриспинов усиливает возможности для выигрыша, давая шанс испытать ещё больше игровых автоматов.
Дополнительные бонусы включают фрибет на сумму 500 и ваучер на 500 для игры в рулетку. Фрибет может быть использован в спортивных ставках, позволяя игрокам делать ставки на выбранные спортивные события без использования средств с их основного счета. Ваучер на 500 для рулетки дает дополнительные средства для использования в одной из самых популярных казино игр, увеличивая шансы на выигрыш.
Эти бонусы, активированные промокодом BONUSMEN, создают привлекательные условия для новых игроков, мотивируя их исследовать различные аспекты платформы Ramenbet и увеличивая их шансы на успешное начало игровой деятельности.
1xbet promo code: . By using the 1xBet bonus code 2024, you can take advantage of a 100% bonus of up to €/$130. This bonus can be claimed when you register at the sportsbook. Make sure to enter this exclusive code when creating a new account on 1xBet to receive the most VIP welcome bonus available. The bonus funds you receive can be used in various sections of 1xBet, including Sports, Live Cricket, Live Casino, 1XGames, ESports, TV Games, and Bingo.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://francebroderie.net/test0/pags/detskiyegoizmzablug.html
After I initially commented I seem to have clicked the -Notify me when new comments are added- checkbox and from now on every time a comment is added I recieve 4 emails with the exact same comment. Perhaps there is a way you are able to remove me from that service? Appreciate it.
mpo888
สล็อตออนไลน์เว็บตรง: ความรื่นเริงที่ท่านไม่ควรพลาด
การเล่นเกมสล็อตในปัจจุบันนี้ได้รับความสนใจเพิ่มมากขึ้น เนื่องจากความง่ายดายที่นักเดิมพันสามารถใช้งานได้จากทุกที่ตลอดเวลา โดยไม่ต้องเสียเวลาการเดินทางไปยังคาสิโนจริง ๆ ในบทความนี้ เราจะนำเสนอเกี่ยวกับ “สล็อตออนไลน์” และความบันเทิงที่ผู้เล่นจะได้สัมผัสในเกมสล็อตเว็บตรง
ความง่ายดายในการเล่นเกมสล็อต
หนึ่งในเหตุผลสล็อตออนไลน์เว็บตรงเป็นที่สนใจอย่างยิ่ง คือความสะดวกสบายที่ผู้เล่นมี คุณสามารถเล่นได้ทุกหนทุกแห่งได้ตลอดเวลา ไม่ว่าจะเป็นที่บ้าน ในที่ทำงาน หรือแม้กระทั่งในการเดินทาง สิ่งที่จำเป็นต้องมีคืออุปกรณ์ที่เชื่อมต่อที่สามารถเชื่อมต่ออินเทอร์เน็ตได้ ไม่ว่าจะเป็นสมาร์ทโฟน แท็บเล็ต หรือคอมพิวเตอร์
เทคโนโลยีที่ทันสมัยกับสล็อตที่เว็บตรง
การเล่นเกมสล็อตในยุคนี้ไม่เพียงแต่สะดวก แต่ยังประกอบด้วยเทคโนโลยีใหม่ล่าสุดอีกด้วย สล็อตเว็บตรงใช้นวัตกรรม HTML5 ซึ่งทำให้ท่านไม่ต้องกังวลใจเกี่ยวกับการลงโปรแกรมหรือแอปพลิเคชันเสริม แค่ใช้เบราว์เซอร์บนเครื่องมือของคุณและเข้าไปที่เว็บไซต์ของเรา ท่านก็สามารถสนุกกับเกมได้ทันที
ความหลากหลายของเกมสล็อตออนไลน์
สล็อตออนไลน์เว็บตรงมาพร้อมกับตัวเลือกหลากหลายของเกมให้เลือกที่ท่านเลือกได้ ไม่ว่าจะเป็นเกมสล็อตแบบคลาสสิกหรือเกมสล็อตที่มาพร้อมกับฟีเจอร์เพิ่มเติมและโบนัสมากมาย คุณจะพบว่ามีเกมให้เลือกเล่นมากมาย ซึ่งทำให้ไม่เบื่อกับการเล่นสล็อตออนไลน์
รองรับทุกอุปกรณ์ที่ใช้
ไม่ว่าท่านจะใช้มือถือแอนดรอยด์หรือ iOS คุณก็สามารถเล่นสล็อตได้ไม่มีสะดุด เว็บไซต์รองรับทุกระบบและทุกเครื่องมือ ไม่ว่าจะเป็นสมาร์ทโฟนรุ่นใหม่หรือรุ่นก่อน หรือถึงแม้จะเป็นแท็บเล็ตและโน้ตบุ๊ก ผู้เล่นก็สามารถเพลิดเพลินกับเกมสล็อตได้อย่างไม่มีปัญหา
ทดลองเล่นสล็อตฟรี
สำหรับผู้ที่ยังใหม่กับการเล่นเกมสล็อต หรือยังไม่แน่นอนเกี่ยวกับเกมที่ต้องการเล่น PG Slot ยังมีระบบทดลองเล่นสล็อตฟรี ท่านสามารถเริ่มเล่นได้ทันทีโดยไม่ต้องลงชื่อเข้าใช้หรือฝากเงิน การทดลองเล่นนี้จะช่วยให้คุณเรียนรู้และรู้จักเกมได้โดยไม่ต้องเสียค่าใช้จ่ายใด ๆ
โบนัสและโปรโมชั่น
ข้อดีข้อหนึ่งของการเล่นสล็อตออนไลน์กับ PG Slot คือมีโปรโมชันและโบนัสมากมายสำหรับผู้เล่น ไม่ว่าคุณจะเป็นสมาชิกใหม่หรือสมาชิกเก่า ผู้เล่นสามารถได้รับโบนัสและโปรโมชันต่าง ๆ ได้อย่างสม่ำเสมอ ซึ่งจะเพิ่มโอกาสในการชนะและเพิ่มความบันเทิงในเกม
สรุป
การเล่นสล็อตออนไลน์ที่ PG Slot เป็นการลงทุนที่คุ้มค่า ผู้เล่นจะได้รับความสนุกและความง่ายดายจากการเล่นเกมสล็อต นอกจากนี้ยังมีโอกาสลุ้นรับรางวัลและโบนัสเพียบ ไม่ว่าท่านจะใช้สมาร์ทโฟน แท็บเล็ตหรือคอมพิวเตอร์รุ่นไหน ก็สามารถเล่นได้ทันที อย่ารอช้า สมัครสมาชิกและเริ่มเล่น PG Slot วันนี้
สล็อตเว็บโดยตรง — สามารถใช้ มือถือ แท็บเล็ต คอมพิวเตอร์ ฯลฯ สำหรับการเล่น
ระบบสล็อตตรงจากเว็บ ของ PG ได้รับการพัฒนาและอัปเดต เพื่อให้ สามารถใช้งาน บนอุปกรณ์ที่หลากหลายได้อย่าง สมบูรณ์ ไม่สำคัญว่าจะใช้ มือถือ แท็บเลต หรือ คอมฯ รุ่นไหน
ที่ PG Slot เราเข้าใจถึงสิ่งที่ผู้เล่นต้องการ จากผู้เล่น ในเรื่อง ความสะดวก และ การเข้าถึงเกมคาสิโนที่รวดเร็ว เราจึง นำ HTML 5 มาใช้ ซึ่งเป็น เทคโนโลยีล่าสุด ปัจจุบันนี้ พัฒนาเว็บของเรา คุณจึงไม่ต้อง ดาวน์โหลดแอป หรือติดตั้งโปรแกรมเพิ่มเติม เพียง เปิดบราวเซอร์ บนอุปกรณ์ที่ คุณมีอยู่ และเยี่ยมชม เว็บของเรา คุณสามารถ เล่นเกมสล็อตได้ทันที
การรองรับอุปกรณ์หลายชนิด
ไม่ว่าคุณจะใช้ สมาร์ทโฟน ระบบ Android หรือ ไอโอเอส ก็สามารถ เล่นสล็อตได้อย่างราบรื่น ระบบของเรา ออกแบบมาให้รองรับ ทุกระบบปฏิบัติการ ไม่สำคัญว่าคุณ กำลังใช้ สมาร์ทโฟน ใหม่หรือเก่า หรือ แท็บเล็ตหรือแล็ปท็อป ทุกอย่างก็สามารถ ใช้งานได้ ไม่มีปัญหา ความเข้ากันได้
เล่นได้ทุกที่ทุกเวลา
ข้อดีของการเล่น PG Slot ก็คือ คุณสามารถ เล่นได้ทุกเวลา ไม่ว่าจะ เป็นที่บ้าน ที่ทำงาน หรือแม้แต่ ในที่สาธารณะ สิ่งที่คุณต้องมีคือ การเชื่อมต่ออินเทอร์เน็ต คุณสามารถ เล่นเกมได้ทันที และคุณไม่ต้อง กังวลกับการดาวน์โหลด หรือติดตั้งโปรแกรมที่ ใช้พื้นที่ในอุปกรณ์
เล่นสล็อตฟรี
เพื่อให้ ผู้เล่นที่ใหม่ มีโอกาสลองและสัมผัสประสบการณ์สล็อตแมชชีนของเรา PG Slot ยังมีสล็อตทดลองฟรี คุณสามารถ ทดลองเล่นได้ทันทีโดยไม่ต้องสมัครหรือฝากเงิน การ ทดลองเล่นสล็อตแมชชีนฟรีนี้จะช่วยให้คุณเรียนรู้วิธีเล่นและเข้าใจเกมก่อนตัดสินใจเดิมพันด้วยเงินจริง
การให้บริการและความปลอดภัย
PG Slot ตั้งใจให้บริการที่ดีที่สุดกับลูกค้า เรามี ทีมงานมืออาชีพพร้อมให้บริการและช่วยเหลือคุณตลอด 24 ชั่วโมง นอกจากนี้เรายังมี ระบบรักษาความปลอดภัยที่ทันสมัย ด้วยวิธีนี้ คุณจึงมั่นใจได้ว่า ข้อมูลส่วนตัวและการเงินของคุณจะปลอดภัย
โปรโมชันและโบนัส
ข้อดีอีกประการของการเล่นสล็อตแมชชีนกับ PG Slot คือ มี โปรโมชันและโบนัสมากมาย ไม่ว่าคุณจะเป็น สมาชิกใหม่หรือสมาชิกเก่า คุณสามารถ รับโปรโมชั่นและโบนัสต่างๆได้อย่างต่อเนื่อง สิ่งนี้จะ เพิ่มโอกาสชนะและความสนุกในเกม
สรุปการเล่นสล็อตเว็บที่ PG Slot ถือเป็นการลงทุนที่คุ้มค่า คุณจะไม่เพียงได้รับความสุขและความสะดวกสบายจากเกมเท่านั้น แต่คุณยังมีโอกาสลุ้นรับรางวัลและโบนัสมากมายอีกด้วย ไม่สำคัญว่าจะใช้โทรศัพท์มือถือ แท็บเล็ต หรือคอมพิวเตอร์รุ่นใด สามารถมาร่วมสนุกกับเราได้เลยตอนนี้ อย่ารอช้า ลงทะเบียนและเริ่มเล่นสล็อตกับ PG Slot วันนี้!
Cериал Голяк https://golyak-serial-online.ru смотреть онлайн в хорошем качестве и с лучшей озвучкой на любых устройствах. Все сезоны истории мелкого преступника Винни и его друзей в английском городке!
ทดลองลองใช้เล่นสล็อต และค้นพบประสบการณ์การเล่นเกมที่ไม่เหมือนใคร!
สำหรับนักพนันที่กำลังมองหาความบันเทิงและโอกาสในการชนะรางวัลมหาศาล สล็อตออนไลน์เป็นอีกหนึ่งทางเลือกที่คุ้มค่าพิจารณา.ด้วยความจำนวนมากของเกมสล็อตที่น่าตื่นเต้น ผู้เล่นสามารถลองเล่นและค้นหาเกมที่ถูกใจได้อย่างง่ายดาย.
ไม่ว่าคุณจะชอบเกมสล็อตคลาสสิกหรือต้องการความท้าทายใหม่, ทางเลือกรอกลับมาให้คุณสัมผัส. จากสล็อตที่มีหัวข้อมากมาย ไปจนถึงเกมที่มีลักษณะพิเศษและรางวัล, ผู้เล่นจะได้พบกับการทดลองเล่นที่น่าตื่นเต้นและน่าติดตาม.
ด้วยการทดลองเล่นสล็อตฟรี, คุณสามารถศึกษาวิธีการเล่นและค้นหากลยุทธ์ที่ถูกใจก่อนลงทุนด้วยเงินจริง. นี่คือโอกาสสำคัญที่จะศึกษากับเกมและเพิ่มโอกาสในการคว้ารางวัลใหญ่.
อย่าประวิงเวลา, ร่วมกับการปฏิบัติสล็อตออนไลน์วันนี้ และค้นพบประสบการณ์การเล่นเกมที่ไม่เหมือนใคร! สัมผัสความตื่นเต้น, ความเพลิดเพลิน และโอกาสมากมายชนะรางวัลใหญ่. ก้าวสู่ความสำเร็จเดินทางสู่ความสำเร็จลุล่วงของคุณในวงการสล็อตออนไลน์แล้ววันนี้!
ลอง ใช้งาน สล็อต PG ไปพร้อมกับ เปิดประตู สู่ ยุค แห่ง ความตื่นเต้น ที่ ไม่มีที่สิ้นสุด
สำหรับ ผู้เล่นพนัน ที่ พยายาม มองหา อารมณ์ เกมที่แตกต่าง, สล็อต PG เป็น ทางเลือก ที่ น่าสนใจเป็นอย่างมาก มากมาย. ด้วย ความหลากหลาย ของ ตัวเกมสล็อต ที่ น่าติดตาม และ น่าทำความรู้จัก, ผู้เล่น จะได้ ตรวจสอบ และ ค้นหา ตัวเกม ที่ ถูกใจ ความชอบการเล่น ของตนเอง.
ถึงแม้ว่า คุณ จะต้องการ ความเพลิดเพลิน แบบดั้งเดิม หรือ ความท้าทาย ที่ไม่เคยพบเจอ, สล็อต PG มีให้เลือก ให้เลือกอย่างมากมาย. ตั้งแต่ สล็อตรูปแบบคลาสสิค ที่ คุ้นเคย ไปจนถึง ประเภทเกม ที่ มี คุณสมบัติพิเศษ และ โบนัสอย่างล้นหลาม, ลูกค้า จะได้ ได้ทดลอง การเล่น ที่ ตื่นเต้น และ สนุกสนาน
เพราะ การทดลองเล่น สล็อต PG ฟรี, ผู้เล่น จะสามารถ ทำความเข้าใจ กระบวนการเล่น และ ทดสอบ เคล็ดลับ ต่างๆ ก่อนที่จะ เริ่มเล่น ด้วยเงินสด. ถึงกระนั้น ถือว่าเป็น ทางออก ที่ยอดเยี่ยม ที่จะ วางแผน และ ส่งเสริม โอกาส ในการ ได้รับรางวัล รางวัลสูง.
อย่าเนิ่นช้า, เข้าร่วม ใน การเล่นทดลอง สล็อต PG ทันที และ พบเจอ การเล่น ที่ ไร้ขอบเขต! สัมผัส ความน่าตื่นตาตื่นใจ, ความเพลิดเพลิน และ ความเป็นไปได้ ในการ รับของรางวัล มากมหาศาล. เริ่มดำเนินการ พัฒนา สู่ ความสมหวัง ของคุณในวงการ เกมสล็อต แล้ววันนี้!
เรื่อง ไซต์ PG Slots ซึ่งมีการ มี ข้อได้เปรียบ หลายประการ เมื่อเทียบกับ คาสิโนแบบ ปกติ, โดยมาก ใน ปัจจุบัน. ประโยชน์สำคัญ เหล่านี้ ได้แก่:
ความคล่องตัว: คุณ สามารถใช้งาน สล็อตออนไลน์ได้ ตลอด 24 ชั่วโมง จาก ทุกสถานที่, ให้ ผู้เล่นสามารถ เข้าร่วม ได้ ทุกที่ โดยไม่จำเป็นต้อง เสียเวลาไป ไปคาสิโนแบบ ทั่วไป ๆ
เกมมากมายแตกต่าง: สล็อตออนไลน์ นำเสนอ ประเภทเกม ที่ หลากหลายรูปแบบ, เช่น สล็อตคลาสสิค หรือ รูปแบบเกม ที่มี ลักษณะ และโบนัส พิเศษ, ไม่ก่อให้เกิด ความเหงา ในเกม
ข้อเสนอส่งเสริมการขาย และโบนัส: สล็อตออนไลน์ ส่วนใหญ่ ให้ ข้อเสนอส่งเสริมการขาย และค่าตอบแทน เพื่อเพิ่ม ความเป็นไปได้ ในการ ชนะ และ ปรับปรุง ความเพลิดเพลิน ให้กับเกม
ความมั่นคง และ ความเชื่อถือได้: สล็อตออนไลน์ แทบจะ ใช้ มาตรการรักษาความปลอดภัย ที่ มีประสิทธิภาพ, และ พึ่งพาได้ ว่า ข้อมูลลับ และ การเงิน จะได้รับ ดูแล
ความช่วยเหลือ: PG Slots ใช้ บุคลากร ที่มีความเชี่ยวชาญ ที่มุ่งมั่น ให้บริการ ตลอดเวลาไม่หยุด
การเล่นบนมือถือ: สล็อต PG รองรับ การเล่นบนอุปกรณ์เคลื่อนที่, ทำให้ ผู้เล่นสามารถเข้าร่วม ได้ทุกที่
เล่นทดลองฟรี: สำหรับ ผู้เล่นรายใหม่, PG ยังให้ ทดลองเล่นโดยไม่เสียค่าใช้จ่าย อีกด้วย, เพื่อให้ คุณ ลองใช้ การเล่น และทราบ เกมก่อน เล่นด้วยเงินจริง
สล็อต PG มี ข้อดี เป็นจำนวนมาก ที่ ทำ ให้ได้รับความต้องการ ในปัจจุบันนี้, ทำให้ การ ความเพลิดเพลิน ให้กับเกมด้วย.
1xbt promo code: bonus for new players up to €/$130. The bonus code must be entered during registration, and then you will receive a best welcome bonus in 2024. 1xBet is a well-known and reliable bookmaker, recognized for its wide selection of sports betting choices and attractive promotions. By utilizing the top-notch 1xBet promotional code, you can unlock an outstanding bonus that enables you to wager on a multitude of sports events and potentially rake in significant profits. Seize this opportunity and relish the thrill of risk-free betting.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — http://crocotheme.com/wp-content/pgs/1xbet_promo_code_420.html
This site certainly has all the information and facts I needed concerning this subject and didn’t know who to ask.
Драгон Мани Казино https://krpb.ru – ваше место для азартных приключений! Наслаждайтесь широким выбором игр, щедрыми бонусами и захватывающими турнирами. Безопасность и честная игра гарантированы. Присоединяйтесь к нам и испытайте удачу в самом захватывающем онлайн-казино!
Hello there! Do you know if they make any plugins to help with Search
Engine Optimization? I’m trying to get my website to rank
for some targeted keywords but I’m not seeing very good results.
If you know of any please share. Many thanks! I saw similar
text here: blogexpander.com
I just like the valuable information you provide on your articles. I will bookmark your weblog and take a look at once more right here regularly. I’m slightly certain I will be informed many new stuff proper right here! Good luck for the next!
Famous French footballer Kylian Mbappe https://kylianmbappe.prostoprosport-ar.com has become a global ambassador for Dior. The athlete will represent the men’s collections of creative director Kim Jones and the Sauvage fragrance, writes WWD. Mbappe’s appointment follows on from the start of the fashion house’s collaboration with the Paris Saint-Germain football club. Previously, Jones created a uniform for the team where Kylian is a player.
1xbet promo: offers a VIP bonus of 100% up to $130 for sports betting and a casino package of €1,950 + 150 free spins. This bonus is valid until December 31, 2024. The promotion is valid for new customers only. The bonus promo code must be used during the registration process.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://airlinesoffice.net/blog/estestvenno_kak_dyhanie.html
Situs Sabung Ayam Digmaan
ทดลองเล่นสล็อต pg ซื้อฟรีสปิน
ลองเล่นสล็อต PG ซื้อหมุนฟรี
ในปัจจุบันนี้ การเล่นเกมสล็อตบนอินเทอร์เน็ตได้รับการยอมรับอย่างมาก โดยเฉพาะอย่างยิ่งเกมสล็อตจากผู้ผลิต PG Slot ที่มีคุณสมบัติพิเศษมากมายให้ผู้เล่นได้รื่นรมย์ หนึ่งในฟีเจอร์ที่น่าสนใจและทำให้การเล่นเกมสนุกยิ่งขึ้นคือ “การซื้อฟรีสปิน” ซึ่งเป็นการเพิ่มช่องทางในการชนะและเพิ่มความตื่นเต้นในการเล่น
ซื้อฟรีสปินคืออะไร
การซื้อตัวเลือกการหมุนฟรีคือการที่ผู้ใช้งานสามารถซื้อโอกาสที่จะได้ในการหมุนวงล้อสล็อตโดยไม่ต้องรอให้เกิดสัญญาณฟรีสปินบนวงล้อ ซึ่งเป็นการเพิ่มช่องทางในการได้รับรางวัลพิเศษต่างๆ ภายในเกม เช่น รางวัลโบนัส แจ็คพอต และอื่นๆ ยิ่งไปกว่านั้น การซื้อฟรีสปินยังช่วยให้ผู้เล่นสามารถเพิ่มยอดเงินรางวัลได้อย่างรวดเร็วและมีประสิทธิผล
ข้อได้เปรียบของการสำรวจเล่นสล็อต PG ซื้อฟรีสปิน
เพิ่มโอกาสในการชนะ: การซื้อตัวเลือกการหมุนฟรีช่วยให้ผู้เล่นมีโอกาสสำเร็จในการได้รับรางวัลมากขึ้น เนื่องจากมีการหมุนวงล้อฟรีเพิ่มเติม ซึ่งอาจนำไปให้การได้รับแจ็คพอตหรือรางวัลโบนัสพิเศษอื่นๆ
ประหยัดเวลาทำงาน: การซื้อตัวเลือกฟรีสปินช่วยประหยัดเวลาทำงานในการเล่น เพราะว่าไม่ต้องรอให้เกิดสัญญาณฟรีสปินบนวงล้อ นักพนันสามารถเข้าโหมดฟรีสปินได้ทันที
ลองหมุนฟรี: สำหรับนักเล่นที่ยังไม่แน่ใจเกี่ยวกับเกม PG Slot ยังมีโหมดทดลองใช้ฟรีผู้เล่นได้ทดลองหมุนและเรียนรู้เกมก่อนที่จะตกลงใจซื้อฟรีสปินด้วยเงินจริง
เพิ่มความรื่นรมย์: การซื้อฟรีสปินช่วยเพิ่มความบันเทิงในการเล่น เพราะว่านักเล่นสามารถเข้าถึงรอบโบนัสและคุณลักษณะพิเศษพิเศษอื่นๆ ได้อย่างไม่ยาก
วิธีการทำการซื้อฟรีสปินในสล็อต PG
เลือกเกมที่ต้องการเล่นจากผู้ผลิต PG Slot
คลิกที่ปุ่มซื้อ “ซื้อฟรีสปิน” ที่แสดงขึ้นบนหน้าจอเกม
ระบุจำนวนฟรีสปินที่ต้องการซื้อและยืนยันการสั่งซื้อ
เริ่มต้นการหมุนวงล้อและสนุกไปกับการเล่น
ผลสรุป
การทดสอบเล่นสล็อต PGและการซื้อฟรีสปินเป็นวิธีที่ดีในการเพิ่มโอกาสในการชนะและเพิ่มความสนุกในการเล่น ด้วยคุณลักษณะพิเศษพิเศษนี้ นักเล่นสามารถเข้าถึงรอบโบนัสและลักษณะพิเศษพิเศษต่างๆ ได้อย่างรวดเร็วและมีประสิทธิภาพ ไม่ว่าคุณจะเป็นใครผู้เล่นมือใหม่หรือผู้เล่นที่มีประสบการณ์ การทดลองเล่นสล็อต PGและการซื้อตัวเลือกการหมุนฟรีจะช่วยให้คุณมีประสบการณ์การหมุนที่น่าตื่นตาตื่นใจและสนุกมากยิ่งขึ้น
ลองเล่นสล็อต PG ซื้อฟรีสปิน แล้วคุณจะพบกับความสนุกสนานและช่องทางในการชนะที่ไม่มีที่สิ้นสุด
ทดลองเล่นสล็อต pg ฟรี
สล็อตตรงจากเว็บ — สามารถใช้ มือถือ แท็บเล็ต คอมพิวเตอร์ ฯลฯ เพื่อเล่น
ระบบสล็อตเว็บโดยตรง ของ PG Slot ได้รับการพัฒนาและปรับแต่ง เพื่อให้ สามารถใช้งาน บนอุปกรณ์ที่หลากหลายได้อย่าง ครบถ้วน ไม่สำคัญว่าจะใช้ สมาร์ทโฟน แท็บเล็ต หรือ คอมพิวเตอร์ส่วนตัว แบบไหน
ที่ พีจีสล็อต เราเข้าใจถึงสิ่งที่ผู้เล่นต้องการ ของลูกค้า ในเรื่อง ความสะดวกสบาย และ การเข้าถึงเกมคาสิโนที่รวดเร็ว เราจึง ใช้ HTML 5 ซึ่งเป็น เทคโนโลยีล่าสุด ในขณะนี้ พัฒนาเว็บของเรา คุณจึงไม่ต้อง โหลดแอป หรือติดตั้งโปรแกรมเพิ่มเติม เพียง เปิดเบราว์เซอร์ บนอุปกรณ์ที่ มีอยู่ของคุณ และเยี่ยมชม เว็บไซต์ของเรา คุณสามารถ สนุกกับสล็อตได้ทันที
การรองรับอุปกรณ์หลายชนิด
ไม่ว่าคุณจะใช้ โทรศัพท์มือถือ ระบบ แอนดรอยด์ หรือ iOS ก็สามารถ เล่นสล็อตออนไลน์ได้ไม่มีสะดุด ระบบของเรา ออกแบบมาเพื่อรองรับ ระบบต่าง ๆ ไม่สำคัญว่าคุณ มี โทรศัพท์ รุ่นใหม่หรือรุ่นเก่า หรือ แท็บเล็ตหรือแล็ปท็อป ทุกอย่างก็สามารถ ใช้งานได้อย่างไม่มีปัญหา ไม่มีปัญหา ในเรื่องความเข้ากันได้
เล่นได้ทุกที่ทุกเวลา
ข้อดีอย่างหนึ่งของการเล่นเว็บสล็อตอย่าง PG Slot นั่นคือ คุณสามารถ เล่นได้ทุกเวลา ไม่ว่าจะ ที่บ้าน ออฟฟิศ หรือแม้แต่ ที่สาธารณะ สิ่งที่คุณต้องมีคือ อินเทอร์เน็ต คุณสามารถ เล่นเกมได้ทันที และคุณไม่ต้อง ห่วงเรื่องการดาวน์โหลด หรือติดตั้งโปรแกรมที่ ใช้พื้นที่บนอุปกรณ์ของคุณ
เล่นสล็อตฟรี
เพื่อให้ ผู้เล่นที่ใหม่ ได้ลองเล่นและสัมผัสเกมสล็อตของเรา PG Slot ยังมีบริการสล็อตฟรี คุณสามารถ ทดลองเล่นได้ทันทีโดยไม่ต้องสมัครหรือฝากเงิน การ ทดลองเล่นสล็อตนี้จะช่วยให้คุณรู้จักวิธีการเล่นและเข้าใจเกมก่อนเดิมพันด้วยเงินจริง
การให้บริการและความปลอดภัย
PG Slot มุ่งมั่นที่จะให้บริการที่ดีที่สุดแก่ลูกค้า เรามี ทีมงานมืออาชีพพร้อมให้บริการและช่วยเหลือคุณตลอด 24 ชั่วโมง นอกจากนี้เรายังมี ระบบรักษาความปลอดภัยที่ทันสมัย ด้วยวิธีนี้ คุณจึงมั่นใจได้ว่า ข้อมูลส่วนตัวและการเงินของคุณจะปลอดภัย
โปรโมชั่นและโบนัสพิเศษ
การเล่นสล็อตกับ PG Slot ยังมีข้อดี ก็คือ มี โปรโมชั่นและโบนัสพิเศษมากมายสำหรับผู้เข้าร่วม ไม่ว่าคุณจะเป็น สมาชิกใหม่หรือสมาชิกเก่า คุณสามารถ รับโปรโมชันและโบนัสได้เรื่อย ๆ สิ่งนี้จะ เพิ่มโอกาสในการชนะและเพิ่มความเพลิดเพลินในเกม
สรุปการเล่นสล็อตเว็บที่ PG Slot ถือเป็นการลงทุนที่คุ้มค่า คุณจะไม่เพียงได้รับความสุขและความสะดวกสบายจากเกมเท่านั้น แต่คุณยังมีโอกาสลุ้นรับรางวัลและโบนัสมากมายอีกด้วย ไม่สำคัญว่าจะใช้โทรศัพท์มือถือ แท็บเล็ต หรือคอมพิวเตอร์รุ่นใด สามารถมาร่วมสนุกกับเราได้เลยตอนนี้ อย่ารอช้า ลงทะเบียนและเริ่มเล่นสล็อตกับ PG Slot วันนี้!
ทดลองเล่นสล็อต pg เว็บ ตรง
ประสบการณ์การทดลองเล่นสล็อต PG บนแพลตฟอร์มเดิมพันตรง: เปิดจักรวาลแห่งความสุขที่ไม่มีที่สิ้นสุด
สำหรับนักเสี่ยงโชคที่ค้นหาการเผชิญหน้าเกมที่ไม่ซ้ำใคร และหวังหาแหล่งเสี่ยงโชคที่มีความน่าเชื่อถือ, การลองเกมสล็อต PG บนเว็บตรงนับว่าตัวเลือกที่น่าทึ่งอย่างมาก. ด้วยความหลากหลายมากมายของสล็อตแมชชีนที่มีให้เลือกเล่นมากมาย, ผู้เล่นจะได้พบเจอกับโลกแห่งความรื่นเริงและความสนุกสนานที่ไร้ขีดจำกัด.
แพลตฟอร์มวางเดิมพันไม่ผ่านเอเย่นต์นี้ นำเสนอประสบการณ์การเล่นที่มั่นคง เชื่อถือได้ และตอบสนองความต้องการของนักพนันได้เป็นอย่างดี. ไม่ว่าผู้เล่นจะชื่นชอบเกมสล็อตแมชชีนแนวคลาสสิกที่เป็นที่รู้จัก หรืออยากทดลองเกมใหม่ๆที่มีคุณสมบัติพิเศษเฉพาะและโบนัสล้นหลาม, พอร์ทัลตรงนี้นี้ก็มีให้เลือกเล่นอย่างมากมาย.
อันเนื่องมาจากระบบการทดลองเล่นสล็อตแมชชีน PG โดยไม่เสียค่าใช้จ่าย, ผู้เล่นจะได้โอกาสดีทำความเข้าใจวิธีเล่นเดิมพันและทดลองวิธีการต่างๆนาๆ ก่อนที่เริ่มใช้เงินจริงด้วยเงินสด. โอกาสนี้ถือเป็นโอกาสอันดีที่จะเพิ่มความพร้อมและสร้างเสริมโอกาสในการได้รับรางวัลมหาศาลใหญ่.
ไม่ว่าคุณจะต้องการความสนุกสนานแบบคลาสสิก หรือความยากแปลกใหม่, เกมสล็อต PG บนเว็บเดิมพันตรงก็มีให้เลือกอย่างมากมาย. คุณอาจจะได้สัมผัสกับประสบการณ์การเล่นเดิมพันที่น่าเร้าใจ น่ารื่นเริง และสนุกสนานไปกับโอกาสในการได้รับรางวัลใหญ่มหาศาล.
อย่ารอช้า, ร่วมสนุกทดลองเล่นสล็อตแมชชีน PG บนเว็บเสี่ยงโชคตรงนี้ขณะนี้ และเจอจักรวาลแห่งความสุขที่น่าเชื่อถือ น่าติดตามต่อ และพร้อมเต็มไปด้วยความสุขสนานรอคอยคุณ. เผชิญความเร้าใจ, ความสนุกสนาน และโอกาสที่ดีในการได้รางวัลมหาศาลมหาศาล. เริ่มต้นเข้าสู่ความสำเร็จในวงการเกมออนไลน์แล้ววันนี้!
Скачать свежие новинки песен https://muzfo.net 2024 года ежедневно. Наслаждайтесь комфортным прослушиванием, скачивайте музыку за пару кликов на сайте.
https://cooempremac.com/?keyword=office-365
1xbet promo: . Avail a complimentary free bets bonus up to $/€130. Register using the bonus code and claim your bonus 100%. You can utilize the received bonus funds in sports or casino. By utilizing the promotional code, you can relish in a multitude of advantages, including deposit bonuses that match your initial investment, complimentary wagers, cashback incentives, and much more. These enticing bonuses grant you extra chances to triumph and enhance the thrill of your betting experience.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://francebroderie.net/test0/pags/detskiyegoizmzablug.html
Keep this going please, great job!
Скачать свежие новинки песен https://muzfo.net 2024 года ежедневно. Наслаждайтесь комфортным прослушиванием, скачивайте музыку за пару кликов на сайте.
[url=https://okmodafinil.com/]modafinil 100mg buy online[/url]
Агентство по продвижению телеграм-каналов https://883666b.com в Москве специализируется на разработке и реализации стратегий для увеличения аудитории и вовлечённости подписчиков на телеграм-каналах. Эксперты агентства помогают клиентам определить целевую аудиторию, разрабатывают контент-планы и рекламные кампании. Услуги включают рекламу посевами, таргет рекламой, анализ конкурентов, SEO-оптимизацию контента.
интернет эквайринг https://internet-ekvajring.kz – безопасные и эффективные платежные решения для вашего бизнеса.
This web site is really a walk-by way of for all of the info you needed about this and didn’t know who to ask. Glimpse here, and also you’ll positively uncover it.
ทดลองเล่นสล็อต pg ไม่ เด้ง
ทดลองลองใช้เล่นสล็อต และค้นพบประสบการณ์การเล่นเกมที่ไม่เหมือนใคร!
สำหรับนักพนันที่กำลังต้องการความบันเทิงและโอกาสในการแสวงหารางวัลมหาศาล สล็อตออนไลน์เป็นอีกหนึ่งโอกาสที่คุ้มค่าใช้.ด้วยความจำนวนมากของเกมสล็อตที่น่าตื่นเต้น ผู้เล่นสามารถทดลองเล่นและค้นหาเกมที่ชื่นชอบได้อย่างง่ายดาย.
ไม่ว่าคุณจะชอบเกมสล็อตคลาสสิกหรือต้องการความท้าทายใหม่, ทางเลือกมากมายรอต้อนรับให้คุณสัมผัส. จากสล็อตที่มีหัวข้อมากมาย ไปจนถึงเกมที่มีฟีเจอร์พิเศษและเงินรางวัล, ผู้เล่นจะได้พบกับการทดลองเล่นที่น่าตื่นเต้นและน่าติดตาม.
ด้วยการทดลองเล่นสล็อตฟรี, คุณสามารถทำความคุ้นเคยวิธีการเล่นและค้นค้นพบกลยุทธ์ที่เหมาะสมก่อนสร้างรายได้ด้วยเงินจริง. นี่คือโอกาสดีที่จะเรียนรู้กับเกมและเพิ่มโอกาสในการแสดงรางวัลใหญ่.
อย่าขยายเวลา, เข้าไปกับการลองเล่นสล็อตออนไลน์วันนี้ และค้นพบประสบการณ์การเล่นเกมที่ไม่เหมือนใคร! สัมผัสความสนใจ, ความยินดี และโอกาสชนะรางวัล. ทำก้าวแรกเดินทางสู่ความสมหวังของคุณในวงการสล็อตออนไลน์แล้ววันนี้!
Only wanna admit that this is invaluable, Thanks for taking your time to write this.
You actually make it appear so easy together with your presentation but I find this topic to be actually something which I feel I might by no means understand. It kind of feels too complex and extremely vast for me. I’m taking a look ahead in your next submit, I will attempt to get the grasp of it!
บาคาร่า
הימורי ספורטיביים – הימור באינטרנט
הימור ספורט הפכו לאחד הענפים הצומחים ביותר בהימורים באינטרנט. שחקנים יכולים להמר על תוצאת של אירועים ספורט נפוצים למשל כדורגל, כדורסל, משחק הטניס ועוד. האפשרויות להימור הן רבות, כולל תוצאת ההתמודדות, כמות השערים, כמות הפעמים ועוד. להלן דוגמאות למשחקי נפוצים שעליהם אפשרי להמר:
כדורגל: ליגת אלופות, גביע העולם, ליגות אזוריות
כדור סל: ליגת NBA, ליגת יורוליג, טורנירים בינלאומיים
משחק הטניס: טורניר ווימבלדון, US Open, רולאן גארוס
פוקר באינטרנט – הימורים באינטרנט
פוקר ברשת הוא אחד מהמשחקים ההימורים המוכרים ביותר כיום. משתתפים יכולים להתחרות נגד יריבים מרחבי תבל במגוון גרסאות של המשחק , לדוגמה טקסס הולדם, Omaha, Stud ועוד. אפשר לגלות תחרויות ומשחקי במגוון דרגות ואפשרויות שונות. אתרי הפוקר המובילים מציעים:
מבחר רב של וריאציות פוקר
טורנירים שבועיים וחודשיות עם פרסים כספיים גבוהים
שולחנות המשחק למשחקים מהירים ולטווח ארוך
תוכניות נאמנות ומועדוני עם הטבות עם הטבות
בטיחות ואבטחה והוגנות
בעת הבחירה בפלטפורמה להימורים, חשוב לבחור אתרי הימורים מורשים המפוקחים המציעים סביבת למשחק מאובטחת והוגנת. אתרים אלו משתמשים בטכנולוגיות אבטחה מתקדמות להגנה על נתונים אישיים ופיננסי, וגם בתוכנות מחולל מספרים רנדומליים (RNG) כדי לוודא הגינות המשחקים במשחקים.
בנוסף, הכרחי לשחק גם באופן אחראי תוך כדי הגדרת מגבלות אישיות הימור אישיות של השחקן. מרבית האתרים מאפשרים לשחקנים להגדיר מגבלות הפסד ופעילויות, כמו גם להשתמש ב- כלים למניעת התמכרות. שחקו בתבונה ואל גם תרדפו אחר הפסדים.
המדריך השלם לקזינו ברשת, הימורי ספורט ופוקר ברשת
הימורים ברשת מציעים גם עולם שלם של הזדמנויות מלהיבות למשתתפים, מתחיל מקזינו אונליין וכל משחקי ספורט ופוקר ברשת. בעת בחירת בפלטפורמת הימורים, הקפידו לבחור אתרי הימורים המפוקחים המציעים סביבה משחק מאובטחת והגיונית. זכרו גם לשחק תמיד בצורה אחראית תמיד – משחקי ההימורים ברשת אמורים להיות מבדרים ומהנים ולא לגרום לבעיות פיננסיות או חברתיות.
[url=https://clomidsale.com/]order clomid online india[/url]
1xBet Bonus Package for Indian Casino Customers
Experience the ultimate excitement of online casino gaming with the exclusive Casino Welcome Offer at 1xBet India 2024. Get ready for an immersive and thrilling journey filled with a wide variety of live dealer games and a vast selection of captivating slots. Unlock this amazing offer by using the 1xBet promo code and take your casino adventure to new heights.
1xBet casino promo code: , bonus 100% up to $1950 and 150 free spins at the casino. Gain access to an exceptional casino welcome package worth ?130,000. This bonus can be claimed across four separate deposits, allowing you to maximize your rewards and extend your gaming sessions. Prepare to be enthralled by the exhilarating gameplay, stunning graphics, and immersive sound effects that will transport you to the heart of the casino action.
Whether you’re a fan of classic table games or prefer the excitement of spinning the reels on slots, 1xBet has you covered. Explore an extensive collection of live dealer games, where you can interact with professional dealers in real-time for an authentic casino experience. Additionally, the slots section boasts a diverse range of games, ensuring there’s something to suit every preference and style.
Attention all casino enthusiasts! You definitely don’t want to miss out on this incredible opportunity to elevate your casino journey. By using the exclusive 1xbet promo: , you can unlock a remarkable ?169,000 welcome package along with 150 free spins for the year 2024. Immerse yourself in the excitement of the casino, make the most of the bonuses, and embark on a gaming adventure like no other at 1xBet India.
For our valued Indian customers who have a keen interest in the casino section, 1xBet presents an enticing alternative welcome package. This package is designed to enhance your gaming experience across your first four deposits, allowing you to receive a whopping ?169,000 in addition to 150 free spins.
Here’s how the bonus package is divided:
1st deposit: 100% matched bonus + 30 free spins on Reliquary of Ra
2nd deposit: 50% matched bonus + 35 free spins on Chieftain Buffalo
3rd deposit: 25% matched bonus + 40 free spins on Stampede Buffalo
4th deposit: 25% matched bonus + 45 free spins on Rich of the Mermaid Hold and Spin
Embrace the Excitement at 1xBet
With these enticing promo codes and bonus offers, 1xBet ensures that new customers can kickstart their betting journey with a thrilling advantage. Whether you prefer sports betting or exploring the casino games, 1xBet has something for everyone. Don’t miss out on the opportunity to elevate your gaming experience—join 1xBet today and unlock a world of excitement.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://magazinetechnologies.com/articles/1xbet_promo_code_420.html
Greetings! Very helpful advice in this particular post! It is the little changes that produce the greatest changes. Many thanks for sharing!
This could be the proper weblog for everyone who is really wants to find out about this topic. You know a great deal of its practically not easy to argue to you (not too I just would want…HaHa). You actually put a whole new spin over a topic thats been revealed for decades. Excellent stuff, just wonderful!
https://saranbaskar.com/?keyword=hitam-slot
Wow! This could be one particular of the most helpful blogs We’ve ever arrive across on this subject. Basically Excellent. I’m also an expert in this topic therefore I can understand your effort.
Excellent stuff. I can’t describe how much your site has helped me within my academic research on the subject. I’m now likely to get top marks without a doubt. Thanks a thousand. I owe you one.
You should participate in a contest for among the best blogs on the web. I will suggest this website!
Промокод букмекерской конторы 1xbet на сегодня: где взять рабочий, куда вводить на сайте и как использовать промокод 1xbet. Бесплатные коды нужно вводить в специальном поле при регистрации на сайте БК или в личном кабинете пользователя, если у вас уже есть аккаунт. Все промокоды букмекерских контор. Список действующих на сегодня промокодов легальных букмекерских контор вы можете найти на сайте в разделе бонусов. Варианты получения промокодов. Зарубежная букмекерская контора 1xВet предлагает несколько вариантов получения промокодов. Бесплатные промокоды 1xBet при регистрации. 1хБет постоянно ищет новых пользователей, поэтому регистрируясь на сайте Вы и так получите до 25000 руб. при первом депозите. Но мы поможем его увеличить до 32 500, для этого введите: 1XFREE777 — увеличивает сумму депозита до 32500 р. Данные бонусы действуют только при первом депозите после регистрации, пополняя свой лицевой счет, при применении кода сумма увеличится в 2 раза, но не более 32500 рублей. Бонусные деньги вы можете ставить на спорт. В открытом доступе в интернете вы сможете найти только такие бонусы, которые мотивируют новичков стать пользователем букмекерской конторы 1хБет – более подробно в этом материале https://poloniya.ru/files/flib/pages/?intervyyu_s_osnovatelem_values_value.html
Comfortabl y, the post is really the freshest on this deserving topic. I harmonise with your conclusions and also can thirstily look forward to your next updates. Simply just saying thanks definitely will not simply be adequate, for the extraordinary clarity in your writing. I will certainly directly grab your rss feed to stay informed of any kind of updates. Gratifying work and much success in your business dealings!
Good – I should definitely pronounce, impressed with your website. I had no trouble navigating through all tabs as well as related info ended up being truly easy to do to access. I recently found what I hoped for before you know it at all. Quite unusual. Is likely to appreciate it for those who add forums or anything, site theme . a tones way for your client to communicate. Nice task..
An interesting discussion is worth comment. I do believe that you should write more on this topic, it might not become a taboo subject but typically persons are inadequate to communicate in on such topics. Yet another. Cheers
жк купить квартиру от застройщика https://nedvizhimost47.ru
I just added your weblog to my blog roll, I pray you would take into consideration doing the same.
Way cool! Some extremely valid points! I appreciate you writing this
post plus the rest of the site is also really good.
An extremely good post. This post sums up for me just what this topic is all about and some of the major benefits that can be produced by knowing about it just like you. A friend once pointed out that you have a totally different approach when you do something for certain as opposed to when you’re simply just toying with it. In the case of this specific topic, I believe you’re taking, or start to go for, a more professional plus thorough approach to what and how you’re writing, which in turn helps you to continue to get better and help others who don’t know anything at all about what you have discussed here. Thank you.
art posters are great for room decoration too, i use art posters on my bedroom as decorations`
You completed several good points there. Used to do a search for the issue and found nearly all people will go in addition to together with your blog.
Way cool! Some very valid points! I appreciate you writing this write-up plus the rest of the website is also really good.
Oh i really envy the way you post topics, how i wish i could write like that.’*\’,`
жк казань купить квартиру от застройщика https://novostroyka47.ru
???? ?????? ?????? ??? ??????? ?????????? ?? ????? ????? ????? ?? ????? ??????
This log was… how do I say it? Relevant!!
Fiinally I’ve found something that helped me. Cheers! https://issuu.com/akhilnadig
We stumbled ver here ifferent web page and thought
I may aas well check thinbs out. I like what I see so i am jhst followijg you.
Look forward to looking at your web page repeatedly. https://medium.com/@davegable541_2661/responsible-gaming-tools-and-strategies-for-safe-play-aviator-game-682b3fc84e9b
Greate article. Keep writing such kind off info on your
page. Im really impressed by it.
Hey there, You’ve performed an incredible job. I’ll definitely digg it and
personally suggedst too my friends. I’m confident they’ll be
benefited from this website. https://www.bestjobs.eu/en/companies/-6857
Its like you read my mind! You seem to know so much about this, liie you wrlte
the book in it or something. I think that yyou could doo with some pics to drive thee message home a
little bit, but instead of that, this is excellent blog.
An excellent read. I’ll definitely be back. https://steemit.com/sport/@victor1kaminski/understanding-randomness-in-gambling
I really like it when individuals come together and share views.
Great website, stick with it!
Hey There. I found your blog using msn. This is a very well written article.
I will make sure to bookmark it and retfurn to rrad
more of your useful information. Thanks forr the post.
I’ll certainly comeback. https://www.goodreads.com/user/show/159153113-akhil-nadig
I have read so many content about the blogger lovers however this piece of writing is really a good paragraph,
keep it up. https://www.producthunt.com/discussions/9971-how-can-i-bet-on-sport-really-fast
Great article! This is the type of information that should be shared across
the net. Shame on Google for not positioning this putt
up higher! Come onn over and visit mmy web site . Thank yyou =) https://www.producthunt.com/@niamh_cunningham1
I always spent my half an hour to read this website’s articles or
reviews all the time along ith a cup of coffee. https://gab.com/Brian44432457/posts/111885882999945491
I genuinely enjoy looking at on this website , it has wonderful content .
How much of an helpful document, hold publishing special someone
Greetings! Very useful advice within this post!
It’s the little changes that make the greatest changes.
Many thanks for sharing!
I like this post a lot. I will definitely be back. Hope that I will be able to read more insightful posts then. Will probably be sharing your knowledge with all of my associates!
House Lawyers… […]just below, are some totally unrelated sites to ours, however, they are definitely worth checking out[…]…
Hello there! This blog post could not be written much better! Reading through this post reminds me of my previous roommate! He always kept talking about this. I most certainly will send this information to him. Pretty sure he’ll have a good read. I appreciate you for sharing!
[url=http://baclofem.com/]baclofen price south africa[/url]
I’m truly enjoying the design and layout of your website. It’s a very easy on the eyes which makes it much more pleasant for me to come here and visit more often. Did you hire out a developer to create your theme? Exceptional work!
1xbet promo code: bonus for new players up to €/$130. The bonus code must be entered during registration, and then you will receive a best welcome bonus in 2024. 1xBet is a well-known and reliable bookmaker, recognized for its wide selection of sports betting choices and attractive promotions. By utilizing the top-notch 1xBet promotional code, you can unlock an outstanding bonus that enables you to wager on a multitude of sports events and potentially rake in significant profits. Seize this opportunity and relish the thrill of risk-free betting.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://airlinesoffice.net/blog/estestvenno_kak_dyhanie.html
That is the correct weblog for anybody who wants to search out out about this topic. You realize so much its virtually arduous to argue with you (not that I really would want aHa). You undoubtedly put a new spin on a subject thats been written about for years. Great stuff, simply great!
This website is awesome. I constantly come across something new & different right here. Thank you for that data.
[url=https://amoxicillinir.online/]amoxicillin buy online[/url]
–Are your clients familiar using the web, do they utilize it routinely?
There is noticeably big money to learn about this. I suppose you made certain nice points in functions also.
F*ckin’ awesome issues here. I am very satisfied to look your article. Thank you a lot and i’m having a look ahead to touch you. Will you please drop me a mail?
Hmm is anyone else encountering problems with the pictures on this blog loading? I’m trying to determine if its a problem on my end or if it’s the blog. Any suggestions would be greatly appreciated.
Hello there! I know this is kinra off topicc but I was wondering which blog platform are you using for this
website? I’m getting sick and tired of WordPress because I’ve had issues with hackers
annd I’m looking at alternatives for anpther platform. I would
bee great if you could point me in the direction of a good
platform. https://pixabay.com/users/aviator_kto-43303656/
Fantastic eat ! I wish to apprentice while you amend your website,
how caan i subscribe for a blog website? The account aided me a acceptable deal.
I had been a little bit acqainted of this your broadcast offered bright clear concept https://scrapbox.io/aviatorjogo/As_principais_tecnologias_que_est%C3%A3o_a_mudar_a_ind%C3%BAstria_do_jogo
What’s up to every one, the contents present at this
website aree tuly amazing for eople experience, well, keep up the
nice work fellows. https://steemit.com/casino/@susan62587/vantagens-e-desvantagens-do-jogo-online-em-comparacao-com-os-casinos-tradicionais
I am not sure where you’re getting your info, but
goodd topic. I nededs to spend some time learning
more or understanding more. Thanks for wonderful info I was looking for this info for my mission. https://www.halaltrip.com/user/profile/156423/aviator/
I’m not tnat much of a online reader to be honest but yur sites really nice,
keep it up! I’ll ggo ahead and bookmark your site to come back later on. Maany thanks https://gamebanana.com/members/3416361
The best and clear News and why it means a lot.
[url=https://maps.t.me/s/worldcasinonet.vc/url?sa=t&url=/https://bellingham-judefr.biz]bellingham[/url]
[url=http://www.t.me/s/worldcasinonet.py/url?q=https://bellingham-judefr.biz]bellingham[/url]
[url=https://youngnudistvideo.com/go.php?url=https://bellingham-judefr.biz]bellingham[/url]
[url=http://www.stefanieleal.com/searchpoint/redir.asp?reg_id=ptypes&sname=/searchpoint/search.asp&lid=1&sponsor=inc&url=https://bellingham-judefr.biz]bellingham[/url]
[url=http://www.sanfordfl.gov/redirect.aspx?url=https://bellingham-judefr.biz]bellingham[/url]
[url=http://prepfootballreport.com.xx3.kz/go.php?url=https://bellingham-judefr.biz]bellingham[/url]
[url=https://hundred.sandbox.google.no/url?q=https://bellingham-judefr.biz]bellingham[/url]
[url=http://ms2000.vaillant.it/ms2000.web/utility/login/loginm2k.aspx?returnurl=https://bellingham-judefr.biz]bellingham[/url]
[url=http://sudburyfireplaces.ca.xx3.kz/go.php?url=https://bellingham-judefr.biz]bellingham[/url]
[url=http://www.boilerzb.com/go.php?go=https://bellingham-judefr.biz]bellingham[/url]
[url=https://different.sandbox.t.me/s/worldcasinonet.pe/url?q=https://bellingham-judefr.biz]bellingham[/url]
[url=http://www.dolinaradosti.org/redirect?url=https://bellingham-judefr.biz]bellingham[/url]
[url=http://www.serie-a.ru/bitrix/redirect.php?goto=https://bellingham-judefr.biz]bellingham[/url]
[url=http://newsbudz.com/go/?url=https://bellingham-judefr.biz]bellingham[/url]
[url=http://se03.cside.jp/~webooo/zippo/naviz.cgi?jump=194&url=https://bellingham-judefr.biz]bellingham[/url]
last news about bellingham
bellingham
bellingham
bellingham
bellingham
bellingham
bellingham
bellingham
bellingham
bellingham
bellingham
bellingham
bellingham
bellingham
bellingham
bellingham
Claim an Exclusive Bonus of 1xBet Promo Code
1xbet: By entering this code registration at 1xBet.com, you will unlock a welcome bonus of ?66,000 for sports betting and casino €1,950 along with 150 free spins. Take advantage of this opportunity to maximize your winnings and enjoy an unparalleled gaming experience at 1xBet. Indian customers are in for a treat with the 1xBet promo code bonus. By creating a new account on the platform, you can avail yourself of a fantastic welcome offer of up to INR 26,000. Please note that if you already have an existing account or have claimed another welcome offer on the platform, you won’t be eligible for this particular bonus.
To claim the bonus, make your first deposit up to a maximum of ?10,000, and you’ll receive a matching deposit in the same amount. The minimum deposit required to qualify for the offer is ?75. However, there are certain wagering requirements that must be met before you can make a withdrawal.
To fulfill the wagering requirements, you need to wager half of your bonus (the deposited amount) at least five times in accumulator bets. The remaining half of the bonus must be used in 1xGames. Keep in mind that you have a thirty-day window to complete the wagering requirements; failure to do so will result in the forfeiture of any bonus winnings.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://nycfirewire.net/pag/proizvodstvoposprod.html
There’s noticeably a bundle to find out about this. I assume you made sure nice factors in options also.
הימורי ספורט
הימורי ספורט – הימורים באינטרנט
הימורי ספורט נעשו לאחד הענפים המשגשגים ביותר בהימור ברשת. משתתפים יכולים להמר על תוצאת של אירועים ספורטיביים מוכרים למשל כדור רגל, כדור סל, משחק הטניס ועוד. האופציות להתערבות הן מרובות, וביניהן תוצאתו המאבק, כמות השערים, כמות הפעמים ועוד. הבא דוגמאות של למשחקים נפוצים עליהם אפשרי להמר:
כדור רגל: ליגת אלופות, מונדיאל, ליגות אזוריות
כדור סל: ליגת NBA, יורוליג, תחרויות בינלאומיות
משחק הטניס: ווימבלדון, אליפות ארה”ב הפתוחה, אליפות צרפת הפתוחה
פוקר ברשת ברשת – הימורים ברשת
משחק הפוקר ברשת הוא אחד מהמשחקים ההימורים הנפוצים ביותר בימינו. שחקנים מסוגלים להתמודד נגד מתחרים מכל רחבי העולם במגוון וריאציות משחק , לדוגמה טקסס הולדם, Omaha, סטאד ועוד. ניתן לגלות תחרויות ומשחקי קש במבחר דרגות ואפשרויות מגוונות. אתרי הפוקר הטובים מציעים גם:
מבחר רב של וריאציות פוקר
טורנירים שבועיות וחודשיות עם פרסים כספיים
שולחנות למשחק מהיר ולטווח ארוך
תוכניות נאמנות ומועדוני VIP VIP בלעדיות
בטיחות ואבטחה והוגנות
כאשר הבחירה פלטפורמה להימורים, חשוב לבחור גם אתרים מורשים המפוקחים המציעים גם סביבת משחק מאובטחת והגיונית. אתרים אלה משתמשים בטכנולוגיות אבטחה מתקדמות להגנה על נתונים אישיים ופיננסי, וכן באמצעות תוכנות גנרטור מספרים אקראיים (RNG) כדי לוודא הגינות במשחקי ההימורים.
מעבר לכך, חשוב לשחק בצורה אחראי תוך כדי קביעת מגבלות הימורים אישיות של השחקן. מרבית אתרי ההימורים מאפשרים גם לשחקנים להגדיר מגבלות הפסד ופעילויות, וגם להשתמש ב- כלים למניעת התמכרות. שחקו בתבונה ואל גם תרדפו אחרי הפסד.
המדריך השלם לקזינו באינטרנט, משחקי ספורט ופוקר באינטרנט באינטרנט
הימורים באינטרנט מציעים גם עולם שלם הזדמנויות מרתקות למשתתפים, החל מקזינו אונליין וגם בהימורי ספורט ופוקר באינטרנט. בזמן הבחירה בפלטפורמת הימורים, הקפידו לבחור גם אתרי הימורים המפוקחים המציעים סביבת משחק בטוחה והגיונית. זכרו גם לשחק באופן אחראי תמיד – משחקי ההימורים באינטרנט נועדו להיות מבדרים ולא גם ליצור בעיות כלכליות או גם חברתיות.
I like what you guys are up also. Such smart work and reporting! Carry on the superb works guys I’ve incorporated you guys to my blogroll. I think it’ll improve the value of my web site .
Fantastic read. I observed your internet site from a google search, and was glad i did. The data has helped me immensely.
This web page is known as a walk-by for all of the data you wished about this and didn’t know who to ask. Glimpse right here, and also you’ll undoubtedly discover it.
your blog is very good. It was very well authored and easy to understand. Unlike additional blogs I have read which are really not good. I also found your posts very interesting
Thanks for your write-up. Another thing is that just being a photographer consists of not only problem in catching award-winning photographs and also hardships in getting the best digicam suited to your requirements and most especially challenges in maintaining the standard of your camera. This can be very true and clear for those photography fans that are straight into capturing the nature’s interesting scenes – the mountains, the particular forests, the wild or perhaps the seas. Visiting these exciting places definitely requires a digicam that can surpass the wild’s tough setting.
1xbet promo: – enjoy a special welcome offer of 100% up to €/$130. This exclusive bonus code grants you an enhanced bonus when used during registration at 1xBet casino, with a bonus of up to €1500 and 150 free spins.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://nycfirewire.net/pag/proizvodstvoposprod.html
I’m not certain the place you’re getting your information, but good topic. I must spend some time finding out more or working out more. Thanks for great info I used to be searching for this info for my mission.
What your stating is completely accurate. I know that everybody ought to say the similar thing, but I just assume that you place it in a way that everyone can fully grasp. I also appreciate the photos you set in right here. They match so properly with what youre hoping to say. Im sure youll reach so many people today with what youve acquired to say.
[url=https://bellingham-judefr.biz]bellingham[/url]
Merit comparison with Pre-eminent Online Casinos in the Sphere 2023. Primary online casino aggregator.
bellingham jude
Music started playing anytime I opened up this web-site, so irritating!
Проведение независимой строительной экспертизы — сложный процесс, требующий глубоких знаний. Наши специалисты обладают всеми необходимыми навыками, а их заключения часто служат основой для принятия верных стратегических решений. Строительно-техническая экспертиза https://stroytehexp.ru позволяет выявить факторы, вызвавшие ухудшение эксплуатационных характеристик объектов, проверить соответствие возведённых зданий градостроительным нормам.
I concur along with your conclusions and can eagerly watch forward to your future updates. The usefulness and significance has me overwhelmed and contains been invaluable to my opinion!
The story of Mbappe’s https://www.asma-online.org rise to fame is as remarkable as his on-field feats. Mbappe’s journey from local pitches to global arenas was meteoric. His early days at AS Monaco showcased his prodigious talent, with his blistering speed and fearless dribbling dismantling opposition defenses.
right on our supermarket, i can buy some cheap protein bars which i always consume when doing workouts,
Информационный ресурс https://ardma.ru, посвящен бизнесу, финансам, инвестициям и криптовалютам. Сайт предлагает экспертные статьи, аналитические отчеты, стратегии и советы для предпринимателей и инвесторов. Здесь можно найти новости и обзоры о бизнесе, маркетинге, трейдинге, а также практические рекомендации по различным видам заработка и управлению финансами.
But a smiling visitant here to share the love (:, btw great style and design .
https://medium.com/@momejar21741/pg-59490dd058fd
สล็อตเว็บโดยตรง — ใช้ได้กับ สมาร์ทโฟน แท็บเลต คอมพิวเตอร์ส่วนตัว ฯลฯ สำหรับการเล่น
ระบบสล็อตเว็บโดยตรง ของ PG ได้รับการพัฒนาและปรับแต่ง เพื่อให้ รองรับการใช้งาน บนอุปกรณ์ที่หลากหลายได้อย่าง เต็มที่ ไม่สำคัญว่าจะใช้ มือถือ แท็บเลต หรือ คอมพิวเตอร์ส่วนตัว แบบไหน
ที่ PG Slot เราเข้าใจว่าผู้เล่นต้องการ จากผู้เล่น ในเรื่อง ความสะดวก และ การเข้าถึงเกมออนไลน์อย่างรวดเร็ว เราจึง นำ HTML 5 มาใช้ ซึ่งเป็น เทคโนโลยีที่ล้ำสมัย ในขณะนี้ มาพัฒนาเว็บไซต์ของเรากันเถอะ คุณจึงไม่ต้อง ติดตั้งแอป หรือติดตั้งโปรแกรมเพิ่มเติม เพียง เปิดบราวเซอร์ บนอุปกรณ์ที่ คุณมีอยู่ และเยี่ยมชม เว็บของเรา คุณสามารถ เล่นเกมสล็อตได้ทันที
การสนับสนุนหลายอุปกรณ์
ไม่ว่าคุณจะใช้ มือถือ ระบบ แอนดรอยด์ หรือ ไอโอเอส ก็สามารถ เล่นสล็อตได้อย่างราบรื่น ระบบของเรา ออกแบบมาให้รองรับ ทุกระบบปฏิบัติการ ไม่สำคัญว่าคุณ มี สมาร์ทโฟน เครื่องใหม่หรือเครื่องเก่า หรือ แม้แต่แท็บเล็ตหรือแล็ปท็อป ทุกอย่างก็สามารถ ใช้งานได้ ไม่มีปัญหา ในเรื่องความเข้ากันได้
เล่นได้ทุกที่ทุกเวลา
ข้อดีของการเล่น PG Slot คือ คุณสามารถ เล่นได้ตลอดเวลา ไม่ว่าจะ อยู่ที่บ้าน ออฟฟิศ หรือแม้แต่ ในที่สาธารณะ สิ่งที่คุณต้องมีคือ อินเทอร์เน็ต คุณสามารถ เริ่มเล่นได้ทันที และคุณไม่ต้อง ห่วงเรื่องการดาวน์โหลด หรือติดตั้งโปรแกรมที่ ใช้พื้นที่ในอุปกรณ์
ทดลองเล่นสล็อตฟรี
เพื่อให้ ผู้เล่นที่ใหม่ มีโอกาสลองและสัมผัสประสบการณ์สล็อตแมชชีนของเรา PG Slot ยังมีบริการสล็อตฟรี คุณสามารถ เริ่มเล่นได้ทันทีโดยไม่ต้องลงทะเบียนหรือฝากเงิน การ เล่นฟรีนี้จะช่วยให้คุณเข้าใจวิธีเล่นและรู้จักเกมก่อนลงเดิมพันจริง
การบริการและความปลอดภัย
PG Slot ตั้งใจให้บริการที่ดีที่สุดกับลูกค้า เรามี ทีมงานพร้อมบริการคุณตลอดเวลา นอกจากนี้เรายังมี ระบบรักษาความปลอดภัยที่ทันสมัย ด้วยวิธีนี้ คุณจึงมั่นใจได้ว่า ข้อมูลส่วนบุคคลและธุรกรรมทางการเงินของคุณจะได้รับการปกป้องอย่างดีที่สุด
โปรโมชั่นและของรางวัลพิเศษ
การเล่นสล็อตกับ PG Slot ยังมีข้อดี ก็คือ มี โปรโมชั่นและโบนัสพิเศษมากมายสำหรับผู้เข้าร่วม ไม่ว่าคุณจะเป็น ผู้เล่นใหม่หรือเก่า คุณสามารถ รับโปรโมชันและโบนัสได้เรื่อย ๆ สิ่งนี้จะ เพิ่มโอกาสในการชนะและเพิ่มความเพลิดเพลินในเกม
สรุปการเล่นสล็อตเว็บที่ PG Slot ถือเป็นการลงทุนที่คุ้มค่า คุณจะไม่เพียงได้รับความสุขและความสะดวกสบายจากเกมเท่านั้น แต่คุณยังมีโอกาสลุ้นรับรางวัลและโบนัสมากมายอีกด้วย ไม่สำคัญว่าจะใช้โทรศัพท์มือถือ แท็บเล็ต หรือคอมพิวเตอร์รุ่นใด สามารถมาร่วมสนุกกับเราได้เลยตอนนี้ อย่ารอช้า ลงทะเบียนและเริ่มเล่นสล็อตกับ PG Slot วันนี้!
[url=https://sildenafilps.online/]viagra best price[/url]
Wow, suprisingly I never knew this. I have been reading your blog alot over the past few days and it has earned a place in my bookmarks.
Real Madrid midfielder Rodrigo https://rodrygo.prostoprosport-ar.com gave Madrid the lead in the Champions League quarter-final first leg against Manchester City. The meeting takes place in Madrid. Rodrigo scored in the 14th minute after a pass from Vinicius Junior.
I every time used to study article in news papers but now as I am a
user of net thus from now I am using net for content,
thanks to web.
It¡¦s really a nice and useful piece of info. I¡¦m satisfied that you just shared this helpful info with us. Please keep us informed like this. Thank you for sharing.
южный парк 2 серия https://southpark-serial.ru
Everything is very open with a really clear explanation of the issues. It was definitely informative. Your website is extremely helpful. Thanks for sharing!
купить квартиру от застройщика цены https://nedvizhimost-47.ru
1xbet promo: Sign up to enhance your welcome bonus by up to 100% and earn a maximum of €130. 1xBet is a renowned betting company that offers attractive bonuses and promo codes to new players. Upon registering, you will gain access to a wide range of promotions and free bets, including free sports and casino bets, as well as free spins for slot machines.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://rompienteclothing.com/docs/art/?opisanie_filymov_006__4.html
pg
ทดลองเล่นสล็อต pg ฟรี
Excellent post. I was checking constantly this blog and I am impressed!
Very helpful information particularly the last part 🙂 I care for such
info a lot. I was looking for this particular info for a very long time.
Thank you and best of luck.
[url=https://acyclovirmc.online/]buy zovirax cream canada[/url]
Hey, you used to write magnificent, but the last few posts have been kinda boring? I miss your super writings. Past few posts are just a little bit out of track! come on!
купить квартиру от застройщика https://kupit-kvartiru47.ru
Карьерный коуч https://vminske.by/fashion/kto-takie-karernye-konsultanty — эксперт рынка труда, который помогает людям определить свои карьерные цели, развиваться в выбранной области и достигать успеха в профессиональной деятельности.
I am glad this it turned out so well and I hope it will continue in the future because it is so interesting and meaningful to the community.
Doceniam skupienie się na zatrudnianiu certyfikowanych profesjonalistów do SEO.
stainless kitchen sinks serves me better and they are stain resistant too..
Dzięki za wskazówki dotyczące znalezienia wiarygodnej firmy SEO.
[url=http://nolvadexin.online/]tamoxifen over the counter[/url]
Bardzo przydatny artykuł o SEO. Planuję zastosować te wskazówki na mojej stronie.
After study a number of the web sites for your web site now, and that i truly such as your method of blogging. I bookmarked it to my bookmark site list and you will be checking back soon. Pls look into my web site as well and told me how you feel.
For the reason that the admin of this site is working, no uncertainty very quickly it will be renowned, due to its quality contents.
seo продвижение по трафику сколько стоит сео оптимизация сайта
создание и продвижение сайта https://seo-prodvizhenye-kazan.ru
bookmarked!!, I like your blog.
Ten blog bardzo mi pomógł w zrozumieniu potrzeby SEO.
Pretty great post. I just stumbled upon your weblog and wanted to mention that I have truly enjoyed surfing around your blog posts. After all I will be subscribing on your feed and I’m hoping you write again soon!
Промокод 1xBet на сегодня при регистрации на сайте. Получи повышение на первый депозит до 32500р. Промокод 1хБет для новых игроков действующий и актуальный. Промокоды 1хБет на июль 2024. рабочий промокод 1xbet, о котором пойдет речь, не имеет срока годности использования и всегда гарантирует прибавку к вашему депозиту. Бесплатным промокодом может воспользоваться любой игрок при регистрации. Не имеет значения, через какую версию сайта букмекера или приложение. 1XFREE777 – специальная комбинация букв и цифр, которая показывает букмекеру автоматическим способом, что игрок должен получить повышенный бонус – более подробно в этом материале http://vip-barnaul.ru/includes/pages/seks_onlayn_video_s_chat_ruletki.html
seo продвижение сайта компании https://prodvizhenye-seo.ru
1xbet: . Avail a complimentary free bets bonus up to $/€130. Register using the bonus code and claim your bonus 100%. You can utilize the received bonus funds in sports or casino. By utilizing the promotional code, you can relish in a multitude of advantages, including deposit bonuses that match your initial investment, complimentary wagers, cashback incentives, and much more. These enticing bonuses grant you extra chances to triumph and enhance the thrill of your betting experience.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://airlinesoffice.net/blog/estestvenno_kak_dyhanie.html
Dzięki za praktyczne wskazówki dotyczące bezpiecznego SEO.
[url=https://advaird.online/]generic advair canada pharmacy[/url]
1xBet Promo Code and Betting Offers 2024
The 1XBET India Promo Code “” allows you to unlock an exclusive bonus of up to 66,000 INR when you sign up at the sportsbook. This offer is valid throughout the year 2024. Immerse yourself in the world of sports betting and take advantage of this incredible opportunity to boost your winnings. Join 1XBET today, enter the promo code during registration, and elevate your betting experience to new heights! 1xBet offers enticing betting offers to its users in India.
Here are the main offers available with the 1xBet promo code:
Sports Welcome Bonus: New users can receive a 100% bonus on their first deposit, up to INR 26,000, using the promo code. The bonus can be used for any sports betting market.
Lucky Friday Offer: Every Friday, 1xBet presents a 100% bonus on deposits made that day, up to INR 10,000. To take advantage of this offer, users need to deposit on Friday and enter the promo code “LuckyFriday.”
Accumulator of the Day: 1xBet selects a daily accumulator bet with high odds and offers an additional 10% bonus on potential winnings. To participate, users must place a bet on the selected accumulator, and if it wins, they receive the bonus.
These offers aim to enhance users’ betting experience on 1xBet. Remember to use the 1xbet when making your first deposit to enjoy the sports welcome bonus as a new customer.
Year-Round Promotional Offers
Throughout the year, 1xBet India presents various promotional offers for both new and existing customers. These can include free bets, cashback, reload bonuses, and more. Some popular promotions include the Lucky Friday offer, providing up to INR 10,000 in bonus funds, and the Wednesday promotion, offering a free bet worth INR 500 for bets on specific sports events.
Furthermore, 1xBet India organizes special promotions during major sporting events like the Indian Premier League (IPL) and the Cricket World Cup. These promotions often feature enhanced odds, free bets, and other exciting perks. Keep an eye on the promotions page on the 1xBet India website or subscribe to the newsletter to stay updated on the latest offers.
Don’t miss out on the opportunity to enhance your betting experience by using the 1xBet promo code and taking advantage of these incredible offers on the platform.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://tinnefeld-hoeren-sehen.de/wp-content/pgs/prohoghdenieigryspe.html
Dzięki za kompleksowy przewodnik po SEO. Bardzo pouczający!
Nie wiedziałem, że nawet małe zmiany mogą mieć tak duży wpływ na SEO. Dzięki za wskazówki!
https://autolux-azerbaijan.com/# Pin Up Azerbaycan
Very interesting points you have remarked, regards for putting up. “What the world really needs is more love and less paperwork.” by Pearl Bailey.
Doceniam szczegółowe wyjaśnienia i porady dotyczące SEO.
Pin up 306 casino: Pin Up Azerbaycan ?Onlayn Kazino – Pin up 306 casino
https://autolux-azerbaijan.com/# Pin-Up Casino
pin-up360 [url=https://autolux-azerbaijan.com/#]pin-up360[/url] pin-up 141 casino
Pin-up Giris: pin-up360 – Pin Up Kazino ?Onlayn
Wow, nie zdawałem sobie sprawy, jak skomplikowane może być SEO. Dzięki za te informacje!
Bardzo przydatne informacje dla każdego, kto martwi się o SEO swojej strony.
Pin-Up Casino: Pin-Up Casino – Pin Up
https://autolux-azerbaijan.com/# pin-up kazino
pin-up 141 casino [url=https://autolux-azerbaijan.com/#]Pin up 306 casino[/url] Pin up 306 casino
Hi! Do you know if they make any plugins to help with SEO? I’m trying to get my blog to rank for some targeted keywords but I’m not seeing very good gains. If you know of any please share. Cheers!
Świetne wskazówki dotyczące znalezienia wiarygodnych usług SEO. Dzięki!
https://autolux-azerbaijan.com/# pin-up 141 casino
Claim an Exclusive Bonus of 1xBet Promo Code
1xbet: By entering this code registration at 1xBet.com, you will unlock a welcome bonus of ?66,000 for sports betting and casino €1,950 along with 150 free spins. Take advantage of this opportunity to maximize your winnings and enjoy an unparalleled gaming experience at 1xBet. Indian customers are in for a treat with the 1xBet promo code bonus. By creating a new account on the platform, you can avail yourself of a fantastic welcome offer of up to INR 26,000. Please note that if you already have an existing account or have claimed another welcome offer on the platform, you won’t be eligible for this particular bonus.
To claim the bonus, make your first deposit up to a maximum of ?10,000, and you’ll receive a matching deposit in the same amount. The minimum deposit required to qualify for the offer is ?75. However, there are certain wagering requirements that must be met before you can make a withdrawal.
To fulfill the wagering requirements, you need to wager half of your bonus (the deposited amount) at least five times in accumulator bets. The remaining half of the bonus must be used in 1xGames. Keep in mind that you have a thirty-day window to complete the wagering requirements; failure to do so will result in the forfeiture of any bonus winnings.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://oqver.net/pages/?chto_takoe_elektricheskiy_shtorm.html
pin-up 141 casino: Pin Up – Pin-Up Casino
Ten post był bardzo pomocny w zrozumieniu procesu SEO. Dzięki!
Some truly interesting information, well written and loosely user pleasant.
Pin Up Kazino ?Onlayn: Pin up 306 casino – Pin Up Azerbaycan ?Onlayn Kazino
https://autolux-azerbaijan.com/# pin-up kazino
Pin Up Kazino ?Onlayn [url=https://autolux-azerbaijan.com/#]pin-up360[/url] Pin-Up Casino
Pin up 306 casino: ?Onlayn Kazino – Pin Up Azerbaycan ?Onlayn Kazino
https://autolux-azerbaijan.com/# Pin Up Azerbaycan ?Onlayn Kazino
Dziękuję za dokładne badania i szczegółowe wyjaśnienia na temat SEO.
Dzięki za podkreślenie znaczenia profesjonalnego podejścia do SEO.
[url=https://lyricamd.online/]cost of lyrica 100 mg[/url]
Świetny artykuł! Cieszę się, że są profesjonaliści, którzy mogą pomóc w SEO.
ла2 пвп сервера
Сервера л2
Pin up 306 casino: ?Onlayn Kazino – Pin Up Kazino ?Onlayn
Pin up 306 casino: Pin-Up Casino – Pin Up Azerbaycan
https://autolux-azerbaijan.com/# Pin Up Azerbaycan ?Onlayn Kazino
pin-up kazino [url=https://autolux-azerbaijan.com/#]?Onlayn Kazino[/url] Pin Up Kazino ?Onlayn
To było bardzo edukacyjne. Na pewno podzielę się tym z innymi.
https://autolux-azerbaijan.com/# ?Onlayn Kazino
Coast Bail Bonds Orange
1100 Town ɑnd Country Rd Suite 1250,
Orange, CA 92868, United Ѕtates
+17147982653
bail bonds officer job responsibilities and salary near me
To były bardzo pomocne informacje na temat kroków w SEO.
Pin-up Giris: Pin Up Azerbaycan ?Onlayn Kazino – ?Onlayn Kazino
https://autolux-azerbaijan.com/# Pin-up Giris
pin-up 141 casino [url=https://autolux-azerbaijan.com/#]Pin-Up Casino[/url] Pin Up Azerbaycan ?Onlayn Kazino
Ten blog wyjaśnia wiele zawiłości SEO. Dzięki!
Vinicius Junior https://viniciusjunior.prostoprosport-ar.com is a Brazilian and Spanish footballer who plays as a striker for Real Madrid and the Brazilian national team. Junior became the first player in the history of Los Blancos, born in 2000, to play an official match and score a goal.
Kylian Mbappe https://kylianmbappe.prostoprosport-ar.com is a French footballer, striker for Paris Saint-Germain and captain of the French national team. He began playing football in the semi-professional club Bondi, which plays in the lower leagues of France. He was noticed by Monaco scouts, which he joined in 2015 and that same year, at the age of 16, he made his debut for the Monegasques. The youngest debutant and goal scorer in the club’s history.
Czuję się znacznie pewniej w temacie SEO po przeczytaniu tego bloga.
Pin Up: Pin Up Azerbaycan – Pin Up
Ten blog dostarczył mi dużo jasności na temat SEO. Dzięki!
Use the 1xbet code: upon registration and you will receive a guaranteed bonus of 120% up to INR 66,000. The promotion is valid throughout 2024 for new sports bettors. 1xBet is a leading global online sportsbook that caters to Indian players with a diverse selection of betting markets.
Here’s an overview of the different markets available on 1xBet:
Sports Betting
1xBet boasts an extensive sportsbook that covers a wide range of sports from around the world. Whether you’re a fan of international sports like football, basketball, tennis, cricket, or you prefer niche sports, 1xBet has got you covered. You can place bets on pre-match and live events, taking advantage of competitive odds and a variety of betting options to maximize your winning potential.
Casino Games
The 1xBet casino offers a thrilling collection of games, including a wide variety of slots, table games, and live dealer games. From classic favourites like blackjack and roulette to innovative video slots and high-paying jackpot games, the casino section provides endless entertainment. Immerse yourself in a world of captivating graphics, immersive gameplay, and the chance to win big with every spin or hand.
Virtual Sports
In addition to real sports, 1xBet also offers virtual sports betting, providing a unique and exciting way to wager. Virtual sports simulate sports events using advanced computer graphics and algorithms, delivering a realistic experience. You can bet on virtual football, basketball, horse racing, and other sports, enjoying fast-paced action and realistic visuals.
1xBet is a comprehensive online betting platform that caters to the diverse preferences of players. Whether you’re a passionate sports fan, a casino enthusiast, or a poker player, 1xBet has a wide range of markets and betting options to suit your needs. Take advantage of the promo code to start your journey with extra bonus funds and explore the thrilling world of 1xBet.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://nycfirewire.net/pag/proizvodstvoposprod.html
https://autolux-azerbaijan.com/# Pin Up Azerbaycan
Victor James Osimhen https://victorosimhen.prostoprosport-ar.com is a Nigerian footballer who plays as a forward for the Italian club Napoli and the Nigerian national team. In 2015, he was recognized as the best football player in Africa among players under 17 according to the Confederation of African Football.
Pin Up Kazino ?Onlayn: Pin up 306 casino – pin-up 141 casino
https://autolux-azerbaijan.com/# pin-up 141 casino
Pin-Up Casino [url=https://autolux-azerbaijan.com/#]Pin-up Giris[/url] pin-up360
Pin Up Azerbaycan: Pin-up Giris – pin-up kazino
台灣線上娛樂城是指通過互聯網提供賭博和娛樂服務的平台。這些平台主要針對台灣用戶,但實際上可能在境外運營。以下是一些關於台灣線上娛樂城的重要信息:
1. 服務內容:
– 線上賭場遊戲(如老虎機、撲克、輪盤等)
– 體育博彩
– 彩票遊戲
– 真人荷官遊戲
2. 特點:
– 全天候24小時提供服務
– 可通過電腦或移動設備訪問
– 常提供優惠活動和獎金來吸引玩家
3. 支付方式:
– 常見支付方式包括銀行轉賬、電子錢包等
– 部分平台可能接受加密貨幣
4. 法律狀況:
– 在台灣,線上賭博通常是非法的
– 許多線上娛樂城實際上是在國外註冊運營
5. 風險:
– 由於缺乏有效監管,玩家可能面臨財務風險
– 存在詐騙和不公平遊戲的可能性
– 可能導致賭博成癮問題
6. 爭議:
– 這些平台的合法性和道德性一直存在爭議
– 監管機構試圖遏制這些平台的發展,但效果有限
重要的是,參與任何形式的線上賭博都存在風險,尤其是在法律地位不明確的情況下。建議公眾謹慎對待,並了解相關法律和潛在風險。
如果您想了解更多具體方面,例如如何識別和避免相關風險,我可以提供更多信息。
wonderful submit, very informative. I ponder why the other specialists of this sector don’t understand this. You should proceed your writing. I am confident, you’ve a great readers’ base already!
1xbet code: offers a VIP bonus of 100% up to $130 for sports betting and a casino package of €1,950 + 150 free spins. This bonus is valid until December 31, 2024. The promotion is valid for new customers only. The bonus promo code must be used during the registration process.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://kaikatei.net/wp-content/pgs/francuzskiy_poceluy_1995_opisanie.html
Doceniam skupienie się na bezpieczeństwie, gdy mowa o SEO.
Портал о здоровье
https://rezus.ru и здоровом образе жизни, рекомендации врачей и полезные сервисы. Простые рекомендации для укрепления здоровья и повышения качества жизни.
Czuję się znacznie pewniej w temacie SEO po przeczytaniu tego bloga.
Toni Kroos https://tonikroos.prostoprosport-ar.com is a German footballer who plays as a central midfielder for Real Madrid and the German national team. World champion 2014. The first German player in history to win the UEFA Champions League six times.
Ten post to świetne źródło informacji dla każdego, kto potrzebuje SEO.
Самый полный список промокодов 1хБет на сегодня у нас на сайте. Все промокоды раздаются бесплатно: на ставку, при регистрации, бездепозитные промики. Обновляем каждые 5 часов. Обычно 1xBet промокод при регистрации предоставляет бонус на первый депозит и используется на этапе создания аккаунта в БК. Сумма вознаграждения достигает 100% от первого пополнения. Следующий тип — промокод 1xbet на сегодня. Он позволяет заключать пари на спортивные события, либо пользоваться привилегиями в сфере азартных игр, доступных на сайте БК. Такой бонус предоставляется бесплатно в честь регистрации, Дня рождения или активности – более подробно в этом материале https://mebel-3d.ru/libraries/news/?mify_i_zablughdeniya_o_prichinah_impotencii.html
Robert Lewandowski https://robertlewandowski.prostoprosport-ar.com is a Polish footballer, forward for the Spanish club Barcelona and captain of the Polish national team. Considered one of the best strikers in the world. Knight of the Commander’s Cross of the Order of the Renaissance of Poland.
Dzięki za szczegółowy przewodnik po tym, czego można oczekiwać podczas wdrażania SEO.
волчонок сезон в хорошем качестве https://volchonok-tv.ru
1xbet code: enter the code during registration and receive a welcome bonus of up to $130 for sports betting and a casino bonus of €1,950 + 150 free spin. Register now at 1xBet to take advantage of this incredible offer. 1xBet Promotion 2024 offers a range of exciting incentives for players. With bonus codes, you can unlock additional benefits and enhance your gaming experience. Get your hands on free money and enjoy the thrill of playing with bonus free bets. Take advantage of this opportunity to play for free and make the most out of your time at 1xBet.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — http://ftvmilfs.net/art/chto_takoe_biorevitalizaciya.html
Mohamed Salah https://mohamedsalah.prostoprosport-ar.com is an Egyptian footballer who plays as a forward for the English club Liverpool and the Egyptian national team. Considered one of the best football players in the world. Three-time winner of the English Premier League Golden Boot: in 2018 (alone), 2019 (along with Sadio Mane and Pierre-Emerick Aubameyang) and 2022 (along with Son Heung-min).
Pedro Gonzalez Lopez https://pedri.prostoprosport-ar.com better known as Pedri, is a Spanish footballer who plays as an attacking midfielder for Barcelona and the Spanish national team. Bronze medalist of the 2020 European Championship, as well as the best young player of this tournament. Silver medalist at the 2020 Olympic Games in Tokyo. At the age of 18, he was included in the list of 30 football players nominated for the 2021 Ballon d’Or.
buy tiktok views and likes buy tiktok likes
acer laptops have much brighter lcd screens compared to other brands`
Appreciate your making the effort to discuss this, Personally i think strongly about it and love learning on this topic. Whenever possible, since you gain expertise, do you mind updating your blog with extra information? It is very helpful for me.
I find myself approach to your journal more and more often to the point where my visits are almost each day now!
The next occasion I read a blog, I’m hoping that this doesnt disappoint me around this. Get real, It was my substitute for read, but I really thought youd have some thing fascinating to talk about. All I hear is actually a couple of whining about something you could fix if you werent too busy seeking attention.
After study a few of the blog articles with your website now, we truly such as your way of blogging. I bookmarked it to my bookmark site list and you will be checking back soon. Pls take a look at my site likewise and tell me if you agree.
Vouêtes vraiment bien informé et très intelligent. Vous avez écrit quelque chose que les gens puissent comprendre et faire l’objet fascinant pour tout le monde. Je suis sauver ce pour une utilisation future.
Lionel Andres Messi Cuccittini https://lionelmessi.prostoprosport-ar.com is an Argentine footballer, forward and captain of the MLS club Inter Miami, captain of the Argentina national team. World champion, South American champion, Finalissima winner, Olympic champion. Considered one of the best football players of all time.
Cristiano Ronaldo https://cristiano-ronaldo.prostoprosport-ar.com is a Portuguese footballer, forward, captain of the Saudi Arabian club An-Nasr and the Portuguese national team. European Champion. Considered one of the best football players of all time. The best scorer in the history of football according to the IFFIS and fourth according to the RSSSF
I think this website has got very superb pent articles posts.
Excellent blog! Do you have any tips and hints for aspiring writers? I’m planning to start my own website soon but I’m a little lost on everything. Would you advise starting with a free platform like WordPress or go for a paid option? There are so many choices out there that I’m totally confused .. Any suggestions? Many thanks!
Hi there! Someone in my Myspace group shared this site with us so I came to give it a look. I’m definitely loving the information. I’m bookmarking and will be tweeting this to my followers! Outstanding blog and wonderful style and design.
Hello, I found your blog in a very new directory of blogs. I don’t discover how your website came up, should have been a typo. Your website looks good, use a nice day.
Oh i really envy the way you post topics, how i wish i could write like that.’:\’`.
Hey are using WordPress for your site platform? I’m new to the blog world but I’m trying to get started and create my own. Do you need any html coding expertise to make your own blog? Any help would be really appreciated!
Бесплатные игры на деньги с моментальными выплатами онлайн – Twin Casino официальный сайт
Anderson Sousa Conceicao better known as Talisca https://talisca.prostoprosport-ar.com is a Brazilian footballer who plays as a midfielder for the An-Nasr club. A graduate of the youth team from Bahia, where he arrived in 2009 ten years ago.
Yassine Bounou https://yassine-bounou.prostoprosport-ar.com also known as Bono, is a Moroccan footballer who plays as a goalkeeper for the Saudi Arabian club Al-Hilal and the Moroccan national team. On November 10, 2022, he was included in the official application of the Moroccan national team to participate in the matches of the 2022 World Cup in Qatar
Please let me know if you’re looking for a author for your site. You have some really good posts and I believe I would be a good asset. If you ever want to take some of the load off, I’d really like to write some content for your blog in exchange for a link back to mine. Please blast me an e-mail if interested. Regards!
There are a few intriguing points on time in this post but I don’t know if them all center to heart. There may be some validity but I’m going to take hold opinion until I take a look at it further. Very good write-up , thanks and we want more! Added to FeedBurner in addition
Your blog would increase in ranking if you post more often.”*;-,
Its not that I need to duplicate your web website, but I truly like the formatof your site. Could you let me know which theme are you using? Or was it custom made?
I undoubtedly did not realize that. Learnt something new today! Thanks for that.
you are in point of fact a good webmaster. The web site loading pace is incredible. It seems that you are doing any unique trick. Also, The contents are masterpiece. you’ve done a excellent job in this topic!
Игровые автоматы с моментальными выплатами на реальные деньги онлайн – леон казино
Harry Edward Kane https://harry-kane.prostoprosport-ar.com is an English footballer, forward for the German club Bayern and captain of the England national team. Considered one of the best football players in the world. He is Tottenham Hotspur’s and England’s all-time leading goalscorer, as well as the second most goalscorer in the Premier League. Member of the Order of the British Empire.
Neymar da Silva Santos Junior https://neymar.prostoprosport-ar.com is a Brazilian footballer who plays as a striker, winger and attacking midfielder for the Saudi Arabian club Al-Hilal and the Brazilian national team. Considered one of the best players in the world. The best scorer in the history of the Brazilian national team.
Can I just say what a relief to search out somebody who really is aware of what theyre speaking about on the internet. You undoubtedly know how to deliver a problem to light and make it important. Extra folks need to learn this and perceive this facet of the story. I cant consider youre no more common because you positively have the gift.
You can increase your blog visitors by having a fan page on facebook.:’*”~
most toddlers love cute teddys as their first toddler toys, my son also loves them a lot,.
A really fascinating read, I may well not agree totally, but you do make some quite legitimate factors.
i love to collect different models of cellphones that is why i have lots of cellphones at home.,
Think about this: Never put all your eggs in one basket.
Erling Breut Haaland https://erling-haaland.prostoprosport-ar.com is a Norwegian footballer who plays as a forward for the English club Manchester City and the Norwegian national team. English Premier League record holder for goals per season.
Thanks for discussing your ideas in this article. The other matter is that if a problem occurs with a computer system motherboard, people should not consider the risk of repairing this themselves because if it is not done properly it can lead to permanent damage to the complete laptop. It will always be safe to approach any dealer of your laptop for any repair of its motherboard. They have technicians who’ve an experience in dealing with mobile computer motherboard issues and can make right analysis and perform repairs.
Quite easily, the article is in reality the sweetest on that laudable topic. I agree with your conclusions and also will eagerly look forward to your approaching updates. Simply just saying thanks can not just be sufficient, for the incredible lucidity in your writing. I will instantly grab your rss feed to stay privy of any kind of updates. Good work and also much success in your business efforts!
Undeniably believe that which you stated. Your favorite justification appeared to be on the internet the easiest thing to be aware of. I say to you, I certainly get irked while people consider worries that they just do not know about. You managed to hit the nail upon the top and also defined out the whole thing without having side-effects , people could take a signal. Will probably be back to get more. Thanks .Chlebek Dukana
Enjoy ones site as its directly to the point but not technical. I’m keen on gadgets as well as anything tech connected thats the reason why i posted right here.
Ali al-Buleahi https://ali-al-bulaihi.prostoprosport-ar.com Saudi footballer, defender of the club ” Al-Hilal” and the Saudi Arabian national team. On May 15, 2018, Ali al-Buleakhi made his debut for the Saudi Arabian national team in a friendly game against the Greek team, coming on as a substitute midway through the second half.
Your ability to write about this kind of info is just the thing we all desire. Simply by discussing your knowledge you support people thru discussing your own personal observations. And I’ll let you know right now your writing served me personally.
I’m sure you will find there’s trouble with your internet site by using Firefox browser.
wooden kitchen cabinets are perfect your your home, they look good and can be cleaned easily,.
I have noticed that over the course of developing a relationship with real estate homeowners, you’ll be able to get them to understand that, in every single real estate transaction, a commission is paid. In the long run, FSBO sellers will not “save” the commission. Rather, they fight to win the commission by means of doing a great agent’s job. In completing this task, they invest their money along with time to conduct, as best they will, the assignments of an broker. Those duties include getting known the home by means of marketing, representing the home to all buyers, constructing a sense of buyer desperation in order to prompt an offer, making arrangement for home inspections, taking on qualification checks with the loan company, supervising fixes, and aiding the closing of the deal.
Luka Modric https://lukamodric.prostoprosport-ar.com is a Croatian footballer, central midfielder and captain of the Spanish club Real Madrid, captain of the Croatian national team. Recognized as one of the best midfielders of our time. Knight of the Order of Prince Branimir. Record holder of the Croatian national team for the number of matches played.
pay per click programs are really great, i could earn some decent cash from it..
I’ve recently been wondering about the very same point myself recently. Happy to see someone on the same wavelength! Nice article.
I really like this blog site, will definitely come back again. Make sure you carry on creating quality content articles.
I am usually to blogging and i really appreciate your website content continuously. This article has really peaks my interest. I am going to bookmark your internet site and maintain checking choosing details.
buy tiktok followers tokmatik.com https://iemlabs.com/blogs/make-money-on-tiktok-without-followers-in-2024-easy-guide/
buy tiktok followers instant https://www.templates.com/blog/how-to-get-more-followers-on-tiktok-expert-tips/
Hello! I merely would choose to give you a huge thumbs up with the great info you’ve got here during this post. I am coming back to your blog post for much more soon.
Hello! I merely would choose to make a enormous thumbs up for that excellent information you may have here for this post. I’ll be returning to your blog for much more soon.
I just could not go away your website before suggesting that I extremely enjoyed the usual info a person supply to your guests? Is going to be back ceaselessly in order to inspect new posts.
Today it seems like Phrase Powerplant is the top blogging service available today. (through just what We have examine) Is always that what you are utilizing in your website?
Awesome web site and with very useful stuff. I’m pleased I discovered this page. The site has plenty of excellent information on the this subject of. Many thanks for this blog post. I should be coming by time and again and reading through your previous entries.
After city whatever of your blogposts I staleness say i constitute this fact one to mostly be top snick. I hump a weblog also and want to repost a few shear of your articles on my own journal tract. Should it be alright if I use this as longish I own write your web journal or make a inward unite to your article I procured the snippet from? If not I see and could not do it without having your acceptance . I hit assemblage marked this article to sound and zynga chronicle willful for testimonial. Anyway appreciate it either way!
Используйте Твин казино промокод и получите эксклюзивные предложения
средство для ежедневной интимной гигиены https://vitam.pro/product-category/kosmeticheskie-sredstva/sredstva-dlja-intimnoj-gigieny-intiline/
I don’t unremarkably comment but I gotta admit thankyou for the post on this great one : D.
Useful information. Fortunate me I discovered your web site by accident, and I am stunned why this accident didn’t came about in advance! I bookmarked it.
The best film magazin https://orbismagazine.com, film industry trade publications in 2024 to keep you informed with the latest video production, filmmaking, photographynews. We create beautiful and magnetic projects.
I went over this internet site and I believe you have a lot of fantastic info , bookmarked (:.
I simply desired to say thanks once again. I’m not certain the things that I would’ve undertaken in the absence of the solutions shared by you concerning such problem. It has been a very distressing setting in my view, but understanding a new well-written tactic you treated it forced me to jump over happiness. I’m just happy for this support and in addition believe you realize what an amazing job your are undertaking training men and women through your web blog. I am sure you haven’t encountered any of us.
It was some sort of pleasure locating your site a short while ago. I came up here right now hoping to come across interesting things. And I was not dissatisfied. Your ideas about new approaches on this subject were topical and a good help to myself. Thank you for making time to write down these things plus for sharing your notions.
I have caught great sites and I have caught not so wonderful blogs. This blog is very informationrmative in many ways and certainloy ranks in the former category. Really appreciate the information your providing use avid scaners!
Great weblog here! Also your site so much up fast! What host are yoou using?
Can I amm getting your associate hyperlink to your host?
I desire my website loaded up aas quickly as yours lol http://forum.prolifeclinics.ro/profile.php?id=1348315
Just wijsh tto say your article is as surprising. The clearness in your post is just great and i could assume you’re an expert
oon this subject. Fine with your permisssion allow me to grab your feed to
keep up to dare with forthcoming post. Thanks a million and please continue the enjoyable work. https://affiliates.trustgdpa.com/what-are-essay-writing/
hey there and thank you for your info – I have definitely picked up
anything new from right here. I did however expertise a
few technical issues using tyis web site, since I experienced to relopad the site
many times previous to I could get it tto load correctly.
I had been wondering if yyour web hosting is OK? Not that
I am complaining, but slluggish loading instances times wilkl often affct your placement in googlee and coulld damage your quality score if
ads and marketing with Adwords. Well I’m adding this RSS to my
email and could look out for a lot more of your respective exciting content.
Make sure you update this again very soon. https://casajienilor.ro/need-more-time-read-these-tips-to-eliminate-essay-writing/
Justt desire to say your article is as astonishing. The
clarity for your submit is simply excellent and i cann suppose you are a professional on this subject.
Fine with your permission let mme to clutch your RSS feed to staqy updated wth approaching post.
Thankjs 1,000,000 and please carry on the rewarding
work. https://ladder2leader.com/characteristics-of-essay-writing/
If you are going for most excellent contents like myself, just payy a quick visit this web sitfe all the time because it provides quality
contents, thanks https://trademarketclassifieds.com/user/profile/569746
ehternet cables are still the ones that i use for my home networking applications::
It’s exhausting to seek out knowledgeable individuals on this topic, but you sound like you recognize what you’re speaking about! Thanks
Great post. I was checling constantly this blog and I am inspired!
Extremely useful information spescifically thee remnaining parrt
🙂 I maintaain such information a lot. I was looking for this certain infdo for a very long time.
Thank you and best of luck. https://www.pitstopodium.com/f1-news/the-ulitmate-essay-writing-trick/
Hurrah, that’s what I was exploring for, what a data!
existing ere at this blog, thanks admin of this site. https://www.pitstopodium.com/f1-news/in-10-minutes-ill-provide-you-with-the-reality-about-essay-writing/
Spot on with this write-up, I really believe this amazing
site needs far more attention. I’ll probably be returning tto see more, thanks for thhe information! https://affiliates.trustgdpa.com/essay-writing-guide/
Have you considered about incorporating some social bookmarking buttons to these blogs. At least for twitter.
Thanks a lot for the share, Keep the work sharing………
Can I merely say thats a relief to discover somebody that in fact knows what theyre preaching about over the internet. You actually have learned to bring an issue to light and earn it critical. The diet must read this and understand this side on the story. I cant believe youre no more well-known when you undoubtedly contain the gift.
Therefore i’m as content with check this out. Really kind of hands-on that must be considering in no way our dog hype this is certainly with various blogs, forums. We appreciate you your own personal anything this valuable most useful file.
Excellent blog you have here but I was curious about if you knew of any forums that cover the same topics talked about in this article? I’d really love to be a part of group where I can get comments from other knowledgeable individuals that share the same interest. If you have any suggestions, please let me know. Appreciate it!
I am not real fantastic with English but I come up this real leisurely to interpret .
I appreciate your information in this article. It’s smart, well-written and easy to understand. You have my attention on this subject. I will be back.
Взять займ или кредит
https://мартин-мебель.рф/onlajn-kalkulyator-dlya-rascheta-kredita/ под проценты, подав заявку на денежный микрозайм для физических лиц. Выбирайте среди 570 лучших предложений займа онлайн. Возьмите микрозайм онлайн или наличными в день обращения. Быстрый поиск и удобное сравнение условий по займам и микрокредитам в МФО.
NGolo Kante https://ngolokante.prostoprosport-ar.com is a French footballer who plays as a defensive midfielder for the Saudi Arabian club Al-Ittihad and the French national team. His debut for the first team took place on May 18, 2012 in a match against Monaco (1:2). In the 2012/13 season, Kante became the main player for Boulogne, which played in Ligue 3.
Hi there, I found your site by means of Google while searching for a comparable subject, your web site got here up, it seems to be great. I have bookmarked it in my google bookmarks.
I am usually to blogging and i really appreciate your website content continuously. This great article has truly peaks my interest. I am going to bookmark your website and keep checking for brand new info.
mexican drugstore online reputable mexican pharmacies online or purple pharmacy mexico price list
https://clipperfund.com/?URL=https://northern-doctors.org:: mexican mail order pharmacies
[url=http://www.e-decor.com.ua/go/?fid=53&url=https://northern-doctors.org]buying from online mexican pharmacy[/url] pharmacies in mexico that ship to usa and [url=http://bbs.cheaa.com/home.php?mod=space&uid=3151030]mexican pharmaceuticals online[/url] medication from mexico pharmacy
Ruben Diogo da Silva Neves https://ruben-neves.prostoprosport-ar.com is a Portuguese footballer who plays as a midfielder for the Saudi Arabian club Al-Hilal and the Portuguese national team. Currently, Ruben Neves plays for the Al-Hilal club wearing number 8. His contract with the Saudi club is valid until the end of June 2026.
mojdez
https://montenegro-immobilien-kaufen.com
mexican pharmacy mexican pharmaceuticals online or purple pharmacy mexico price list
https://www.google.cg/url?q=https://northern-doctors.org buying from online mexican pharmacy
[url=https://www.google.tt/url?q=https://northern-doctors.org]mexican pharmacy[/url] mexico pharmacies prescription drugs and [url=http://bbs.chinabidding.com/home.php?mod=space&uid=703758]buying from online mexican pharmacy[/url] pharmacies in mexico that ship to usa
Kobe Bean Bryant https://kobebryant.prostoprosport-ar.com is an American basketball player who played in the National Basketball Association for twenty seasons for one team, the Los Angeles Lakers. He played as an attacking defender. He was selected in the first round, 13th overall, by the Charlotte Hornets in the 1996 NBA Draft. He won Olympic gold twice as a member of the US national team.
Интимные услуги в столице является проблемой как сложной и разнообразной темой. Хотя данная деятельность запрещается законом, эта деятельность существует как важным нелегальной областью.
Исторические аспекты
В Советского Союза эру коммерческий секс имела место незаконно. После распада Союза, в обстановке хозяйственной кризиса, эта деятельность стала очевидной.
Сегодняшняя Ситуация
Сейчас интимные услуги в Москве включает различные формы, начиная с люксовых эскорт-сервисов и до публичной коммерческого секса. Высококлассные сервисы часто предоставляются через в сети, а улицы секс-работа сосредоточена в конкретных районах Москвы.
Общественно-экономические аспекты
Некоторые представительницы слабого пола приходят в этот бизнес вследствие финансовых трудностей. Интимные услуги является привлекательной из-за перспективы быстрого заработка, но эта деятельность подразумевает вред для здоровья и личной безопасности.
Юридические аспекты
Интимные услуги в РФ нелегальна, и за эту деятельность осуществление предусмотрены жесткие штрафы. Секс-работниц постоянно привлекают к к административной отчетности.
Таким образом, невзирая на запреты, проституция остаётся аспектом незаконной экономики Москвы с существенными социально-правовыми последствиями.
проститутки в метро люблино
when we do our home renovation, we always look for new home styles and designs on the internet for some great ideas.
1xBet Bonus Package for Indian Casino Customers
Experience the ultimate excitement of online casino gaming with the exclusive Casino Welcome Offer at 1xBet India 2024. Get ready for an immersive and thrilling journey filled with a wide variety of live dealer games and a vast selection of captivating slots. Unlock this amazing offer by using the 1xBet promo code and take your casino adventure to new heights.
1xBet casino promo code: , bonus 100% up to $1950 and 150 free spins at the casino. Gain access to an exceptional casino welcome package worth ?130,000. This bonus can be claimed across four separate deposits, allowing you to maximize your rewards and extend your gaming sessions. Prepare to be enthralled by the exhilarating gameplay, stunning graphics, and immersive sound effects that will transport you to the heart of the casino action.
Whether you’re a fan of classic table games or prefer the excitement of spinning the reels on slots, 1xBet has you covered. Explore an extensive collection of live dealer games, where you can interact with professional dealers in real-time for an authentic casino experience. Additionally, the slots section boasts a diverse range of games, ensuring there’s something to suit every preference and style.
Attention all casino enthusiasts! You definitely don’t want to miss out on this incredible opportunity to elevate your casino journey. By using the exclusive 1xbet code promo bonus: , you can unlock a remarkable ?169,000 welcome package along with 150 free spins for the year 2024. Immerse yourself in the excitement of the casino, make the most of the bonuses, and embark on a gaming adventure like no other at 1xBet India.
For our valued Indian customers who have a keen interest in the casino section, 1xBet presents an enticing alternative welcome package. This package is designed to enhance your gaming experience across your first four deposits, allowing you to receive a whopping ?169,000 in addition to 150 free spins.
Here’s how the bonus package is divided:
1st deposit: 100% matched bonus + 30 free spins on Reliquary of Ra
2nd deposit: 50% matched bonus + 35 free spins on Chieftain Buffalo
3rd deposit: 25% matched bonus + 40 free spins on Stampede Buffalo
4th deposit: 25% matched bonus + 45 free spins on Rich of the Mermaid Hold and Spin
Embrace the Excitement at 1xBet
With these enticing promo codes and bonus offers, 1xBet ensures that new customers can kickstart their betting journey with a thrilling advantage. Whether you prefer sports betting or exploring the casino games, 1xBet has something for everyone. Don’t miss out on the opportunity to elevate your gaming experience—join 1xBet today and unlock a world of excitement.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://lusitanohorsefinder.com/wp-content/pages/pages/simptomy_liposarkomy_osobennosti_lecheniya_zabolevaniya.html
I do not understand exactly how I ran across your blog because I had been researching information on Real Estate inWinter Springs, FL, but anyway, I have thoroughly enjoyed reading it, keep it up!
Купити ліхтарики https://bailong-police.com.ua оптом та в роздріб, каталог та прайс-лист, характеристики, відгуки, акції та знижки. Купити ліхтарик онлайн з доставкою. Відмінний вибір ліхтарів: налобні, ручні, тактичні, ультрафіолетові, кемпінгові, карманні за вигідними цінами.
I like Your Article about Anniversary of Mother Teresa’s Death | Fr. Frank Pavone’s Blog Perfect just what I was searching for! .
Продажа подземных канализационных ёмкостей https://neseptik.com по выгодным ценам. Ёмкости для канализации подземные объёмом до 200 м3. Металлические накопительные емкости для канализации заказать и купить в Екатеринбурге.
best online pharmacies in mexico mexican pharmacy or medication from mexico pharmacy
https://clients1.google.tm/url?q=https://northern-doctors.org mexico pharmacies prescription drugs
[url=https://maps.google.mn/url?q=https://northern-doctors.org]п»їbest mexican online pharmacies[/url] п»їbest mexican online pharmacies and [url=https://dongzong.my/forum/home.php?mod=space&uid=2899]п»їbest mexican online pharmacies[/url] mexican pharmacy
purple pharmacy mexico price list mexico drug stores pharmacies or mexico pharmacies prescription drugs
https://images.google.bf/url?q=https://northern-doctors.org purple pharmacy mexico price list
[url=https://scanverify.com/siteverify.php?site=northern-doctors.org]mexican pharmaceuticals online[/url] mexico drug stores pharmacies and [url=http://ckxken.synology.me/discuz/home.php?mod=space&uid=46351]mexican mail order pharmacies[/url] mexico pharmacies prescription drugs
“I would like to express appreciation to you for rescuing me from this particular condition. After researching through the the net and coming across basics which were not productive, I was thinking my life was gone. Being alive devoid of the solutions to the problems you’ve sorted out by means of this site is a crucial case, as well as ones which might have in a wrong way affected my entire career if I had not come across your blog post. Your mastery and kindness in playing with almost everything was precious. I’m not sure what I would’ve done if I had not encountered such a thing like this. I am able to at this point relish my future. Thanks a lot so much for your high quality and results-oriented help. I will not think twice to suggest your site to any person who should get assistance on this matter.”
Lebron Ramone James https://lebronjames.prostoprosport-ar.com American basketball player who plays the positions of small and power forward. He plays for the NBA team Los Angeles Lakers. Experts recognize him as one of the best basketball players in history, and a number of experts put James in first place. One of the highest paid athletes in the world.
You must continue your writing.. Great post. A rise in A lot more Amazing.
https://win-line.net/אתרי-הימורים-אמינים/
לשלוח, נתונים לדבריך.
פעילות ההימורים באינטרנט הפכה לענף פופולרי מאוד בעת האחרונה, המספק מגוון רחב של אלטרנטיבות משחק, החל מ הימורי ספורט.
בניתוח זה נפרט את תופעת הפעילות המקוונת ונעניק לכם נתונים חשובים שיתרום לכם לנתח בתחום מסקרן זה.
קזינו אונליין – התמודדות באינטרנט
קזינו אונליין מכיל מבחר מגוון של פעילויות ידועים כגון פוקר. הקזינו באינטרנט נותנים למתמודדים ליהנות מחוויית משחק אותנטית מכל מקום.
סוג המשחק תיאור קצר
מכונות שלוט הימורי גלגל
משחק הרולטה הימור על מספרים וצבעים על גלגל הרולטה
משחק הקלפים בלאק ג’ק משחק קלפים בו המטרה היא 21 נקודות
התמודדות בפוקר משחק קלפים אסטרטגי
משחק קלפים באקרה משחק קלפים פשוט וזריז
הימורים על אירועי ספורט – פעילות באינטרנט
הימורים בתחום הספורט מהווים אחד הסגמנטים הצומחים המובילים ביותר בהתמודדות באינטרנט. מתמודדים רשאים לסחור על ביצועים של תחרויות ספורט פופולריים כגון טניס.
העסקאות אפשר לבצע על תוצאת האירוע, מספר האירועים ועוד.
סוג ההימור ניתוח ענפי ספורט נפוצים
ניחוש הביצועים ניחוש הביצועים הסופיים בתחרות כדורגל, כדורסל, קריקט
הפרש תוצאות ניחוש הפרש הנקודות בין הקבוצות כדורגל, כדורסל, הוקי
מספר שערים/נקודות ניחוש כמות הביצועים בתחרות כדורגל, כדורסל, הוקי קרח
המנצח בתחרות ניחוש מי יהיה הזוכה (ללא קשר לתוצאה) מגוון ענפי ספורט
התמרמרות בזמן אמת התמודדות במהלך התחרות בזמן אמת מגוון ענפי ספורט
פעילות מעורבת שילוב של מספר סוגי התמרמרות מספר תחומי ספורט
פעילות פוקר מקוונת – התמודדות באינטרנט
פוקר אונליין מכיל אחד מתחומי הקזינו המובילים ביותר בזמן האחרון. שחקנים מסוגלים להשתתף עם משתתפים אחרים מכמה העולם במגוון
Hey there! I’m at work browsing your blog from my new iphone! Just wanted to say I love reading through your blog and look forward to all your posts! Carry on the great work!
Comfortabl y, the post is really the freshest on this deserving topic. I harmonise with your conclusions and also can thirstily look forward to your next updates. Simply just saying thanks definitely will not simply be adequate, for the extraordinary clarity in your writing. I will certainly directly grab your rss feed to stay informed of any kind of updates. Gratifying work and much success in your business dealings!
Luis Fernando Diaz Marulanda https://luis-diaz.prostoprosport-ar.com Colombian footballer, winger for Liverpool and the Colombian national team . Diaz is a graduate of the Barranquilla club. On April 26, 2016, in a match against Deportivo Pereira, he made his Primera B debut. On January 30, 2022, he signed a contract with the English Liverpool for five years, the transfer amount was 40 million euros.
Maria Sharapova https://maria-sharapova.prostoprosport-ar.com Russian tennis player. The former first racket of the world, winner of five Grand Slam singles tournaments from 2004 to 2014, one of ten women in history who has the so-called “career slam”.
You need to indulge in a tournament for example of the finest blogs on the web. Let me recommend this blog!
Это сделать просто, если иметь промокод 1xbet на сегодня бесплатно. Правда, дается он при условии выполнения некоторых правил. промокод 1xbet на сегодня. Не совсем промокод, но вы все равно ставите не свои деньги, если пополните депозит, – 100% бонуса от внесенной суммы. Максимум указан в верхней части главной страницы официального сайта. 100% бонус за пополнение от 1xbet. Но прежде чем получить бонус нужно пройти регистрацию. Зайдите на сайт БК 1xBet и нажмите по стрелке кнопку «Регистрация». 2. Выберите один из методов регистрации (самый быстрый — в один клик). Кликните на «Зарегистрироваться» – более подробно в этом материале http://mcable.ru/files/?infekcii_u_lyudey_s_immunodeficitom.html
Kevin De Bruyne https://kevin-de-bruyne.prostoprosport-ar.com Belgian footballer, midfielder of the Manchester club City” and the Belgian national team. A graduate of the football clubs “Ghent” and “Genk”. In 2008 he began his adult career, making his debut with Genk.
Mohammed Khalil Ibrahim Al-Owais https://mohammed-alowais.prostoprosport-ar.com is a Saudi professional footballer who plays as a goalkeeper for the national team Saudi Arabia and Al-Hilal. He is known for his quick reflexes and alertness at the gate.
Isn’t it entertaining if we always talk about topics like that.~`’-*
Hey, just looking around some blogs, seems a pretty nice platform you are using and the theme as well. I’m currently using WordPress for a few of my sites but looking to change one of them over to a platform similar to yours as a trial run. Anything in particular you would recommend about it? Have a nice Tuesday!
I am usually to blogging and that i actually appreciate your site content. This content has truly peaks my interest. Let me bookmark your internet site and maintain checking for brand spanking new data.
Quincy Anton Promes https://quincy-promes.prostoprosport-br.com Dutch footballer, attacking midfielder and forward for Spartak Moscow . He played for the Dutch national team. He won his first major award in 2017, when Spartak became the champion of Russia.
п»їbest mexican online pharmacies best online pharmacies in mexico or buying prescription drugs in mexico
http://dl.theme-wordpress.ir/index.php?url=http://northern-doctors.org medicine in mexico pharmacies
[url=https://images.google.gl/url?sa=t&url=https://northern-doctors.org]medication from mexico pharmacy[/url] mexico pharmacy and [url=http://wuyuebanzou.com/home.php?mod=space&uid=565020]mexican border pharmacies shipping to usa[/url] mexico drug stores pharmacies
Экспертиза ремонта в квартире https://remnovostroi.ru проводится для оценки качества выполненных работ, соответствия требованиям безопасности и стандартам строительства. Специалисты проверяют используемые материалы, исполнение работ, конструктивные особенности, безопасность, внешний вид и эстетику ремонта. По результатам экспертизы составляется экспертное заключение с оценкой качества и рекомендациями по устранению недостатков.
It absolutely was any exhilaration finding your site yesterday evening. We arrived here these days seeking something totally new. I used to be not disappointed. Your opinions on brand new approaches on this factor were helpful as well as an superb help to me personally. Appreciate leaving out time to write out these items and for discussing your thoughts.
There are definitely a whole lot of particulars like that to take into consideration. That is a nice point to deliver up. I provide the ideas above as general inspiration but clearly there are questions like the one you bring up where crucial thing might be working in sincere good faith. I don?t know if finest practices have emerged round issues like that, however I’m positive that your job is clearly recognized as a fair game. Both boys and girls really feel the impression of just a moment’s pleasure, for the rest of their lives.
Larry Joe Bird https://larry-bird.prostoprosport-br.com American basketball player who spent his entire professional career in the NBA ” Boston Celtics.” Olympic champion (1992), champion of the 1977 Universiade, 3-time NBA champion (1981, 1984, 1986), three times recognized as MVP of the season in the NBA (1984, 1985, 1986), 10 times included in the symbolic teams of the season (1980-88 – first team, 1990 – second team).
Roberto Firmino Barbosa de Oliveira https://roberto-firmino.prostoprosport-br.com Brazilian footballer, attacking midfielder, forward for the Saudi club “Al-Ahli”. Firmino is a graduate of the Brazilian club KRB, from where he moved to Figueirense in 2007. In June 2015 he moved to Liverpool for 41 million euros.
Nice thoughts. I like your site design as well. Keep up the good work.
The way you write, you are really a professional blogger.’”,`’
1xBet Bonus Package for Indian Casino Customers
Experience the ultimate excitement of online casino gaming with the exclusive Casino Welcome Offer at 1xBet India 2024. Get ready for an immersive and thrilling journey filled with a wide variety of live dealer games and a vast selection of captivating slots. Unlock this amazing offer by using the 1xBet promo code and take your casino adventure to new heights.
1xBet casino promo code: , bonus 100% up to $1950 and 150 free spins at the casino. Gain access to an exceptional casino welcome package worth ?130,000. This bonus can be claimed across four separate deposits, allowing you to maximize your rewards and extend your gaming sessions. Prepare to be enthralled by the exhilarating gameplay, stunning graphics, and immersive sound effects that will transport you to the heart of the casino action.
Whether you’re a fan of classic table games or prefer the excitement of spinning the reels on slots, 1xBet has you covered. Explore an extensive collection of live dealer games, where you can interact with professional dealers in real-time for an authentic casino experience. Additionally, the slots section boasts a diverse range of games, ensuring there’s something to suit every preference and style.
Attention all casino enthusiasts! You definitely don’t want to miss out on this incredible opportunity to elevate your casino journey. By using the exclusive 1xbet pakistan promo code: , you can unlock a remarkable ?169,000 welcome package along with 150 free spins for the year 2024. Immerse yourself in the excitement of the casino, make the most of the bonuses, and embark on a gaming adventure like no other at 1xBet India.
For our valued Indian customers who have a keen interest in the casino section, 1xBet presents an enticing alternative welcome package. This package is designed to enhance your gaming experience across your first four deposits, allowing you to receive a whopping ?169,000 in addition to 150 free spins.
Here’s how the bonus package is divided:
1st deposit: 100% matched bonus + 30 free spins on Reliquary of Ra
2nd deposit: 50% matched bonus + 35 free spins on Chieftain Buffalo
3rd deposit: 25% matched bonus + 40 free spins on Stampede Buffalo
4th deposit: 25% matched bonus + 45 free spins on Rich of the Mermaid Hold and Spin
Embrace the Excitement at 1xBet
With these enticing promo codes and bonus offers, 1xBet ensures that new customers can kickstart their betting journey with a thrilling advantage. Whether you prefer sports betting or exploring the casino games, 1xBet has something for everyone. Don’t miss out on the opportunity to elevate your gaming experience—join 1xBet today and unlock a world of excitement.
A more detailed description of how to correctly use a promotional code when registering with 1xBet — https://infinisafe.de/pag/priuchenie_schenka_k_lotku.html
Humans have maintained populations of useful animals around their positions of habitat since pre-historic times. They have deliberately fed dogs seen useful, while disregarding or killing others, thereby founding a relationship between humans and targeted types of dog over thousands of years. Over these millennia, domesticated dogs have developed into distinct types, or groups , such as livestock shielder dogs.
Khvicha Kvaratskhelia https://khvicha-kvaratskhelia.prostoprosport-br.com Georgian footballer, winger for Napoli and captain of the Georgian national team. A graduate of Dynamo Tbilisi. He made his debut for the adult team on September 29, 2017 in the Georgian championship match against Kolkheti-1913. In total, in the 2017 season he played 4 matches and scored 1 goal in the championship.
Damian Emiliano Martinez https://emiliano-martinez.prostoprosport-br.com Argentine footballer, goalkeeper of the Aston Villa club and national team Argentina. Champion and best goalkeeper of the 2022 World Cup.
There is noticeably a lot of money to comprehend this. I assume you have made particular nice points in functions also.
I conceive this web site holds some real superb information for everyone : D.
Amaze! I have been searching yahoo for hours for this and i also ultimately found it in this article!
Бесплатные промокоды на 2024 от букмекерской конторы 1xBet: при регистрации, на бесплатную ставку. Рассказываем, как использовать и куда вводить промокоды в 1хБет. промокод 1хбет при регистрации. Бесплатный промокод для увеличения бонуса. Букмекерская контора 1хБет – одна из самых популярных беттинговых площадок, предлагающая высокие коэффициенты, широкую линию с дополнительной росписью. Благодаря низкой марже БК пользователи стабильно зарабатывают на ставках на спорт. Отличительной особенностью букмекерской конторы 1xBet является возможность совершения ставок по промокодам, которые предоставляются бесплатно – более подробно в этом материале https://l-and-k.ru/wp-includes/pgs/fundamentalynyy_analiz_foreks_protiv_tehnicheskogo_analiza_treyding.html
Jack Peter Grealish https://jackgrealish.prostoprosport-br.com English footballer, midfielder of the Manchester City club and the England national team. A graduate of the English club Aston Villa from Birmingham. In the 2012/13 season he won the NextGen Series international tournament, playing for the Aston Villa under-19 team
Kyle Andrew Walker https://kylewalker.prostoprosport-br.com English footballer, captain of the Manchester City club and the England national team. In the 2013/14 season, he was on loan at the Notts County club, playing in League One (3rd division of England). Played 37 games and scored 5 goals in the championship.
소녀 에볼루션 티어표
I’ve read much confusing information on this topic and have been disappointed in the content. Your article makes this information clear and easy to understand.
[url=http://accutaneiso.online/]where can you get accutane online no rx[/url]
https://win-line.net/סוכן-קזינו-הימורים/
לשלוח, נתונים לדבריך.
ההתמודדות באינטרנט הפכה לענף נחשק מאוד בשנים האחרונות, המכיל מבחר רחב של אופציות התמודדות, כמו מכונות מזל.
בסיכום זה נסקור את עולם ההימורים המקוונים ונספק לכם הערות חשובות שיתרום לכם לחקור בתחום מרתק זה.
הימורי ספורט – קזינו באינטרנט
קזינו אונליין מכיל אופציות שונות של פעילויות ידועים כגון רולטה. ההימורים באינטרנט נותנים לשחקנים לחוות מאווירת משחק מקצועית מכל מקום.
המשחקים תיאור מקוצר
משחקי מזל משחקי מזל עם גלגלים
גלגל הרולטה הימור על מספרים וצבעים על גלגל מסתובב
בלאק ג’ק משחק קלפים בו המטרה להגיע לסכום של 21
התמודדות בפוקר התמודדות אסטרטגית בקלפים
התמודדות בבאקרה משחק קלפים מהיר וקצר
הימורים בתחום הספורט – הימורים באינטרנט
התמרמרות ספורטיבית מהווים חלק מ אחד הענפים הצומחים הגדולים ביותר בהימורים באינטרנט. מבקרים מסוגלים לסחור על ביצועים של אירועי ספורט מועדפים כגון כדורסל.
העסקאות יכולים להיות על הביצועים בתחרות, מספר השערים ועוד.
אופן ההתמודדות הסבר תחרויות ספורט מקובלות
ניחוש הביצועים ניחוש התוצאה הסופית של התחרות כדורגל, כדורסל, הוקי
הפרש ביצועים ניחוש הפרש הנקודות בין הקבוצות כל ענפי הספורט
כמות הסקורים ניחוש כמות הסקורים בתחרות כדורגל, כדורסל, קריקט
המנצח בתחרות ניחוש איזו קבוצה תנצח (ללא קשר לתוצאה) מרבית ענפי הספורט
הימורים דינמיים הימורים במהלך האירוע בזמן אמת כדורגל, טניס, כדורסל
התמרמרות מגוונת שילוב של מספר אופני התמודדות מגוון ענפי ספורט
משחקי קלפים אונליין – פעילות באינטרנט
משחקי קלפים אונליין הוא אחד מענפי הפעילות הפופולריים הגדולים ביותר בשנים האחרונות. מבקרים יכולים להתמודד מול יריבים מכמה הגלובוס במגוון
Laure Boulleau https://laure-boulleau.prostoprosport-fr.com French football player, defender. She started playing football in the Riom team, in 2000 she moved to Isere, and in 2002 to Issigneux. All these teams represented the Auvergne region. In 2003, Bullo joined the Clairefontaine academy and played for the academy team for the first time.
Son Heung Min https://sonheung-min.prostoprosport-br.com South Korean footballer, striker and captain of the English Premier League club Tottenham Hotspur and the Republic of Korea national team. In 2022 he won the Premier League Golden Boot. Became the first Asian footballer in history to score 100 goals in the Premier League
Интимные услуги в столице существует как сложной и многогранной проблемой. Невзирая на она противозаконна юридически, это занятие остаётся важным нелегальной областью.
Контекст в прошлом
В Советского Союза периоды интимные услуги процветала нелегально. По окончании Советского Союза, в обстановке рыночной нестабильной ситуации, проституция стала более видимой.
Сегодняшняя состояние
На сегодняшний день секс-работа в городе Москве принимает многообразие форм, от высококлассных услуг эскорта и до на улице интимных услуг. Высококлассные услуги в большинстве случаев предлагаются через в сети, а на улице коммерческий секс сконцентрирована в выделенных зонах Москвы.
Социальные и экономические факторы
Большинство женщины занимаются в эту сферу ввиду экономических неурядиц. Коммерческий секс может быть привлекательным из-за шанса быстрого дохода, но такая работа подразумевает риски для здоровья и личной безопасности.
Правовые Вопросы
Секс-работа в РФ нелегальна, и за её проведение установлены серьёзные штрафы. Коммерческих секс-работников постоянно привлекают к административной отчетности.
Таким образом, игнорируя запреты, интимные услуги продолжает быть частью экономики в тени столицы с значительными социальными и юридическими последствиями.
Antoine Griezmann https://antoine-griezmann.prostoprosport-fr.com French footballer, striker and midfielder for Atletico Madrid. Player and vice-captain of the French national team, as part of the national team – world champion 2018. Silver medalist at the 2016 European Championship and 2022 World Championship.
In January 2010, Harry Kane https://harry-kane.prostoprosport-fr.com received an invitation to the England U-team for the first time 17 for the youth tournament in Portugal. At the same time, the striker, due to severe illness, did not go to the triumphant 2010 European Championship for boys under 17 for the British.
Karim Mostafa Benzema https://karim-benzema.prostoprosport-fr.com French footballer, striker for the Saudi club Al-Ittihad . He played for the French national team, for which he played 97 matches and scored 37 goals.
Achraf Hakimi Mou https://achraf-hakimi.prostoprosport-fr.com Moroccan footballer, defender of the French club Paris Saint-Germain “and the Moroccan national team. He played for Real Madrid, Borussia Dortmund and Inter Milan.
Le code promo 1xbet togo, utilisez-le lors de l’inscription et obtenez un bonus de 200% jusqu’a 130$. Seuls les nouveaux joueurs peuvent obtenir le bonus. Ce contrat bonus est valable jusqu’au 31 decembre 2024. Apres le depot, le joueur recoit sur le compte bonus le montant des bonus pour les Paris de 100% du montant du depot, mais pas plus de $100. Pour recuperer le bonus recu, le joueur doit placer au moins cinq Paris dans les cinq jours suivants. Pour les Paris, vous devez faire un Express avec 3 evenements ou plus avec des cotes d’au moins 1,40.
Sweet Bonanza https://sweet-bonanza.prostoprosport-fr.com is an exciting slot from Pragmatic Play that has quickly gained popularity among players thanks to its unique gameplay, colorful graphics and the opportunity to win big prizes. In this article, we’ll take a closer look at all aspects of this game, from mechanics and bonus features to strategies for successful play and answers to frequently asked questions.
Bernardo Silva https://bernardo-silva.prostoprosport-fr.com Portuguese footballer, midfielder. Born on August 10, 1994 in Lisbon. Silva is considered one of the best attacking midfielders in the world. The football player is famous for his endurance and performance. The athlete’s diminutive size is more than compensated for by his creativity, dexterity and foresight.
Kylian Mbappe Lotten https://kylian-mbappe.prostoprosport-fr.com Footballeur francais, attaquant du Paris Saint-Germain et capitaine de l’equipe de France. Le 1er juillet 2024, il deviendra joueur du club espagnol du Real Madrid.
Jogo do Tigre https://jogo-do-tigre.prostoprosport-br.com is a simple and fun game that tests your reflexes and coordination. In this game you need to put your finger on the screen, pull out the stick and go through each peg. However, you must ensure that the stick is the right length, neither too long nor too short.
Mohamed Salah Hamed Mehrez Ghali https://mohamed-salah.prostoprosport-fr.com Footballeur egyptien, attaquant du club anglais de Liverpool et l’equipe nationale egyptienne. Considere comme l’un des meilleurs footballeurs du monde
Declan Rice https://declan-rice.prostoprosport-fr.com Footballeur anglais, milieu defensif du club d’Arsenal et de l’equipe nationale equipe d’Angleterre. Originaire de Kingston upon Thames, Declan Rice s’est entraine a l’academie de football de Chelsea des l’age de sept ans. En 2014, il devient joueur de l’academie de football de West Ham United.
Des que le compte est active et que le premier depot est recu sur le compte courant, le compte bonus recevra un montant de 130$. En consequence, les chances d’un joueur de gagner au premier pari augmentent de 130%. Et cet avantage est rendu disponible grace au Codes promo gratuits 1xbet.
Comprehensive Guide to Mac Antivirus Software: Protection, Features, and Recommendations
Jamal Musiala https://jamal-musiala.prostoprosport-fr.com footballeur allemand, milieu offensif du club allemand du Bayern et du equipe nationale d’Allemagne. Il a joue pour les equipes anglaises des moins de 15 ans, des moins de 16 ans et des moins de 17 ans. En octobre 2018, il a dispute deux matchs avec l’equipe nationale d’Allemagne U16. En novembre 2020, il a fait ses debuts avec l’equipe d’Angleterre U21.
Declan Rice https://declan-rice.prostoprosport-fr.com Footballeur anglais, milieu defensif du club d’Arsenal et de l’equipe nationale equipe d’Angleterre. Originaire de Kingston upon Thames, Declan Rice s’est entraine a l’academie de football de Chelsea des l’age de sept ans. En 2014, il devient joueur de l’academie de football de West Ham United.
Olivier Jonathan Giroud https://olivier-giroud.prostoprosport-fr.com French footballer, striker for Milan and the French national team. Knight of the Legion of Honor. Participant in four European Championships (2012, 2016, 2020 and 2024) and three World Championships (2014, 2018 and 2022).
Offre speciale 1xbet code promo tours gratuits vous offre une remise de 100% sur le montant total de votre premier depot jusqu’a 100$, bien entendu, dans votre devise locale. Profitez-en facilement en saisissant le code promotionnel lors de votre inscription et recevez un bonus sur 1xbet.com.
Xavi or Xavi Quentin Sy Simons https://xavi-simons.prostoprosport-fr.com Dutch footballer, midfielder of the Paris Saint-Germain club -Germain” and the Dutch national team, playing on loan for the German club RB Leipzig.
Ronaldo de Asis Moreira https://ronaldinhogaucho.prostoprosport-br.com Brazilian footballer, played as an attacking midfielder and striker. World Champion (2002). Winner of the Golden Ball (2005). The best football player in the world according to FIFA in 2004 and 2005.
[url=https://ibaclofen.com/]baclofen pills[/url]
Carlos Henrique Casimiro https://carloscasemiro.prostoprosport-br.com Futebolista brasileiro, volante do clube ingles Manchester United e capitao do Selecao Brasileira. Pentacampeao da Liga dos Campeoes da UEFA, campeao mundial e sul-americano pela selecao juvenil brasileira.
Kylian Mbappe Lotten https://kylianmbappe.prostoprosport-br.com Futebolista frances, atacante do Paris Saint-Germain e capitao da selecao francesa equipe . Em 1? de julho de 2024, ele se tornara jogador do clube espanhol Real Madrid.
אתרי הימורים
https://win-line.net/אתרי-הימורים-אמינים/
להגיש, ראיה לדבריך.
ההתמודדות באינטרנט הפכה לנישה מושך מאוד לאחרונה, המספק אפשרויות שונות של אפשרויות התמודדות, החל מ קזינו אונליין.
בסיכום זה נבחן את תעשיית ההתמודדות המקוונת ונייעץ לכם הערות חשובות שיסייע לכם להבין בנושא מרתק זה.
קזינו אונליין – התמודדות באינטרנט
קזינו אונליין מציע מבחר מגוון של פעילויות ידועים כגון פוקר. ההימורים באינטרנט נותנים לשחקנים ליהנות מאווירת התמודדות מקורית בכל מקום ובשעה.
הפעילות תיאור קצר
מכונות מזל משחקי מזל
הימורי רולטה הימור על תוצאות על גלגל מסתובב בצורה עגולה
משחק הקלפים בלאק ג’ק משחק קלפים להשגת ניקוד של 21
משחק הפוקר משחק קלפים מבוסס אסטרטגיה
באקרה משחק קלפים מהיר וקצר
הימורים על אירועי ספורט – קזינו באינטרנט
הימורים בתחום הספורט מהווים אחד התחומים המשגשגים המרכזיים ביותר בפעילות באינטרנט. שחקנים יכולים לסחור על פרמטרים של אתגרי ספורט פופולריים כגון כדורגל.
התמודדויות אפשר לבצע על תוצאת התחרות, מספר העופרות ועוד.
המשחק הסבר משחקי ספורט מרכזיים
ניחוש התפוקה ניחוש הביצועים הסופיים בתחרות כדורגל, כדורסל, טניס
הפרש נקודות ניחוש הפרש הנקודות בין הקבוצות כל ענפי הספורט
מספר שערים/נקודות ניחוש כמות הביצועים בתחרות כדורגל, כדורסל, הוקי קרח
מנצח המשחק ניחוש מי יזכה בתחרות (ללא קשר לביצועים) מספר ענפי ספורט
התמרמרות בזמן אמת הימורים במהלך המשחק בזמן אמת כדורגל, טניס, כדורסל
פעילות מעורבת שילוב של מספר סוגי התמרמרות מספר ענפי ספורט
התמודדות בפוקר מקוון – הימורים באינטרנט
פעילות פוקר מקוונת מכיל אחד מתחומי הפעילות המשגשגים המובהקים ביותר בזמן האחרון. משתתפים מורשים להשתתף כנגד שחקנים אחרים מרחבי העולם בסוגים ש
בלאק ג’ק
https://win-line.net/בלאק-גק-black-jack/
להעביר, אסמכתא לדבריך.
ההמרה באינטרנט הפכה לנישה נחשק מאוד בעשור האחרון, המספק אפשרויות מגוונות של אופציות הימורים, כגון הימורי ספורט.
בסקירה זה נבדוק את תחום ההימורים המקוונים ונמסור לכם הערות חשובות שיסייע לכם לחקור בנושא מעניין זה.
הימורי ספורט – התמודדות באינטרנט
משחקי פוקר מכיל אלטרנטיבות רבות של משחקים מוכרים כגון פוקר. הקזינו באינטרנט נותנים למתמודדים לחוות מאווירת התמודדות אמיתית בכל עת ומקום.
האירוע תיאור מקוצר
מכונות מזל הימורי גלגל
גלגל הרולטה הימור על תוצאות על גלגל מסתובב
משחק קלפים להגעה ל-21 משחק קלפים להשגת ניקוד של 21
משחק הפוקר משחק קלפים מבוסס אסטרטגיה
משחק קלפים באקרה משחק קלפים פשוט ומהיר
הימורים בתחום הספורט – התמודדות באינטרנט
הימורים על אירועי ספורט הם אחד התחומים המשגשגים המרכזיים ביותר בקזינו באינטרנט. משתתפים רשאים להמר על ביצועים של תחרויות ספורט מבוקשים כגון כדורגל.
העסקאות יכולים להיות על תוצאת האירוע, מספר השערים ועוד.
אופן ההתמודדות הסבר ענפי ספורט נפוצים
ניחוש התפוקה ניחוש התוצאה הסופית של המשחק כדורגל, כדורסל, אמריקאי
הפרש סקורים ניחוש ההפרש בסקורים בין הקבוצות כדורגל, כדורסל, טניס
כמות התוצאות ניחוש כמה שערים או נקודות יהיו במשחק כדורגל, כדורסל, טניס
הקבוצה המנצחת ניחוש איזו קבוצה תנצח (ללא קשר לתוצאה) מגוון ענפי ספורט
התמרמרות בזמן אמת התמודדות במהלך התחרות בזמן אמת כדורגל, טניס, כדורסל
התמודדות מורכבת שילוב של מספר אופני התמודדות מרבית ענפי הספורט
פוקר אונליין – פעילות באינטרנט
התמודדות בפוקר מקוון מכיל אחד מתחומי ההימורים המובילים המשפיעים ביותר כיום. שחקנים מורשים להשתלב בפני שחקנים אחרים מרחבי העולם בסוגים ש
Kaka https://kaka.prostoprosport-br.com Futebolista brasileiro, meio-campista. O apelido “Kaka” e um diminutivo de Ricardo. Formado em Sao Paulo. De 2002 a 2016, integrou a Selecao Brasileira, pela qual disputou 92 partidas e marcou 29 gols. Campeao mundial 2002.
Lionel Messi https://lionelmessi.prostoprosport-br.com e um jogador de futebol argentino, atacante e capitao do clube da MLS Inter Miami. , capitao da selecao argentina. Campeao mundial, campeao sul-americano, vencedor da Finalissima, campeao olimpico. Considerado um dos melhores jogadores de futebol de todos os tempos.
Mohamed Salah https://mohamedsalah.prostoprosport-br.com e um futebolista egipcio que joga como atacante do clube ingles Liverpool e do Selecao egipcia. Considerado um dos melhores jogadores de futebol do mundo. Tricampeao da Chuteira de Ouro da Premier League inglesa: em 2018 (sozinho), 2019 (junto com Sadio Mane e Pierre-Emerick Aubameyang) e 2022 (junto com Son Heung-min).
Harry Kane https://harry-kane.prostoprosport-br.com recebeu um convite para a selecao sub-alterna da Inglaterra pela primeira vez tempo 17 para o torneio juvenil em Portugal. Ao mesmo tempo, o atacante, devido a doenca grave, nao compareceu ao triunfante Campeonato Europeu Sub-17 masculino de 2010 pelos britanicos.
Zlatan Ibrahimovic https://zlatan-ibrahimovic.prostoprosport-br.com Bosnian pronunciation: [zlatan ibraxi?mo?it?]; genus. 3 October 1981, Malmo, Sweden) is a Swedish footballer who played as a striker. Former captain of the Swedish national team.
tipobet porn
Luis Alberto Suarez Diaz https://luis-suarez.prostoprosport-br.com Uruguayan footballer, striker for Inter Miami and Uruguay national team. The best scorer in the history of the Uruguay national team. Considered one of the world’s top strikers of the 2010s
tipobet porn
Jude Bellingham https://jude-bellingham.prostoprosport-br.com Futebolista ingles, meio-campista do clube espanhol Real Madrid e do Selecao da Inglaterra. Em abril de 2024, ele ganhou o premio Breakthrough of the Year do Laureus World Sports Awards. Ele se tornou o primeiro jogador de futebol a recebe-lo.
[url=http://dezithromax.online/]zithromax pills[/url]
Gareth Frank Bale https://garethbale.prostoprosport-br.com Jogador de futebol gales que atuou como ala. Ele jogou na selecao galesa. Ele se destacou pela alta velocidade e um golpe bem colocado. Artilheiro (41 gols) e recordista de partidas disputadas (111) na historia da selecao.
Robert Lewandowski https://robert-lewandowski.prostoprosport-br.com e um futebolista polones, atacante do clube espanhol Barcelona e capitao da selecao polonesa. Considerado um dos melhores atacantes do mundo. Cavaleiro da Cruz do Comandante da Ordem do Renascimento da Polonia.
гранитная брусчатка памятники Уфалей
Hi! I know this is somewhat off topic but I was wondering which blog platform are you using for this website?
I’m getting sick and tired of WordPress because I’ve had issues with hackers and I’m
looking at alternatives for another platform. I would be great if you
could point me in the direction of a good platform.
Kevin De Bruyne https://kevin-de-bruyne.prostoprosport-br.com Futebolista belga, meio-campista do Manchester club City” e a selecao belga. Formado pelos clubes de futebol “Ghent” e “Genk”. Em 2008 iniciou sua carreira adulta, fazendo sua estreia no Genk.
Antoine Griezmann https://antoine-griezmann.prostoprosport-br.com Futebolista frances, atacante e meio-campista do Atletico de Madrid. Jogador e vice-capitao da selecao francesa, integrante da selecao – campea mundial 2018. Medalhista de prata no Europeu de 2016 e no Mundial de 2022.
Virgil van Dijk https://virgilvandijk.prostoprosport-br.com Futebolista holandes, zagueiro central, capitao do clube ingles Liverpool e capitao do a selecao holandesa.
Utilisez le dernier code promo pour 1xbet 2024 et profitez de l’offre VIP 1xBet de 200% jusqu’a 78 000 XOF sur les paris sportifs. Inscrivez-vous avec un code promotionnel et recevez un bonus de bienvenue. Vous pouvez utiliser l’argent du bonus pour parier sur des sports ou jouer dans des casinos en ligne. La promotion 2024 est valable pour tous les nouveaux clients.
Профессиональные seo https://seo-optimizaciya-kazan.ru услуги для максимизации онлайн-видимости вашего бизнеса. Наши эксперты проведут глубокий анализ сайта, оптимизируют контент и структуру, улучшат технические аспекты и разработают индивидуальные стратегии продвижения.
Victor James Osimhen https://victor-osimhen.prostoprosport-br.com e um futebolista nigeriano que atua como atacante. O clube italiano Napoli e a selecao nigeriana.
Romelu Menama Lukaku Bolingoli https://romelulukaku.prostoprosport-br.com Futebolista belga, atacante do clube ingles Chelsea e da selecao belga . Por emprestimo, ele joga pelo clube italiano Roma.
Quelle est la mise minimale et la limite minimale de 1xBet?
Conformement aux regles du bookmaker, le depot minimum dans le bureau est de 1$.code promo 1xbet pour bonus La mise minimale est de 0,2 $ou l’equivalent de ce montant dans une autre monnaie de jeu.
Thomas Mueller https://thomasmueller.prostoprosport-br.com is a German football player who plays for the German Bayern Munich. Can play in different positions – striker, attacking midfielder. The most titled German footballer in history
Neymar da Silva Santos Junior https://neymar.prostoprosport-br.com e um futebolista brasileiro que atua como atacante, ponta e atacante. meio-campista do clube saudita Al-Hilal e da selecao brasileira. Considerado um dos melhores jogadores do mundo. O maior artilheiro da historia da Selecao Brasileira.
Jude Victor William Bellingham https://jude-bellingham.prostoprosport-cz.org anglicky fotbalista, zaloznik spanelskeho klubu Real Madrid a anglicky narodni tym. V dubnu 2024 ziskal cenu za prulom roku z Laureus World Sports Awards. Stal se prvnim fotbalistou, ktery ji obdrzel.
Edson Arantes do Nascimento https://pele.prostoprosport-br.com Brazilian footballer, forward (attacking midfielder. Played for Santos clubs) and New York Cosmos. Played 92 matches and scored 77 goals for the Brazilian national team.
Kylian Mbappe Lotten https://kylian-mbappe.prostoprosport-cz.org Francouzsky fotbalista, utocnik Paris Saint-Germain a kapitan tymu francouzskeho tymu. 1. cervence 2024 se stane hracem spanelskeho klubu Real Madrid.
Oh my goodness! Incredible article dude! Thanks, However I am having difficulties with your RSS. I don’t understand why I cannot join it. Is there anyone else having similar RSS issues? Anyone that knows the solution will you kindly respond? Thanx!
Harry Kane https://harry-kane.prostoprosport-cz.org dostal pozvanku do anglickeho tymu nezletilych jako prvni cas 17. na turnaj mladeze v Portugalsku. Utocnik se zaroven kvuli vazne nemoci neobjevil na triumfalnim mistrovstvi Evropy muzu do 17 let 2010 pro Brity.
Mohamed Salah https://mohamed-salah.prostoprosport-cz.org je egyptsky fotbalista, ktery hraje jako utocnik za anglictinu. klub Liverpool a egyptsky narodni tym. Povazovan za jednoho z nejlepsich fotbalistu na svete.
[url=https://mcadvair.online/]advair prescription[/url]
Kevin De Bruyne https://kevin-de-bruyne.prostoprosport-cz.org Belgicky fotbalista, zaloznik Manchesteru klub City” a belgicky narodni tym. Absolvent fotbalovych klubu „Ghent” a „Genk”. V roce 2008 zahajil svou karieru dospelych, debutoval v Genku.
п»їbest mexican online pharmacies mexican online pharmacies prescription drugs or mexican online pharmacies prescription drugs
https://toolbarqueries.google.ba/url?q=http://cmqpharma.online mexican rx online
[url=https://www.google.ws/url?q=https://cmqpharma.online]mexico pharmacies prescription drugs[/url] mexico drug stores pharmacies and [url=https://forexzloty.pl/members/399740-ltdzzeiyre]mexico drug stores pharmacies[/url] medicine in mexico pharmacies
[url=https://enolvadex.com/]tamoxifen 10mg tablets[/url]
Lionel Messi https://lionel-messi.prostoprosport-cz.org je argentinsky fotbalista, utocnik a kapitan klubu MLS Inter Miami. , kapitan argentinske reprezentace. Mistr sveta, vitez Jizni Ameriky, vitez finale, olympijsky vitez. Povazovan za jednoho z nejlepsich fotbalistu vsech dob.
Bernardo Silva https://bernardo-silva.prostoprosport-cz.org Portugalsky fotbalista, zaloznik. Narozen 10. srpna 1994 v Lisabonu. Silva je povazovan za jednoho z nejlepsich utocnych zalozniku na svete. Fotbalista je povestny svou vytrvalosti a vykonem.
Antoine Griezmann https://antoine-griezmann.prostoprosport-cz.org Francouzsky fotbalista, utocnik a zaloznik za Atletico de Madrid. Hrac a vicekapitan francouzskeho narodniho tymu, clen tymu – mistr sveta 2018 Stribrny medailista z mistrovstvi Evropy 2016 a mistrovstvi sveta 2022.
Robert Lewandowski https://robert-lewandowski.prostoprosport-cz.org je polsky fotbalista, utocnik spanelskeho klubu Barcelona a kapitan polskeho narodniho tymu. Povazovan za jednoho z nejlepsich utocniku na svete. Rytir krize velitele polskeho renesancniho radu.
pharmacies in mexico that ship to usa buying prescription drugs in mexico online or mexico pharmacies prescription drugs
https://x5.re/link.php?link=http://cmqpharma.com reputable mexican pharmacies online
[url=http://katiefreudenschuss.de/termin.php?verans%20taltung=sounds+like+heimat&tag=mo&datum=07.11&zeit%20=00%3A00&location=im+tv%3A&stadt=wdr+fernsehen&inf%20o=was+h%FCbsch-h%E4sslich+aussieht%2C+kann+durchau%20s+gut+klingen.+das+m%F6chte+das+wdr-doku-format+%252%206quot%3Bsounds+like+heimat%26quot%3B+beweisen.+mod%20erator+marco+schreyl+schickt+daf%FCr+in+jeder+stad%20t+drei+musiker+auf+die+suche+nach+dem+typischen+kl%20ang+einer+nordrhein-westf%E4lischen+stadt.+zwei+ta%20ge+hat+jeder+von+ihnen+zeit%2C+um+die+stadt+und+ih%20re+bewohner+auf+seine+art+und+weise+kennenzulernen%20+-+um+drei+perfekt+passende+songs+zu+komponieren.&%20url=cmqpharma.com%20%20]mexican online pharmacies prescription drugs[/url] mexican pharmaceuticals online and [url=http://www.jade-crack.com/home.php?mod=space&uid=1100465]mexican online pharmacies prescription drugs[/url] mexican online pharmacies prescription drugs
Список бесплатных промокодов 1xBet. Получи максимальный бонус при регистрации на сайте и в приложении! +100% к первому депозиту для всех новых игроков. Указанный выше промо-код дает новым игрокам возможность получить повышенный на 30% bonus. Как получить и использовать бонус 32500 рублей по промо-коду букмекерской компании 1хБет? Рабочие промокоды 1xBet при регистрации на официальном сайте компании. рабочий промокод 1хбет бонус. Актуальный Промо-Коды 1 Икс Бет на 2024 год – это возможность сделать бесплатную ставку на сумму, которая указана в промокоде. Содержание: Где найти промокод 1xbet на сегодня бесплатно. Букмекерская контора 1 Икс Бет только новым людям дает бонус при пополнени. Чем полезный промокод на 1xbet. На какие виды спорта можно взять промокоды в 1 xbet. Как проверить промокод на 1хбет. Использовать его необходимо при регистрации на официальном сайте конторы 1xbet (а промокоды для купона при пари, находятся в самом низу статьи) – более подробно в этом материале http://webladies.ru/cron/pgs/1xbet.html
Pablo Martin Paez Gavira https://gavi.prostoprosport-cz.org Spanelsky fotbalista, zaloznik barcelonskeho klubu a spanelske reprezentace. Povazovan za jednoho z nejtalentovanejsich hracu sve generace. Ucastnik mistrovstvi sveta 2022. Vitez Ligy narodu UEFA 2022/23
Luka Modric https://luka-modric.prostoprosport-cz.org je chorvatsky fotbalista, stredni zaloznik a kapitan spanelskeho tymu. klub Real Madrid, kapitan chorvatskeho narodniho tymu. Uznavan jako jeden z nejlepsich zalozniku nasi doby. Rytir Radu prince Branimira. Rekordman chorvatske reprezentace v poctu odehranych zapasu.
Son Heung Min https://son-heung-min.prostoprosport-cz.org Jihokorejsky fotbalista, utocnik a kapitan anglickeho klubu Premier League Tottenham Hotspur a narodniho tymu Korejske republiky. V roce 2022 vyhral Zlatou kopacku Premier League.
Cristiano Ronaldo https://cristiano-ronaldo.prostoprosport-cz.org je portugalsky fotbalista, utocnik, kapitan Saudske Arabie klubu An-Nasr a portugalskeho narodniho tymu. Mistr Evropy. Povazovan za jednoho z nejlepsich fotbalistu vsech dob. Nejlepsi strelec v historii fotbalu podle IFFIS a ctvrty podle RSSSF
mexican mail order pharmacies mexican border pharmacies shipping to usa or mexican pharmaceuticals online
https://www.google.by/url?sa=t&url=https://cmqpharma.online pharmacies in mexico that ship to usa
[url=https://kulturkritik.net/pop_link.php?link=https://cmqpharma.online::]buying from online mexican pharmacy[/url] best online pharmacies in mexico and [url=https://knoqnoq.com/home.php?mod=space&uid=15941]buying prescription drugs in mexico online[/url] mexico drug stores pharmacies
Pedro Gonzalez Lopez https://pedri.prostoprosport-cz.org lepe znamy jako Pedri, je spanelsky fotbalista, ktery hraje jako utocny zaloznik. za Barcelonu a spanelskou reprezentaci. Bronzovy medailista z mistrovstvi Evropy 2020 a zaroven nejlepsi mlady hrac tohoto turnaje.
Alison Ramses Becker https://alisson-becker.prostoprosport-cz.org Brazilsky fotbalista nemeckeho puvodu, brankar klubu Liverpool a brazilsky narodni tym. Je povazovan za jednoho z nejlepsich brankaru sve generace a je znamy svymi vynikajicimi zakroky, presnosti prihravek a schopnosti jeden na jednoho.
Rodrigo Silva de Goiz https://rodrygo.prostoprosport-cz.org Brazilsky fotbalista, utocnik Realu Madrid a brazilskeho narodniho tymu. V breznu 2017 byl Rodrigo povolan do narodniho tymu Brazilie U17 na zapasy Montague Tournament.
Karim Benzema https://karim-benzema.prostoprosport-cz.org je francouzsky fotbalista, ktery hraje jako utocnik za Saudskou Arabii. Arabsky klub Al-Ittihad. Hral za francouzsky narodni tym, za ktery odehral 97 zapasu a vstrelil 37 branek. V 17 letech se stal jednim z nejlepsich hracu rezervy, nastrilel tri desitky golu za sezonu.
Utilisez le meilleur code promo pour 1xbet 2024 et profitez de l’offre VIP 1xBet de 200% jusqu’a 78 000 XOF sur les paris sportifs. Inscrivez-vous avec un code promotionnel et recevez un bonus de bienvenue. Vous pouvez utiliser l’argent du bonus pour parier sur des sports ou jouer dans des casinos en ligne. La promotion 2024 est valable pour tous les nouveaux clients.
Thibaut Nicolas Marc Courtois https://thibaut-courtois.prostoprosport-cz.org Belgicky fotbalista, brankar spanelskeho klubu Real Madrid . V sezone 2010/11 byl uznan jako nejlepsi brankar v belgicke Pro League a take hrac roku pro Genk. Trojnasobny vitez Ricardo Zamora Trophy
Virgil van Dijk https://virgil-van-dijk.prostoprosport-cz.org Nizozemsky fotbalista, stredni obrance, kapitan anglickeho klubu Liverpool a kapitan nizozemskeho narodniho tymu.
Bruno Guimaraes Rodriguez Moura https://bruno-guimaraes.prostoprosport-cz.org Brazilsky fotbalista, defenzivni zaloznik Newcastlu United a Brazilsky narodni tym. Vitez olympijskych her 2020 v Tokiu.
Toni Kroos https://toni-kroos.prostoprosport-cz.org je nemecky fotbalista, ktery hraje jako stredni zaloznik za Real Madrid a nemecky narodni tym. Mistr sveta 2014. Prvni nemecky hrac v historii, ktery sestkrat vyhral Ligu mistru UEFA.
I genuinely prize your work, Great post.
Toni Kroos https://toni-kroos.prostoprosport-cz.org je nemecky fotbalista, ktery hraje jako stredni zaloznik za Real Madrid a nemecky narodni tym. Mistr sveta 2014. Prvni nemecky hrac v historii, ktery sestkrat vyhral Ligu mistru UEFA.
Darwin Gabriel Nunez Ribeiro https://darwin-nunez.prostoprosport-cz.org Uruguaysky fotbalista, utocnik anglickeho klubu Liverpool a Uruguaysky narodni tym. Bronzovy medailista mistrovstvi Jizni Ameriky mezi mladeznickymi tymy.
Romelu Menama Lukaku Bolingoli https://romelu-lukaku.prostoprosport-cz.org Belgicky fotbalista, utocnik anglickeho klubu Chelsea a Belgican vyber. Na hostovani hraje za italsky klub Roma.
obviously like your web-site but you have to check the spelling on quite a few of your posts.
A number of them are rife with spelling problems and I find it very bothersome to tell the truth nevertheless I’ll surely come again again.
Overall, with a strong selection of slots, software packages, and other table games and scratchcards, there’s more than you could ever need at Slots.lv. fname: “+(type=data2.slot.getTargetingMap()).fname+” To claim the first bonus using a credit card, you’ll need to use the bonus code HELLOSLOTS200 with your first Slots.lv deposit and the code HELLOSLOTS100 every time you want to claim the bonus on one of your subsequent eight deposits. The player ‘AMORRIS100’ played the slot game Night with Cleo with a 3x multiplier bonus feature which appeared not to be working likely due to a technical glitch. He contacted the support, however, his problem stayed unresolved and the casino did not respond to player’s complaint. Contact Tony Garcia at tgarcia@reviewjournal or 702-383-0307. Follow @TonyGLVNews on Twitter.
https://www.joindota.com/users/2268550-httpsgamblio
Our review team has rated Slot Crazy Online Casino on the categories below and Slot Crazy scores a good 64% ratings overall. Luck Casino provides new customers the chance to secure 100 free spins without a deposit. These spins can be utilized on selected slots. Follow the instructions below to activate this welcome offer: Luck Casino provides new customers the chance to secure 100 free spins without a deposit. These spins can be utilized on selected slots. Follow the instructions below to activate this welcome offer: The offers then keep on coming as you will also be able to claim 10 free spins per £10 deposited on your second and third deposits too! Rest assured that we’re committed to making all of our slot games FUNtastic! They are all unique in their own way so picking the best one for you can be tricky. To better understand each slot machine, click on the “Pay Table” option inside the menu in each slot. Once you’ve found the slot machine you like best, get to spinning and winning!
pharmacies in mexico that ship to usa buying from online mexican pharmacy or mexican rx online
https://www.dawgshed.com/proxy.php?link=https://cmqpharma.online:: reputable mexican pharmacies online
[url=https://cse.google.is/url?q=https://cmqpharma.online]purple pharmacy mexico price list[/url] mexico pharmacy and [url=http://bbs.cheaa.com/home.php?mod=space&uid=3153170]mexican border pharmacies shipping to usa[/url] reputable mexican pharmacies online
номер телефона проститутки https://prostitutki-213.ru
mexican online pharmacies prescription drugs buying prescription drugs in mexico online or mexican rx online
http://go.informpartner.com/return/wap/?ret=https://cmqpharma.com п»їbest mexican online pharmacies
[url=https://cse.google.co.zw/url?q=https://cmqpharma.com]mexico pharmacies prescription drugs[/url] buying from online mexican pharmacy and [url=http://bbs.zhizhuyx.com/home.php?mod=space&uid=10775263]mexico pharmacies prescription drugs[/url] mexican mail order pharmacies
buy tiktok followers uk https://tiktok-followers-buy.com
buy instant tiktok followers https://buy-tiktok-followers.com
отчаянные домохозяйки онлайн бесплатно https://domohozyayki-serial.ru
https://businka74.ru официальный сайт Rio Bet Casino
сайт драгон мани казино драгон мани казино
Большой выбор игровых автоматов, рабочее зеркало сайта плей фортуна официальный сайт вход играть на реальные деньги онлайн
Качественная и недорогая купить мебель лучшие цены, доставка и сборка.
Pin Up casino https://pin-up.salexy.kz official website, Pin Up slot machines play for money online, Pin Up mirror working for today.
Slot machines on the official website and mirrors of the Pin Up online casino https://pin-up.tr-kazakhstan.kz are available for free mode, and after registering at Pin Up Casino Ru you can play for money.
Pin up entry to the official website. Play online casino Pin Up https://pin-up.prostoprosport.ru for real money. Register on the Pin Up Casino website and claim bonuses!
Sports in Azerbaijan https://idman-xeberleri.com.az development and popular sports Azerbaijan is a country with rich sports traditions and outstanding achievements on the international stage.
[url=https://ciproffl.online/]ciprofloxacin 250mg price[/url]
buying prescription drugs in mexico online mexican pharmacy or mexico pharmacy
https://cse.google.com.hk/url?sa=t&url=https://cmqpharma.online buying prescription drugs in mexico online
[url=https://www.google.co.th/url?q=https://cmqpharma.online]mexican pharmaceuticals online[/url] buying prescription drugs in mexico and [url=https://xiazai7.com/home.php?mod=space&uid=19453]mexican rx online[/url] buying from online mexican pharmacy
World of Games https://onlayn-oyunlar.com.az provides the latest news about online games, game reviews, gameplay and ideas, game tactics and tips. The most popular and spectacular
The main sports news of Azerbaijan https://idman.com.az. Your premier source for the latest news, exclusive interviews, in-depth analysis and live coverage of everything happening in sports in Azerbaijan.
UFC in Azerbaijan https://ufc.com.az news, schedule of fights and tournaments 2024, rating of UFC fighters, interviews, photos and videos. Live broadcasts and broadcasts of tournaments, statistics.
NHL (National Hockey League) News https://nhl.com.az the latest and greatest NHL news for today. Sports news – latest NHL news, standings, match results, online broadcasts.
Top sports news https://idman-azerbaycan.com.az photos and blogs from experts and famous athletes, as well as statistics and information about matches of leading championships.
Latest news and details about the NBA in Azerbaijan https://nba.com.az. Hot events, player transfers and the most interesting events. Explore the world of the NBA with us.
Discover the fascinating world of online games with GameHub Azerbaijan https://online-game.com.az. Get the latest news, reviews and tips for your favorite games. Join our gaming community today!
The latest top football news https://futbol.com.az today. Interviews with football players, online broadcasts and match results, analytics and football forecasts, photos and videos.
buying prescription drugs in mexico buying prescription drugs in mexico or mexican online pharmacies prescription drugs
http://www.fairkaufen.de/auktion/phpinfo.php?a%5B%5D=best+place+to+buy+viagra mexico drug stores pharmacies
[url=https://toolbarqueries.google.tk/url?q=https://cmqpharma.com]mexican rx online[/url] mexican rx online and [url=http://bbs.xinhaolian.com/home.php?mod=space&uid=4207548]mexico drug stores pharmacies[/url] mexican online pharmacies prescription drugs
Каталог рейтингов хостингов https://pro-hosting.tech на любой вкус и под любые, даже самые сложные, задачи.
Сантехник — вызов сантехника на дом в Москве и Московской области в удобное для вас время.
Combien de temps faut-il pour retirer des fonds sur une carte Visa ou MasterCard?
Le retrait des fonds sur les cartes bancaires des systemes de paiement Visa et Mastercard depend du montant de la transaction, du jour de la semaine et de l’heure de la journee.code promo 1xbet cote d’ivoire 2024 En regle generale, les fonds arrivent sur le compte indique dans un delai de 24 heures.
Play PUBG Mobile https://pubg-mobile.com.az an exciting world of high-quality mobile battle royale. Unique maps, strategies and intense combat await you in this exciting mobile version of the popular game.
The Dota 2 website https://dota2.com.az Azerbaijan provides the most detailed information about the latest game updates, tournaments and upcoming events. We have all the winning tactics, secrets and important guides.
[url=http://doxycyclineo.com/]buy doxycycline 100mg tablets[/url]
Latest news about games for Android https://android-games.com.az, reviews and daily updates. Read now and get the latest information on the most exciting games
Хотите сделать в квартире ремонт? Тогда советуем вам посетить сайт https://stroyka-gid.ru, где вы найдете всю необходимую информацию по строительству и ремонту.
Check out the latest news, guides and in-depth reviews of the available options for playing Minecraft Az https://minecraft.com.az. Find the latest information about Minecraft Download, Pocket Edition and Bedrock Edition.
The most popular sports site https://sports.com.az of Azerbaijan, where the latest sports news, forecasts and analysis are collected.
Latest news and analytics of the Premier League https://premier-league.com.az. Detailed descriptions of matches, team statistics and the most interesting football events. EPL Azerbaijan is the best place for football fans.
mexico drug stores pharmacies mexico drug stores pharmacies or mexican pharmaceuticals online
https://www.google.dk/url?q=https://cmqpharma.online mexico drug stores pharmacies
[url=https://www.google.com.mt/url?q=https://cmqpharma.online]medicine in mexico pharmacies[/url] purple pharmacy mexico price list and [url=http://www.1moli.top/home.php?mod=space&uid=3413]mexico drug stores pharmacies[/url] mexico pharmacies prescription drugs
My brother suggested I would possibly like this blog. He used to be entirely right. This submit truly made my day. You cann’t believe simply how much time I had spent for this information! Thanks!
https://LoveFlover.ru — сайт посвященный комнатным растениям. Предлагает подробные статьи о выборе, выращивании и уходе за различными видами комнатных растений. Здесь можно найти полезные советы по созданию зелёного уголка в доме, руководства по декору и решению распространённых проблем, а также информацию о подходящих горшках и удобрениях. Платформа помогает создавать уютную атмосферу и гармонию в интерьере с помощью растений.
1xbet https://1xbet.best-casino-ar.com with withdrawal without commission. Register online in a few clicks. A large selection of slot machines in mobile applications and convenient transfers in just a few minutes.
Pin Up official https://pin-up.adb-auto.ru website. Login to your personal account and register through the Pin Up mirror. Slot machines for real money at Pinup online casino.
Pin-up Casino https://pin-up.admsov.ru/ is an online casino licensed and regulated by the government of Curacao . Founded in 2016, it is home to some of the industry’s leading providers, including NetEnt, Microgaming, Play’n GO and others. This means that you will be spoiled for choice when it comes to choosing a game.
[url=https://dexamethasonen.com/]where can i get dexamethasone[/url]
Pin Up online casino https://pin-up.webrabota77.ru/ is the official website of a popular gambling establishment for players from the CIS countries. The site features thousands of slot machines, online tables and other branded entertainment from Pin Up casino.
Pin Up Casino https://pin-up.noko39.ru Registration and Login to the Official Pin Up Website. thousands of slot machines, online tables and other branded entertainment from Pin Up casino. Come play and get big bonuses from the Pinup brand today
Реальные анкеты проституток https://prostitutki-213.ru Москвы с проверенными фото – от элитных путан до дешевых шлюх. Каталог всех индивидуалок на каждой станции метро с реальными фотографиями без ретуши и с отзывами реальных клиентов.
Смотрите онлайн сериал Отчаянные домохозяйки https://domohozyayki-serial.ru в хорошем качестве HD 720 бесплатно, рейтинг сериала: 8.058, режиссер сериала: Дэвид Гроссман, Ларри Шоу, Дэвид Уоррен.
Can I just say what a relief to find someone who actually knows what theyre talking about on the internet. You definitely know how to bring an issue to light and make it important. More people need to read this and understand this side of the story. I cant believe youre not more popular because you definitely have the gift.
Buy TikTok followers https://tiktok-followers-buy.com to get popular and viral with your content. All packages are real and cheap — instant delivery within minutes. HQ followers for your TikTok. 100% real users. The lowest price for TikTok followers on the market
Pin Up Casino https://pin-up.sibelshield.ru official online casino website for players from the CIS countries. Login and registration to the Pin Up casino website is open to new users with bonuses and promotional free spins.
Pin Up https://pin-up.fotoevolution.ru казино, которое радует гемблеров в России на протяжении нескольких лет. Узнайте, что оно подготовило посетителям. Описание, бонусы, отзывы о легендарном проекте. Регистрация и вход.
Изготовление памятников и надгробий https://uralmegalit.ru по низким ценам. Собственное производство. Высокое качество, широкий ассортимент, скидки, установка.
Pin Up Casino https://pin-up.ergojournal.ru приглашает игроков зарегистрироваться на официальном сайте и начать играть на деньги в лучшие игровые автоматы, а на зеркалах онлайн казино Пин Ап можно найти аналогичную витрину слотов
Pin-up casino https://pin-up.jes-design.ru популярное онлайн-казино и ставки на спорт. Официальный сайт казино для доступа к играм и другим функциям казино для игры на деньги.
medication from mexico pharmacy mexican mail order pharmacies or mexican border pharmacies shipping to usa
https://maps.google.co.ao/url?sa=t&url=https://cmqpharma.online medication from mexico pharmacy
[url=http://images.google.mn/url?q=https://cmqpharma.online]mexico pharmacies prescription drugs[/url] mexico drug stores pharmacies and [url=http://www.1moli.top/home.php?mod=space&uid=3335]mexican online pharmacies prescription drugs[/url] pharmacies in mexico that ship to usa
mexican border pharmacies shipping to usa mexican border pharmacies shipping to usa or buying prescription drugs in mexico online
http://www.nakayama-dr.jp/feed2js2/feed2js.php?src=http://cmqpharma.com mexican mail order pharmacies
[url=http://www.ndxa.net/modules/wordpress/wp-ktai.php?view=redir&url=http://cmqpharma.com/]mexico drug stores pharmacies[/url] buying from online mexican pharmacy and [url=https://forexzloty.pl/members/399794-xhwdsuiceu]purple pharmacy mexico price list[/url] buying from online mexican pharmacy
Открой мир карточных игр в Pin-Up https://pin-up.porsamedlab.ru казино Блэкджек, Баккара, Хило и другие карточные развлечения. Регистрируйтесь и играйте онлайн!
Официальный сайт Pin Up казино https://pin-up.nasledie-smolensk.ru предлагает широкий выбор игр и щедрые бонусы для игроков. Уникальные бонусные предложения, онлайн регистрация.
Pinup казино https://pin-up.vcabinet.kz это не просто сайт, а целый мир азартных развлечений, где каждый может найти что-то свое. От традиционных игровых автоматов до прогнозов на самые популярные спортивные события.
Latest Diablo news https://diablo.com.az game descriptions and guides. Diablo.az is the largest Diablo portal in the Azerbaijani language.
I truly appreciate this post. I have been looking everywhere for this! Thank goodness I found it on Bing. You have made my day! Thanks again!
Latest World of Warcraft (WOW) tournament news https://wow.com.az, strategies and game analysis. The most detailed gaming portal in Azerbaijani language
I’m usually to running a blog and i really admire your content. The article has actually peaks my interest. I’m going to bookmark your site and preserve checking for brand new information.
Azerbaijan NFL https://nfl.com.az News, analysis and topics about the latest experience, victories and records. A portal where the most beautiful NFL games in the world are generally studied.
Discover exciting virtual football in Fortnite https://fortnite.com.az. Your central hub for the latest news, expert strategies and interesting e-sports reports. Collecting points with us!
The latest analysis, tournament reviews and the most interesting features of the Spider-Man game https://spider-man.com.az series in Azerbaijani.
Read the latest Counter-Strike 2 news https://counter-strike.net.az, watch the most successful tournaments and become the best in the world of the game on the CS2 Azerbaijan website.
Latest boxing news https://boks.com.az, Resul Abbasov’s achievements, Tyson Fury’s fights and much more. All in Ambassador Boxing.
Qu’est-ce que la strategie de jeu?
La strategie de jeu est un algorithme d’action que le joueur doit suivre en faisant un pari. Les actions peuvent inclure la taille du pari, le montant des cotes, la duree de la serie de Paris.1x code bonus de pari L’objectif principal de toute strategie est d’obtenir des gains qui seront en mesure de compenser toutes les depenses precedentes.
Explore the extraordinary journey of Kilian Mbappe https://kilian-mbappe.com.az, from his humble beginnings to global stardom. Delve into his early years, meteoric rise through the ranks, and impact on and off the football field.
Mesut Ozil https://mesut-ozil.com.az latest news, statistics, photos and much more. Get the latest news and information about one of the best football players Mesut Ozil.
Latest news, statistics, photos and much more about Pele https://pele.com.az. Get the latest news and information about football legend Pele.
Sergio Ramos Garcia https://sergio-ramos.com.az Spanish footballer, defender. Former Spanish national team player. He played for 16 seasons as a central defender for Real Madrid, where he captained for six seasons.
mexican rx online mexico drug stores pharmacies or mexican mail order pharmacies
https://www.southsouthfacility.org/redirect.php?redirect=https://cmqpharma.online medicine in mexico pharmacies
[url=http://2ch-ranking.net/redirect.php?url=http://cmqpharma.online]best online pharmacies in mexico[/url] medication from mexico pharmacy and [url=http://www.so0912.com/home.php?mod=space&uid=2262968]purple pharmacy mexico price list[/url] buying from online mexican pharmacy
[url=https://albuterolp.online/]ventolin 2mg tab[/url]
It?¦s actually a nice and helpful piece of info. I?¦m happy that you simply shared this useful information with us. Please stay us informed like this. Thanks for sharing.
Gianluigi Buffon https://buffon.com.az Italian football player, goalkeeper. Considered one of the best goalkeepers of all time. He holds the record for the number of games in the Italian Championship, as well as the number of minutes in this tournament without conceding a goal.
Paulo Bruno Ezequiel Dybala https://dybala.com.az Argentine footballer, striker for the Italian club Roma and the Argentina national team. World champion 2022.
Paul Labille Pogba https://pogba.com.az French footballer, central midfielder of the Italian club Juventus. Currently suspended for doping and unable to play. World champion 2018.
Канал для того, чтобы знания и опыт, могли помочь любому человеку сделать ремонт https://tvin270584.livejournal.com в своем жилище, любой сложности!
Kevin De Bruyne https://kevin-de-bruyne.liverpool-fr.com Belgian footballer, born 28 June 1991 years in Ghent. He has had a brilliant club career and also plays for the Belgium national team. De Bruyne is known for his spectacular goals and brilliant assists.
http://www.findbookingdeals.com
I recently came across a gem of a website for booking hotels worldwide: http://www.findbookingdeals.com. This site has been a lifesaver for my recent trips. It offers an extensive range of options, from high-end luxury hotels to affordable stays, and even some truly unique boutique hotels.
The best part? It’s incredibly user-friendly. Navigating through the site is a breeze, and you can uncover amazing deals without the usual hassle. The customer service is also exceptional, which makes the experience even better.
If you’re planning any travel soon, I highly recommend giving http://www.findbookingdeals.com a try. It simplifies the process of finding the perfect accommodation, allowing you to focus on enjoying your trip. Trust me, it’s worth checking out!
I wanted to share a fantastic resource for booking hotels around the world: http://www.worldhotels-in.com. I’ve used this site for my last few trips, and it’s been a game-changer. The selection is enormous, covering everything from luxury resorts to budget-friendly spots, and even unique boutique hotels.
What really stands out is the ease of use. The booking process is straightforward, and you can find great deals without spending hours searching. Plus, the customer service is top-notch, which is always a huge plus when you’re traveling.
If you’re planning a trip soon, definitely check out http://www.worldhotels-in.com. It takes the hassle out of finding the perfect place to stay, so you can focus on enjoying your travels. Highly recommend it!
An impressive share! I have just forwarded this onto a co-worker who was conducting a little research on this. And he in fact bought me dinner due to the fact that I found it for him… lol. So allow me to reword this…. Thanks for the meal!! But yeah, thanx for spending some time to talk about this topic here on your internet site.
Paul Labille Pogba https://paul-pogba.psg-fr.com Footballeur francais, milieu de terrain central du club italien de la Juventus. Champion du monde 2018. Actuellement suspendu pour dopage et incapable de jouer.
Mohamed Salah Hamed Mehrez Ghali https://mohamed-salah.liverpool-fr.com Footballeur egyptien, attaquant du club anglais de Liverpool et l’equipe nationale egyptienne. Considere comme l’un des meilleurs joueurs du monde.
The young talent who conquered Paris Saint-Germain: how Xavi Simons became https://xavi-simons.psg-fr.com leader of a superclub in record time.
medication from mexico pharmacy medication from mexico pharmacy or mexican pharmaceuticals online
https://clients1.google.sh/url?q=https://cmqpharma.com purple pharmacy mexico price list
[url=http://aldana.jp/m/index.cgi?id=1&mode=redirect&no=5&ref_eid=19&url=http://cmqpharma.com]mexico drug stores pharmacies[/url] mexico drug stores pharmacies and [url=http://talk.dofun.cc/home.php?mod=space&uid=1203186]buying from online mexican pharmacy[/url] mexican pharmaceuticals online
Le 1xbet meilleur code promo, utilisez-le lors de l’inscription et obtenez un bonus de 200% jusqu’a 130$. Seuls les nouveaux joueurs peuvent obtenir le bonus. Ce contrat bonus est valable jusqu’au 31 decembre 2024. Apres le depot, le joueur recoit sur le compte bonus le montant des bonus pour les Paris de 100% du montant du depot, mais pas plus de $100. Pour recuperer le bonus recu, le joueur doit placer au moins cinq Paris dans les cinq jours suivants. Pour les Paris, vous devez faire un Express avec 3 evenements ou plus avec des cotes d’au moins 1,40.
medicine in mexico pharmacies mexican pharmacy or mexico drug stores pharmacies
https://images.google.co.uz/url?q=https://cmqpharma.online mexican mail order pharmacies
[url=https://clients1.google.ie/url?q=https://cmqpharma.online]buying from online mexican pharmacy[/url] medication from mexico pharmacy and [url=http://www.donggoudi.com/home.php?mod=space&uid=860479]mexico drug stores pharmacies[/url] medicine in mexico pharmacies
Kylian Mbappe https://kylian-mbappe.psg-fr.com Footballeur, attaquant francais. Il joue pour le PSG et l’equipe de France. Ne le 20 decembre 1998 a Paris. Mbappe est francais de nationalite. La taille de l’athlete est de 178 cm.
Изготовление, сборка и ремонт мебели https://shkafy-na-zakaz.blogspot.com для Вас, от эконом до премиум класса.
Kevin De Bruyne https://liverpool.kevin-de-bruyne-fr.com Belgian footballer, born 28 June 1991 years in Ghent. He has had a brilliant club career and also plays for the Belgium national team. De Bruyne is known for his spectacular goals and brilliant assists.
Paul Pogba https://psg.paul-pogba-fr.com is a world-famous football player who plays as a central midfielder. The player’s career had its share of ups and downs, but he was always distinguished by his perseverance and desire to win.
Kylian Mbappe https://psg.kylian-mbappe-fr.com Footballeur, attaquant francais. L’attaquant de l’equipe de France Kylian Mbappe a longtemps refuse de signer un nouveau contrat avec le PSG, l’accord etant en vigueur jusqu’a l’ete 2022.
Thibaut Nicolas Marc Courtois https://thibaut-courtois.real-madrid-ar.com Footballeur belge, gardien de but du Club espagnol “Real Madrid”. Lors de la saison 2010/11, il a ete reconnu comme le meilleur gardien de la Pro League belge, ainsi que comme joueur de l’annee pour Genk. Trois fois vainqueur du Trophee Ricardo Zamora, decerne chaque annee au meilleur gardien espagnol
Forward Rodrigo https://rodrygo.real-madrid-ar.com is now rightfully considered a rising star of Real Madrid. The talented Santos graduate is compared to Neymar and Cristiano Ronaldo, but the young talent does not consider himself a star.
Jude Victor William Bellingham https://jude-bellingham.real-madrid-ar.com English footballer, midfielder of the Spanish club Real Madrid and the England national team. In April 2024, he won the Breakthrough of the Year award from the Laureus World Sports Awards.
Saud Abdullah Abdulhamid https://saud-abdulhamid.real-madrid-ar.com Saudi footballer, defender of the Al -Hilal” and the Saudi Arabian national team. Asian champion in the age category up to 19 years. Abdulhamid is a graduate of the Al-Ittihad club. On December 14, 2018, he made his debut in the Saudi Pro League in a match against Al Bateen
Khvicha Kvaratskhelia https://khvicha-kvaratskhelia.real-madrid-ar.com midfielder of the Georgian national football team and the Italian club “Napoli”. Became champion of Italy and best player in Serie A in the 2022/23 season. Kvaratskhelia is a graduate of Dynamo Tbilisi and played for the Rustavi team.
Vinicius Junior https://vinisius-junior.com.az player news, fresh current and latest events for today about the player of the 2024 season
Latest news and information about Marcelo https://marcelo.com.az on this site! Find Marcelo’s biography, career, playing stats and more. Find out the latest information about football master Marcelo with us!
Khabib Abdulmanapovich Nurmagomedov https://khabib-nurmagomedov.com.az Russian mixed martial arts fighter who performed under the auspices of the UFC. Former UFC lightweight champion.
Welcome to our official site! Get to know the history, players and latest news of Inter Miami Football Club https://inter-miami.com.az. Discover with us the successes and great performances of America’s newest and most exciting soccer club.
Conor Anthony McGregor https://conor-mcgregor.com.az Irish mixed martial arts fighter who also performed in professional boxing. He performs under the auspices of the UFC in the lightweight weight category. Former UFC lightweight and featherweight champion.
Qu’est-ce qu’une «Vitrine de codes promotionnels»?
Ceci est une section speciale sur le site du bookmaker code promo 1xbet aujourd’huidice, qui contient tous les codes promotionnels actuels. Sur la vitrine, les joueurs sont disponibles codes bonus pour les Paris sportifs, pour la section avec le jeu. Chaque code peut etre echange contre des points promo en fonction des denominations.
Оперативный вывод из запоя https://www.liveinternet.ru/users/laralim/post505923855/ на дому. Срочный выезд частного опытного нарколога круглосуточно. При необходимости больного госпитализируют в стационар.
Видеопродакшн студия https://humanvideo.ru полного цикла. Современное оборудование продакшн-компании позволяет снимать видеоролики, фильмы и клипы высокого качества. Создание эффективных видеороликов для рекламы, мероприятий, видеоролики для бизнеса.
[url=http://accutaneiso.com/]accutane capsules[/url]
This is a good tip especially to those new to the blogosphere. Simple but very accurate info… Thanks for sharing this one. A must read post.
Совсем недавно открылся новый интернет портал BlackSprut (Блекспрут) https://bs2cite.cc в даркнете, который предлагает купить нелегальные товары и заказать запрещенные услуги. Самая крупнейшая площадка СНГ. Любимые шопы и отзывчивая поддержка.
Заказать вывоз мусора вывоз мусора недорого в Москве и Московской области, недорого и в любое время суток в мешках или контейнерами 8 м?, 20 м?, 27 м?, 38 м?, собственный автопарк. Заключаем договора на вывоз мусора.
Реальные анкеты https://prostitutki-vyzvat-moskva.ru Москвы с проверенными фото – от элитных путан до дешевых шлюх. Каталог всех индивидуалок на каждой станции метро с реальными фотографиями без ретуши и с отзывами реальных клиентов.
Welcome to the site dedicated to Michael Jordan https://michael-jordan.com.az, a basketball legend and symbol of world sports culture. Here you will find highlights, career, family and news about one of the greatest athletes of all time.
Diego Armando Maradona https://diego-maradona.com.az Argentine footballer who played as an attacking midfielder and striker. He played for the clubs Argentinos Juniors, Boca Juniors, Barcelona, ??Napoli, and Sevilla.
Gucci купить http://thebestluxurystores.ru по низкой цене в интернет-магазине брендовой одежды. Одежда и обувь бренда Gucci c доставкой.
Muhammad Ali https://muhammad-ali.com.az American professional boxer who competed in the heavy weight category; one of the most famous boxers in the history of world boxing.
Монтаж систем отопления https://fectum.pro, водоснабжения, вентиляции, канализации, очистки воды, пылеудаления, снеготаяния, гелиосистем в Краснодаре под ключ.
Offre speciale code promo 1xbet burundi vous offre une remise de 100% sur le montant total de votre premier depot jusqu’a 100$, bien entendu, dans votre devise locale. Profitez-en facilement en saisissant le code promotionnel lors de votre inscription et recevez un bonus sur 1xbet.com.
Lev Ivanovich Yashin https://lev-yashin.com.az Soviet football player, goalkeeper. Olympic champion in 1956 and European champion in 1960, five-time champion of the USSR, three-time winner of the USSR Cup.
Usain St. Leo Bolt https://usain-bolt.com.az Jamaican track and field athlete, specialized in short-distance running, eight-time Olympic champion and 11-time world champion (a record in the history of this competition among men).
Al-Nasr https://al-nasr.com.az your source of news and information about Al-Nasr Football Club . Find out the latest results, transfer news, player and manager interviews, fixtures and much more.
You have a source of the latest and most interesting sports news from Kazakhstan: “Kazakhstan sports news https://sports-kazahstan.kz: Games and records” ! Follow us to receive updates and interesting news every minute!
Game World https://kz-games.kz offers the latest online gaming news, game reviews, gameplay and ideas, gaming tactics and tips . Start playing our most popular and amazing games and get ready to become the leader in the online gaming world!
Latest news and information about the NBA https://basketball-kz.kz in Kazakhstan. Hot stories, player transfers and highlights. Watch the NBA world with us.
Top sports news https://sport-kz-news.kz, photos and blogs from experts and famous athletes, as well as statistics and information about matches of leading championships.
The latest top football news https://football-kz.kz today. Interviews with football players, online broadcasts and match results, analytics and football forecasts, photos and videos.
Which of these styling tools/products do you employ most?
Designers cost for his or her companies any
number of the way: Some request a flat price
overlaying their design and supervision; others cost a retainer
for their companies and an hourly rate; some
add a set percentage to designer-discounted costs to yield a profit; and still others
use a combination of all these strategies. Excellent news is that it is still a preferred
at-home business that individuals go into. Do that early in the method in order that you know what limitations it may pose.
Latest news about games for Android https://android-games.kz, reviews and daily updates. Read now and get the latest information about the most exciting games
Check out Minecraft kz https://minecraft-kz.kz for the latest news, guides, and in-depth reviews of the game options available. Find the latest information on Minecraft Download, Pocket Edition and Bedrock Edition.
Latest news from World of Warcraft https://wow-kz.kz (WOW) tournaments, strategy and game analysis. The most detailed gaming portal in the language.
Latest news and analysis of the Premier League https://premier-league.kz. Full descriptions of matches, team statistics and the most interesting football events. Premier Kazakhstan is the best place for football fans.
mexico drug stores pharmacies: medicine in mexico pharmacies – buying prescription drugs in mexico
mexican online pharmacies prescription drugs
http://cmqpharma.com/# mexico drug stores pharmacies
mexico pharmacies prescription drugs
Доставка груза и грузоперевозки https://tamozhennyy-deklarant.blogspot.com по России через транспортную компанию автотранспортом доступна и для частных лиц. Перевозчик отправит или доставит ваш груз: выгодные тарифы индивидуальный подход из рук в руки 1 машиной.
Зеркала интерьерные https://zerkala-mag.ru в интернет-магазине «Зеркала с подсветкой» Самые низкие цены на зеркала!
Предлагаем купить гаражное оборудование https://profcomplex.pro, автохимию, технику и уборочный инвентарь для клининговых компаний. Доставка по Москве и другим городам России.
Qu’est-ce qui donne au joueur la verification dans 1xbet?
La verification est une procedure obligatoire pour les clients du bookmaker 1x code bonus de pari. La procedure prevoit la verification des donnees personnelles du client pour la conformite avec les donnees reelles qui sont presentees sur la carte d’identite.
Купить зеркала https://zerkala-m.ru по низким ценам. Более 1980 моделей, купить недорого в интернет-магазине в Москве с доставкой по России. Удобный каталог, низкие цены, качественные фото.
I’m looking forward to your next article.국민은행 대출
Spider-Man https://spiderman.kz the latest news, articles, reviews, dates, spoilers and other latest information. All materials on the topic “Spider-Man”
Latest Counter-Strike 2 news https://counter-strike-kz.kz, watch the most successful tournaments and be the best in the gaming world.
The latest top football news https://football.sport-news-eg.com today. Interviews with football players, online broadcasts and match results, analytics and football forecasts, photos and videos.
Discover the dynamic world of Arab sports https://sports-ar.com through the lens of Arab sports news. Your premier source for breaking news, exclusive interviews, in-depth analysis and live coverage of everything happening in sports.
Интернет магазин электроники https://techno-line.store и цифровой техники по доступным ценам. Доставка мобильной электроники по Москве и Московской области.
UFC news https://ufc-ar.com, schedule of fights and tournaments 2024, ratings of UFC fighters, interviews, photos and videos. Live broadcasts and broadcasts of tournaments, statistics, forums and fan blogs.
NHL news https://nhl-ar.com (National Hockey League) – the latest and most up-to-date NHL news for today.
The most important sports news https://bein-sport-egypt.com, photos and blogs from experts and famous athletes, as well as statistics and information about matches of leading leagues.
News and events of the American Basketball League https://basketball-eg.com in Egypt. Hot events, player transfers and the most interesting events. Explore the world of the NBA with us.
Le code promotionnel 1xbet. Enregistrez-vous des a present avec notre code promotionnel 1xBet valable jusqu’en 2024 pour beneficier d’un bonus de 200% sur votre premier depot. Utilisez le code de bonus lors de l’ouverture de votre nouveau compte 1xbet afin de recevoir votre bonus de bienvenue de 130$. L’enregistrement est autorise pour les personnes ayant atteint l’age de 18 ans et residant dans les pays ou l’activite du bookmaker n’est pas limitee au niveau legislatif.
Discover the wonderful world of online games https://game-news-ar.com. Get the latest news, reviews and tips for your favorite games.
News, tournaments, guides and strategies about the latest GTA games https://gta-ar.com. Stay tuned for the best GTA gaming experience
Minecraft news https://minecraft-ar.com, guides and in-depth reviews of the gaming features available in Minecraft Ar. Get the latest information on downloading Minecraft, Pocket Edition and Bedrock Edition.
Latest news https://android-games-ar.com about Android games, reviews and daily updates. The latest information about the most exciting games.
I recently came across a gem of a website for booking hotels worldwide: http://www.findbookingdeals.com. This site has been a lifesaver for my recent trips. It offers an extensive range of options, from high-end luxury hotels to affordable stays, and even some truly unique boutique hotels.
The best part? It’s incredibly user-friendly. Navigating through the site is a breeze, and you can uncover amazing deals without the usual hassle. The customer service is also exceptional, which makes the experience even better.
If you’re planning any travel soon, I highly recommend giving http://www.findbookingdeals.com a try. It simplifies the process of finding the perfect accommodation, allowing you to focus on enjoying your trip. Trust me, it’s worth checking out!
tipobet porn
Your passion for this topic is contagious.버팀목 대출
The site is dedicated to football https://fooball-egypt.com, football history and news. Latest news and fresh reviews of the world of football
Открытие для себя Ерлинг Хааланда https://manchestercity.erling-haaland-cz.com, a talented player of «Manchester City». Learn more about his skills, achievements and career growth.
The path of 21-year-old Jude Bellingham https://realmadrid.jude-bellingham-cz.com from young talent to one of the most promising players in the world, reaching new heights with Dortmund and England.
French prodigy Kylian Mbappe https://realmadrid.kylian-mbappe-cz.com is taking football by storm, joining his main target, ” Real.” New titles and records are expected.
Harry Kane’s journey https://bavaria.harry-kane-cz.com from Tottenham’s leading striker to Bayern’s leader and Champions League champion – this is the story of a triumphant ascent to the football Olympus.
There are additionally architects, materials suppliers and
subcontractors (electricians, carpenters and heating and cooling professionals, for example) to be
situated and brought into the fold. These materials
can be found at most hardware shops and house improvement centers.
Heating and cooling methods are usually trouble-free and straightforward to take care of.
No matter what sort of heating and cooling system you’ve, there are a
number of things you can do to keep the system in top situation.
Изготовим для Вас изделия из металла https://smith-moskva.blogspot.com, по вашим чертежам или по нашим эскизам.
Промышленные насосы https://superomsk.ru/news/137099/pogrujne_nasos/ Wilo предлагают широкий ассортимент решений для различных отраслей промышленности, включая водоснабжение, отопление, вентиляцию, кондиционирование и многие другие. Благодаря своей высокой производительности и эффективности, насосы Wilo помогают снизить расходы на энергию и обслуживание, что делает их идеальным выбором для вашего бизнеса.
https://buzard.ru панели для отделки фасада – интернет магазин
The fascinating story of the rise of Brazilian prodigy Vinicius Junior https://realmadrid.vinicius-junior-cz.com to the heights of glory as part of the legendary Madrid “Real”
Mohamed Salah https://liverpool.mohamed-salah-cz.com, who grew up in a small town in Egypt, conquered Europe and became Liverpool star and one of the best players in the world.
Полезные советы и пошаговые инструкции по строительству https://svoyugol.by, ремонту и дизайну домов и квартир, выбору материалов, монтажу и установке своими руками.
The inspiring story of how talented Kevin De Bruyne https://manchestercity.kevin-de-bruyne-cz.com became the best player of Manchester City and the Belgium national team. From humble origins to the leader of a top club.
Lionel Messi https://intermiami.lionel-messi-cz.com, one of the best football players of all time, moves to Inter Miami” and changes the face of North American football.
Bernardo Mota Veiga de Carvalho e Silva https://manchestercity.bernardo-silva-cz.com Portuguese footballer, club midfielder Manchester City and the Portuguese national team.
L’inscription a 1xBet est-elle disponible sans passeport?
Vous pouvez vous inscrire a Code promo du casino 1xbet sans donnees de passeport, mais a l’avenir, dans votre compte personnel, vous devrez remplir un questionnaire indiquant votre nom, votre nom et votre date de naissance. A l’avenir, avant la premiere Conclusion, il faudra egalement passer par la verification.
Antoine Griezmann https://atlticomadrid-dhb.antoine-griezmann-cz.com Atletico Madrid star whose talent and decisive goals helped the club reach the top of La Liga and the UEFA Champions League.
The story of Robert Lewandowski https://barcelona.robert-lewandowski-cz.com, his impressive journey from Poland to Barcelona, ??where he became not only a leader on the field, but also a source of inspiration for young players.
Son Heung-min’s https://tottenhamhotspur.son-heung-min-cz.com success story at Tottenham Hotspur and his influence on the South Korean football, youth inspiration and changing the perception of Asian players.
We explore the path of Luka Modric https://realmadrid.luka-modric-cz.com to Real Madrid, from a difficult adaptation to legendary Champions League triumphs and personal awards.
The impact of the arrival of Cristiano Ronaldo https://annasr.cristiano-ronaldo-cz.com at Al-Nasr. From sporting triumphs to cultural changes in Saudi football.
Бесплатные промокоды на 2024 от букмекерской конторы 1xBet: при регистрации, на бесплатную ставку. Рассказываем, как использовать и куда вводить промокоды в 1хБет. 1хбет промокод. Бесплатный промокод для увеличения бонуса. Букмекерская контора 1хБет – одна из самых популярных беттинговых площадок, предлагающая высокие коэффициенты, широкую линию с дополнительной росписью. Благодаря низкой марже БК пользователи стабильно зарабатывают на ставках на спорт. Отличительной особенностью букмекерской конторы 1xBet является возможность совершения ставок по промокодам, которые предоставляются бесплатно – более подробно в этом материале https://www.jkfitness.com/wp-content/pags/promokod_260.html
AML проверка
Контроль по борьбе с отмыванием денег: Как избежать ограничение ресурсов у криптовалютных бирж
По какой причине требуется антиотмывочные меры?
Антиотмывочные меры (Противодействие легализации доходов) – включает в себя система действий, направленных в целях противодействия отбеливания активов. Подобная оценка способствует охранять электронные средства участников и предотвращать применение платформ нелегальных транзакций. Процедура противодействия отмыванию денег обязательна для обеспечения неприкосновенности своих фондов вместе с соблюдением правовых требований.
Базовые подходы оценки
Участники криптосферы а также другие транзакционные предложения применяют ряд главных подходов с целью проверки клиентов:
“Знай своего клиента”: Эта методика включает простые действия в целях идентификации документов пользователя, например анализ удостоверений местонахождения. Верификация личности помогает убедиться, в надежности владельца представляет собой доверенным.
CFT: Ориентирована на предотвращение поддержки террористической деятельности. Инструментарий контролирует подозрительные транзакции при необходимости блокирует аккаунты в рамках проведения внутреннего аудита.
Преимущества антиотмывочных мер
Проверка по борьбе с отмыванием денег позволяет участникам криптосферы:
Придерживаться мировые и местные правовые нормы.
Защищать владельцев незаконных операций.
Укреплять показатель репутации среди участников госорганов.
Каким способом защитить свои активы во время операций на криптовалютном рынке
С намерением ограничить вероятности блокировки ресурсов, придерживайтесь перечисленным рекомендациям:
Работайте с заслуживающие доверие сервисы: Обращайтесь исключительно к обменникам высокой популярностью наряду с высоким уровнем надежности.
Анализируйте получателей: Прибегайте к решения для верификации в интересах проверки криптовалютных реквизитов контрагентов заранее до совершением транзакций.
Постоянно модифицируйте криптовалютные реквизиты: Такой подход окажет содействие предотвратить вероятных ограничений, если Ваши контрагенты партнеры попадут под ограничения.
Сберегайте подтверждения операций: В случае необходимости вы сможете обосновать чистоту взятых ресурсов.
Обобщение
Проверка по борьбе с отмыванием денег – выступает в качестве существенный средство для обеспечения неприкосновенности операций
с криптовалютой. Данная процедура оказывает содействие минимизировать отмывание денег, обеспечение экстремистских группировок и другие противоправные действия. Выполняя рекомендациям по безопасности а также выбирая проверенные сервисы, сможете снизить вероятности ограничения ресурсов и наслаждаться надежной взаимодействием с криптовалютами.
Find out how Pedri https://barcelona.pedri-cz.com becomes a key figure for Barcelona – his development, influence and ambitions determine the club’s future success in world football.
A study of the influence of Rodrigo https://realmadrid.rodrygo-cz.com on the success and marketing strategy of Real Madrid: analysis of technical skills, popularity in Media and commercial success.
Find out how Pedro Gavi https://barcelona.gavi-cz.com helped Barcelona achieve success thanks to his unique qualities, technique and leadership, becoming a key player in the team.
Find out about Alisson https://liverpool.alisson-becker-cz.com‘s influence on Liverpool’s success, from his defense to personal achievements that made him one of the best goalkeepers in the world.
How Karim Benzema https://alIttihad.karim-benzema-cz.com changed the game of Al-Ittihad and Saudi football: new tactics, championship success, increased viewership and commercial success.
r7 casino вход r7 casino регистрация
buy real instagram views buy instagram views
Thibaut Courtois https://realmadrid.thibaut-courtois-cz.com the indispensable goalkeeper of “Real”, whose reliability, leadership and outstanding The game made him a key figure in the club.
Find out how Virgil van Dijk https://liverpool.virgil-van-dijk-cz.com became an integral part of style игры «Liverpool», ensuring the stability and success of the team.
You do not should call it a day in your inexperienced tomatoes
— stick them within the freezer to save them from the cold!
Simply decide and slice them, then separate the individual slices with freezer paper and
keep them on ice till you are ready to show them into
one thing scrumptious. After all, you do not have to
maintain them entire. Usually, tomato-growers
have unripened crop left on the vines when the
weather starts to show chilly. If you often stand on your toes
all day long, you may really profit from train on a street bike in a bent over, but supported, position.
Find out how Bruno Guimaraes https://newcastleunited.bruno-guimaraes-cz.com became a catalyst for the success of Newcastle United thanks to his technical abilities and leadership on the field and beyond.
Thank you for sharing your expertise with us.무료 프라그마틱
Играйте на казино онлайн играть и выигрывайте
Study of the playing style of Toni Kroos https://real-madrid.toni-kroos-cz.com at Real Madrid: his accurate passing, tactical flexibility and influence on the team’s success.
The young Uruguayan Darwin Nunez https://liverpool.darwin-nunez-cz.com broke into the elite of world football, and he became a key Liverpool player.
Romelu Lukaku https://chelsea.romelu-lukaku-cz.com, one of the best strikers in Europe, returns to Chelsea to continue climbing to the top of the football Olympus.
Star Brazilian striker Gabriel Jesus https://arsenal.gabriel-jesus-cz.com put in a superb performance to lead Arsenal to new heights after moving from Manchester City.
A fascinating story about how David Alaba https://realmadrid.david-alaba-cz.com after starting his career at the Austrian academy Vienna became a key player and leader of the legendary Real Madrid.
http://www.findbookingdeals.com
I recently came across a gem of a website for booking hotels worldwide: http://www.findbookingdeals.com. This site has been a lifesaver for my recent trips. It offers an extensive range of options, from high-end luxury hotels to affordable stays, and even some truly unique boutique hotels.
The best part? It’s incredibly user-friendly. Navigating through the site is a breeze, and you can uncover amazing deals without the usual hassle. The customer service is also exceptional, which makes the experience even better.
If you’re planning any travel soon, I highly recommend giving http://www.findbookingdeals.com a try. It simplifies the process of finding the perfect accommodation, allowing you to focus on enjoying your trip. Trust me, it’s worth checking out!
Offre speciale 1xBet Obtenez un bonus sportif supplementaire de 200% jusqu’a 130 €/$ avec le code bonus 1xbet, en plus du bonus de bienvenue standard de 1950$ et de 150 tours gratuits au casino. Profitez de cette opportunite pour jouer et gagner de l’argent grace aux paris sportifs. Chez nous, tout le monde peut devenir gagnant !
The fascinating story of Antonio Rudiger’s transfer https://real-madrid.antonio-rudiger-cz.com to Real Madrid and his rapid rise as a key player at one of the best clubs in the world.
The story of how the incredibly talented footballer Riyad Mahrez https://alahli.riyad-mahrez-cz.com reached new heights in career, moving to Al Ahly and leading the team to victory.
The fascinating story of Marcus Rashford’s ascent https://manchester-united.marcus-rashford-cz.com to glory in the Red Devils: from a young talent to one of the key players of the team.
Tobey Maguire’s Ascent Study https://spider-man.tobey-maguire.cz to the superstar through his iconic image of Spider-Man in the cult trilogy.
There are lots of choices you possibly can select from and in this manner
your groomsmen may think that you already know them
lots. Apart from this, there are many restrictions like product attributes, tool availability and establishing of occasions.
Start with a impartial basis like textured white plaster or mottled stone-look tiles and a
dark, distressed-wooden vanity cabinet topped in stone or faux-stone counters.
That makes it vital to seek out all the documents
that include the very fact and remark them, in order that government officials know what might be disclosed and differentiate it from other information that nonetheless
needs to be protected.
Try to make a fascinating actor Johnny Depp https://secret-window.johnny-depp.cz, who will become the slave of his strong hero Moudriho Creeps in the thriller “Secret Window”.
Fascinating event related to this Keanu Reeves helped him in the role of the iconic John Wick characters https://john-wick.keanu-reeves.cz, among which there is another talent who has combat smarts with inappropriate charisma.
Jackie Chan https://peakhour.jackie-chan.cz from a poor boy from Hong Kong to a world famous Hollywood stuntman. The incredible success story of Jackie Chan.
Follow Liam Neeson’s career https://hostage.liam-neeson.cz as he fulfills his potential as Brian Mills in the film “Taken” and becomes one of the leading stars of Hollywood action films.
Emily Olivia Laura Blunt https://oppenheimer.emily-blunt.cz British and American actress. Winner of the Golden Globe (2007) and Screen Actors Guild (2019) awards.
Le code promo 1xbet congo, utilisez-le lors de l’inscription et obtenez un bonus de 200% jusqu’a 130$. Seuls les nouveaux joueurs peuvent obtenir le bonus. Ce contrat bonus est valable jusqu’au 31 decembre 2024. Apres le depot, le joueur recoit sur le compte bonus le montant des bonus pour les Paris de 100% du montant du depot, mais pas plus de $100. Pour recuperer le bonus recu, le joueur doit placer au moins cinq Paris dans les cinq jours suivants. Pour les Paris, vous devez faire un Express avec 3 evenements ou plus avec des cotes d’au moins 1,40.
The inspiring story of Zendaya’s rise https://spider-man.zendaya-maree.cz, from her early roles to her blockbuster debut in Marvel Cinematic Universe.
The inspiring story of the ascent of the young actress Anya Taylor https://queensmove.anya-taylor-joy.cz to fame after her breakthrough performance in the TV series “The Queen’s Move”. Conquering new peaks.
An indomitable spirit, incredible skills and five championships – how Kobe Bryant https://losangeles-lakers.kobe-bryant.cz became an icon of the Los Angeles Lakers and the entire NBA world.
Carlos Vemola https://oktagon-mma.karlos-vemola.cz Czech professional mixed martial artist, former bodybuilder, wrestler and member Sokol.
Witness the thrilling story of Jiri Prochazka’s https://ufc.jiri-prochazka-ufc.cz rapid rise to the top of the UFC’s light heavyweight division, marked by his dynamic fighting style and relentless determination.
Your post is a breath of fresh air.백링크 작업
[url=http://incorporation.ru/redirect.php?url=https://pin-up-casino-kz.biz]Pin up[/url]
[url=http://www.msandr.cc/__media__/js/netsoltrademark.php?d=https://pin-up-casino-kz.biz]Pin up[/url]
[url=http://www.delycam.com/go.php?url=https://pin-up-casino-kz.biz]Pin up[/url]
[url=http://gov.co.vu.xx3.kz/go.php?url=https://pin-up-casino-kz.biz]Pin up[/url]
[url=http://www.ess-enes.ru/bitrix/redirect.php?goto=https://pin-up-casino-kz.biz]Pin up[/url]
[url=http://havenk.com/redirect.php?link=https://pin-up-casino-kz.biz]Pin up[/url]
[url=http://www.regionsite.com/externalLink.asp?url=https://pin-up-casino-kz.biz]Pin up[/url]
[url=http://dq-msl.gamerch.com/gamerch/external_link/?url=https://pin-up-casino-kz.biz]Pin up[/url]
[url=http://www.scga.org/Account/AccessDenied.aspx?url=https://pin-up-casino-kz.biz]Pin up[/url]
[url=http://home.kongweb.net/link.php?url=https://pin-up-casino-kz.biz]Pin up[/url]
[url=http://burlapistan.com/__media__/js/netsoltrademark.php?d=https://pin-up-casino-kz.biz]Pin up[/url]
[url=http://l.u.c.ykongwang.qu.nxunyangongy.u.xx3.kz/go.php?url=https://pin-up-casino-kz.biz]Pin up[/url]
[url=http://puppyculture.postaffiliatepro.com/scripts/click.php?a_aid=54da9488d5cd0&desturl=https://pin-up-casino-kz.biz]Pin up[/url]
[url=http://maps.google.co.id/url?q=https://pin-up-casino-kz.biz]Pin up[/url]
[url=http://maps.t.me/s/worldcasinonet.ar/url?q=https://pin-up-casino-kz.biz]Pin up[/url]
Place your bet at pin up online – most prestigious bookmaker in Kazakhstan
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
I recently came across a gem of a website for booking hotels worldwide: http://www.findbookingdeals.com. This site has been a lifesaver for my recent trips. It offers an extensive range of options, from high-end luxury hotels to affordable stays, and even some truly unique boutique hotels.
The best part? It’s incredibly user-friendly. Navigating through the site is a breeze, and you can uncover amazing deals without the usual hassle. The customer service is also exceptional, which makes the experience even better.
If you’re planning any travel soon, I highly recommend giving http://www.findbookingdeals.com a try. It simplifies the process of finding the perfect accommodation, allowing you to focus on enjoying your trip. Trust me, it’s worth checking out!
[url=http://tm-orlandinos.ru/?wptouch_switch=desktop&redirect=https://pin-up-casino-kz.biz]Pin up[/url]
[url=http://moneysolution.com/redirect.php?url=https://pin-up-casino-kz.biz]Pin up[/url]
[url=http://startuplongmont.com.xx3.kz/go.php?url=https://pin-up-casino-kz.biz]Pin up[/url]
[url=http://okanenoki.hatenablog.com/iframe/hatena_bookmark_comment?canonical_uri=https://pin-up-casino-kz.biz]Pin up[/url]
[url=http://doterra.myvoffice.com/Application/index.cfm?&EnrollerID=604008&Theme=Default&ReturnUrl=https://pin-up-casino-kz.biz]Pin up[/url]
[url=http://clients1.google.sr/url?q=https://pin-up-casino-kz.biz]Pin up[/url]
[url=http://www.construireenpaca.com/redirect.php?url_partenaire=https://pin-up-casino-kz.biz]Pin up[/url]
[url=http://images.google.tk/url?q=https://pin-up-casino-kz.biz]Pin up[/url]
[url=http://www.sillbeer.com/?url=https://pin-up-casino-kz.biz]Pin up[/url]
[url=http://www.connectingonline.com.ar/Site/Click.aspx?t=c&e=4800&sm=0&c=674422&cs=4a7i7a7a&url=https://pin-up-casino-kz.biz]Pin up[/url]
[url=http://freenudegranny.com/cgi-bin/atc/out.cgi?id=74&u=https://pin-up-casino-kz.biz]Pin up[/url]
[url=http://qvazar.ru/bitrix/redirect.php?event1=&event2=&event3=&goto=https://pin-up-casino-kz.biz]Pin up[/url]
[url=http://eigner.blog.idnes.cz/redir.aspx?url=https://pin-up-casino-kz.biz]Pin up[/url]
[url=http://darksideshop.com.xx3.kz/go.php?url=https://pin-up-casino-kz.biz]Pin up[/url]
[url=http://in.tempus.no/AbpLocalization/ChangeCulture?cultureName=se&returnUrl=https://pin-up-casino-kz.biz]Pin up[/url]
Place your bet at pin up now – most reliable bookmaker in Kazakhstan
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Jon Jones https://ufc.jon-jones.cz a dominant fighter with unrivaled skill, technique and physique who has conquered the light heavyweight division.
An article about the triumphant 2023 Ferrari https://ferrari.charles-leclerc.cz and their star driver Charles Leclerc, who became the Formula world champion 1.
Young Briton Lando Norris https://mclaren.lando-norris.cz is at the heart of McLaren’s Formula 1 renaissance, regularly achieving podium finishes and winning.
Let’s speak a little bit about how electric motors
and gasoline engines send energy to the wheels.
Fuel engines are simpler and simpler to manufacture and maintain. Conventional fuel automobiles carry out higher at excessive
speeds as in comparison with electric automobiles. Why are
gasoline vehicles better than electric automobiles?
1. Why Did Industrial Electric Automobiles Disappear
for Almost a Century? Thomas Davenport built the primary
sensible automotive with an electric motor in the 1830s.
Why did gas guzzlers take over?
The legendary Spanish racer Fernando Alonso https://formula-1.fernando-alonso.cz returns to Formula 1 after several years.
Activision and Call of Duty https://activision.call-of-duty.cz leading video game publisher and iconic shooter with a long history market dominance.
montenegro house https://montenegro-real-estate-prices.com
Free movies https://www.moviesjoy.cc and TV streaming online, watch movies online in HD 1080p.
the most popular sports website https://sports-forecasts.com in the Arab world with the latest sports news, predictions and analysis in real time.
Latest news and analysis of the English Premier League https://epl-ar.com. Detailed descriptions of matches, team statistics and the most interesting football events.
Latest Diablo news https://diablo-ar.com, detailed game descriptions and guides. Diablo.az – The largest Diablo information portal in Arabic.
child porn
Latest World of Warcraft tournament news https://ar-wow.com (WOW), strategies and game analysis. The most detailed gaming portal in Arabic.
NFL https://nfl-ar.com News, analysis and topics about the latest practices, victories and records. A portal that explores the most beautiful games in the NFL world in general.
The latest analysis, reviews of https://spider-man-ar.com tournaments and the most interesting things from the “Spider-Man” series of games in Azerbaijani language. It’s all here!
Discover exciting virtual football https://fortnite-ar.com in Fortnite. Your central hub for the latest news, expert strategy and exciting eSports reporting.
Latest Counter-Strike 2 news https://counter-strike-ar.com, watch the most successful tournaments and be the best in the gaming world on CS2 ar.
外送茶是什麼?禁忌、價格、茶妹等級、術語等..老司機告訴你!
外送茶是什麼?
外送茶、外約、叫小姐是一樣的東西。簡單來說就是在通訊軟體與茶莊聯絡,選好自己喜歡的妹子後,茶莊會像送飲料這樣把妹子派送到您指定的汽車旅館、酒店、飯店等交易地點。您只需要在您指定的地點等待,妹妹到達後,就可以開心的開始一場美麗的約會。
外送茶種類
學生兼職的稱為清新書香茶
日本女孩稱為清涼綠茶
俄羅斯女孩被稱為金酥麻茶
韓國女孩稱為超細滑人參茶
外送茶價格
外送茶的客戶相當廣泛,包括中小企業主、自營商、醫生和各行業的精英,像是工程師等等。在台北和新北地區,他們的消費指數大約在 7000 到 10000 元之間,而在中南部則通常在 4000 到 8000 元之間。
對於一般上班族和藍領階層的客人來說,建議可以考慮稍微低消一點,比如在北部約 6000 元左右,中南部約 4000 元左右。這個價位的茶妹大多是新手兼職,但有潛力。
不同地區的客人可以根據自己的經濟能力和喜好選擇適合自己的價位範圍,以免感到不滿意。物價上漲是一個普遍現象,受到地區和經濟情況等因素的影響,茶莊的成本也在上升,因此價格調整是合理的。
外送茶外約流程
加入LINE:加入外送茶官方LINE,客服隨時為你服務。茶莊一般在中午 12 點到凌晨 3 點營業。
告知所在地區:聯絡客服後,告訴他們約會地點,他們會幫你快速找到附近的茶妹。
溝通閒聊:有任何約妹問題或需要查看妹妹資訊,都能得到詳盡的幫助。
提供預算:告訴客服你的預算,他們會找到最適合你的茶妹。
提早預約:提早預約比較好配合你的空檔時間,也不用怕到時候約不到你想要的茶妹。
外送茶術語
喝茶術語就像是進入茶道的第一步,就像是蓋房子打地基一樣。在這裡,我們將這些外送茶入門術語分類,讓大家能夠清楚地理解,讓喝茶變得更加容易上手。
魚:指的自行接客的小姐,不屬於任何茶莊。
茶:就是指「小姐」的意思,由茶莊安排接客。
定點茶:指由茶莊提供地點,客人再前往指定地點與小姐交易。
外送茶:指的是到小姐到客人指定地點接客。
個工:指的是有專屬工作室自己接客的小姐。
GTO:指雞頭也就是飯店大姊三七茶莊的意思。
摳客妹:只負責找客人請茶莊或代調找美眉。
內機:盤商應召站提供茶園的人。
經紀人:幫內機找美眉的人。
馬伕:外送茶司機又稱教練。
代調:收取固定代調費用的人(只針對同業)。
阿六茶:中國籍女子,賣春的大陸妹。
熱茶、熟茶:年齡比較大、年長、熟女級賣春者(或稱阿姨)。
燙口 / 高溫茶:賣春者年齡過高。
台茶:從事此職業的台灣小姐。
本妹:從事此職業的日本籍小姐。
金絲貓:西方國家的小姐(歐美的、金髮碧眼的那種)。
青茶、青魚:20 歲以下的賣春者。
乳牛:胸部很大的小姐(D 罩杯以上)。
龍、小叮噹、小叮鈴:體型比較肥、胖、臃腫、大隻的小姐。
п»їbest mexican online pharmacies: mexican pharmacy – mexican online pharmacies prescription drugs
Le codes promo gratuits pour 1xbet vous offre un bonus de bienvenue pour une simple inscription allant jusqu’a 130 $. Copiez simplement le code promotionnel et utilisez-le lors de l’inscription. Ceci est la version la plus volumineuse de l’enregistrement, cependant, c’est l’enregistrement complet et ouvre le joueur un acces complet aux fonctionnalites de la plate-forme de jeu.
Latest boxing news, achievements of Raisol Abbasov https://boxing-ar.com, Tyson Fury fights and much more. It’s all about the boxing ambassador.
Discover the wonderful world of online games https://onlayn-oyinlar.com with GameHub. Get the latest news, reviews and tips for your favorite games. Join our gaming community today!
Sports news https://gta-uzbek.com the most respected sports site in Uzbekistan, which contains the latest sports news, forecasts and analysis.
Latest GTA game news https://gta-uzbek.com, tournaments, guides and strategies. Stay tuned for the best GTA gaming experience
Latest news from the world of boxing https://boks-uz.com, achievements of Resul Abbasov, Tyson Fury’s fights and much more. Everything Boxing Ambassador has.
mexican online pharmacies prescription drugs
https://cmqpharma.online/# п»їbest mexican online pharmacies
mexico drug stores pharmacies
Explore the extraordinary journey of Kylian Mbappe https://mbappe-real-madrid.com, from his humble beginnings to global stardom.
Get the latest https://mesut-ozil-uz.com Mesut Ozil news, stats, photos and more.
Latest news about Pele https://mesut-ozil-uz.com, statistics, photos and much more. Get the latest news and information about football legend Pele.
Serxio Ramos Garsiya https://serxio-ramos.com ispaniyalik futbolchi, himoyachi. Ispaniya terma jamoasining sobiq futbolchisi. 16 mavsum davomida u “Real Madrid”da markaziy himoyachi sifatida o’ynadi.
Ronaldo de Asis Moreira https://ronaldinyo.com braziliyalik futbolchi, yarim himoyachi va hujumchi sifatida o’ynagan. Jahon chempioni (2002). “Oltin to’p” sovrindori (2005).
Официальный сайт онлайн-казино Vavada https://vavada-kz-game.kz это новый адрес лучших слотов и джекпотов. Ознакомьтесь с бонусами и играйте на реальные деньги из Казахстана.
Marcus Lilian Thuram-Julien https://internationale.marcus-thuram-fr.com French footballer, forward for the Internazionale club and French national team.
Legendary striker Cristiano Ronaldo https://an-nasr.cristiano-ronaldo-fr.com signed a contract with the Saudi club ” An-Nasr”, opening a new chapter in his illustrious career in the Middle East.
Manchester City and Erling Haaland https://manchester-city.erling-haaland-fr.com explosive synergy in action. How a club and a footballer light up stadiums with their dynamic play.
Lionel Messi https://inter-miami.lionel-messi-fr.com legendary Argentine footballer, announced his transfer to the American club Inter Miami.
I was extremely pleased to find this great site. I need to to thank you for your time due to this wonderful read!! I definitely really liked every bit of it and I have you bookmarked to look at new things in your site.
The official website where you can find everything about the career of Gianluigi Buffon https://gianluigi-buffon.com. Discover the story of this legendary goalkeeper who left his mark on football history and relive his achievements and unforgettable memories with us.
Website dedicated to football player Paul Pogba https://pogba-uz.com. Latest news from the world of football.
Welcome to our official website! Go deeper into Paulo Dybala’s https://paulo-dybala.com football career. Discover Dybala’s unforgettable moments, amazing talents and fascinating journey in the world of football on this site.
Latest news on the Vinicius Junior fan site https://vinisius-junior.com. Vinicius Junior has been playing since 2018 for Real Madrid (Real Madrid). He plays in the Left Winger position.
Coffeeroom https://coffeeroom.by – магазин кофе, чая, кофетехники, посуды, химии и аксессуаров в Минске для дома и офиса.
Прокат и аренда автомобилей https://autorent.by в Минске 2019-2022. Сутки от 35 руб.
Find the latest information on Khabib Nurmagomedov https://khabib-nurmagomedov.uz news and fights. Check out articles and videos detailing Khabib UFC career, interviews, wins, and biography.
Latest news and information about Marcelo https://marselo-uz.com on this site! Find Marcelo’s biography, career, game stats and more.
After checking out a number of the blog posts on your site, I truly appreciate your way of blogging. I book-marked it to my bookmark site list and will be checking back soon. Take a look at my web site too and tell me what you think.
外送茶是什麼?禁忌、價格、茶妹等級、術語等..老司機告訴你!
外送茶是什麼?
外送茶、外約、叫小姐是一樣的東西。簡單來說就是在通訊軟體與茶莊聯絡,選好自己喜歡的妹子後,茶莊會像送飲料這樣把妹子派送到您指定的汽車旅館、酒店、飯店等交易地點。您只需要在您指定的地點等待,妹妹到達後,就可以開心的開始一場美麗的約會。
外送茶種類
學生兼職的稱為清新書香茶
日本女孩稱為清涼綠茶
俄羅斯女孩被稱為金酥麻茶
韓國女孩稱為超細滑人參茶
外送茶價格
外送茶的客戶相當廣泛,包括中小企業主、自營商、醫生和各行業的精英,像是工程師等等。在台北和新北地區,他們的消費指數大約在 7000 到 10000 元之間,而在中南部則通常在 4000 到 8000 元之間。
對於一般上班族和藍領階層的客人來說,建議可以考慮稍微低消一點,比如在北部約 6000 元左右,中南部約 4000 元左右。這個價位的茶妹大多是新手兼職,但有潛力。
不同地區的客人可以根據自己的經濟能力和喜好選擇適合自己的價位範圍,以免感到不滿意。物價上漲是一個普遍現象,受到地區和經濟情況等因素的影響,茶莊的成本也在上升,因此價格調整是合理的。
外送茶外約流程
加入LINE:加入外送茶官方LINE,客服隨時為你服務。茶莊一般在中午 12 點到凌晨 3 點營業。
告知所在地區:聯絡客服後,告訴他們約會地點,他們會幫你快速找到附近的茶妹。
溝通閒聊:有任何約妹問題或需要查看妹妹資訊,都能得到詳盡的幫助。
提供預算:告訴客服你的預算,他們會找到最適合你的茶妹。
提早預約:提早預約比較好配合你的空檔時間,也不用怕到時候約不到你想要的茶妹。
外送茶術語
喝茶術語就像是進入茶道的第一步,就像是蓋房子打地基一樣。在這裡,我們將這些外送茶入門術語分類,讓大家能夠清楚地理解,讓喝茶變得更加容易上手。
魚:指的自行接客的小姐,不屬於任何茶莊。
茶:就是指「小姐」的意思,由茶莊安排接客。
定點茶:指由茶莊提供地點,客人再前往指定地點與小姐交易。
外送茶:指的是到小姐到客人指定地點接客。
個工:指的是有專屬工作室自己接客的小姐。
GTO:指雞頭也就是飯店大姊三七茶莊的意思。
摳客妹:只負責找客人請茶莊或代調找美眉。
內機:盤商應召站提供茶園的人。
經紀人:幫內機找美眉的人。
馬伕:外送茶司機又稱教練。
代調:收取固定代調費用的人(只針對同業)。
阿六茶:中國籍女子,賣春的大陸妹。
熱茶、熟茶:年齡比較大、年長、熟女級賣春者(或稱阿姨)。
燙口 / 高溫茶:賣春者年齡過高。
台茶:從事此職業的台灣小姐。
本妹:從事此職業的日本籍小姐。
金絲貓:西方國家的小姐(歐美的、金髮碧眼的那種)。
青茶、青魚:20 歲以下的賣春者。
乳牛:胸部很大的小姐(D 罩杯以上)。
龍、小叮噹、小叮鈴:體型比較肥、胖、臃腫、大隻的小姐。
Discover how Riyad Mahrez https://al-ahli.riyad-mahrez.com transformed Al-Ahli, becoming a key player and catalyst in reaching new heights in world football.
Find the latest information on Conor McGregor https://conor-mcgregor.uz news, fights, and interviews. Check out detailed articles and news about McGregor’s UFC career, wins, training, and personal life.
Get to know the history, players and latest news of the Inter Miami football club https://inter-miami.uz. Join us to learn about the successes and great performances of America’s newest and most exciting soccer club.
A site dedicated to Michael Jordan https://michael-jordan.uz, a basketball legend and symbol of world sports culture. Here you will find highlights, career, family and news about one of the greatest athletes of all time.
Explore the dynamic world of sports https://noticias-esportivas-br.org through the lens of a sports reporter. Your source for breaking news, exclusive interviews, in-depth analysis and live coverage of all sports.
Промокоды 1xBet на сегодня. Получите бесплатно при регистрации бонус. Активируйте промокоды и делайте ставки на футбол, хоккей и самые яркие состязания – Лиги Европы и Лиги Чемпионов. Отличительная особенность букмекера – возможность использования промокод в 1xbet или для активных клиентов, уже имеющих учетную запись. Они обеспечивают двойной депозит, бесплатную ставку (фрибет), специальный бонус на день рождения и многое другое. Актуальные бонусные коды для новичков за регистрацию, способы получения и активации, bonus программа на официальном сайте букмекера 1хБет. Бесплатные промокоды при регистрации в 2024 году в 1xBet – более подробно в этом материале http://lipetskregionsport.ru/news/pages/1hbet_promokod_na_6500_pri_registracii.html
[url=https://lasixor.online/]where to buy furosemide[/url]
Hi, I do believe this is an excellent blog. I stumbledupon it 😉 I’m going to return yet again since i have saved as a favorite it. Money and freedom is the greatest way to change, may you be rich and continue to help others.
The latest top football news https://futebol-ao-vivo.net today. Interviews with football players, online broadcasts and match results, analytics and football forecasts
If you are a fan of UFC https://ufc-hoje.com the most famous organization in the world, come visit us. The most important news and highlights from the UFC world await you on our website.
Site with the latest news, statistics, photos of Pele https://edson-arantes-do-nascimento.com and much more. Get the latest news and information about football legend Pele.
Welcome to our official website, where you will find everything about the career of Gianluigi Buffon https://gianluigi-buffon.org. Discover the story of this legendary goalkeeper who made football history.
The best site dedicated to the football player Paul Pogba https://pogba.org. Latest news from the world of football.
Le 1xbet code promo pari gratuit 2024 pour beneficier d’une offre VIP de 100% jusqu’a 130€ sur les paris sportifs ou de 1950€ + 150 tours. Tous les nouveaux joueurs ayant utilise le code lors de leur inscription recoivent un bonus de bienvenue. Ce code bonus special vous permettra de recevoir un bonus augmente lors de votre inscription sur le site du bookmaker 1xBet.com ! Ne manquez pas cette occasion et inscrivez-vous des maintenant avec le code promo 1xbet pour obtenir un bonus allant jusqu’a 130 €/$.
Vinicius Junior https://vinicius-junior.org all the latest current and latest news for today about the player of the 2024 season
Analysis of Arsenal’s impressive revival https://arsenal.bukayo-saka.biz under the leadership of Mikel Arteta and the key role of young star Bukayo Saki in the club’s return to the top.
Gavi’s success story https://barcelona.gavi-fr.com at Barcelona: from his debut at 16 to a key role in club and national team of Spain, his talent inspires the world of football.
Pedri’s story https://barcelona.pedri-fr.com from his youth in the Canary Islands to becoming a world-class star in Barcelona, ??with international success and recognition.
Throughout this grand design of things you’ll secure a B- with regard to hard work. Where exactly you lost me personally was in your particulars. You know, people say, the devil is in the details… And it could not be more true in this article. Having said that, let me reveal to you just what did give good results. Your authoring is definitely extremely persuasive and that is probably why I am taking the effort in order to comment. I do not really make it a regular habit of doing that. Next, even though I can notice the jumps in reason you make, I am definitely not confident of how you seem to connect the ideas which in turn help to make the conclusion. For right now I will subscribe to your position but trust in the foreseeable future you actually connect the facts much better.
Discover the journey of Charles Leclerc https://ferrari.charles-leclerc-fr.com, from young Monegasque driver to Ferrari Formula 1 leader, from his early years to his main achievements within the team.
Discover Pierre Gasly’s https://alpine.pierre-gasly.com journey through the world of Formula 1, from his beginnings with Toro Rosso to his extraordinary achievements with Alpine.
Leroy Sane’s https://bavaria.leroy-sane-ft.com success story at FC Bayern Munich: from adaptation to influence on the club’s results. Inspiration for hard work and professionalism in football.
From childhood teams to championship victories, the path to success with the Los Angeles Lakers https://los-angeles-lakers.lebron-james-fr.com requires not only talent, but also undeniable dedication and work.
Discover the story of Rudy Gobert https://minnesota-timberwolves.rudy-gobert.biz, the French basketball player whose defensive play and leadership transformed the Minnesota Timberwolves into a powerhouse NBA team.
ProNerve 6 nerve relief formula stands out due to its advanced formula combining natural ingredients that have been specifically put together for the exceptional health advantages it offers.
The story of the Moroccan footballer https://al-hilal.yassine-bounou.com, who became a star at Al-Hilal, traces his journey from the streets of Casablanca to international football stardom and his personal development.
Victor Wembanyama’s travel postcard https://san-antonio-spurs.victor-wembanyama.biz from his career in France to his impact in the NBA with the San Antonio Spurs.
The history of Michael Jordan’s Chicago Bulls https://chicago-bulls.michael-jordan-fr.com extends from his rookie in 1984 to a six-time NBA championship.
Neymar https://al-hilal.neymar-fr.com at Al-Hilal: his professionalism and talent inspire young people players, taking the club to new heights in Asian football.
Golden State Warriors success story https://golden-state-warriors.stephen-curry-fr.com Stephen Curry: From becoming a leader to creating a basketball dynasty that redefined the game.
Hello there! This post couldn’t be written much better! Going through this post reminds me of my previous roommate! He always kept preaching about this. I will send this post to him. Pretty sure he’ll have a good read. Thank you for sharing!
[url=https://pin-up-casino-no.biz]pin up no[/url]
Plasser innsatsen din hos pinup online – mest elite bookmaker
pinup
[url=http://pin-up-casino-sv.biz]Pinup casino[/url]
Placera ditt spel hos pin up online – mycket elite bookmaker
Pin up
The password administration problem is more likely
to grow as Net functions built around cloud computing exchange the necessity for a lot of locally put
in utilities. As we speak’s password management solutions take these Internet and cell
challenges into consideration. Later, we’ll take an in depth take
a look at their dangers.
[url=https://pin-up-casino-ar.biz]online casino[/url]
Place your bet at pin up online – most prestigious bookmaker
Pinup ar
[url=http://intranet.supportedby.candidatis.eu/cache.php?url=https://pin-up-casino-us.biz]online casino[/url]
Place your bet at pinup online – direct prestigious bookmaker
Pin up
[url=https://pin-up-casino-no.biz]pin up[/url]
Plasser innsatsen din hos pinup online – mest palitelig bookmaker
pinup casino
[url=https://pin-up-casino-sv.biz]Pin up[/url]
Placera ditt spel hos pin up online – mest prestigeious bookmaker
Pin up sv
Замена венцов красноярск
Gerakl24: Опытная Смена Основания, Венцов, Покрытий и Перемещение Строений
Организация Геракл24 занимается на выполнении комплексных работ по реставрации основания, венцов, покрытий и перемещению домов в населённом пункте Красноярск и за пределами города. Наша группа квалифицированных экспертов гарантирует превосходное качество выполнения всех видов ремонтных работ, будь то древесные, каркасные, кирпичные или бетонные дома.
Плюсы работы с Геракл24
Профессионализм и опыт:
Весь процесс выполняются исключительно опытными специалистами, с многолетним большой практику в направлении строительства и восстановления строений. Наши мастера профессионалы в своем деле и реализуют проекты с безупречной точностью и вниманием к деталям.
Комплексный подход:
Мы предоставляем разнообразные услуги по ремонту и реконструкции строений:
Смена основания: усиление и реставрация старого основания, что гарантирует долговечность вашего здания и устранить проблемы, связанные с оседанием и деформацией строения.
Замена венцов: замена нижних венцов деревянных домов, которые наиболее часто подвергаются гниению и разрушению.
Смена настилов: установка новых полов, что существенно улучшает внешний облик и функциональность помещения.
Перенос строений: качественный и безопасный перенос строений на новые места, что обеспечивает сохранение строения и избежать дополнительных затрат на создание нового.
Работа с различными типами строений:
Древесные строения: восстановление и укрепление деревянных конструкций, обработка от гниения и насекомых.
Дома с каркасом: усиление каркасных конструкций и реставрация поврежденных элементов.
Дома из кирпича: восстановление кирпичной кладки и укрепление стен.
Бетонные дома: восстановление и укрепление бетонных структур, ремонт трещин и дефектов.
Надежность и долговечность:
Мы применяем только высококачественные материалы и новейшее оборудование, что гарантирует долгий срок службы и прочность всех выполненных задач. Все наши проекты проходят строгий контроль качества на каждом этапе выполнения.
Индивидуальный подход:
Мы предлагаем каждому клиенту персонализированные решения, учитывающие все особенности и пожелания. Мы стараемся, чтобы конечный результат полностью соответствовал вашим ожиданиям и требованиям.
Почему выбирают Геракл24?
Работая с нами, вы приобретете надежного партнера, который берет на себя все заботы по ремонту и реставрации вашего дома. Мы обеспечиваем выполнение всех работ в установленные сроки и с соблюдением всех строительных норм и стандартов. Выбрав Геракл24, вы можете не сомневаться, что ваше здание в надежных руках.
Мы всегда готовы проконсультировать и дать ответы на все вопросы. Свяжитесь с нами, чтобы обсудить детали и получить больше информации о наших услугах. Мы сохраним и улучшим ваш дом, сделав его уютным и безопасным для долгого проживания.
Gerakl24 – ваш выбор для реставрации и ремонта домов в Красноярске и области.
[url=https://pin-up-casino-ar.biz]Pin up casino[/url]
Place your bet at pin up online – direct reliable bookmaker
Pinup casino
[url=http://intranet.supportedby.candidatis.eu/cache.php?url=https://pin-up-casino-us.biz]online casino[/url]
Place your bet at pinup online – very elite bookmaker
Pin up
Del Mar Energy Inc is an international industrial holding company engaged in the extraction of oil, gas, and coal
The success story of the French footballer https://juventus.thierry-henry.biz at Juventus: from his career at the club to leadership on the field , becoming a legend and a source of inspiration for youth.
The story of the great Kobe Bryant https://los-angeles-lakers.kobe-bryant-fr.com with ” Los Angeles Lakers: his path to the championship, his legendary achievements.
Novak Djokovic’s https://tennis.novak-djokovic-fr.biz journey from childhood to the top of world tennis: early years, first victories, dominance and influence on the sport.
Find out the story of Jon Jones https://ufc.jon-jones-fr.biz in the UFC: his triumphs, records and controversies, which made him one of the greatest fighters in the MMA world.
En utilisant le Code promo 1xbet aujourd’hui, vous pouvez beneficier d’une augmentation de 100% en plus du bonus de bienvenue standard. Selon votre emplacement geographique, vous recevrez un bonus de 100%, 200% ou 300%, bonus 130$. Ce bonus est ensuite divise en deux parties, dont la moitie est utilisable pour les paris sportifs et l’autre moitie pour le casino. Avant de pouvoir retirer vos fonds, vous devrez jouer le montant du bonus 5 fois pour les paris sportifs combines et 30 fois pour les jeux de casino. Les nouveaux utilisateurs devront probablement verifier leur compte en fournissant un passeport ou un permis de conduire dans le cadre d’une verification KYC avant de pouvoir effectuer un retrait.
[url=http://couponsanddiscouts.com/ab//https://pin-up-casino-fi.biz]Pin up[/url]
[url=http://ipv4.t.me/s/worldcasinonet/url?sa=t&source=web&rct=j&url=https://pin-up-casino-fi.biz]Pin up[/url]
[url=http://www.iidajc.org/mt/mt4i.cgi?id=5&mode=redirect&no=8&ref_eid=4&url=https://pin-up-casino-fi.biz]Pin up[/url]
[url=http://mega-pro.ru/bitrix/redirect.php?event1=&event2=&event3=&goto=https://pin-up-casino-fi.biz]Pin up[/url]
[url=http://orphansandkingdoms.com/out/screenings/13628?minimal=1&ab=https://pin-up-casino-fi.biz]Pin up[/url]
[url=http://www.domywife.com/cgi-bin/ucj/c.cgi?url=https://pin-up-casino-fi.biz]Pin up[/url]
[url=http://misc.symbaloo.com/redirect.php?network=tradetracker&campaignID=480&url=https://pin-up-casino-fi.biz]Pin up[/url]
[url=http://www.v063.ru/bitrix/rk.php?goto=https://pin-up-casino-fi.biz]Pin up[/url]
[url=http://www.viagginrete-it.it/urlesterno.asp?url=https://pin-up-casino-fi.biz]Pin up[/url]
[url=http://www.gratisporr.org/ept/out.php?f=1&pct=50&url=/video/166869/Black-amateur-takes-it-in-the-ass-in-1st-amateur-vidhttps://pin-up-casino-fi.biz]Pin up[/url]
[url=http://www.yasni.com/go.php?to=https://pin-up-casino-fi.biz]Pin up[/url]
[url=http://viet-house.ru/bitrix/redirect.php?event1=&event2=&event3=&goto=https://pin-up-casino-fi.biz]Pin up[/url]
[url=http://www.ohremedia.cz/advertisementClick?id=326&link=https://pin-up-casino-fi.biz]Pin up[/url]
[url=http://www.igimu.com/link.php?url=https://pin-up-casino-fi.biz]Pin up[/url]
[url=http://www.vtn.com.br/lazer-e-entretenimento/museus/museu.php?museu=Galeria%20de%20Arte%20de%20Nova%20Gales%20do%20Sul&site=https://pin-up-casino-fi.biz]Pin up[/url]
Aseta panoksesi pin up nyt – useim luotettava vedonvalittaja
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
[url=http://muznavigator.com/bitrix/redirect.php?goto=https://pin-up-casino-fi.biz]Pin up[/url]
[url=http://messengerzerner.com.au/?URL=https://pin-up-casino-fi.biz]Pin up[/url]
[url=http://images.google.com.ni/url?q=https://pin-up-casino-fi.biz]Pin up[/url]
[url=http://lukas10m4j.ka-blogs.com.xx3.kz/go.php?url=https://pin-up-casino-fi.biz]Pin up[/url]
[url=http://mangarockapk88529.jaiblogs.com.xx3.kz/go.php?url=https://pin-up-casino-fi.biz]Pin up[/url]
[url=http://maps.google.co.kr/url?q=https://pin-up-casino-fi.biz]Pin up[/url]
[url=http://parkfuels.com.au/?URL=https://pin-up-casino-fi.biz]Pin up[/url]
[url=http://jonath.co.uk/htdocs/blog/index.php?exit=https://pin-up-casino-fi.biz]Pin up[/url]
[url=http://pretparken.be/nl/telparkexit.asp?url=https://pin-up-casino-fi.biz]Pin up[/url]
[url=http://hobbyone.ru/bitrix/redirect.php?goto=https://pin-up-casino-fi.biz]Pin up[/url]
[url=http://souztransrus.ru/bitrix/redirect.php?event1=&event2=&event3=&goto=https://pin-up-casino-fi.biz]Pin up[/url]
[url=http://vivrussia.ru/bitrix/rk.php?goto=https://pin-up-casino-fi.biz]Pin up[/url]
[url=http://smartvssmart.blogspot.com.au/search/?label=https://pin-up-casino-fi.biz]Pin up[/url]
[url=http://islamicwiki.in.xx3.kz/go.php?url=https://pin-up-casino-fi.biz]Pin up[/url]
[url=http://www.rayfilm.cz/cs/download/redir.php?url=https://pin-up-casino-fi.biz]Pin up[/url]
Aseta panoksesi pinup online – suorain luotettava vedonvalittaja
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Pin up
Gerakl24: Квалифицированная Реставрация Основания, Венцов, Полов и Передвижение Зданий
Фирма Gerakl24 занимается на предоставлении полных работ по реставрации фундамента, венцов, настилов и перемещению зданий в месте Красноярск и в окрестностях. Наша группа профессиональных специалистов обещает высокое качество выполнения различных типов ремонтных работ, будь то древесные, с каркасом, кирпичные или из бетона дома.
Достоинства сотрудничества с Геракл24
Профессионализм и опыт:
Все работы выполняются только высококвалифицированными специалистами, с обладанием большой практику в сфере возведения и ремонта зданий. Наши мастера эксперты в своей области и выполняют работу с безупречной точностью и вниманием к деталям.
Полный спектр услуг:
Мы предоставляем разнообразные услуги по реставрации и восстановлению зданий:
Реставрация фундамента: замена и укрепление фундамента, что позволяет продлить срок службы вашего строения и устранить проблемы, вызванные оседанием и деформацией.
Смена венцов: реставрация нижних венцов из дерева, которые чаще всего подвергаются гниению и разрушению.
Установка новых покрытий: установка новых полов, что значительно улучшает внешний облик и функциональные характеристики.
Перемещение зданий: безопасное и надежное перемещение зданий на другие участки, что помогает сохранить здание и избежать дополнительных затрат на возведение нового.
Работа с любыми типами домов:
Дома из дерева: восстановление и укрепление деревянных конструкций, защита от гниения и вредителей.
Каркасные строения: укрепление каркасов и замена поврежденных элементов.
Кирпичные строения: реставрация кирпичной кладки и усиление стен.
Дома из бетона: ремонт и укрепление бетонных конструкций, ремонт трещин и дефектов.
Качество и прочность:
Мы используем только проверенные материалы и современное оборудование, что гарантирует долгий срок службы и прочность всех выполненных задач. Все проекты подвергаются строгому контролю качества на каждом этапе выполнения.
Персонализированный подход:
Мы предлагаем каждому клиенту подходящие решения, учитывающие все особенности и пожелания. Мы стараемся, чтобы итог нашей работы полностью соответствовал вашим запросам и желаниям.
Почему стоит выбрать Геракл24?
Обратившись к нам, вы получаете надежного партнера, который возьмет на себя все хлопоты по ремонту и реконструкции вашего строения. Мы гарантируем выполнение всех работ в сроки, оговоренные заранее и с соблюдением всех правил и норм. Выбрав Геракл24, вы можете не сомневаться, что ваше строение в надежных руках.
Мы предлагаем консультацию и ответить на ваши вопросы. Звоните нам, чтобы обсудить ваш проект и получить больше информации о наших услугах. Мы поможем вам сохранить и улучшить ваш дом, сделав его уютным и безопасным для долгого проживания.
Геракл24 – ваш партнер по реставрации и ремонту домов в Красноярске и окрестностях.
https://gerakl24.ru/поднять-дом-красноярск/
Whether or not you live in Madeira Seashore, Florida,
snowbird here in the winter time, or are visiting for a weekend, the charming
small seaside city in Tampa Bay affords some unique purchasing locations – excellent for
picking up gifts for associates or for your self! Healthcare
in Daytona Seashore is dominated by Halifax Well being (previously known as Halifax Hospital).
Urban design plays an important position in shaping the mental
health and nicely-being of individuals dwelling in cities.
Assist your youngsters design this funny rock that will
make you roll with laughter each time you take a look at it.
By utilizing the web site for towing info, you may entry present data and
assets that may assist you make informed selections regarding your towing requirements.
Remember to carry and lower with your legs, keep your ft
shoulder-width apart, work slowly and ask a buddy to
assist — handling something as large and awkward as a mattress shouldn’t be a one-man job.
Whereas many new mattresses no longer require flipping to
keep them in good condition, it’s possible you’ll find you continue to have to rotate your mattress twice a yr.
Beds and mattresses ship more than 714,000 people to the emergency
department each year. An estimated eight out of 10 patients who visit the
emergency room because of MVAs are treated and launched.
Carlos Alcaraz https://tennis.carlos-alcaraz-fr.biz from a talented junior to the ATP top 10. His rise is the result of hard work, support and impressive victories at major world tournaments.
Jannik Sinner https://tennis.jannik-sinner-fr.biz an Italian tennis player, went from starting his career to entering the top 10 of the ATP, demonstrating unique abilities and ambitions in world tennis.
The fascinating story of Daniil Medvedev’s https://tennis.daniil-medvedev-fr.biz rise to world number one. Find out how a Russian tennis player quickly broke into the elite and conquered the tennis Olympus.
Discover Casper Ruud’s https://tennis.casper-ruud-fr.com journey from his Challenger debut to the top 10 of the world tennis rankings. A unique success.
The fascinating story of Alexander Zverev’s https://tennis.alexander-zverev-fr.biz rapid rise from a junior star to one of the leaders of modern tennis.
[url=https://accutaneiso.com/]generic accutane online[/url]
In this text, we’ll discover these enigmatic areas in our solar system.
Explore the links on the subsequent page to be taught much more
about humanity’s future. Warfare and self-destruction may
nonetheless pose a threat to humanity’s survival, but ecological issues will likely be a thing of the previous.
We’d even encounter an alien type II civilization long earlier than we obtain that level ourselves.
By 7010 C.E., humanity may obtain management over planetary or even stellar energy.
7010, then it can nonetheless have the flexibility to govern and control atmospheric and
geothermal forces. Different theorized kind II feats embody interstellar travel and the flexibility to move
entire planets — and all this on prime of whatever breakthroughs have occurred in genetics and computing.
Type II civilizations can summon the facility of a whole
star system. Reaching Type II status would allow interstellar travel, the power to maneuver complete planets,
and the potential to harness the vitality of a whole star system.
The Kardashev Scale categorizes civilizations
primarily based on their capacity to harness energy.
Asking questions are in fact good thing if you are not understanding anything completely, however
this post gives nice understanding yet.
Normally, heirs can’t travel collectively, but William chooses to travel along with his children. After years of relationship, and some months of separation, when did William finally pop the
question? Take this quiz to search out out whether you’d make it past the first question! However, most people remember
the unique format, which began with the $100 query and ended with the $1 million question. After this, their relationship was followed so intently that
folks started taking bets, like legitimately betting, on when the
two would get engaged. Then let’s get this social gathering began. The event was the brainchild of then Democratic Senator Gaylord Nelson of Wisconsin, and it was a watershed second for the rising U.S.
Meredith Viera hosted from 2002 to 2013. Then she passed the reigns to Cedric the
Entertainer, who was adopted by Terry Crews. First,
you are going to want to find out who sells CBD oil that is going to be just right for you.
Plus, it is not like he could meet anybody who does not
know he is married. Try to recollect what you did
that day that may affect your sleep and you’ll know the way to place an end to this downside.
[u][b] Привет![/b][/u]
Купить диплом о высшем образовании.
Мы предлагаем заказать диплом в высочайшем качестве, неотличимый от оригинального документа без участия специалиста высокой квалификации со специальным оборудованием.
[b]Где приобрести диплом по необходимой специальности?[/b]
http://pdlspd.listbb.ru/viewtopic.php?f=3&t=409
[b]Удачи![/b]
[u][b] Добрый день![/b][/u]
Мы можем предложить дипломы психологов, юристов, экономистов и любых других профессий по выгодным тарифам.
Мы можем предложить документы техникумов, которые расположены на территории всей России. Можно купить качественный диплом за любой год, включая сюда документы СССР. Дипломы и аттестаты выпускаются на бумаге высшего качества. Это дает возможность делать настоящие дипломы, которые не отличить от оригиналов. Они будут заверены всеми обязательными печатями и штампами.
Гарантируем, что при проверке документа работодателями, подозрений не возникнет.
[b]Где приобрести диплом специалиста?[/b]
[url=http://apple.ibord.ru/viewtopic.php?id=13543]laver.listbb.ru/viewtopic.php?f=3&t=821[/url]
You made some good points there. I looked on the web to find out more about the issue and found most people will go along with your views on this website.
The legendary boxing world champion Mike Tyson https://ufc.mike-tyson-fr.biz made an unexpected transition to the UFC in 2024, where he rose to the top, becoming the oldest heavyweight champion.
The powerful story of Conor McGregor’s https://ufc.conor-mcgregor-fr.biz rise to a two-division UFC championship that forever changed the landscape of mixed martial arts.
[url=https://itretinoin.online/]buy retin a cream nz[/url]
The fascinating story of how Lewis Hamilton https://mercedes.lewis-hamilton-fr.biz became a seven-time Formula 1 world champion after signing with Mercedes.
The story of Fernando Alonso https://formula-1.fernando-alonso-fr.com in Formula 1: a unique path to success through talent, tenacity and strategic decisions, inspiring and exciting.
The fascinating story of the creation and rapid growth of Facebook https://facebook.mark-zuckerberg-fr.biz under the leadership of Mark Zuckerberg, who became one of the most influential technology entrepreneurs of our time.
bookmarked!!, I love your website!
NetTruyen ZZZ: Nền tảng đọc truyện tranh trực tuyến dành cho mọi lứa tuổi
NetTruyen ZZZ là nền tảng đọc truyện tranh trực tuyến miễn phí với số lượng truyện tranh lên đến hơn 30.000 đầu truyện với chất lượng hình ảnh và tốc độ tải cao. Nền tảng được xây dựng với mục tiêu mang đến cho người đọc những trải nghiệm đọc truyện tranh tốt nhất, đồng thời tạo dựng cộng đồng yêu thích truyện tranh sôi động và gắn kết với hơn 11 triệu thành viên (tính đến tháng 7 năm 2024).
NetTruyen ZZZ – Kho tàng truyện tranh phong phú:
NetTruyen ZZZ sở hữu kho tàng truyện tranh khổng lồ với hơn 30.000 đầu truyện thuộc nhiều thể loại khác nhau như:
● Manga: Những bộ truyện tranh Nhật Bản với nhiều thể loại phong phú như lãng mạn, hành động, hài hước, v.v.
● NetTruyen anime: Hàng ngàn bộ truyện tranh anime chọn lọc được đăng tải đều đặn trên NetTruyen ZZZ được chuyển thể từ phim hoạt hình Nhật Bản với nội dung hấp dẫn và hình ảnh đẹp mắt.
● Truyện manga: Hơn 10.000 bộ truyện tranh manga hay nhất được đăng tải đầy đủ trên NetTruyen ZZZ.
● Truyện manhua: Hơn 5000 bộ truyện tranh manhua được đăng tải trọn bộ đầy đủ trên NetTruyen ZZZ.
● Truyện manhwa: Những bộ truyện tranh manhwa Hàn Quốc được yêu thích nhất có đầy đủ trên NetTruyen với cốt truyện lôi cuốn và hình ảnh bắt mắt cùng với nét vẽ độc đáo và nội dung đa dạng.
● Truyện ngôn tình: Những câu chuyện tình yêu lãng mạn, ngọt ngào và đầy cảm xúc.
● Truyện trinh thám: Những câu chuyện ly kỳ, bí ẩn và đầy lôi cuốn xoay quanh các vụ án và quá trình phá án.
● Truyện tranh xuyên không: Những câu chuyện về những nhân vật du hành thời gian hoặc không gian đến một thế giới khác.
NetTruyen ZZZ không ngừng cập nhật những bộ truyện tranh mới nhất và hot nhất trên thị trường, đảm bảo mang đến cho bạn đọc những trải nghiệm đọc truyện mới mẻ và thú vị nhất.
Chất lượng hình ảnh và nội dung đỉnh cao tại NetTruyenZZZ:
Với hơn 30 triệu lượt truy cập hằng tháng, NetTruyen ZZZ luôn chú trọng vào chất lượng hình ảnh và nội dung của các bộ truyện tranh được đăng tải trên nền tảng. Hình ảnh được hiển thị sắc nét, rõ ràng, không bị mờ hay vỡ ảnh. Nội dung được dịch thuật chính xác, dễ hiểu và giữ nguyên vẹn ý nghĩa của tác phẩm gốc.
NetTruyen ZZZ hợp tác với đội ngũ dịch giả và biên tập viên chuyên nghiệp, giàu kinh nghiệm để đảm bảo chất lượng bản dịch tốt nhất. Nền tảng cũng có hệ thống kiểm duyệt nội dung nghiêm ngặt để đảm bảo nội dung lành mạnh, phù hợp với mọi lứa tuổi.
Trải nghiệm đọc truyện mượt mà, tiện lợi:
NetTruyen ZZZ được thiết kế với giao diện đẹp mắt, thân thiện với người dùng và dễ dàng sử dụng. Bạn đọc có thể đọc truyện tranh trên mọi thiết bị, từ máy tính, điện thoại thông minh đến máy tính bảng. Nền tảng cũng cung cấp nhiều tính năng tiện lợi như:
● Tìm kiếm truyện tranh theo tên, tác giả, thể loại, v.v.
● Lưu truyện tranh yêu thích để đọc sau.
● Đánh dấu trang để dễ dàng quay lại vị trí đang đọc.
● Chia sẻ truyện tranh với bạn bè.
● Tham gia bình luận và thảo luận về truyện tranh.
NetTruyen ZZZ luôn nỗ lực để mang đến cho bạn đọc những trải nghiệm đọc truyện mượt mà, tiện lợi và thú vị nhất.
Định hướng phát triển:
NetTruyen ZZZ cam kết không ngừng phát triển và hoàn thiện để trở thành nền tảng đọc truyện tranh trực tuyến tốt nhất dành cho bạn đọc tại Việt Nam. Nền tảng sẽ tiếp tục cập nhật những bộ truyện tranh mới nhất và hot nhất trên thị trường thế giới, đồng thời nâng cao chất lượng hình ảnh và nội dung. NetTruyen ZZZ cũng sẽ phát triển thêm nhiều tính năng mới để mang đến cho bạn đọc những trải nghiệm đọc truyện tốt nhất.
NetTruyen ZZZ luôn đặt lợi ích của bạn đọc lên hàng đầu. Nền tảng cam kết:
● Cung cấp kho tàng truyện tranh khổng lồ và đa dạng với chất lượng hình ảnh và nội dung đỉnh cao.
● Mang đến cho bạn đọc những trải nghiệm đọc truyện mượt mà, tiện lợi và thú vị nhất.
● Luôn lắng nghe ý kiến phản hồi của bạn đọc và không ngừng cải thiện để mang đến dịch vụ tốt nhất.
NetTruyen ZZZ hy vọng sẽ trở thành người bạn đồng hành không thể thiếu của bạn trong hành trình khám phá thế giới truyện tranh đầy màu sắc.
Kết nối với NetTruyen ZZZ ngay hôm nay để tận hưởng những trải nghiệm đọc truyện tuyệt vời.
Kim Kardashian’s https://the-kardashians.kim-kardashian-fr.com incredible success story, from sex scandal to pop culture icon and billion-dollar fortune.
Max Verstappen and Red Bull Racing’s https://red-bull-racing.max-verstappen-fr.com path to success in Formula 1. A story of talent, determination and team support leading to a championship title.
Une ascension fulgurante au pouvoir Donald Trump https://usa.donald-trump-fr.com et son empire commercial
The astonishing story of Emmanuel Macron’s https://president-of-france.emmanuel-macron-fr.com political rise from bank director to the highest office in France.
The story of Joe Biden’s https://president-of-the-usa.joe-biden-fr.com triumphant journey, overcoming many obstacles on his path to the White House and becoming the 46th President of the United States.
Замена венцов красноярск
Геракл24: Профессиональная Замена Основания, Венцов, Настилов и Передвижение Зданий
Компания Геракл24 специализируется на предоставлении всесторонних работ по замене фундамента, венцов, покрытий и перемещению строений в городе Красноярском регионе и за пределами города. Наш коллектив профессиональных экспертов обеспечивает превосходное качество исполнения различных типов реставрационных работ, будь то из дерева, с каркасом, кирпичные постройки или из бетона дома.
Достоинства сотрудничества с Gerakl24
Квалификация и стаж:
Каждая задача осуществляются только опытными специалистами, с обладанием долгий практику в сфере создания и ремонта зданий. Наши мастера эксперты в своей области и осуществляют задачи с высочайшей точностью и вниманием к деталям.
Комплексный подход:
Мы предоставляем разнообразные услуги по реставрации и ремонту домов:
Смена основания: укрепление и замена старого фундамента, что обеспечивает долгий срок службы вашего строения и предотвратить проблемы, вызванные оседанием и деформацией.
Реставрация венцов: замена нижних венцов деревянных домов, которые чаще всего подвержены гниению и разрушению.
Смена настилов: замена старых полов, что кардинально улучшает внешний вид и функциональность помещения.
Передвижение домов: безопасное и надежное перемещение зданий на новые локации, что помогает сохранить здание и предотвращает лишние расходы на строительство нового.
Работа с любыми типами домов:
Древесные строения: восстановление и защита деревянных строений, защита от гниения и вредителей.
Дома с каркасом: усиление каркасных конструкций и реставрация поврежденных элементов.
Кирпичные дома: реставрация кирпичной кладки и укрепление конструкций.
Бетонные дома: реставрация и усиление бетонных элементов, устранение трещин и повреждений.
Качество и прочность:
Мы используем лишь качественные материалы и новейшее оборудование, что обеспечивает долгий срок службы и надежность всех работ. Каждый наш проект подвергаются строгому контролю качества на всех этапах выполнения.
Персонализированный подход:
Каждому клиенту мы предлагаем подходящие решения, учитывающие ваши требования и желания. Мы стремимся к тому, чтобы конечный результат полностью соответствовал вашим запросам и желаниям.
Почему стоит выбрать Геракл24?
Сотрудничая с нами, вы найдете надежного партнера, который берет на себя все заботы по ремонту и реконструкции вашего строения. Мы обеспечиваем выполнение всех задач в установленные сроки и с соблюдением всех строительных норм и стандартов. Связавшись с Геракл24, вы можете быть уверены, что ваше здание в надежных руках.
Мы готовы предоставить консультацию и дать ответы на все вопросы. Звоните нам, чтобы обсудить детали вашего проекта и узнать о наших сервисах. Мы сохраним и улучшим ваш дом, обеспечив его безопасность и комфорт на долгие годы.
Геракл24 – ваш надежный партнер в реставрации и ремонте домов в Красноярске и за его пределами.
https://gerakl24.ru/поднять-дом-красноярск/
Everything is very open with a very clear clarification of the challenges. It was really informative. Your site is very helpful. Thanks for sharing.
code promo 1xbet aujourd’huidice 2024 tous les details sur les bonus de bienvenue. Enregistrez-vous des maintenant avec notre offre speciale 1xBet 2024 pour beneficier d’un bonus de bienvenue de 100% jusqu’a 130$. Tous les nouveaux joueurs recoivent un bonus de bienvenue de 1xBet pour la creation d’un compte avec un code promotionnel.
Parisian PSG https://paris.psg-fr.com is one of the most successful and ambitious football clubs in Europe. Find out how he became a global football superstar.
Olympique de Marseille https://liga1.marseilles-fr.com after several years in the shadows, once again becomes champion of France. How did they do it and what prospects open up for the club
Travel to the pinnacle of French football https://stadede-bordeaux.bordeaux-fr.org at the Stade de Bordeaux, where the passion of the game meets the grandeur of architecture.
The fascinating story of Gigi Hadid’s rise to Victoria’s Secret Angel https://victorias-secret.gigi-hadid-fr.com status and her journey to the top of the modeling industry.
The fascinating story of the creation and meteoric rise of Amazon https://amazon.jeff-bezos-fr.com from its humble beginnings as an online bookstore to its dominant force in the world of e-commerce.
[u][b] Здравствуйте![/b][/u]
Заказать диплом о высшем образовании
[b]Мы предлагаем[/b] быстро и выгодно приобрести диплом, который выполнен на оригинальной бумаге и заверен мокрыми печатями, штампами, подписями. Документ способен пройти любые проверки, даже при использовании специально предназначенного оборудования. Достигайте своих целей быстро и просто с нашим сервисом.
[b]Где купить диплом по актуальной специальности?[/b]
https://fbadult.com/blogs/3050/Диплом-на-заказ-качество-и-надежность
[u][b] Рады оказаться полезными![u][b].
I would like to show my thanks to this writer for rescuing me from such a instance. Because of looking throughout the world-wide-web and getting opinions which are not beneficial, I figured my life was well over. Living without the presence of solutions to the difficulties you have fixed as a result of your good short article is a critical case, and the kind which might have in a negative way damaged my entire career if I had not encountered your web site. Your good competence and kindness in maneuvering everything was important. I don’t know what I would’ve done if I had not encountered such a subject like this. I am able to now look ahead to my future. Thanks for your time so much for your reliable and amazing guide. I will not be reluctant to propose your blog post to any person who wants and needs guidance on this issue. [Reply]
диплом купить петрозаводск [url=https://diplomyx.com/]diplomyx.com[/url] .
What’s Taking place i’m new to this, I stumbled upon this I have discovered It absolutely useful and it has helped me out loads. I hope to give a contribution & assist different users like its helped me. Great job.
A fascinating story about how Elon Musk https://spacex.elon-musk-fr.com and his company SpaceX revolutionized space exploration, opening new horizons for humanity.
An exploration of Nicole Kidman’s https://watch.nicole-kidman-fr.com career, her notable roles, and her continued quest for excellence as an actress.
The inspiring story of Travis Scott’s https://yeezus.travis-scott-fr.com rise from emerging artist to one of modern hip-hop’s brightest stars through his collaboration with Kanye West.
How Taylor Swift https://midnights.taylor-swift-fr.com reinvented her sound and image on the intimate and reflective album “Midnights,” revealing new dimensions of her talent.
I intended to create you a little observation just to say thank you as before with the lovely techniques you’ve shown on this page. It was so surprisingly open-handed of people like you giving openly precisely what many of us might have sold as an electronic book to get some cash on their own, and in particular since you could possibly have tried it if you ever desired. These tactics as well worked to be the fantastic way to be aware that many people have the identical passion just like mine to grasp a lot more with regard to this matter. I know there are millions of more enjoyable situations ahead for individuals who see your blog post.
An fascinating discussion might be priced at comment. I’m sure that you simply write much more about this topic, it might not be a taboo subject but generally individuals are inadequate to dicuss on such topics. To another. Cheers
Explore the rich history and unrivaled atmosphere of the iconic Old Trafford Stadium https://old-trafford.manchester-united-fr.com, home of one of the world’s most decorated football clubs, Manchester United.
I was very happy to discover this site. I want to to thank you for ones time for this particularly fantastic read!! I definitely enjoyed every little bit of it and i also have you saved to fav to look at new stuff in your site.
You’re probably thinking since this is a studio comedy, everything will be wrapped up in a nice little package.
Hello there, I found your blog via Google while searching for a related topic, your web site came up, it looks great. I have bookmarked it in my google bookmarks.
The University of Chicago School Mathematics Project Memory Math – Memory matching card game for kids where they remove numerical cards from the playing field by pairing up a number with another card that has that many dots on it. Players can select levels where they do basic matching or match the results of math equations using common math operators Evaluate Exponents About Komodo – Komodo is a fun and effective way to boost primary maths skills. Designed for 5 to 11 year olds to use in the home, Komodo uses a little and often approach to learning maths (15 minutes, 3 to 5 times per week) that fits into the busy routine. Komodo users develop fluency and confidence in maths – without keeping them at the screen for long. One instructional challenge of the district has been finding fun, challenging, And relevant web-based programming to strengthen foundational skills. We have seen improvement in students’ math skills when they meet their individual First In Math goals. First In Math has been an MVP!
https://stalinarch.ru/wiki/index.php/Off_the_rails_online
Download more games Drawception is an excellent choice for playing with adults. In this multiplayer game, a player will receive a phrase like “flying sandwich” to draw. After, the AI will show the drawing to the second player, who will also attempt to write a descriptive phrase for that drawing. Similarly, the AI will display the descriptive word from the second player to the third player. The third player will attempt to draw the phrase. Notably, the players cannot write descriptive phrases in their drawings. The process continues until all participants guess a chance to draw a phrase or guess the drawing. Feel free to have students keep the same partners for all 11 rounds or you can have them switch up their partners from round to round.
is montenegro in the eu Kotor Montenegro
Единственная в России студия кастомных париков https://wigdealers.ru, где мастера индивидуально подбирают структуру волос и основу по форме головы, после чего стригут, окрашивают, делают укладку и доводят до идеала ваш будущий аксессуар.
The iconic Anfield https://enfield.liverpool-fr.com stadium and the passionate Liverpool fans are an integral part of English football culture.
An exploration of the history of Turin’s https://turin.juventus-fr.org iconic football club – Juventus – its rivalries, success and influence on Italian football.
The new Premier League https://premier-league.chelsea-fr.com season has gotten off to an intriguing start, with a new-look Chelsea looking to return to the Champions League, but serious challenges lie ahead.
Hiya, I’m really glad I’ve found this information. Nowadays bloggers publish only about gossips and net and this is actually frustrating. A good web site with interesting content, that’s what I need. Thanks for keeping this web-site, I will be visiting it. Do you do newsletters? Can’t find it.
Hello there, just became aware of your blog through Google, and found that it’s truly informative. I’m going to watch out for brussels. I’ll be grateful if you continue this in future. Many people will be benefited from your writing. Cheers!
It’s difficult to get knowledgeable individuals within this topic, however, you be understood as you know what you are referring to! Thanks
I just wanted to type a quick comment to thank you for some of the splendid items you are showing on this site. My extended internet search has finally been recognized with extremely good facts to go over with my visitors. I ‘d assert that many of us visitors are truly endowed to be in a fine network with many marvellous people with interesting hints. I feel rather privileged to have seen your entire website page and look forward to so many more pleasurable moments reading here. Thanks a lot again for a lot of things.
This is the perfect web site for anybody who would like to understand this topic. You understand so much its almost tough to argue with you (not that I really would want to…HaHa). You definitely put a fresh spin on a topic that’s been written about for many years. Wonderful stuff, just great.
You sure enough have some agreeable beliefs and aspects. Your journal render a pure expression at the subject.
I’ve been searching for this information and at last located your post. Your own posts are aiding me in uncovering some needed specifics. Make sure you continue your writing.
Tyson Fury https://wbc.tyson-fury-fr.com is the undefeated WBC world champion and reigns supreme in boxing’s heavyweight division.
Explore the career and significance of Monica Bellucci https://malena.monica-bellucci-fr.com in Malena (2000), which explores complex themes of beauty and human strength in wartime.
Inter Miami FC https://mls.inter-miami-fr.com has become a major player in MLS thanks to its star roster, economic growth and international influence.
Discover Rafael Nadal’s https://mls.inter-miami-fr.com impressive rise to the top of world tennis, from his debut to his career Grand Slam victory.
The story of Kanye West https://the-college-dropout.kanye-west-fr.com, starting with his debut album “The College Dropout,” which changed hip-hop and became his cultural legacy.
[url=https://eflomax.online/]flomax women[/url]
Преимущества аренды склада https://bro-droider.ru/2024/07/04/аренда-склада-от-собственника-в-новой/, как аренда складских помещений может улучшить ваш бизнес
The fascinating story of the phenomenal rise and meteoric fall of Diego Maradona https://napoli.diegomaradona.biz, who became a cult figure at Napoli in the 1980s.
Rivaldo, or Rivaldo https://barcelona.rivaldo-br.com, is one of the greatest football players to ever play for Barcelona.
A fascinating story about Brazilian veteran Thiago Silva’s https://chelsea.thiago-silva.net difficult path to the top of European football as part of Chelsea London.
Explore the remarkable journey of Vinicius Junior https://real-madrid.vinicius-junior.net, the Brazilian prodigy who conquered the world’s biggest stage with his dazzling skills and unparalleled ambition at Real Madrid.
[url=http://dexamethasoneff.online/]order dexamethasone[/url]
Saved as a favorite, I really like your website!
I used to be able to find good information from your blog articles.
Aw, this was an exceptionally good post. Taking the time and actual effort to create a really good article… but what can I say… I procrastinate a lot and don’t seem to get anything done.
Quelles methodes puis-je utiliser pour l’entree et la sortie?
Le bookmaker 1xbet met a la disposition des joueurs tous les moyens de paiement disponibles aujourd’hui.code promo 1xbet togo Vous pouvez faire un depot avec des cartes bancaires Visa et Mastercard, avec des portefeuilles electroniques, via des systemes de paiement, via des services bancaires par Internet, en utilisant les services des operateurs mobiles, sur des portefeuilles pour crypto – monnaie. Pour le retrait, il est recommande d’utiliser des cartes bancaires, des portefeuilles electroniques et des systemes de paiement. La liste des methodes de paiement se trouve dans la section «Paiements».
Spot on with this write-up, I absolutely think this site needs a great deal more attention. I’ll probably be returning to read through more, thanks for the information.
Cristiano Ronaldo https://al-nassr.cristianoronaldo-br.net one of the greatest football players of all time, begins a new chapter in his career by joining An Nasr Club.
The fascinating story of Marcus Rashford’s rise https://manchester-united.marcusrashford-br.com from academy youth to the main striker and captain of Manchester United. Read about his meteoric rise and colorful career.
The story of Luka Modric’s rise https://real-madrid.lukamodric-br.com from young talent to one of the greatest midfielders of his generation and a key player for the Royals.
From academy product to captain and leader of Real Madrid https://real-madrid.ikercasillas-br.com Casillas became one of the greatest players in the history of Real Madrid.
Follow Bernardo Silva’s impressive career https://manchester-city.bernardosilva.net from his debut at Monaco to to his status as a key player and leader of Manchester City.
A fascinating discussion is definitely worth comment. There’s no doubt that that you should publish more about this subject matter, it might not be a taboo matter but usually people do not speak about such topics. To the next! Best wishes.
рио бет казино регистрация Rio Bet Casino
вход Rio Bet Casino Rio Bet
реристрация Dragon Money Casino сайт драгон мани казино
Dragon Money Casino Dragon Money
Хотите научиться готовить самые изысканные и сложные торты? В этом https://v1.skladchik.org/tags/tort/ разделе вы найдете множество подробных пошаговых рецептов самых трендовых и известных тортов с возможностью получить их за сущие копейки благодаря складчине. Готовьте с удовольствием и открывайте для себя новые рецепты вместе с Skladchik.org
Everything is very open with a really clear clarification of the issues. It was really informative. Your site is useful. Thank you for sharing!
купить диплом о высшем образовании с проведением [url=diploms-x.com]diploms-x.com[/url] .
Лучшие пансионаты для пожилых людей https://ernst-neizvestniy.ru в Самаре – недорогие дома для престарелых в Самарской области
Пансионаты для пожилых людей https://moyomesto.ru в Самаре по доступным ценам. Специальные условия по уходу, индивидуальные программы.
The fascinating story of Sergio Ramos’ https://seville.sergioramos.net rise from Sevilla graduate to one of Real Madrid and Spain’s greatest defenders.
Ousmane Dembele’s https://paris-saint-germain.ousmanedembele-br.com rise from promising talent to key player for French football giants Paris Saint-Germain. An exciting success story.
An outstanding share! I have just forwarded this onto a co-worker who was doing a little homework on this. And he actually bought me lunch due to the fact that I found it for him… lol. So let me reword this…. Thanks for the meal!! But yeah, thanks for spending the time to talk about this subject here on your site.
https://artdaily.com/news/171650/Mp3Juice-Review–The-Pros-and-Cons-You-Need-to-Know
I blog quite often and I truly thank you for your information. This article has truly peaked my interest. I will book mark your site and keep checking for new details about once a week. I subscribed to your RSS feed too.
nettruyen
NetTruyen ZZZ: Nền tảng đọc truyện tranh trực tuyến dành cho mọi lứa tuổi
NetTruyen ZZZ là nền tảng đọc truyện tranh trực tuyến miễn phí với số lượng truyện tranh lên đến hơn 30.000 đầu truyện với chất lượng hình ảnh và tốc độ tải cao. Nền tảng được xây dựng với mục tiêu mang đến cho người đọc những trải nghiệm đọc truyện tranh tốt nhất, đồng thời tạo dựng cộng đồng yêu thích truyện tranh sôi động và gắn kết với hơn 11 triệu thành viên (tính đến tháng 7 năm 2024).
NetTruyen ZZZ – Kho tàng truyện tranh phong phú:
NetTruyen ZZZ sở hữu kho tàng truyện tranh khổng lồ với hơn 30.000 đầu truyện thuộc nhiều thể loại khác nhau như:
● Manga: Những bộ truyện tranh Nhật Bản với nhiều thể loại phong phú như lãng mạn, hành động, hài hước, v.v.
● NetTruyen anime: Hàng ngàn bộ truyện tranh anime chọn lọc được đăng tải đều đặn trên NetTruyen ZZZ được chuyển thể từ phim hoạt hình Nhật Bản với nội dung hấp dẫn và hình ảnh đẹp mắt.
● Truyện manga: Hơn 10.000 bộ truyện tranh manga hay nhất được đăng tải đầy đủ trên NetTruyen ZZZ.
● Truyện manhua: Hơn 5000 bộ truyện tranh manhua được đăng tải trọn bộ đầy đủ trên NetTruyen ZZZ.
● Truyện manhwa: Những bộ truyện tranh manhwa Hàn Quốc được yêu thích nhất có đầy đủ trên NetTruyen với cốt truyện lôi cuốn và hình ảnh bắt mắt cùng với nét vẽ độc đáo và nội dung đa dạng.
● Truyện ngôn tình: Những câu chuyện tình yêu lãng mạn, ngọt ngào và đầy cảm xúc.
● Truyện trinh thám: Những câu chuyện ly kỳ, bí ẩn và đầy lôi cuốn xoay quanh các vụ án và quá trình phá án.
● Truyện tranh xuyên không: Những câu chuyện về những nhân vật du hành thời gian hoặc không gian đến một thế giới khác.
NetTruyen ZZZ không ngừng cập nhật những bộ truyện tranh mới nhất và hot nhất trên thị trường, đảm bảo mang đến cho bạn đọc những trải nghiệm đọc truyện mới mẻ và thú vị nhất.
Chất lượng hình ảnh và nội dung đỉnh cao tại NetTruyenZZZ:
Với hơn 30 triệu lượt truy cập hằng tháng, NetTruyen ZZZ luôn chú trọng vào chất lượng hình ảnh và nội dung của các bộ truyện tranh được đăng tải trên nền tảng. Hình ảnh được hiển thị sắc nét, rõ ràng, không bị mờ hay vỡ ảnh. Nội dung được dịch thuật chính xác, dễ hiểu và giữ nguyên vẹn ý nghĩa của tác phẩm gốc.
NetTruyen ZZZ hợp tác với đội ngũ dịch giả và biên tập viên chuyên nghiệp, giàu kinh nghiệm để đảm bảo chất lượng bản dịch tốt nhất. Nền tảng cũng có hệ thống kiểm duyệt nội dung nghiêm ngặt để đảm bảo nội dung lành mạnh, phù hợp với mọi lứa tuổi.
Trải nghiệm đọc truyện mượt mà, tiện lợi:
NetTruyen ZZZ được thiết kế với giao diện đẹp mắt, thân thiện với người dùng và dễ dàng sử dụng. Bạn đọc có thể đọc truyện tranh trên mọi thiết bị, từ máy tính, điện thoại thông minh đến máy tính bảng. Nền tảng cũng cung cấp nhiều tính năng tiện lợi như:
● Tìm kiếm truyện tranh theo tên, tác giả, thể loại, v.v.
● Lưu truyện tranh yêu thích để đọc sau.
● Đánh dấu trang để dễ dàng quay lại vị trí đang đọc.
● Chia sẻ truyện tranh với bạn bè.
● Tham gia bình luận và thảo luận về truyện tranh.
NetTruyen ZZZ luôn nỗ lực để mang đến cho bạn đọc những trải nghiệm đọc truyện mượt mà, tiện lợi và thú vị nhất.
Định hướng phát triển:
NetTruyen ZZZ cam kết không ngừng phát triển và hoàn thiện để trở thành nền tảng đọc truyện tranh trực tuyến tốt nhất dành cho bạn đọc tại Việt Nam. Nền tảng sẽ tiếp tục cập nhật những bộ truyện tranh mới nhất và hot nhất trên thị trường thế giới, đồng thời nâng cao chất lượng hình ảnh và nội dung. NetTruyen ZZZ cũng sẽ phát triển thêm nhiều tính năng mới để mang đến cho bạn đọc những trải nghiệm đọc truyện tốt nhất.
NetTruyen ZZZ luôn đặt lợi ích của bạn đọc lên hàng đầu. Nền tảng cam kết:
● Cung cấp kho tàng truyện tranh khổng lồ và đa dạng với chất lượng hình ảnh và nội dung đỉnh cao.
● Mang đến cho bạn đọc những trải nghiệm đọc truyện mượt mà, tiện lợi và thú vị nhất.
● Luôn lắng nghe ý kiến phản hồi của bạn đọc và không ngừng cải thiện để mang đến dịch vụ tốt nhất.
NetTruyen ZZZ hy vọng sẽ trở thành người bạn đồng hành không thể thiếu của bạn trong hành trình khám phá thế giới truyện tranh đầy màu sắc.
Kết nối với NetTruyen ZZZ ngay hôm nay để tận hưởng những trải nghiệm đọc truyện tuyệt vời.
The incredible success story of 20-year-old Florian Wirtz https://bayer-04.florianwirtz-br.com, who quickly joined the Bayer team and became one of the best young talents in the world.
The incredible story https://napoli.khvichakvaratskhelia-br.com of a young Georgian talent’s transformation into an Italian Serie A star. Khvicha Kvaraeshvili is a rising phenomenon in European football.
The compelling story of Alisson Becker’s https://bayer-04.florianwirtz-br.com meteoric rise from young talent to key figure in Liverpool’s triumphant era under Jurgen Klopp.
O meio-campista Rafael Veiga leva https://palmeiras.raphaelveiga-br.com o Palmeiras ao sucesso – o campeonato brasileiro e a vitoria na Copa Libertadores aos 24 anos.
Midfielder Rafael Veiga leads https://manchester-city.philfoden-br.com Palmeiras to success – the championship Brazilian and victory in the Copa Libertadores at the age of 24.
Saved as a favorite, I really like your blog!
In-depth articles about the most famous football players https://zenit-saint-petersburg.wendel-br.com, clubs and events. Learn everything about tactics, rules of the game and football history.
The rise of 20-year-old midfielder Jamal Musiala https://bavaria.jamalmusiala-br.com to the status of a winger in the Bayern Munich team. A story of incredible talent.
A historia da jornada triunfante de Anitta https://veneno.anitta-br.com de aspirante a cantora a uma das interpretes mais influentes da musica moderna, incluindo sua participacao na serie de TV “Veneno”.
Fabrizio Moretti https://the-strokes.fabriziomoretti-br.com the influential drummer of The Strokes, and his unique sound revolutionized the music scene, remaining icons of modern rock.
Selena Gomez https://calm-down.selenagomez-br.net the story from child star to global musical influence, summarized in hit “Calm Down”, with Rema.
Активация промокода: В процессе регистрации игрокам будет предложено ввести Промокод Чемпион. Введение этого кода активирует бонусы, предусмотренные для новых пользователей. Этот шаг критически важен для получения всех преимуществ, предлагаемых промокодом, включая фриспины и бонусы на депозит.
It’s difficult to find experienced people in this particular topic, but you sound like you know what you’re talking about! Thanks
[url=http://lyricamd.online/]lyrica cheapest price[/url]
child porn
1xBet offre precisement cela et vos bonus peuvent etre maximises en utilisant le meilleur code promo pour 1xbet 2024. Consultez simplement ci-dessous pour decouvrir ce qui vous attend en tant que nouveau client sur ce site de paris. Grace a ces connaissances, il est tout a fait logique de s’attendre a une serie de bonus de bienvenue attrayants pour les nouveaux joueurs provenant d’autres pays. Voici quelques exemples de ces pays : Burkina Faso, Ghana, Ouganda, Zambie, Cameroun, Senegal, Benin, Congo, Guinee, Cote d’Ivoire, Togo, Mali, etc.
After I initially commented I seem to have clicked on the -Notify me when new comments are added- checkbox and now each time a comment is added I get four emails with the same comment. Perhaps there is an easy method you can remove me from that service? Thank you.
The root of your writing whilst sounding agreeable at first, did not work perfectly with me after some time. Someplace within the paragraphs you managed to make me a believer unfortunately only for a very short while. I still have a problem with your jumps in assumptions and you might do well to fill in all those gaps. In the event that you actually can accomplish that, I could undoubtedly be impressed.
купить проведенный диплом [url=https://asxdiplomik.com/kupit-diplom-moskva/]купить проведенный диплом[/url] .
[u][b] Привет, друзья![/b][/u]
Купить диплом о высшем образовании
[b]Мы предлагаем[/b] выгодно приобрести диплом, который выполнен на оригинальном бланке и заверен мокрыми печатями, штампами, подписями. Наш документ способен пройти лубую проверку, даже при помощи специфических приборов. Достигайте цели максимально быстро с нашей компанией.
[b]Где купить диплом по актуальной специальности?[/b]
[url=http://kormushka48.ru/forum/user/15788//]kormushka48.ru/forum/user/15788/[/url]
[url=http://kids-news.ru/vash-put-k-uspehu-legalno-i-byistro/]kids-news.ru/vash-put-k-uspehu-legalno-i-byistro[/url]
[url=http://linkthere.club/read-blog/8168/]linkthere.club/read-blog/8168[/url]
[url=http://subscribe.ru/member/quick/]subscribe.ru/member/quick[/url]
[url=http://www.pets-ural.ru/content/forum/viewtopic.php?p=78013#78013/]www.pets-ural.ru/content/forum/viewtopic.php?p=78013#78013[/url]
Kobe Bryant https://los-angeles-lakers.kobebryant-br.net one of the greatest basketball players of all the times, left an indelible mark on the history of sport.
Bieber’s https://baby.justinbieber-br.com path to global fame began with his breakthrough success Baby, which became his signature song and one of the most popular music videos of all time.
In the world of professional tennis, the name of Gustavo Kuerten https://roland-garros.gustavokuerten.com is closely linked to one of the most prestigious Grand Slam tournaments – Roland Garros.
Achraf Hakimi https://paris-saint-germain.ashrafhakimi.net is a young Moroccan footballer who quickly reached the football elite European in recent years.
Ayrton Senna https://mclaren.ayrtonsenna-br.com is one of the greatest drivers in the history of Formula 1.
Hi, I do think this is an excellent blog. I stumbledupon it 😉 I will return yet again since i have book marked it. Money and freedom is the greatest way to change, may you be rich and continue to guide others.
[u][b] Добрый день![/b][/u]
Мы можем предложить документы ВУЗов, которые находятся в любом регионе России. Вы сможете заказать диплом от любого заведения, за любой год, включая сюда документы старого образца. Документы выпускаются на бумаге самого высшего качества. Это позволяет делать настоящие дипломы, не отличимые от оригинала. Они заверяются необходимыми печатями и штампами.
[b]Приобрести диплом о высшем образовании.[/b]
[url=http://chillibell.com/read-blog/36/]chillibell.com/read-blog/36[/url]
[b]Удачи![/b]
Spot on with this write-up, I seriously believe this amazing site needs a great deal more attention. I’ll probably be returning to see more, thanks for the information!
[u][b] Добрый день![/b][/u]
Мы предлагаем дипломы любой профессии по невысоким тарифам. Стоимость может зависеть от определенной специальности, года выпуска и университета.
Где купить диплом специалиста?
[b]Заказать диплом о высшем образовании[/b]
[url=http://landik-diploms-srednee.ru/kupit-diplom-v-kazani ]landik-diploms-srednee.ru/kupit-diplom-v-kazani [/url]
[b]Успешной учебы![/b]
[url=http://bactrim.company/]bactrim without prescription[/url]
[u][b] Привет, друзья![/b][/u]
[b]Купить документ[/b] о получении высшего образования вы сможете в нашей компании в столице.
[url=http://asxdiplomik24.ru/kupit-diplom-omsk/]asxdiplomik24.ru/kupit-diplom-omsk[/url]
[b]Успехов в учебе![/b]
[u][b] Привет![/b][/u]
[b]Официальная покупка школьного аттестата с упрощенным обучением в Москве [/b]
[url=http://ekonomimvmeste.ukrbb.net/viewtopic.php?f=8&t=57863/]ekonomimvmeste.ukrbb.net/viewtopic.php?f=8&t=57863[/url]
[u][b] Окажем помощь![u][b].
Anderson Silva https://killer-bees-muay-thai-college.andersonsilva.net was born in 1975 in Curitiba Brazil. From a young age he showed an interest in martial arts, starting to train in karate at the age of 5.
Daniel Alves https://paris-saint-germain.danielalves.net is a name that symbolizes the greatness of the world of football.
Bruno Miguel Borges Fernandes https://manchester-united.brunofernandes-br.com was born on September 8, 1994 in Maia, Portugal.
Rodrygo Silva de Goes https://real-madrid.rodrygo-br.com, known simply as Rodrygo, emerged as one of the the brightest young talents in world football.
Nuno Mendes https://paris-saint-germain.nuno-mendes.com, a talented Portuguese left-back, He quickly became one of the key figures in the Paris Saint-Germain (PSG) team.
Le code promo 1xbet cameroun, utilisez-le lors de l’inscription et obtenez un bonus de 200% jusqu’a 130$. Seuls les nouveaux joueurs peuvent obtenir le bonus. Ce contrat bonus est valable jusqu’au 31 decembre 2024. Apres le depot, le joueur recoit sur le compte bonus le montant des bonus pour les Paris de 100% du montant du depot, mais pas plus de $100. Pour recuperer le bonus recu, le joueur doit placer au moins cinq Paris dans les cinq jours suivants. Pour les Paris, vous devez faire un Express avec 3 evenements ou plus avec des cotes d’au moins 1,40.
Right here is the right webpage for everyone who would like to find out about this topic. You realize so much its almost tough to argue with you (not that I actually will need to…HaHa). You definitely put a brand new spin on a topic that’s been written about for ages. Wonderful stuff, just wonderful.
[url=http://accutaneiso.com/]accutane online canadian pharmacy[/url]
[u][b] Здравствуйте![/b][/u]
Где купить диплом специалиста?
Мы предлагаем быстро заказать диплом, который выполнен на оригинальной бумаге и заверен мокрыми печатями, водяными знаками, подписями официальных лиц. Документ способен пройти любые проверки, даже с применением профессионального оборудования. Достигайте цели быстро и просто с нашими дипломами.
[b]Приобрести диплом о высшем образовании.[/b]
[url=http://bizinhome.mn.co/posts/61837993/]bizinhome.mn.co/posts/61837993[/url]
Earvin “Magic” Johnson https://los-angeles-lakers.magicjohnson.biz is one of the most legendary basketball players in history. NBA history.
Vinicius Junior https://real-madrid.vinicius-junior-ar.com the Brazilian prodigy whose full name is Vinicius Jose Baixao de Oliveira Junior, has managed to win the hearts of millions of fans around the world in a short period of time.
Victor Osimhen https://napoli.victorosimhen-ar.com born on December 29, 1998 in Lagos, Nigeria, has grown from an initially humble player to one of the brightest strikers in modern football.
Toni Kroos https://real-madrid.tonikroos-ar.com the German midfielder known for his accurate passes and calmness on the field, has achieved remarkable success at one of the most prestigious football clubs in the world.
Robert Lewandowski https://barcelona.robertlewandowski-ar.com is one of the most prominent footballers of our time, and his move to Barcelona has become one of the most talked about topics in world football.
Как получить диплом о среднем образовании в Москве и других городах
[url=http://asxdiplomik.com/kupit-diplom-vracha/]asxdiplomik.com/kupit-diplom-vracha[/url]
If constructed appropriately, wildlife ponds can support a variety of dwelling issues, each plants and animals.
Wildlife photographers want a certain set of qualities in addition to sharp pictures expertise.
If the tank is small, make sure to choose fish that don’t need a
variety of aeration. After a radical cleansing, you can put a fish or two within the lava lamp.
Make sure that you put all deposits on a bank card so if fraud is concerned you can get your
money back. As an example, if you are injured and have a note from the physician, that’s a
chit that might get you mild obligation for every week.
The patent for the primary lava lamp was made with
these materials: “solidified globule of mineral oil, paraffin and a dye as well as paraffin wax or petroleum jell, ideally Ondina 17 with a mild paraffin, carbontetrachoride, a dye and the paraffin wax or petroleum jelly.” In response to lava lamp manufacturers,
the material inside is non-hazardous, but they do have the poison hotline quantity next to this data.
Properly then, mister or missus large shot, get comfy and let’s check your data of weird castles, loopy giant numbers and embargoed
snack foods. On the subsequent web page, we’ll get started with only a few geometric shapes.
An electronically controlled adaptive suspension started
with one in all three settings: tender, normal, or exhausting.
One in every of Kissmetrics’ signature features is the path Report, which tells you
the specific routes customers tend to make use of on your site.
Evaluate keyword ends in natural and paid search, study your opponents’ marketing strategies, learn the way a lot they spend on advertising, watch their each day position adjustments and discover different potential rivals
based mostly on keyword overlap together with your
site. It isn’t enough to construct an internet site, troubleshoot it continually, fill orders,
deal with prospects and create marketing campaigns.
Managerial potential in the scholars, where they exhibit management and delegation expertise, analytical
or crucial problem-fixing skills, advertising and
marketing skills, etc appeal to more employment opportunities.
An on the web pastime store Sydney will have a bigger choice of airsoft weapons,
radio management helicopters Sydney, angling enchantment as well as spinning rod as well as they’ll completely have these all at a a large quantity a lot more environment friendly expense on condition that they don’t have to pay the prices requested for to maintain a bodily establishment operating like the prices ought to pay the lease for the office as well as their electrical price.
Aw, this was an incredibly good post. Taking the time and actual effort to generate a superb article… but what can I say… I put things off a lot and never manage to get anything done.
можно ли сейчас купить диплом о высшем образовании [url=https://diplomasx.com/]можно ли сейчас купить диплом о высшем образовании[/url] .
You refer prospects to International Travel Int’l. It is an expertise to
travel by means of Europe and through winters, it gets all the extra entrancing.
However they had been additionally extra complex than many realize.
Insects have gotten more popular as a meals lately. A beach with a wide range of services
and amenities like Santa Monica or Redondo Seaside could also be preferable to a
extra remote beach like Malibu or Palos Verdes for adventurers.
Nevertheless,” she provides, “this idea has been superseded by Einstein’s Theory
of Normal Relativity, which is an enchancment on ‘Newtonian Gravity,’ that posits that matter deforms house-time
itself (like a heavy ball making a dimple on a rubber sheet).
Bolster also made the numerous level that Jaguar’s painstaking growth of a rear subframe mounted on rubber bushings had eradicated one of many chief arguments against unbiased rear suspension: noise intrusion into the cockpit.
Even small youngsters face stress sooner or later of their journey to adulthood.
Each sides will use discovery as a instrument to get as
a lot damaging information from the opposite side within the hopes
that they can have the higher hand throughout both settlement talks and at trial.
Early world maps cowl depictions of the world from the Iron Age
to the Age of Discovery and the emergence of modern geography in the course of
the early fashionable interval. In June 2009, the World Well being
Organization (WHO) announced that the disease had reached
international pandemic stage, a distinction that refers back to the
unfold of the condition, not its severity. To be successful, games have to permit players to consider an imaginary
world as a real place with real guidelines.
Many SUV manufacturers, responding to consumer fears, have developed safer vehicles utilizing electronic stabilizing technologies.
Utilizing aluminum for physique panels didn’t resonate well with some critics at first.
Your group’s radios, after all, must all be utilizing
the same privateness code as a way to work with one another.
All of this tutorial work is feasible because of 1 common trait of MMORPG worlds —
they’re immersive.
Everything is very open with a really clear explanation of the issues. It was really informative. Your website is very useful. Thanks for sharing.
Lastly, employers ought to present complete psychological health care and create a office culture that values
employee properly-being. Take small steps every day to strengthen your
resilience and support the effectively-being of your self and people round you.
Social media and video recreation firms can help youth psychological
health by constructing person-friendly instruments that promote healthier online experiences, providing equitable access to technology, and allowing for independent research to review the impact of their merchandise
on psychological health.
[u][b] Здравствуйте![/b][/u]
[b]Купить документ[/b] университета можно у нас.
[url=http://diplomasx.com/kupit-diplom-magistra/]diplomasx.com/kupit-diplom-magistra[/url]
[u][b] Привет, друзья![/b][/u]
Где заказать диплом по необходимой специальности?
Мы готовы предложить документы ВУЗов, которые расположены в любом регионе Российской Федерации. Можно заказать качественный диплом от любого ВУЗа, за любой год, указав подходящую специальность и оценки за все дисциплины. Дипломы выпускаются на бумаге высшего качества. Это позволяет делать настоящие дипломы, не отличимые от оригиналов. Документы будут заверены необходимыми печатями и штампами.
[b]Мы можем предложить дипломы[/b] любой профессии по приятным тарифам.
[url=http://diplomasx24.ru/kupit-diplom-o-srednem-obrazovanii]diplomasx24.ru/kupit-diplom-o-srednem-obrazovanii[/url]
[u][b] Рады оказать помощь![u][b]
[u][b] Привет![/b][/u]
[b]Мы готовы предложить документы ВУЗов,[/b] расположенных на территории всей Российской Федерации. Можно заказать диплом от любого заведения, за любой год, указав актуальную специальность и хорошие оценки за все дисциплины. Дипломы и аттестаты делаются на бумаге высшего качества. Это дает возможности делать настоящие дипломы, которые невозможно отличить от оригиналов. Они будут заверены всеми требуемыми печатями и подписями.
[url=http://lovisribca.ru/search.php]lovisribca.ru/search.php[/url]
Having read this I thought it was extremely enlightening. I appreciate you taking the time and effort to put this information together. I once again find myself spending a lot of time both reading and commenting. But so what, it was still worth it!
[u][b] Привет, друзья![/b][/u]
[b]Купить диплом о высшем образовании.[/b]
Мы предлагаем документы ВУЗов, расположенных в любом регионе России. Вы сможете приобрести качественный диплом от любого заведения, за любой год, включая сюда документы старого образца. Документы делаются на бумаге самого высшего качества. Это дает возможности делать государственные дипломы, не отличимые от оригиналов. Они будут заверены всеми требуемыми печатями и подписями.
[url=http://owen.ru/forum/album.php?albumid=218&attachmentid=77155&commentid=2439/]owen.ru/forum/album.php?albumid=218&attachmentid=77155&commentid=2439[/url]
[u][b] Привет, друзья![/b][/u]
Мы изготавливаем дипломы любой профессии по доступным тарифам. Стоимость зависит от выбранной специальности, года получения и ВУЗа.
[url=http://landik-diploms-srednee.ru/diplom-bakalavra ]landik-diploms-srednee.ru/diplom-bakalavra [/url]
[b]Хорошей учебы![/b]
[u][b] Привет, друзья![/b][/u]
[b]Легальная покупка диплома о среднем образовании в Москве и регионах [/b]
[url=http://rst.adk.audio/company/personal/user/1577/forum/message/1953/1985/#message1985/]rst.adk.audio/company/personal/user/1577/forum/message/1953/1985/#message1985[/url]
[u][b] Всегда вам поможем![u][b].
купить диплом колледжа в краснодаре [url=https://asxdiplomik24.ru/]asxdiplomik24.ru[/url] .
[u][b] Привет![/b][/u]
[b]Купить диплом о высшем образовании.[/b]
[url=http://sonnick84.blog2news.com/28794981/%D0%A7%D1%82%D0%BE-%D0%B8%D0%BC%D0%B5%D0%BD%D0%BD%D0%BE-%D0%BF%D0%BE%D0%BD%D0%B0%D0%B4%D0%BE%D0%B1%D0%B8%D1%82%D1%81%D1%8F-%D0%B8%D0%B7-%D1%82%D0%B5%D1%85%D0%BD%D0%B8%D0%BA%D0%B8-%D0%B4%D0%BB%D1%8F-%D1%81%D0%BE%D0%B7%D0%B4%D0%B0%D0%BD%D0%B8%D1%8F-%D0%B4%D0%BE%D0%BA%D1%83%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2/]sonnick84.blog2news.com/28794981/%D0%A7%D1%82%D0%BE-%D0%B8%D0%BC%D0%B5%D0%BD%D0%BD%D0%BE-%D0%BF%D0%BE%D0%BD%D0%B0%D0%B4%D0%BE%D0%B1%D0%B8%D1%82%D1%81%D1%8F-%D0%B8%D0%B7-%D1%82%D0%B5%D1%85%D0%BD%D0%B8%D0%BA%D0%B8-%D0%B4%D0%BB%D1%8F-%D1%81%D0%BE%D0%B7%D0%B4%D0%B0%D0%BD%D0%B8%D1%8F-%D0%B4%D0%BE%D0%BA%D1%83%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2[/url]
[u][b] Привет![/b][/u]
Где заказать диплом по необходимой специальности?
[url=http://vseogirls.ru/byistroe-oformlenie-diploma-lyuboy-spetsialnosti/]vseogirls.ru/byistroe-oformlenie-diploma-lyuboy-spetsialnosti[/url]
[b]Успешной учебы![/b]
Use water correctly and not only will you cut back your environmental affect, however you’ll save
money on water. Not only will you get more enjoyment out of your yard by beautifying it
on a funds, however you will save money and add lots of worth to one of your biggest investments.
Not only will you conserve this important fluid, you will save money, too.
There are now firms that will stroll you through each step of the process – from registering your area to optimizing
your webpage in order that the search engines can discover it.
[u][b] Здравствуйте![/b][/u]
Где купить диплом специалиста?
[b]Купить диплом любого ВУЗа.[/b]
[url=http://abris-zip.ru/company/personal/user/171/forum/message/1233/1243//]abris-zip.ru/company/personal/user/171/forum/message/1233/1243/[/url]
[u][b] Здравствуйте![/b][/u]
[b]Где заказать диплом специалиста?[/b]
[b]Мы готовы предложить дипломы[/b] психологов, юристов, экономистов и любых других профессий по доступным ценам.
[url=http://www.85sucai.com/member/index.php?uid=yhicyp]www.85sucai.com/member/index.php?uid=yhicyp[/url]
[u][b] Добрый день![/b][/u]
Заказать документ о получении высшего образования можно в нашем сервисе. Мы предлагаем документы об окончании любых университетов РФ. Вы получите необходимый диплом по любым специальностям, включая документы СССР.
[url=http://montrealpal.com/read-blog/1005/]montrealpal.com/read-blog/1005[/url]
[url=http://kvartal8b.getbb.ru/viewtopic.php?f=19&t=21929/]kvartal8b.getbb.ru/viewtopic.php?f=19&t=21929[/url]
[url=http://mojgorod.getbb.ru/viewtopic.php?f=12&t=1467/]mojgorod.getbb.ru/viewtopic.php?f=12&t=1467[/url]
[url=http://myweektour.ru/realnyie-diplomyi-dlya-realnyih-professionalov//]myweektour.ru/realnyie-diplomyi-dlya-realnyih-professionalov/[/url]
[url=http://vip.forums.party/viewtopic.php?id=3434#p71050/]vip.forums.party/viewtopic.php?id=3434#p71050[/url]
[u][b] Привет, друзья![/b][/u]
[b]Купить диплом старого образца, можно ли это сделать по быстрой схеме? [/b]
[url=http://vitaco.ru/communication/forum/user/4590//]vitaco.ru/communication/forum/user/4590/[/url]
[u][b] Всегда вам поможем![u][b].
[u][b] Привет![/b][/u]
[b]Мы изготавливаем дипломы[/b] любой профессии по приятным ценам.
[url=http://www.lafornacella.com/%D0%BA%D1%83%D0%BF%D0%B8%D1%82%D1%8C-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%BF%D0%B5%D1%80%D0%B5%D0%BA%D0%B2%D0%B0%D0%BB%D0%B8%D1%84%D0%B8%D0%BA%D0%B0%D1%86%D0%B8%D0%B8//]www.lafornacella.com/%D0%BA%D1%83%D0%BF%D0%B8%D1%82%D1%8C-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%BF%D0%B5%D1%80%D0%B5%D0%BA%D0%B2%D0%B0%D0%BB%D0%B8%D1%84%D0%B8%D0%BA%D0%B0%D1%86%D0%B8%D0%B8/[/url]
[u][b] Добрый день![/b][/u]
Купить диплом университета
[url=http://club.sabaylok.com/blogs/4715/%D0%9A%D0%B0%D0%BA-%D0%B2%D1%8B%D0%B1%D1%80%D0%B0%D1%82%D1%8C-%D0%BF%D1%80%D0%BE%D0%B2%D0%B5%D1%80%D0%B5%D0%BD%D0%BD%D1%8B%D0%B9-%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%BD%D0%B5%D1%82-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD-%D1%87%D1%82%D0%BE-%D1%80%D0%B5%D0%B0%D0%BB%D0%B8%D0%B7%D1%83%D0%B5%D1%82-%D0%B4%D0%BE%D0%BA%D1%83%D0%BC%D0%B5%D0%BD%D1%82%D1%8B/]club.sabaylok.com/blogs/4715/%D0%9A%D0%B0%D0%BA-%D0%B2%D1%8B%D0%B1%D1%80%D0%B0%D1%82%D1%8C-%D0%BF%D1%80%D0%BE%D0%B2%D0%B5%D1%80%D0%B5%D0%BD%D0%BD%D1%8B%D0%B9-%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%BD%D0%B5%D1%82-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD-%D1%87%D1%82%D0%BE-%D1%80%D0%B5%D0%B0%D0%BB%D0%B8%D0%B7%D1%83%D0%B5%D1%82-%D0%B4%D0%BE%D0%BA%D1%83%D0%BC%D0%B5%D0%BD%D1%82%D1%8B[/url]
Can I simply just say what a relief to discover someone that genuinely understands what they’re talking about on the net. You definitely realize how to bring an issue to light and make it important. A lot more people must look at this and understand this side of the story. I was surprised you aren’t more popular because you certainly have the gift.
Greetings! Very helpful advice within this article! It is the little changes that will make the most important changes. Thanks for sharing!
Hello! Do you know if they make any plugins to help with SEO? I’m trying to get my blog to rank for some targeted keywords but I’m not seeing very good success. If you know of any please share. Many thanks!
[url=https://effexor.directory/]buy effexor online[/url]
[u][b] Привет![/b][/u]
Заказать документ института можно у нас в Москве. Мы предлагаем документы об окончании любых ВУЗов Российской Федерации.
[url=http://fly-fishing.ru/forum/topic/9322/?page=1#post-46168/]fly-fishing.ru/forum/topic/9322/?page=1#post-46168[/url]
[url=http://propusk-spb.ru/index.php?subaction=userinfo&user=uqavomat/]propusk-spb.ru/index.php?subaction=userinfo&user=uqavomat[/url]
[url=http://myskupera.ru/forum/messages/forum1/topic12/message78083/?result=reply#message78083/]myskupera.ru/forum/messages/forum1/topic12/message78083/?result=reply#message78083[/url]
[url=http://nis.com.tn/index.php?option=com_kunena&view=topic&catid=2&id=6776&Itemid=151/]nis.com.tn/index.php?option=com_kunena&view=topic&catid=2&id=6776&Itemid=151[/url]
[url=http://advanced-retail.a2hosted.com/doku.php?id=landsdiplomy/]advanced-retail.a2hosted.com/doku.php?id=landsdiplomy[/url]
[u][b] Привет, друзья![/b][/u]
[b]Наш сервис предлагает заказать диплом[/b] высокого качества, неотличимый от оригинального документа без использования специального оборудования и опытного специалиста.
[url=http://www.6986986.com/forum.php?mod=viewthread&tid=9038&pid=132437&page=3758&extra=page%3D1#pid132437/]www.6986986.com/forum.php?mod=viewthread&tid=9038&pid=132437&page=3758&extra=page%3D1#pid132437[/url]
[b]Успехов в учебе![/b]
Pedro Gonzalez Lopez https://barcelona.pedri-ar.com known as Pedri, was born on November 25, 2002 in the small town of Tegeste, located on Tenerife, one of the Canary Islands.
Mohamed Salah https://liverpool.mohamedsalah-ar.com an Egyptian footballer, rose to fame through his outstanding performances at Liverpool Football Club.
The story of Leo Messi https://inter-miami.lionelmessi.ae‘s transfer to Inter Miami began long before the official announcement. Rumors about Messi’s possible departure from Barcelona appeared in 2020
Yacine Bounou https://al-hilal.yassine-bounou-ar.com known simply as Bono, is one of the most prominent Moroccan footballers of our time.
[u][b] Добрый день![/b][/u]
[b]Приобрести документ[/b] о получении высшего образования можно в нашей компании.
[url=http://diploms-x.com/kupit-diplom-krasnoyarsk/]diploms-x.com/kupit-diplom-krasnoyarsk[/url]
[b]Успешной учебы![/b]
Andreson Souza Conceicao https://al-nassr.talisca-ar.com known as Talisca, is one of the brightest stars of modern football.
Oh my goodness! Awesome article dude! Thank you so much, However I am encountering problems with your RSS. I don’t understand the reason why I can’t subscribe to it. Is there anybody else having identical RSS problems? Anyone who knows the solution will you kindly respond? Thanx!
code promotionnel 1xbett utilisez le code bonus pour obtenir un bonus VIP de 100% jusqu’a 130€ pour les Paris sportifs, ainsi qu’un bonus de casino de 1950 € + 150 tours de machines a sous. En utilisant le code promotionnel, vous pouvez vous attendre a ce que vos gains soient aussi eleves que dans le cas du plus grand bookmaker 1xbet. Tous les joueurs des pays suivants peuvent utiliser le code lors de l’inscription et recevoir un bonus de bienvenue:
Very good article. I certainly appreciate this site. Stick with it!
If some one wants to bee updated with hottest technologies after that he must be pay a visit this
web page and be up to date everyday. https://vocal.media/authors/haments87
Awesome blog! Do you have any tips and hints for asppiring
writers? I’m planning to start my own blog soon buut I’m a little lost on everything.
Would you suggest starting with a free platform like WordPress orr go
for a paid option? There are so many options out there that I’mcompletely
overwhelmed .. Anyy suggestions? Appreciate it! https://www.flickr.com/people/200929815@N05/
You have made some good points there. I checked on the weeb too learn more about the issuje and found most individuals will ggo along with your
viewss on this web site. https://vocal.media/authors/mariana-dias-fd1ec0i7y
My family evesry time say that I am wasting my time here at
net, but I know I am getting experience everyday by reading such good posts. https://www.producthunt.com/@gustave_guertin
These are really enormous ideas in regarding blogging.
You have touched some pleasant poings here. Any way keep up wrinting. https://www.producthunt.com/@aviator_game
Great blog here! Also your site a loot up very fast! What
web host are you using? Can I am getting your associate link to your host?
I desire my web site loaded uup as quickly as yours
lol https://linktr.ee/aviatorsgames
Nice post. I learn something totally new and challenging on blogs I stumbleupon on a daily basis.
It will always be helpful to read through articles from other authors
and use something from their web sites. https://exchange.prx.org/series/47306-explorando-o-aviator-no-paraserpiloto-com-um-port
I enjoy reading through an article that will make men and women think. Also, many thanks for allowing me to comment.
Brazilian footballer Neymar https://al-hilal.neymar-ar.com known for his unique playing style and outstanding achievements in world football, has made a surprise move to Al Hilal Football Club.
Harry Kane https://bayern.harry-kane-ar.com one of the most prominent English footballers of his generation, completed his move to German football club Bayern Munich in 2023.
Erling Haaland https://manchester-city.erling-haaland-ar.com born on July 21, 2000 in Leeds, England, began his football journey at an early age.
Luka Modric https://real-madrid.lukamodric-ar.com can certainly be called one of the outstanding midfielders in modern football.
[u][b] Привет![/b][/u]
[b]Мы предлагаем документы техникумов[/b], которые расположены в любом регионе РФ. Вы сможете заказать качественно сделанный диплом за любой год, указав актуальную специальность и оценки за все дисциплины. Дипломы и аттестаты печатаются на “правильной” бумаге высшего качества. Это позволяет делать настоящие дипломы, не отличимые от оригинала. Документы заверяются всеми требуемыми печатями и штампами.
[url=http://d91652pj.beget.tech/2024/07/09/priobretaem-diplom-v-proverennom-magazine-po-komfortnoy-cene.html/]d91652pj.beget.tech/2024/07/09/priobretaem-diplom-v-proverennom-magazine-po-komfortnoy-cene.html[/url]
Football in Saudi Arabia https://al-hilal.ali-al-bulaihi-ar.com has long been one of the main sports, attracting millions of fans. In recent years, one of the brightest stars in Saudi football has been Ali Al-Bulaihi, defender of Al-Hilal Football Club.
[u][b] Привет, друзья![/b][/u]
[b]Всё, что нужно знать о покупке аттестата о среднем образовании [/b]
[url=http://dog-ola.ru/viewtopic.php?f=28&t=7443/]dog-ola.ru/viewtopic.php?f=28&t=7443[/url]
[u][b] Окажем помощь![u][b].
купить диплом специалиста в самаре [url=https://diplomyx.com/]diplomyx.com[/url] .
купить диплом в калуге [url=https://asxdiplomik.com/]asxdiplomik.com[/url] .
[u][b] Добрый день![/b][/u]
[b]Мы изготавливаем дипломы[/b] любой профессии по приятным тарифам.
[url=http://bondhusova.com/blogs/60411/%D0%93%D1%80%D0%B0%D0%BC%D0%BE%D1%82%D0%BD%D0%BE-%D0%BF%D1%80%D0%B8%D0%BE%D0%B1%D1%80%D0%B5%D1%82%D0%B0%D0%B5%D0%BC-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%B2-%D1%81%D0%B5%D1%82%D0%B8-%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%BD%D0%B5%D1%82-%D0%B0%D0%B2%D1%82%D0%BE%D1%80%D1%81%D0%BA%D0%B8%D0%B9-%D0%BE%D0%B1%D0%B7%D0%BE%D1%80/]bondhusova.com/blogs/60411/%D0%93%D1%80%D0%B0%D0%BC%D0%BE%D1%82%D0%BD%D0%BE-%D0%BF%D1%80%D0%B8%D0%BE%D0%B1%D1%80%D0%B5%D1%82%D0%B0%D0%B5%D0%BC-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%B2-%D1%81%D0%B5%D1%82%D0%B8-%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%BD%D0%B5%D1%82-%D0%B0%D0%B2%D1%82%D0%BE%D1%80%D1%81%D0%BA%D0%B8%D0%B9-%D0%BE%D0%B1%D0%B7%D0%BE%D1%80[/url]
[url=http://www.lillian-too.com/guestbook/go.php?url=https://de-corp.ru]детская одежда оптом[/url]
[url=http://image.t.me/s/worldcasinonet.mm/url?q=https://de-corp.ru]детская одежда оптом[/url]
[url=http://property-d.com/redir.php?url=https://de-corp.ru]детская одежда оптом[/url]
[url=http://www.moteur.ma/fr/forum/redirection/?url=https://de-corp.ru]детская одежда оптом[/url]
[url=http://out.ucoz.org/go?https://de-corp.ru]детская одежда оптом[/url]
[url=http://www.zetor-forum.de/forum/gourl/?url=https://de-corp.ru]детская одежда оптом[/url]
[url=http://www.japaneseallure.com/st/st.php?id=301982&url=https://de-corp.ru]детская одежда оптом[/url]
[url=http://ponkotsu33.com/st-manager/click/track?id=10876&type=raw&url=https://de-corp.ru]детская одежда оптом[/url]
[url=http://www.verybigclits.com/cgi-bin/atc/out.cgi?id=31&u=https://de-corp.ru]детская одежда оптом[/url]
[url=http://chelyabinsk.torens-auto.com/bitrix/redirect.php?goto=https://de-corp.ru]детская одежда оптом[/url]
[url=http://bodova.blog.idnes.cz/redir.aspx?url=https://de-corp.ru]детская одежда оптом[/url]
[url=http://www.sxeye.org.cn/link2.asp?iurl=https://de-corp.ru]детская одежда оптом[/url]
[url=http://ubmbs.ru/bitrix/redirect.php?event1=&event2=&event3=&goto=https://de-corp.ru]детская одежда оптом[/url]
[url=http://bavaria-munchen.com/goto.php?url=https://de-corp.ru]детская одежда оптом[/url]
[url=http://bvkenergiasolar.com.br/link.asp?obanner=1&olink=https://de-corp.ru]детская одежда оптом[/url]
Детская одежда оптом из Турции
детская одежда оптом
детская одежда оптом
детская одежда оптом
детская одежда оптом
детская одежда оптом
детская одежда оптом
детская одежда оптом
детская одежда оптом
детская одежда оптом
детская одежда оптом
детская одежда оптом
детская одежда оптом
детская одежда оптом
детская одежда оптом
детская одежда оптом
[u][b] Здравствуйте![/b][/u]
Где заказать диплом по необходимой специальности?
[b]Приобрести диплом о высшем образовании.[/b]
[url=http://bmw-donbass.ru/gallery/image/839-%D1%88%D0%B8%D1%80%D0%BE%D0%BA%D0%B8%D0%B9-%D0%B2%D1%8B%D0%B1%D0%BE%D1%80-%D0%B4%D0%BE%D0%BA%D1%83%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2-%D0%B2-%D0%BF%D0%BE%D0%BF%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%BC-%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%BD%D0%B5%D1%82-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5//]bmw-donbass.ru/gallery/image/839-%D1%88%D0%B8%D1%80%D0%BE%D0%BA%D0%B8%D0%B9-%D0%B2%D1%8B%D0%B1%D0%BE%D1%80-%D0%B4%D0%BE%D0%BA%D1%83%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2-%D0%B2-%D0%BF%D0%BE%D0%BF%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%BC-%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%BD%D0%B5%D1%82-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5/[/url]
[url=http://spbcongress.ru/go.php?go=https://top-kreditka.ru]оформить кредитную карту[/url]
[url=http://jobnearyou.net/jobclick/?RedirectURL=https://top-kreditka.ru]оформить кредитную карту[/url]
[url=http://loja.daikenelevadores.com.br/conta/login?next=https://top-kreditka.ru]оформить кредитную карту[/url]
[url=http://www.avtoservis178.ru/go/url=https://top-kreditka.ru]оформить кредитную карту[/url]
[url=http://advertisingplusadexchange.com/mypromoclick.php?aff=bigjoeny&url=https://top-kreditka.ru]оформить кредитную карту[/url]
[url=http://url.sitehis.com/?url=https://top-kreditka.ru]оформить кредитную карту[/url]
[url=http://www.dealsonwines.co.uk/go.php?url=https://top-kreditka.ru]оформить кредитную карту[/url]
[url=http://medapparaty.kz/bitrix/redirect.php?goto=https://top-kreditka.ru]оформить кредитную карту[/url]
[url=http://aut.armavir.ru.xx3.kz/go.php?url=https://top-kreditka.ru]оформить кредитную карту[/url]
[url=http://klvadm.ru/bitrix/rk.php?goto=https://top-kreditka.ru]оформить кредитную карту[/url]
[url=http://lugaabrasiv.ru/bitrix/rk.php?goto=https://top-kreditka.ru]оформить кредитную карту[/url]
[url=http://productsforabetterlife.net.xx3.kz/go.php?url=https://top-kreditka.ru]оформить кредитную карту[/url]
[url=http://maps.t.me/s/worldcasinonet.lb/url?sa=t&rct=j&url=https://top-kreditka.ru]оформить кредитную карту[/url]
[url=http://nti2035.ru/bitrix/redirect.php?event1=&event2=&event3=&goto=https://top-kreditka.ru]оформить кредитную карту[/url]
[url=http://nintendo-64.de/?wptouch_switch=mobile&redirect=https://top-kreditka.ru]оформить кредитную карту[/url]
Оформи заявку на кредитную карту от лучших банков России онлайн
оформить кредитную карту
оформить кредитную карту
оформить кредитную карту
оформить кредитную карту
оформить кредитную карту
оформить кредитную карту
оформить кредитную карту
оформить кредитную карту
оформить кредитную карту
оформить кредитную карту
оформить кредитную карту
оформить кредитную карту
оформить кредитную карту
оформить кредитную карту
оформить кредитную карту
[u][b] Здравствуйте![/b][/u]
Приобрести документ о получении высшего образования вы имеете возможность в нашей компании в столице. Мы предлагаем документы об окончании любых ВУЗов Российской Федерации. Вы получите необходимый диплом по любым специальностям, включая документы Советского Союза.
[url=http://pdapal.com/read-blog/1006/]pdapal.com/read-blog/1006[/url]
[url=http://kvartal8b.getbb.ru/viewtopic.php?f=19&t=21929/]kvartal8b.getbb.ru/viewtopic.php?f=19&t=21929[/url]
[url=http://ayema.ng/blogs/33768/Диплом-в-кратчайшие-сроки-качественно-и-безопасно/]ayema.ng/blogs/33768/Диплом-в-кратчайшие-сроки-качественно-и-безопасно[/url]
[url=http://miku-crdb.ru/forum/messages/forum1/topic343/message372/?result=new#message372/]miku-crdb.ru/forum/messages/forum1/topic343/message372/?result=new#message372[/url]
[url=http://msfo-soft.ru/msfo/forum/messages/forum24/topic10455/message298443/?result=new#message298443/]msfo-soft.ru/msfo/forum/messages/forum24/topic10455/message298443/?result=new#message298443[/url]
[url=http://www.kollabora.com/external?url=https://de-corp.ru]детская одежда оптом[/url]
[url=http://eclipseme.sourceforge.net/redirect.php?redirect=https://de-corp.ru]детская одежда оптом[/url]
[url=http://veracruzclub.ru/links.php?go=https://de-corp.ru]детская одежда оптом[/url]
[url=http://www.taro-print.ru/bitrix/redirect.php?event1=click_to_call&event2=&event3=&goto=https://de-corp.ru]детская одежда оптом[/url]
[url=http://czab.ru/go.php?to=https://de-corp.ru]детская одежда оптом[/url]
[url=http://www.verney-carron.com/jump.cfm?c=260&l=lien&i=&p=https://de-corp.ru]детская одежда оптом[/url]
[url=http://blog.explore.org.xx3.kz/go.php?url=https://de-corp.ru]детская одежда оптом[/url]
[url=http://www.dozentenboerse.de/tools/hp/?url=https://de-corp.ru]детская одежда оптом[/url]
[url=http://jp.coln.kr/member/login.html?noMemberOrder=&returnUrl=https://de-corp.ru]детская одежда оптом[/url]
[url=http://old.upn.ru/redirect.aspx?url=https://de-corp.ru]детская одежда оптом[/url]
[url=http://www.sociostudies.org/bitrix/redirect.php?goto=https://de-corp.ru]детская одежда оптом[/url]
[url=http://danahamplova.blog.idnes.cz/redir.aspx?url=https://de-corp.ru]детская одежда оптом[/url]
[url=http://neigwlhotelpwllheli.2day.uk/NeigwlHotelPwllheli/search/?url=https://de-corp.ru]детская одежда оптом[/url]
[url=http://www.ostarrichi.com/external.html?link=https://de-corp.ru]детская одежда оптом[/url]
[url=http://kekeeimpex.com/Home/ChangeCurrency?urls=&cCode=GBP&cRate=77.86247https://de-corp.ru]детская одежда оптом[/url]
Детская одежда оптом из Турции
детская одежда оптом
детская одежда оптом
детская одежда оптом
детская одежда оптом
детская одежда оптом
детская одежда оптом
детская одежда оптом
детская одежда оптом
детская одежда оптом
детская одежда оптом
детская одежда оптом
детская одежда оптом
детская одежда оптом
детская одежда оптом
детская одежда оптом
[url=http://www.hun.pl/out.php?url=https://top-kreditka.ru]оформить кредитную карту[/url]
[url=http://www.nautilus.tv/0004it/AdRedir.asp?url=https://top-kreditka.ru]оформить кредитную карту[/url]
[url=http://jobnearyou.net/jobclick/?RedirectURL=https://top-kreditka.ru]оформить кредитную карту[/url]
[url=http://denysdesign.com/play.php?q=https://top-kreditka.ru]оформить кредитную карту[/url]
[url=http://adamjanak.blog.idnes.cz/redir.aspx?url=https://top-kreditka.ru]оформить кредитную карту[/url]
[url=http://www.bauen-in-vorarlberg.at/go.php?url=https://top-kreditka.ru]оформить кредитную карту[/url]
[url=http://jelevelencre.com.xx3.kz/go.php?url=https://top-kreditka.ru]оформить кредитную карту[/url]
[url=http://ronl.org/redirect?url=https://top-kreditka.ru]оформить кредитную карту[/url]
[url=http://leads.su/?source=webinar.new_cabinet3&ref_id=13057&go=https://top-kreditka.ru]оформить кредитную карту[/url]
[url=http://maps.t.me/s/worldcasinonet.pe/url?sa=t&source=web&rct=j&url=https://top-kreditka.ru]оформить кредитную карту[/url]
[url=http://www.jvca2001.org/modules/wordpress/wp-ktai.php?view=redir&url=https://top-kreditka.ru]оформить кредитную карту[/url]
[url=http://maps.google.co.uk/url?sa=t&url=https://top-kreditka.ru]оформить кредитную карту[/url]
[url=http://people.telephone-france.fr/redir.php?url=https://top-kreditka.ru]оформить кредитную карту[/url]
[url=http://re-file.com/cushion.php?url=https://top-kreditka.ru]оформить кредитную карту[/url]
[url=http://www.iads.com.np/prachar/www/delivery/ck.php?oaparams=2__bannerid=23692__zoneid=80__cb=b64fc8cdb7__oadest=https://top-kreditka.ru]оформить кредитную карту[/url]
Оформи заявку на кредитную карту от лучших банков России онлайн
оформить кредитную карту
оформить кредитную карту
оформить кредитную карту
оформить кредитную карту
оформить кредитную карту
оформить кредитную карту
оформить кредитную карту
оформить кредитную карту
оформить кредитную карту
оформить кредитную карту
оформить кредитную карту
оформить кредитную карту
оформить кредитную карту
оформить кредитную карту
оформить кредитную карту
visit my website https://currencyconvert.net
Сайт https://ps-likers.ru предлагает уроки по фотошоп для начинающих. На страницах сайта можно найти пошаговые руководства по анимации, созданию графики для сайтов, дизайну, работе с текстом и фотографиями, а также различные эффекты.
RDBox.de https://rdbox.de bietet schallgedammte Gehause fur 3D-Drucker, die eine sehr leise Druckumgebung schaffen – nicht lauter als ein Kuhlschrank. Unsere Losungen sorgen fur stabile Drucktemperatur, Vibrationsisolierung, Luftreinigung und mobile App-Steuerung.
N’Golo Kante https://al-ittihad.ngolokante-ar.com the French midfielder whose career has embodied perseverance, hard work and skill, has continued his path to success at Al-Ittihad Football Club, based in Saudi Arabia.
[u][b] Привет, друзья![/b][/u]
[b]Мы предлагаем дипломы[/b] любой профессии по приятным ценам.
[url=http://orangekitchendecor.all-new.info/%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%BE%D1%85%D1%80%D0%B0%D0%BD%D0%BD%D0%B8%D0%BA%D0%B0-%D0%BD%D0%BE%D0%B2%D0%BE%D0%B3%D0%BE-%D0%BE%D0%B1%D1%80%D0%B0%D0%B7%D1%86%D0%B0-%D0%BA%D1%83%D0%BF%D0%B8/]orangekitchendecor.all-new.info/%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%BE%D1%85%D1%80%D0%B0%D0%BD%D0%BD%D0%B8%D0%BA%D0%B0-%D0%BD%D0%BE%D0%B2%D0%BE%D0%B3%D0%BE-%D0%BE%D0%B1%D1%80%D0%B0%D0%B7%D1%86%D0%B0-%D0%BA%D1%83%D0%BF%D0%B8/[/url]
Kobe Bryant https://los-angeles-lakers.kobebryant-ar.com also known as the “Black Mamba”, is one of the most iconic and iconic figures in NBA history.
[u][b] Добрый день![/b][/u]
[b]Заказать документ[/b] института можно в нашей компании в Москве.
[url=http://ast-diplomy24.ru/kupit-diplom-magistra/]ast-diplomy24.ru/kupit-diplom-magistra[/url]
Way cool! Some very valid points! I appreciate you penning this article and also the rest of the site is extremely good.
Next time I read a blog, I hope that it doesn’t disappoint me as much as this particular one. After all, Yes, it was my choice to read through, however I truly thought you would have something helpful to say. All I hear is a bunch of crying about something you can fix if you weren’t too busy searching for attention.
[u][b] Добрый день![/b][/u]
[b]Официальная покупка школьного аттестата с упрощенным обучением в Москве[/b]
[url=http://iloveyouclub.net/blogs/1883/%D0%9D%D0%B0-%D1%87%D1%82%D0%BE-%D0%B2%D0%BD%D0%B8%D0%BC%D0%B0%D0%BD%D0%B8%D0%B5-%D0%BE%D0%B1%D1%80%D0%B0%D1%82%D0%B8%D1%82%D1%8C-%D0%BF%D1%80%D0%B8-%D0%B7%D0%B0%D0%BA%D0%B0%D0%B7%D0%B5-%D0%B4%D0%BE%D0%BA%D1%83%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2-%D0%B2-%D1%81%D0%B5%D1%82%D0%B8/]iloveyouclub.net/blogs/1883/%D0%9D%D0%B0-%D1%87%D1%82%D0%BE-%D0%B2%D0%BD%D0%B8%D0%BC%D0%B0%D0%BD%D0%B8%D0%B5-%D0%BE%D0%B1%D1%80%D0%B0%D1%82%D0%B8%D1%82%D1%8C-%D0%BF%D1%80%D0%B8-%D0%B7%D0%B0%D0%BA%D0%B0%D0%B7%D0%B5-%D0%B4%D0%BE%D0%BA%D1%83%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2-%D0%B2-%D1%81%D0%B5%D1%82%D0%B8[/url]
[u][b] Привет![/b][/u]
Готовы предложить документы ВУЗов, расположенных в любом регионе РФ. Вы сможете заказать диплом за любой год, указав необходимую специальность и оценки за все дисциплины. Документы печатаются на бумаге высшего качества. Это дает возможность делать государственные дипломы, не отличимые от оригинала. Документы будут заверены всеми требуемыми печатями и штампами.
[b]Мы можем предложить дипломы[/b] любых профессий по выгодным тарифам. Стоимость зависит от выбранной специальности, года получения и образовательного учреждения. Всегда стараемся поддерживать для покупателей адекватную политику тарифов. [b]Важно[/b], чтобы дипломы были доступными для большинства граждан.
[url=http://arusak-diploms-srednee.ru/kupit-diplom-magistra ]arusak-diploms-srednee.ru/kupit-diplom-magistra [/url]
[b]Успехов в учебе![/b]
[u][b] Привет![/b][/u]
[b]Заказать документ[/b] института можно в нашем сервисе.
[url=http://diplomyx24.ru/kupit-diplom-nizhnij-novgorod/]diplomyx24.ru/kupit-diplom-nizhnij-novgorod[/url]
[b]Хорошей учебы![/b]
I couldn’t refrain from commenting. Perfectly written!
Very nice blog post. I definitely appreciate this site. Stick with it!
[u][b] Привет![/b][/u]
[b]Мы изготавливаем дипломы[/b] любых профессий по приятным тарифам.
[url=http://www.acrossperu.com/%D0%BA%D1%83%D0%BF%D0%B8%D1%82%D1%8C-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%B2-%D0%BA%D0%BE%D0%B2%D1%80%D0%BE%D0%B2%D0%B5//]www.acrossperu.com/%D0%BA%D1%83%D0%BF%D0%B8%D1%82%D1%8C-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%B2-%D0%BA%D0%BE%D0%B2%D1%80%D0%BE%D0%B2%D0%B5/[/url]
Cristiano Ronaldo https://al-nassr.cristiano-ronaldo.ae is one of the greatest names in football history, with his achievements inspiring millions of fans around the world.
[url=http://eflomax.online/]noroxin without prescription[/url]
In 2018, the basketball world witnessed one of the most remarkable transformations in NBA history. LeBron James https://los-angeles-lakers.lebronjames-ar.com one of the greatest players of our time, decided to leave his hometown Cleveland Cavaliers and join the Los Angeles Lakers.
Luis Diaz https://liverpool.luis-diaz-ar.com is a young Colombian striker who has enjoyed rapid growth since joining the ” Liverpool” in January 2022.
[u][b] Привет![/b][/u]
Где купить диплом специалиста?
[b]Заказать диплом о высшем образовании.[/b]
[url=http://prof-komplekt.com/club/user/1035/blog/11031//]prof-komplekt.com/club/user/1035/blog/11031/[/url]
[u][b] Привет, друзья![/b][/u]
[b]Как безопасно купить диплом колледжа или ВУЗа в России, что важно знать [/b]
[url=http://mockwanasvyazi.getbb.ru/viewtopic.php?f=12&t=1501/]mockwanasvyazi.getbb.ru/viewtopic.php?f=12&t=1501[/url]
[u][b] Будем рады вам помочь![u][b].
[u][b] Привет, друзья![/b][/u]
[b]Мы предлагаем документы техникумов[/b], которые расположены в любом регионе Российской Федерации. Можно приобрести диплом от любого заведения, за любой год, включая сюда документы СССР. Дипломы и аттестаты делаются на бумаге самого высшего качества. Это позволяет делать настоящие дипломы, не отличимые от оригинала. Документы будут заверены необходимыми печатями и штампами.
[url=http://r6c130wvs.ltfblog.com/27743093/%D0%9F%D0%BE%D0%B4%D1%80%D0%BE%D0%B1%D0%BD%D0%BE%D0%B5-%D0%BE%D0%BF%D0%B8%D1%81%D0%B0%D0%BD%D0%B8%D0%B5-%D0%B7%D0%B0%D0%BA%D0%B0%D0%B7%D0%B0-%D0%B0%D1%82%D1%82%D0%B5%D1%81%D1%82%D0%B0%D1%82%D0%B0-%D0%B2-%D0%B8%D0%B7%D0%B2%D0%B5%D1%81%D1%82%D0%BD%D0%BE%D0%BC-%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%BD%D0%B5%D1%82-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5/]r6c130wvs.ltfblog.com/27743093/%D0%9F%D0%BE%D0%B4%D1%80%D0%BE%D0%B1%D0%BD%D0%BE%D0%B5-%D0%BE%D0%BF%D0%B8%D1%81%D0%B0%D0%BD%D0%B8%D0%B5-%D0%B7%D0%B0%D0%BA%D0%B0%D0%B7%D0%B0-%D0%B0%D1%82%D1%82%D0%B5%D1%81%D1%82%D0%B0%D1%82%D0%B0-%D0%B2-%D0%B8%D0%B7%D0%B2%D0%B5%D1%81%D1%82%D0%BD%D0%BE%D0%BC-%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%BD%D0%B5%D1%82-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5[/url]
Very good article. I absolutely love this site. Keep writing!
Nice post. I was checking continuously this blog and I am impressed!
Very usegul info specially the last part 🙂 I care for such information much.
I was seeking this certain information for a very long time.
Thank you and best of luck. https://passionatequran.com/blog/index.php?entryid=316
I am extremely inspired along with youir writing skills and also with the lahout tto your blog.
Is this a pid topic or did you modify it yourself? Either way keep up the nice hgh
quality writing, it’s uncommon to see a great blog like this onne these days.. https://tigaedu.com/blog/index.php?entryid=303328
you’re in point of fact a good webmaster.
The web sige loading velocity is amazing. It
seems that you are doing any unique trick. Also, The contents are masterwork.
you’ve performed a fantastic job inn this matter! https://pbase.com/josephtaylor
Very energetic article, I enjoyed that bit. Will there be a part 2? http://demo.qkseo.in/viewtopic.php?id=834483
Maria Sharapova https://tennis.maria-sharapova-ar.com was born on April 19, 1987 in Nyagan, Russia. When Masha was 7 years old, her family moved to Florida, where she started playing tennis.
Kevin De Bruyne https://manchester-city.kevin-de-bruyne-ar.com is a name every football fan knows today.
Muhammad Al Owais https://al-hilal.mohammed-alowais-ar.com is one of the most prominent names in modern Saudi football. His path to success in Al Hilal team became an example for many young athletes.
Roberto Firmino https://al-ahli.roberto-firmino-ar.com one of the most talented and famous Brazilian footballers of our time, has paved his way to success in different leagues and teams.
I think this is among tthe most important information for
me. And i’m glad reading your article. Butt want
to remark on some general things, The web site style is
wonderful, the articles is really excellent : D. Good job, cheers http://demo.qkseo.in/viewtopic.php?id=834520
Can I simply say what a comfort to discover somebody who actually knows what they’re talking about on the web. You actually realize how to bring a problem to light and make it important. More and more people need to read this and understand this side of your story. I was surprised you’re not more popular since you certainly have the gift.
Keep on writing, great job! https://dev2.emathisi.gr/blog/index.php?entryid=409
Hi my loved one! I wish to say that this post is awesome,
great written and include approximately all important infos.
I would like to peer more posts like this . https://forum.pgbu.ir/viewtopic.php?id=690
This piece of writing iss actually a nice one it helps new the web users, who
are wishing in favor of blogging. https://enfogentraining.com/blog/index.php?entryid=67317
That is very fascinating, You’re an excessively skilled blogger.
I’ve joined your feed and look ahead to searching for moree of
your magnificent post. Additionally, I have shared
your wweb site in my social networks http://another-ro.com/forum/viewtopic.php?id=407626
Genuinely no matter if someone doesn’t understand then itts
upp to other viewers that they will help,so here it occurs. https://passionatequran.com/blog/index.php?entryid=332
I enjoy reading a post that can make men and women think. Also, thank you for allowing for me to comment.
Angel Di Maria https://benfica.angel-di-maria-ar.com is a name that will forever remain in the memories of Benfica fans.
Khvicha Kvaratskhelia https://napoli.khvicha-kvaratskhelia-ar.com is a name that in recent years has become a symbol of Georgian football talent and ambition.
Football in Saudi Arabia https://al-hilal.saud-abdulhamid-ar.com is gaining more and more popularity and recognition on the international stage, and Saud Abdul Hamid, the young and talented defender of Al Hilal, is a shining example of this success.
code promo pour parier gratuit dans 1xbet. Utilisez – le lors de votre inscription pour obtenir un bonus de 100% jusqu’a 130$. Pour obtenir des bonus du bookmaker 1xbet, vous devez remplir certaines conditions, mais les codes promotionnels vous permettent de les obtenir beaucoup plus facilement. La taille des bonus disponibles pour les joueurs via les codes promotionnels 1xBet peut etre petite, mais meme un petit bonus peut augmenter considerablement le potentiel de jeu du client.
After looking into a few of the articles on your blog, I honestly like your technique of blogging. I added it to my bookmark webpage list and will be checking back soon. Please check out my website too and tell me how you feel.
Annual journey insurance is accessible for several
types of travelers. Children could possibly spend a lot of the academic journey
day in small teams, observing, chatting and learning about each
other. As soon as they arrive on the ranch (where the show is filmed), contestants need to
work out 5 to eight hours a day. In 2008, Google decided
to alter its day care service to make the
entire program more like the Woods. However, just as it takes more than groundbreaking music
to provide rise to a rock god, we think it takes greater than progressive breakthroughs and superb machines to make a scientific one.
As a result, a lot of the motion remains unnoticed, no one
publicly takes credit score for the defeats and, generally, the enemy has no idea they’ve
even suffered. Most also have clauses not permitting you to
speak negatively in regards to the show or disclose anything about your experience, even after it is over.
They arrive from Asia initially, however you’ll find them all over the world as of late.
Казахский национальный технический университет https://satbayev.university им. К.Сатпаева
Upcoming fantasy MOBA https://bladesofthevoid.com evolved by Web3. Gacha perks, AI and crafting in one swirling solution!
Продажа новых автомобилей Hongqi
https://hongqi-krasnoyarsk.ru/about-hongqi в Красноярске у официального дилера Хончи. Весь модельный ряд, все комплектации, выгодные цены, кредит, лизинг, трейд-ин
Excellent post. I am dealing with a few of these issues as well..
командир купил диплом [url=https://diplomasx.com/]diplomasx.com[/url] .
Kylie Jenner https://kylie-cosmetics.kylie-jenner-ar.com is an American model, media personality, and businesswoman, born on August 10, 1997 in Los Angeles, California.
[u][b] Привет![/b][/u]
Где купить диплом по актуальной специальности?
[b]Купить диплом о высшем образовании.[/b]
[url=http://samovod.ru/content/articles/65961//]samovod.ru/content/articles/65961/[/url]
[u][b] Здравствуйте![/b][/u]
Готовы предложить документы ВУЗов, расположенных в любом регионе Российской Федерации. Вы можете купить диплом от любого заведения, за любой год, указав необходимую специальность и хорошие оценки за все дисциплины. Дипломы и аттестаты делаются на “правильной” бумаге высшего качества. Это позволяет делать настоящие дипломы, не отличимые от оригинала. Они будут заверены необходимыми печатями и подписями.
[b]Мы готовы предложить дипломы[/b] любых профессий по приятным ценам. Стоимость может зависеть от выбранной специальности, года получения и ВУЗа. Стараемся поддерживать для клиентов адекватную ценовую политику. [b]Важно[/b], чтобы дипломы были доступными для большинства наших граждан.
[url=http://arusak-diploms-srednee.ru/diplom-sredne-spetcialnoe-obrazovanie В ]arusak-diploms-srednee.ru/diplom-sredne-spetcialnoe-obrazovanie В [/url]
[b]Успешной учебы![/b]
[u][b] Привет![/b][/u]
[b]Заказать документ[/b] о получении высшего образования можно в нашей компании.
[url=http://diplomasx.com/kupit-diplom-voronezh/]diplomasx.com/kupit-diplom-voronezh[/url]
[u][b] Привет, друзья![/b][/u]
[b]Приобрести документ[/b] о получении высшего образования вы можете у нас в Москве.
[url=http://ast-diploms.com/kupit-diplom-omsk/]ast-diploms.com/kupit-diplom-omsk[/url]
[b]Успехов в учебе![/b]
[u][b] Привет![/b][/u]
[b]Мы предлагаем документы техникумов[/b], которые находятся в любом регионе Российской Федерации. Можно заказать диплом от любого заведения, за любой год, указав подходящую специальность и хорошие оценки за все дисциплины. Дипломы и аттестаты выпускаются на бумаге высшего качества. Это позволяет делать государственные дипломы, которые не отличить от оригинала. Они будут заверены необходимыми печатями и подписями.
[url=http://xicidypaco.tearosediner.net/podrobnoe-opisanie-priobretenia-dokumentov-v-onlajn-magazine/]xicidypaco.tearosediner.net/podrobnoe-opisanie-priobretenia-dokumentov-v-onlajn-magazine[/url]
где смотреть дату выдачи диплома о высшем образовании [url=https://asxdiplomik24.ru/]asxdiplomik24.ru[/url] .
I quite like looking through an article that will make men and women think. Also, many thanks for permitting me to comment.
medication canadian pharmacy: canadian pharmacy online ship to usa – trusted canadian pharmacy
mexico drug stores pharmacies: mexican pharmacy – mexico drug stores pharmacies
indian pharmacy online: world pharmacy india – online shopping pharmacy india
https://foruspharma.com/# purple pharmacy mexico price list
india online pharmacy [url=http://indiapharmast.com/#]indian pharmacies safe[/url] cheapest online pharmacy india
medicine in mexico pharmacies [url=http://foruspharma.com/#]reputable mexican pharmacies online[/url] mexican rx online
Spot on with this write-up, I absolutely believe this amazing site needs a lot more attention. I’ll probably be returning to see more, thanks for the advice.
https://foruspharma.com/# mexican mail order pharmacies
Excellent blog you’ve got here.. It’s difficult to find high-quality writing like yours nowadays. I really appreciate individuals like you! Take care!!
Промокод Champion Casino позволяет клиентам получить увеличенный приветственный бонус за регистрацию. Вознаграждение состоит из: денег на депозит — до +120%; фриспинов (бесплатных вращений) — 100 штук; фрибета. Взять промокод на сайте партнеров казино Чемпион; запросить у консультанта службы онлайн-поддержки; найти промокод в социальных сетях бренда Champion Casino
Bella Hadid https://img-models.bella-hadid-ar.com is an American model who has emerged in recent years as one of the most influential figures in the world of fashion.
Sadio Mane https://al-nassr.sadio-mane-ar.com the Senegalese footballer best known for his performances at clubs such as Southampton and Liverpool, has become a prominent figure in Al Nassr.
Brazilian footballer Ricardo Escarson https://orlando-city.kaka-ar.com dos Santos Leite, better known as Kaka, is one of the most famous and successful players in football history.
Zinedine Zidane https://real-madrid.zinedine-zidane-ar.com the legendary French footballer, entered the annals of football history as a player and coach.
top 10 online pharmacy in india: indian pharmacy online – top 10 pharmacies in india
bookmarked!!, I love your web site!
pharmacy website india top 10 online pharmacy in india or <a href=" https://image.google.cd/url?g2_fromNavId=xcbb836f8&q=https://indiapharmast.com/ “>Online medicine order
http://www.gensuikin.org/i/index.cgi?id=1&mode=redirect&no=242&ref_eid=110&url=http://indiapharmast.com top 10 pharmacies in india
[url=http://www.nhhappenings.com/links_return.asp?R=https%3A%2F%2Findiapharmast.com%2F]top 10 pharmacies in india[/url] top 10 pharmacies in india and [url=https://discuz.nciaer.com/home.php?mod=space&uid=36667]pharmacy website india[/url] india online pharmacy
[u][b] Привет![/b][/u]
Где купить диплом по актуальной специальности?
[b]Купить диплом любого ВУЗа.[/b]
[url=http://d91652pj.beget.tech/2024/07/04/kak-podyskat-proverennyy-onlayn-magazin-s-shirokim-vyborom-diplomov.html/]d91652pj.beget.tech/2024/07/04/kak-podyskat-proverennyy-onlayn-magazin-s-shirokim-vyborom-diplomov.html[/url]
[u][b] Здравствуйте![/b][/u]
[b]Приобрести диплом о высшем образовании.[/b]
[url=http://censornet.ru/diplomyi-dlya-lyubyih-potrebnostey//]censornet.ru/diplomyi-dlya-lyubyih-potrebnostey/[/url]
[b]Успешной учебы![/b]
canadian discount pharmacy: canadian neighbor pharmacy – the canadian drugstore
[u][b] Привет, друзья![/b][/u]
[b]Заказать документ[/b] ВУЗа можно в нашем сервисе.
[url=http://ast-diplomas.com/kupit-diplom-voronezh/]ast-diplomas.com/kupit-diplom-voronezh[/url]
[b]Удачи![/b]
Edson Arantes https://santos.pele-ar.com do Nascimento, known as Pele, was born on October 23, 1940 in Tres Coracoes, Minas Gerais, Brazil.
Brazilian footballer Malcom https://al-hilal.malcom-ar.com (full name Malcom Felipe Silva de Oliveira) achieved great success in Al Hilal, one of the leading football teams in Saudi Arabia and the entire Middle East.
Monica Bellucci https://dracula.monica-bellucci-ar.com one of the most famous Italian actresses of our time, has a distinguished artistic career spanning many decades. Her talent, charisma, and stunning beauty made her an icon of world cinema.
[u][b] Привет![/b][/u]
Купить документ ВУЗа вы сможете в нашем сервисе. Мы предлагаем документы об окончании любых университетов РФ. Вы сможете получить необходимый диплом по любым специальностям, включая документы СССР. Гарантируем, что в случае проверки документов работодателем, подозрений не возникнет.
[url=http://newspromworld.ru/kupit-diplom-bez-riska/]newspromworld.ru/kupit-diplom-bez-riska[/url]
[url=http://www.politikforum.ru/member.php?u=13385920/]www.politikforum.ru/member.php?u=13385920[/url]
[url=http://darkgate.pl/events/event/23-ассортимент-и-варианты-доставки-в-магазине-покупаем-аттестат//]darkgate.pl/events/event/23-ассортимент-и-варианты-доставки-в-магазине-покупаем-аттестат/[/url]
[url=http://vhopnation.io/read-blog/6/]vhopnation.io/read-blog/6[/url]
[url=http://www.brodyaga.org/club/user/110581/blog/6303//]www.brodyaga.org/club/user/110581/blog/6303/[/url]
best india pharmacy: world pharmacy india – india pharmacy
http://foruspharma.com/# mexican pharmaceuticals online
buying drugs from canada [url=http://canadapharmast.com/#]cheapest pharmacy canada[/url] reliable canadian pharmacy reviews
Привет, друзья!
Купить диплом любого университета
[url=http://landik-diploms-srednee.ru/kupit-diplom-volgograd В ]landik-diploms-srednee.ru/kupit-diplom-volgograd В [/url]
Успешной учебы!
[u][b] Привет![/b][/u]
[b]Диплом техникума купить официально с упрощенным обучением в Москве [/b]
[url=http://laver.listbb.ru/ucp.php?mode=login&sid=18d2c3d86a1349f5b0a3d2f32c6037d9/]laver.listbb.ru/ucp.php?mode=login&sid=18d2c3d86a1349f5b0a3d2f32c6037d9[/url]
[u][b] Будем рады вам помочь![u][b].
[u][b] Привет![/b][/u]
[b]Мы можем предложить документы техникумов[/b], расположенных в любом регионе РФ. Вы можете купить качественный диплом от любого учебного заведения, за любой год, указав подходящую специальность и оценки за все дисциплины. Дипломы и аттестаты печатаются на “правильной” бумаге высшего качества. Это дает возможности делать настоящие дипломы, которые невозможно отличить от оригинала. Документы заверяются всеми необходимыми печатями и подписями.
[url=http://p33340zg.beget.tech/2024/07/09/zakazyvaem-diplom-v-proverennom-onlayn-magazine-po-komfortnoy-cene.html/]p33340zg.beget.tech/2024/07/09/zakazyvaem-diplom-v-proverennom-onlayn-magazine-po-komfortnoy-cene.html[/url]
online pharmacy india: п»їlegitimate online pharmacies india – top 10 pharmacies in india
safe reliable canadian pharmacy [url=https://canadapharmast.com/#]canadian valley pharmacy[/url] canadian pharmacy ed medications
Enregistrez-vous en utilisant le 1xbet code promo casino afin de profiter d’une offre exclusive de bonus de 100% jusqu’a 130$ sur les paris sportifs gratuits. Pour beneficier de cette offre de pari gratuit bonifiee, vous devrez placer 5 paris sur des accumulateurs dans les 30 jours. Il existe diverses strategies pour les paris combines, mais si vous souhaitez gagner et obtenir des paris gratuits, nous vous recommandons de privilegier des selections de cotes plus courtes et de vous concentrer sur des paris combines surs pour commencer.
[u][b] Привет, друзья![/b][/u]
Купить документ о получении высшего образования вы сможете у нас. Мы оказываем услуги по производству и продаже документов об окончании любых университетов РФ. Вы получите необходимый диплом по любым специальностям, включая документы старого образца.
[url=http://molbiol.ru/forums/index.php?showtopic=1245119/]molbiol.ru/forums/index.php?showtopic=1245119[/url]
[url=http://forum-nine.mirbb.com/t11758-topic#31170/]forum-nine.mirbb.com/t11758-topic#31170[/url]
[url=http://www.paladiny.ru/forummess.dwar.php?TopicID=27649/]www.paladiny.ru/forummess.dwar.php?TopicID=27649[/url]
[url=http://www.bideew.com/create-blog//]www.bideew.com/create-blog/[/url]
[url=http://realtyintellect.ru/vash-put-k-uspehu-diplom-bez-lishnih-zabot/]realtyintellect.ru/vash-put-k-uspehu-diplom-bez-lishnih-zabot[/url]
[u][b] Привет, друзья![/b][/u]
Приобрести документ о получении высшего образования можно в нашей компании. Мы оказываем услуги по продаже документов об окончании любых университетов России.
[url=http://e-audit.gefest.me/index.php?subaction=userinfo&user=erubysa/]e-audit.gefest.me/index.php?subaction=userinfo&user=erubysa[/url]
[url=http://www.detskiy-mir.net/index.php?subaction=userinfo&user=uxofapas/]www.detskiy-mir.net/index.php?subaction=userinfo&user=uxofapas[/url]
[url=http://pro-tulu.ru/users/icaleq/]pro-tulu.ru/users/icaleq[/url]
[url=http://новодвинцы.рф/forum/messages/forum4/topic840/message264406/?result=reply#message264406/]новодвинцы.рф/forum/messages/forum4/topic840/message264406/?result=reply#message264406[/url]
[url=http://www.dxzw.com/member/index.php?uid=ogabudul/]www.dxzw.com/member/index.php?uid=ogabudul[/url]
[u][b] Привет, друзья![/b][/u]
Где купить диплом специалиста?
Мы предлагаем документы ВУЗов, расположенных на территории всей России. Вы можете приобрести диплом за любой год, включая документы старого образца СССР. Дипломы делаются на “правильной” бумаге самого высшего качества. Это позволяет делать государственные дипломы, не отличимые от оригиналов. Они заверяются необходимыми печатями и штампами.
[b]Мы изготавливаем дипломы[/b] любых профессий по приятным ценам.
[url=http://asxdiplomik24.ru/kupit-diplom-sankt-peterburg]asxdiplomik24.ru/kupit-diplom-sankt-peterburg[/url]
[u][b] Рады оказать помощь![u][b]
[u][b] Привет, друзья![/b][/u]
Купить документ ВУЗа можно в нашем сервисе. Мы оказываем услуги по изготовлению и продаже документов об окончании любых университетов России. Вы получите диплом по любой специальности, включая документы старого образца. Гарантируем, что в случае проверки документов работодателем, никаких подозрений не возникнет.
[b]Мы готовы предложить дипломы[/b] психологов, юристов, экономистов и любых других профессий по приятным ценам. Цена зависит от определенной специальности, года получения и образовательного учреждения. Всегда стараемся поддерживать для клиентов адекватную политику тарифов. Для нас важно, чтобы дипломы были доступны для большого количества наших граждан.
[url=http://gamesfortop.ru/diplom-po-vyigodnoy-tsene-investitsiya-v-vashe-budushhee/]gamesfortop.ru/diplom-po-vyigodnoy-tsene-investitsiya-v-vashe-budushhee[/url]
[b]Поможем вам всегда![/b]
canadian mail order pharmacy best canadian pharmacy online or vipps approved canadian online pharmacy
http://www.weedy.be/2-uncategorised/1320-redirect2?url=http://canadapharmast.com online canadian pharmacy review
[url=https://clients1.google.com.vc/url?q=https://canadapharmast.com]canadian pharmacy ltd[/url] canadian pharmacies and [url=https://m.414500.cc/home.php?mod=space&uid=3558554]canadian pharmacy 24[/url] canadian pharmacy ed medications
[u][b] Добрый день![/b][/u]
[b]Заказать документ[/b] о получении высшего образования вы сможете в нашей компании.
[url=http://ast-diploms.com/kupit-diplom-omsk/]ast-diploms.com/kupit-diplom-omsk[/url]
[u][b] Привет![/b][/u]
[b]Приобрести диплом о высшем образовании.[/b]
[url=http://mamadona.ru/blogs/faq_i_podderzhka._priobretaem_dokumenty_v_seti_internet//]mamadona.ru/blogs/faq_i_podderzhka._priobretaem_dokumenty_v_seti_internet/[/url]
Jude Bellingham https://real-madrid.jude-bellingham-ar.com a young and talented English footballer, has enjoyed great success with Real Madrid since his arrival.
Jackie Chan https://karate-kid.jackiechan-ar.com was born in 1954 in Hong Kong under the name Chan Kong San.
Hello are using WordPress for your site platform? I’m new
to the blog world but I’m trying to get started aand set up my own. Do you require any coding knowledge to make your
own blog? Any help would be really appreciated! https://caramellaapp.com/milanmu1/P0hifu1kH/slot-machines
https://foruspharma.com/# mexican online pharmacies prescription drugs
top 10 pharmacies in india: Online medicine home delivery – india online pharmacy
best canadian pharmacy: canadian pharmacy – canadian pharmacy tampa
[url=https://t.me/noticias_deCampoGrande]noticias[/url]
noticias
noticias
This website was… how do I say it? Relevant!! Finally I have found something that helped me. Cheers.
[u][b] Привет, друзья![/b][/u]
[b]Мы изготавливаем дипломы[/b] любых профессий по приятным тарифам.
[url=http://myworldgo.com/blog/107879/kak-mozhno-budet-zakazat-nedorogo-kachestvennyj-diplom-v-internete/]myworldgo.com/blog/107879/kak-mozhno-budet-zakazat-nedorogo-kachestvennyj-diplom-v-internete[/url]
[url=https://t.me/noticias_deBeloHorizonte]noticias[/url]
noticias
noticias
Le code promo 1xbet cameroun. Enregistrez-vous des a present avec notre code promotionnel 1xBet valable jusqu’en 2024 pour beneficier d’un bonus de 200% sur votre premier depot. Utilisez le code de bonus lors de l’ouverture de votre nouveau compte 1xbet afin de recevoir votre bonus de bienvenue de 130$. L’enregistrement est autorise pour les personnes ayant atteint l’age de 18 ans et residant dans les pays ou l’activite du bookmaker n’est pas limitee au niveau legislatif.
buy prescription drugs from india [url=https://indiapharmast.com/#]best india pharmacy[/url] Online medicine order
reputable mexican pharmacies online buying prescription drugs in mexico online or mexican drugstore online
https://maps.google.com.ly/url?sa=t&url=https://foruspharma.com mexican rx online
[url=https://images.google.rw/url?sa=t&url=https://foruspharma.com]medication from mexico pharmacy[/url] mexico drug stores pharmacies and [url=https://xiazai7.com/home.php?mod=space&uid=23542]buying prescription drugs in mexico online[/url] mexican pharmaceuticals online
mexico pharmacies prescription drugs: mexico drug stores pharmacies – mexico pharmacy
[u][b] Добрый день![/b][/u]
[b]Приобрести документ[/b] института вы имеете возможность у нас в Москве.
[url=http://diplomasx.com/kupit-diplom-voronezh/]diplomasx.com/kupit-diplom-voronezh[/url]
[b]Удачи![/b]
You’ve presented a balanced view on this issue.검색엔진최적화 대행사
Добрый день!
Заказать диплом любого университета
[url=http://landik-diploms-srednee.ru/attestat-shkoly В ]landik-diploms-srednee.ru/attestat-shkoly В [/url]
Хорошей учебы!
canadian pharmacy meds review: reddit canadian pharmacy – canadian family pharmacy
https://canadapharmast.online/# online canadian drugstore
pharmacy website india [url=https://indiapharmast.com/#]best india pharmacy[/url] Online medicine home delivery
[u][b] Привет, друзья![/b][/u]
[b]Пошаговая инструкция по безопасной покупке диплома о высшем образовании [/b]
[url=http://bs.listbb.ru/ucp.php?mode=login&sid=0dbc71da6039f11d9423895baa9e2c0f/]bs.listbb.ru/ucp.php?mode=login&sid=0dbc71da6039f11d9423895baa9e2c0f[/url]
[u][b] Рады оказать помощь![u][b].
[u][b] Привет![/b][/u]
[b]Мы предлагаем документы техникумов[/b], расположенных в любом регионе Российской Федерации. Вы имеете возможность купить диплом от любого заведения, за любой год, включая документы старого образца. Дипломы и аттестаты выпускаются на “правильной” бумаге самого высокого качества. Это дает возможность делать государственные дипломы, которые невозможно отличить от оригиналов. Документы заверяются всеми требуемыми печатями и подписями.
[url=http://blogs.rufox.ru/~sonnick84/48232.htm/]blogs.rufox.ru/~sonnick84/48232.htm[/url]
mexican online pharmacies prescription drugs: buying prescription drugs in mexico – medicine in mexico pharmacies
mexican border pharmacies shipping to usa: buying prescription drugs in mexico – best online pharmacies in mexico
http://canadapharmast.com/# canadian pharmacy ltd
Hi there would you mind letting me know which web host you’re working with? I’ve loaded your blog in 3 different web browsers and I must say this blog loads a lot quicker then most. Can you suggest a good web hosting provider at a honest price? Cheers, I appreciate it!
indianpharmacy com online pharmacy india or top online pharmacy india
https://toolbarqueries.google.co.ck/url?sa=t&url=https://indiapharmast.com best online pharmacy india
[url=http://dbtune.org/jamendo/cliopatria/browse/list_resource?r=https%3A%2F%2Findiapharmast.com%2F]india pharmacy[/url] buy medicines online in india and [url=https://www.sdxle.com/home.php?mod=space&uid=1650133]cheapest online pharmacy india[/url] buy prescription drugs from india
canadian family pharmacy: canadian pharmacy scam – buying drugs from canada
[u][b] Привет![/b][/u]
Заказать документ о получении высшего образования вы сможете в нашей компании в Москве. Мы оказываем услуги по изготовлению и продаже документов об окончании любых ВУЗов Российской Федерации. Вы сможете получить диплом по любым специальностям, включая документы СССР.
[url=http://a90275db.beget.tech/2024/07/13/vash-diplom-bez-lishnih-zabot-bystro-i-bezopasno.html/]a90275db.beget.tech/2024/07/13/vash-diplom-bez-lishnih-zabot-bystro-i-bezopasno.html[/url]
[url=http://telugusaahityam.com/Легальный_диплом_без_лишних_хлопот:_узнайте_как!/]telugusaahityam.com/Легальный_диплом_без_лишних_хлопот:_узнайте_как![/url]
[url=http://niagarafallspal.com/read-blog/968/]niagarafallspal.com/read-blog/968[/url]
[url=http://www.hb9lc.org/wiki/index.php/Быстрое_оформление_диплома_любой_специальности/]www.hb9lc.org/wiki/index.php/Быстрое_оформление_диплома_любой_специальности[/url]
[url=http://4asdaiprognoza.listbb.ru/viewtopic.php?f=2&t=658/]4asdaiprognoza.listbb.ru/viewtopic.php?f=2&t=658[/url]
It’s nearly impossible to find knowledgeable people for this subject, however, you sound like you know what you’re talking about! Thanks
india pharmacy mail order: best india pharmacy – Online medicine home delivery
http://indiapharmast.com/# world pharmacy india
canadapharmacyonline [url=http://canadapharmast.com/#]pharmacy in canada[/url] canadian pharmacies comparison
[u][b] Привет, друзья![/b][/u]
[b]Мы готовы предложить дипломы[/b] психологов, юристов, экономистов и других профессий по приятным ценам.
[url=http://openmotonews.ru/vash-diplom-byistro-i-nadezhno/]openmotonews.ru/vash-diplom-byistro-i-nadezhno[/url]
I’m pretty pleased to find this site. I need to to thank you for your time for this particularly wonderful read!! I definitely appreciated every part of it and I have you saved as a favorite to look at new information in your web site.
amoxicillin price without insurance amoxicillin 500 mg where to buy
https://maps.google.com.ua/url?sa=j&source=web&rct=j&url=https://amoxildelivery.pro amoxicillin online pharmacy
[url=https://images.google.ki/url?sa=t&url=https://amoxildelivery.pro]buy amoxil[/url] order amoxicillin 500mg
buy paxlovid online: paxlovid cost without insurance – paxlovid cost without insurance
http://paxloviddelivery.pro/# paxlovid price
[u][b] Добрый день![/b][/u]
[b]Заказать документ[/b] о получении высшего образования можно у нас в столице.
[url=http://ast-diplom24.ru/kupit-diplom-moskva/]ast-diplom24.ru/kupit-diplom-moskva[/url]
[u][b] Добрый день![/b][/u]
[b]Приобрести документ[/b] о получении высшего образования вы можете в нашей компании в Москве.
[url=http://diplomyx24.ru/kupit-diplom-sankt-peterburg/]diplomyx24.ru/kupit-diplom-sankt-peterburg[/url]
[b]Удачи![/b]
I’ve bookmarked this for future reference.seo 백링크
Приобретение диплома ПТУ с сокращенной программой обучения в Москве
[url=http://diplomasx24.ru/kupit-diplom-ekaterinbur/]diplomasx24.ru/kupit-diplom-ekaterinbur[/url]
Enregistrez-vous en utilisant le code promo 1xbet aujourd’huidice afin de profiter d’une offre exclusive de bonus de 100% jusqu’a 130$ sur les paris sportifs gratuits. Pour beneficier de cette offre de pari gratuit bonifiee, vous devrez placer 5 paris sur des accumulateurs dans les 30 jours. Il existe diverses strategies pour les paris combines, mais si vous souhaitez gagner et obtenir des paris gratuits, nous vous recommandons de privilegier des selections de cotes plus courtes et de vous concentrer sur des paris combines surs pour commencer.
https://ciprodelivery.pro/# purchase cipro
paxlovid cost without insurance [url=https://paxloviddelivery.pro/#]п»їpaxlovid[/url] paxlovid buy
https://ciprodelivery.pro/# ciprofloxacin generic
[u][b] Добрый день![/b][/u]
[b]Как не попасть впросак при покупке диплома колледжа или ПТУ в России [/b]
[url=http://j67236dr.bget.ru/index.php?subaction=userinfo&user=icyrop/]j67236dr.bget.ru/index.php?subaction=userinfo&user=icyrop[/url]
[u][b] Рады оказать помощь![u][b].
It’s difficult to find knowledgeable people in this particular subject, however, you sound like you know what you’re talking about! Thanks
[u][b] Привет, друзья![/b][/u]
[b]Можно ли быстро купить диплом старого образца и в чем подвох? [/b]
[url=http://fordtransit.5nx.ru/viewtopic.php?f=25&t=9347/]fordtransit.5nx.ru/viewtopic.php?f=25&t=9347[/url]
[u][b] Окажем помощь![u][b].
п»їpaxlovid: paxlovid pill – paxlovid buy
https://clomiddelivery.pro/# how can i get cheap clomid for sale
paxlovid for sale [url=https://paxloviddelivery.pro/#]buy paxlovid online[/url] paxlovid pharmacy
Good article. I am experiencing some of these issues as well..
doxycycline 200mg price in india: vibramycin doxycycline – doxycycline pills buy
can you get generic clomid prices can i order cheap clomid pills
https://cse.google.ge/url?q=https://clomiddelivery.pro can you get generic clomid without dr prescription
[url=http://data.oekakibbs.com/search/search.php?id=**%A4%EB%A4%AD%A4%EB%A4%AD%A4%EB%A4%AD*geinou*40800*40715*png*21*265*353*%A4%A6%A4%AD*2006/09/03*clomiddelivery.pro***0*0&wcolor=000060080000020&wword=%A5%D1%A5%BD%A5%B3%A5%F3]cost of generic clomid without dr prescription[/url] buying clomid tablets
[u][b] Добрый день![/b][/u]
[b]Мы предлагаем документы ВУЗов[/b], которые расположены на территории всей России. Вы сможете заказать качественный диплом за любой год, указав подходящую специальность и оценки за все дисциплины. Дипломы и аттестаты выпускаются на бумаге высшего качества. Это дает возможности делать государственные дипломы, не отличимые от оригиналов. Документы будут заверены необходимыми печатями и штампами.
[url=http://faithstreamer.com/blogs/3114/%D0%9F%D0%BE%D0%B4%D1%80%D0%BE%D0%B1%D0%BD%D0%BE%D0%B5-%D0%BE%D0%BF%D0%B8%D1%81%D0%B0%D0%BD%D0%B8%D0%B5-%D0%BF%D0%BE%D0%BA%D1%83%D0%BF%D0%BA%D0%B8-%D0%B4%D0%BE%D0%BA%D1%83%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2-%D0%B2-%D0%B8%D0%B7%D0%B2%D0%B5%D1%81%D1%82%D0%BD%D0%BE%D0%BC-%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%BD%D0%B5%D1%82-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5/]faithstreamer.com/blogs/3114/%D0%9F%D0%BE%D0%B4%D1%80%D0%BE%D0%B1%D0%BD%D0%BE%D0%B5-%D0%BE%D0%BF%D0%B8%D1%81%D0%B0%D0%BD%D0%B8%D0%B5-%D0%BF%D0%BE%D0%BA%D1%83%D0%BF%D0%BA%D0%B8-%D0%B4%D0%BE%D0%BA%D1%83%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2-%D0%B2-%D0%B8%D0%B7%D0%B2%D0%B5%D1%81%D1%82%D0%BD%D0%BE%D0%BC-%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%BD%D0%B5%D1%82-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5[/url]
купить дипломы об окончании техникума [url=https://ast-diploms.com/]ast-diploms.com[/url] .
где смотреть дату выдачи диплома о высшем образовании [url=https://diplomasx.com/]где смотреть дату выдачи диплома о высшем образовании[/url] .
купить диплом специалиста в казани [url=www.diploms-x.com]www.diploms-x.com[/url] .
Travis Scott https://astroworld.travis-scott-ar.com is one of the brightest stars in the modern hip-hop industry.
The history of one of France’s https://france.paris-saint-germain-ar.com most famous football clubs, Paris Saint-Germain, began in 1970, when capitalist businessmen Henri Delaunay and Jean-Auguste Delbave founded the club in the Paris Saint-Germain-en-Laye area.
Juventus Football Club https://italy.juventus-ar.com is one of the most successful and decorated clubs in the history of Italian and world football.
Chelsea https://england.chelsea-ar.com is one of the most successful English football clubs of our time.
buy generic ciprofloxacin: cipro ciprofloxacin – ciprofloxacin over the counter
https://ciprodelivery.pro/# buy cipro
https://clomiddelivery.pro/# where to get cheap clomid
[u][b] Здравствуйте![/b][/u]
Приобрести документ о получении высшего образования вы сможете в нашей компании в Москве. Мы оказываем услуги по продаже документов об окончании любых университетов Российской Федерации. Вы сможете получить необходимый диплом по любым специальностям, любого года выпуска, в том числе документы СССР.
[url=http://baraholka.forum2x2.ru/t2916-topic#8115/]baraholka.forum2x2.ru/t2916-topic#8115[/url]
[url=http://wheeoo.com/read-blog/14181/]wheeoo.com/read-blog/14181[/url]
[url=http://1stroitelny.kz/faq/show/id/669248c6a489f940a43a1afc.html/]1stroitelny.kz/faq/show/id/669248c6a489f940a43a1afc.html[/url]
[url=http://ls.co-x.ru/2024/07/15/diplomy-dlya-vashego-uspeha.html/]ls.co-x.ru/2024/07/15/diplomy-dlya-vashego-uspeha.html[/url]
[url=http://bike.by/forum/viewtopic.php?f=84&t=36612/]bike.by/forum/viewtopic.php?f=84&t=36612[/url]
Good day! I could have sworn I’ve visited this site before but after browsing through many of the posts I realized it’s new to me. Anyhow, I’m certainly pleased I found it and I’ll be bookmarking it and checking back frequently.
купить диплом вуза спб [url=https://asxdiplomik24.ru/]asxdiplomik24.ru[/url] .
http://doxycyclinedelivery.pro/# doxycycline brand name india
paxlovid pill [url=http://paxloviddelivery.pro/#]paxlovid pill[/url] paxlovid pill
I want to to thank you for this very good read!! I certainly enjoyed every little bit of it. I have you book marked to look at new things you post…
[u][b] Привет, друзья![/b][/u]
[b]Заказать документ[/b] ВУЗа вы можете в нашей компании.
[url=http://ast-diploms.com/kupit-diplom-ekaterinbur/]ast-diploms.com/kupit-diplom-ekaterinbur[/url]
paxlovid price buy paxlovid online
http://www.bssystems.org/url?q=https://paxloviddelivery.pro Paxlovid buy online
[url=http://historico.cubainformacion.tv/enlazar.php?video=leccionesdemanipulacion077ITA.flv&id=17321&ur=https://paxloviddelivery.pro/]paxlovid pill[/url] buy paxlovid online
paxlovid buy: paxlovid generic – paxlovid cost without insurance
http://ciprodelivery.pro/# buy cipro cheap
cipro 500mg best prices [url=https://ciprodelivery.pro/#]cipro ciprofloxacin[/url] ciprofloxacin over the counter
[u][b] Здравствуйте![/b][/u]
[b]Купить документ[/b] о получении высшего образования вы можете у нас.
[url=http://ast-diplomas.com/otzyvy/]ast-diplomas.com/otzyvy[/url]
[b]Успешной учебы![/b]
Several popular cryptocurrency apps have hundreds of available cryptos. For example, Crypto has one of the largest lists of cryptocurrencies available for U.S. traders to buy and sell. Coinbase and Gemini also have a wide range of cryptos. Traders using brokers to buy and sell cryptocurrency derivatives contracts do not own the actual cryptocurrency. This is because cryptocurrency derivatives products are a form of speculative “betting.” Buy BTC, ETH, and other crypto easily Even though you cannot (yet) buy real, cashable cryptocurrencies (e.g. Bitcoins) at CapTrader, this does not mean that you cannot participate in this exciting market. In the meantime, there are a variety of products of different types, which can be traded on the classic exchanges (and thus of course also with us), and make participation easier than ever for you. It is up to you whether you decide to invest directly in a future, an ETF ETN or a fund, or whether you prefer a lower correlation via shares, which may offer additional opportunities. In the following, we present some options from each of these areas, so that you can make the optimal choice for your goals.
http://tmenter.net/bbs/board.php?bo_table=free&me_code=&wr_id=41031
Mudrex is the top crypto investing app in India for its simplicity and variety. With over 350 coins and tokens available, investing is quick and easy: deposit funds, pick your coin or token, and invest. Plus, it prioritises security with biometric authentication and cold wallet storage. Mudrex also offers expert-curated “Coin Sets” for diversified investing, reducing risk and making it stand out as the best crypto app in India. We earn commissions from some affiliate partners at no extra cost to users (partners are listed on our ‘About Us’ page in the ‘Partners’ section). Despite these affiliations, our content remains unbiased and independent. We generate revenue through banner advertising and affiliate partnerships, which do not influence our impartial reviews or content integrity. Our editorial and marketing teams operate independently, ensuring the accuracy and objectivity of our financial insights.
Автомобили Hongqi https://hongqi-krasnoyarsk.ru в наличии – официальный дилер Hongqi Красноярск
Liverpool https://england.liverpool-ar.com holds a special place in the history of football in England.
When Taylor Swift https://shake-it-off.taylor-swift-ar.com released “Shake It Off” in 2014, she had no idea how much the song would impact her life and music career.
Priyanka Chopra https://baywatch.priyankachopra-ar.com is an Indian actress, singer, film producer and model who has achieved global success.
Здравствуйте!
Стоимость дипломов высшего и среднего образования и процесс их получения
[url=http://arusak-diploms-srednee.ru/kupit-diplom-kandidata-nauk ]arusak-diploms-srednee.ru/kupit-diplom-kandidata-nauk [/url]
Oh my goodness! Awesome article dude! Thank you, However I am going through troubles with your RSS. I don’t understand why I cannot join it. Is there anybody having the same RSS problems? Anybody who knows the solution can you kindly respond? Thanx.
buy cipro online: ciprofloxacin – buy cipro cheap
https://doxycyclinedelivery.pro/# cost of doxycycline 100mg in india
[u][b] Здравствуйте![/b][/u]
[b]Как быстро получить диплом магистра? Легальные способы [/b]
[url=http://чпуремонт.рф/showthread.php?tid=53674/]чпуремонт.рф/showthread.php?tid=53674[/url]
Окажем помощь!
cheap amoxicillin 500mg: buying amoxicillin online – buy amoxicillin from canada
http://ciprodelivery.pro/# where can i buy cipro online
Jennifer Lopez https://lets-get-loud.jenniferlopez-ar.com was born in 1969 in the Bronx, New York, to parents who were Puerto Rican immigrants.
http://ciprodelivery.pro/# cipro for sale
doxycycline price in india [url=http://doxycyclinedelivery.pro/#]doxycycline antimalarial[/url] doxycycline 100mg capsules price
[u][b] Добрый день![/b][/u]
[b]Мы готовы предложить документы ВУЗов[/b], которые находятся в любом регионе России. Можно заказать качественный диплом от любого заведения, за любой год, указав необходимую специальность и оценки за все дисциплины. Дипломы и аттестаты печатаются на бумаге высшего качества. Это позволяет делать государственные дипломы, не отличимые от оригиналов. Они будут заверены необходимыми печатями и штампами.
[url=http://sonnick84.bloguetechno.com/%D0%91%D1%8B%D1%81%D1%82%D1%80%D0%BE-%D0%B7%D0%B0%D0%BA%D0%B0%D0%B7%D1%8B%D0%B2%D0%B0%D0%B5%D0%BC-%D0%B0%D1%82%D1%82%D0%B5%D1%81%D1%82%D0%B0%D1%82-%D0%B2-%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%BD%D0%B5%D1%82-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5-russian-diplom-63743859/]sonnick84.bloguetechno.com/%D0%91%D1%8B%D1%81%D1%82%D1%80%D0%BE-%D0%B7%D0%B0%D0%BA%D0%B0%D0%B7%D1%8B%D0%B2%D0%B0%D0%B5%D0%BC-%D0%B0%D1%82%D1%82%D0%B5%D1%81%D1%82%D0%B0%D1%82-%D0%B2-%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%BD%D0%B5%D1%82-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5-russian-diplom-63743859[/url]
After some difficult years in the late 2010s, Manchester United https://england.manchester-united-ar.com returned to greatness in English football by 2024.
The Formula One World Championship https://world-circuit-racing-championship.formula-1-ar.com, known as the Formula Championship in motor racing, is the highest tier of professional motor racing.
Michael Jordan https://chicago-bulls.michael-jordan-ar.com is one of the greatest basketball players of all time, whose career with the Chicago Bulls is legendary.
buy amoxicillin online without prescription amoxicillin 500 mg cost
https://www.blogarama.com/redirect.php?destination=http://amoxildelivery.pro amoxicillin buy no prescription
[url=http://tsm.ru/bitrix/redirect.php?event1=&event2=&event3=&goto=https://amoxildelivery.pro/]where to buy amoxicillin[/url] amoxicillin 500 coupon
прихожая дизайн интерьера https://dizayn-interera-doma.ru
paxlovid covid: п»їpaxlovid – paxlovid for sale
http://ciprodelivery.pro/# ciprofloxacin generic
paxlovid buy [url=https://paxloviddelivery.pro/#]paxlovid india[/url] Paxlovid buy online
This is a good tip particularly to those fresh to the blogosphere. Short but very precise info… Thanks for sharing this one. A must read post.
[u][b] Добрый день![/b][/u]
Приобрести документ о получении высшего образования вы можете в нашей компании. Мы оказываем услуги по производству и продаже документов об окончании любых университетов России.
[url=http://msfo-soft.ru/msfo/forum/messages/forum33/topic9962/message278497/?result=new#message278497/]msfo-soft.ru/msfo/forum/messages/forum33/topic9962/message278497/?result=new#message278497[/url]
[url=http://”www.fsh.mi.th/newswb3/index.php?action=profile;u=69625″/]”www.fsh.mi.th/newswb3/index.php?action=profile;u=69625″[/url]
[url=http://bazar-planet.ru/index.php?threads/Нужна-работа.87/page-5#post-5030/]bazar-planet.ru/index.php?threads/Нужна-работа.87/page-5#post-5030[/url]
[url=http://munservis.mirniy.ru/index.php?subaction=userinfo&user=eqize/]munservis.mirniy.ru/index.php?subaction=userinfo&user=eqize[/url]
[url=http://camillacastro.us/forums/viewtopic.php?pid=407075#p407075/]camillacastro.us/forums/viewtopic.php?pid=407075#p407075[/url]
https://clomiddelivery.pro/# how to buy generic clomid without rx
car rental Montenegro airport https://montenegro-car-rental-hire.com
The golf https://arabic.golfclub-ar.com industry in the Arab world is growing rapidly, attracting players from all over the world.
Mike Tyson https://american-boxer.mike-tyson-ar.com one of the most famous and influential boxers in history, was born on June 30, 1966 in Brooklyn, New York.
Manny Pacquiao https://filipino-boxer.manny-pacquiao-ar.com is one of the most prominent boxers in the history of the sport.
Muhammad Ali https://american-boxer.muhammad-ali-ar.com is perhaps one of the most famous and greatest athletes in the history of boxing.
where buy cheap clomid pill: cost generic clomid – cost of clomid for sale
http://clomiddelivery.pro/# can you get generic clomid without dr prescription
[u][b] Добрый день![/b][/u]
[b]Купить документ[/b] о получении высшего образования можно в нашей компании.
[url=http://ast-diplomas.com/kupit-diplom-bakalavra-ili-specialista /]ast-diplomas.com/kupit-diplom-bakalavra-ili-specialista [/url]
I really like it when folks come together and share ideas. Great site, keep it up!
[u][b] Привет![/b][/u]
[b]Заказать документ[/b] о получении высшего образования вы имеете возможность в нашей компании в столице.
[url=http://diploms-x.com/kupit-diplom-o-srednem-obrazovanii/]diploms-x.com/kupit-diplom-o-srednem-obrazovanii[/url]
[b]Успешной учебы![/b]
paxlovid pill paxlovid price
https://www.akutsu-dc.com/feed2js/feed2js.php?src=https://paxloviddelivery.pro paxlovid price
[url=https://cse.google.gg/url?sa=t&url=https://paxloviddelivery.pro]п»їpaxlovid[/url] paxlovid for sale
http://clomiddelivery.pro/# generic clomid
paxlovid covid [url=http://paxloviddelivery.pro/#]paxlovid price[/url] Paxlovid buy online
how can i get generic clomid without prescription get generic clomid no prescription
https://cse.google.com.pg/url?sa=t&url=https://clomiddelivery.pro where to buy cheap clomid without rx
[url=http://www.google.co.ck/url?q=http://clomiddelivery.pro]can you get generic clomid pills[/url] buy generic clomid without prescription
buy clomid tablets: how to get cheap clomid pills – can you buy clomid for sale
Find medicine details. Patient drug facts.
[url=https://imitrex2rp.top/#]sumatriptan[/url]
Access medicine facts. Get pill facts.
Greetings, I do believe your site could be having browser compatibility issues. Whenever I take a look at your blog in Safari, it looks fine however when opening in I.E., it has some overlapping issues. I just wanted to provide you with a quick heads up! Apart from that, excellent site!
[u][b] Привет, друзья![/b][/u]
[b]Заказать диплом о высшем образовании.[/b]
[url=http://rusere.ru/communication/forum/messages/forum11/message3680/2967-kak-podobrat-nadezhnyy-magazin-s-bolshim-katalogom-diplomov?result=new/]rusere.ru/communication/forum/messages/forum11/message3680/2967-kak-podobrat-nadezhnyy-magazin-s-bolshim-katalogom-diplomov?result=new[/url]
Access medication details. Get pill info.
[url=https://imitrex2rp.top/#]buy imitrex pills online[/url]
Misuse consequences detailed. Pill information here.
[u][b] Привет![/b][/u]
Заказать документ о получении высшего образования.
[url=http://blogsfere.com/viewtopic.php?t=181683/]blogsfere.com/viewtopic.php?t=181683[/url]
[url=http://industrialagency.org/blogs/74709/Легкий-способ-получить-диплом-любой-профессии/]industrialagency.org/blogs/74709/Легкий-способ-получить-диплом-любой-профессии[/url]
[url=http://pokemon-go.onl/users/6146/]pokemon-go.onl/users/6146[/url]
[url=http://buldingnews.ru/diplomyi-s-garantiey-podlinnosti/]buldingnews.ru/diplomyi-s-garantiey-podlinnosti[/url]
[url=http://wiki.why42.ru/wiki/Оформление_дипломов_с_гарантией_качества/]wiki.why42.ru/wiki/Оформление_дипломов_с_гарантией_качества[/url]
Comprehensive pill resource. Patient medicine info.
[url=https://imitrex2rp.top/#]order sumatriptan[/url]
Latest drug news. Medicine facts provided.
[u][b] Добрый день![/b][/u]
[b]Реально ли приобрести диплом стоматолога? Основные этапы [/b]
[url=http://deviva.ru/viewtopic.php?id=9117#p62051/]deviva.ru/viewtopic.php?id=9117#p62051[/url]
Рады помочь!
where can i buy amoxicillin over the counter uk: amoxicillin 500 mg tablet – amoxicillin 500mg capsules price
https://amoxildelivery.pro/# amoxicillin canada price
cipro pharmacy [url=https://ciprodelivery.pro/#]cipro pharmacy[/url] cipro ciprofloxacin
https://doxycyclinedelivery.pro/# buy doxycycline online usa
Read about medications. Get pill info.
[url=https://imitrex2rp.top/#]buy imitrex uk[/url]
Pill impacts described. Medication leaflet provided.
Latest medicine developments. Medication essentials explained.
[url=https://imitrex2rp.top/#]buy sumatriptan online[/url]
Patient drug information. Pill trends described.
You are so cool! I do not think I have read through something like this before. So nice to find someone with a few original thoughts on this issue. Seriously.. thank you for starting this up. This web site is something that is needed on the web, someone with a bit of originality.
[u][b] Привет, друзья![/b][/u]
[b]Мы можем предложить документы ВУЗов[/b], расположенных в любом регионе РФ. Можно заказать диплом за любой год, указав актуальную специальность и хорошие оценки за все дисциплины. Дипломы и аттестаты выпускаются на бумаге высшего качества. Это позволяет делать настоящие дипломы, не отличимые от оригинала. Документы заверяются необходимыми печатями и подписями.
[url=http://astronomyfriends.com/read-blog/316/]astronomyfriends.com/read-blog/316[/url]
paxlovid price: Paxlovid over the counter – paxlovid buy
https://amoxildelivery.pro/# where can i buy amoxicillin without prec
Side effects explained. Pill leaflet here.
[url=https://imitrex2rp.top/#]buy imitrex usa[/url]
Medicine trends available. Comprehensive drug facts.
[u][b] Здравствуйте![/b][/u]
[b]Как получить диплом техникума официально и без лишних проблем [/b]
[url=http://dinskoi-raion.ru/forum/?PAGE_NAME=profile_view&UID=64044/]dinskoi-raion.ru/forum/?PAGE_NAME=profile_view&UID=64044[/url]
[u][b] Рады оказаться полезными![u][b].
The road to the Premier League https://english-championship.premier-league-ar.com begins long before a team gets promoted to the English Premier League for the first time
In recent years, the leading positions in the Spanish https://spanish-championship.laliga-ar.com championship have been firmly occupied by two major giants – Barcelona and Real Madrid.
The Italian football championship https://italian-championship.serie-a-ar.com known as Serie A, has seen an impressive revival in recent years.
In the German football https://german-championship.bundesliga-football-ar.com championship known as the Bundesliga, rivalries between clubs have always been intense.
Patient drug resource. Medication leaflet here.
[url=https://imitrex2rp.top/#]where buy imitrex[/url]
Patient pill resource. Get drug facts.
http://amoxildelivery.pro/# buy amoxicillin without prescription
where can i get cheap clomid price [url=http://clomiddelivery.pro/#]clomid otc[/url] can you get cheap clomid without rx
Formulation info listed. Get pill details.
[url=https://imitrex2rp.top/#]buy imitrex cheap[/url]
Read about medications. Pill overview available.
[url=http://zoloto585.ru/bitrix/rk.php?goto=https://jamalmusiala-br.biz]musiala[/url]
[url=https://www.aegeussociety.org/antiquity/index.php?e=curl_error&return=https://jamalmusiala-br.biz]musiala[/url]
[url=http://kosmosmebel.ru.xx3.kz/go.php?url=https://jamalmusiala-br.biz]musiala[/url]
[url=https://totalfreewebcams.chaturbate.com/external_link/?url=https://jamalmusiala-br.biz]musiala[/url]
[url=http://www.madinterracial.com/out.php?m=60&url=https://jamalmusiala-br.biz]musiala[/url]
[url=http://libproxy.kmou.ac.kr/_Lib_Proxy_Url/https://jamalmusiala-br.biz]musiala[/url]
[url=http://evertkok.nl/informatica/PHP/test2.php?a%5B%5D=<a%20href=https://jamalmusiala-br.biz]musiala[/url]
[url=https://www.sandbox.t.me/s/worldcasinonet.co/url?sa=t&url=http%3A%2F%2Ft.me/s/worldcasinonet]musiala[/url]
[url=https://mkblog.cn/go/?url=https://jamalmusiala-br.biz]musiala[/url]
[url=https://r.triptease.io/redirect?url=https://jamalmusiala-br.biz]musiala[/url]
[url=http://www.style.hu/redirect.php?url=https://jamalmusiala-br.biz]musiala[/url]
[url=http://www.amateur-wives-posts.com/cgi-bin/toplist/out.cgi?id=sambrads&url=https://jamalmusiala-br.biz]musiala[/url]
[url=http://my4rum.mywap.lt/redirect.php?url=https://jamalmusiala-br.biz]musiala[/url]
[url=https://www.google.dk/url?q=https://jamalmusiala-br.biz]musiala[/url]
[url=http://www.irwebcast.com/cgi-local/report/redirect.cgi?url=https://jamalmusiala-br.biz]musiala[/url]
last musialanews here!
musiala
musiala
musiala
musiala
musiala
musiala
musiala
musiala
musiala
musiala
musiala
musiala
musiala
musiala
musiala
[url=https://openx.lepetitjournal.com/openx/www/delivery/ck.php?ct=1&oaparams=2__bannerid=10266__zoneid=961__cb=8a91cc394e__oadest=https://firminoroberto-fr.biz]firmino[/url]
[url=http://www.maturetubeporn.com/cgi-bin/atx/out.cgi?id=496&tag=toplistbtm&trade=https://firminoroberto-fr.biz]firmino[/url]
[url=https://elsword.fun/out/ct.php?url=https://firminoroberto-fr.biz]firmino[/url]
[url=http://xn--12cb9hxa5ad0h.net/re?url=https://firminoroberto-fr.biz]firmino[/url]
[url=http://factfaces.com.xx3.kz/go.php?url=https://firminoroberto-fr.biz]firmino[/url]
[url=http://www.british-girls.com/out.php?url=https://firminoroberto-fr.biz]firmino[/url]
[url=http://www.pump-world.com/magazine/link.asp?lgg=en&company=P+&+M+Pumps§ion=1&id=8931&caption=Chopper+Pumps+meet+the+Challange+of+Corrosives&info=11.06.2016&redir=http:/https://firminoroberto-fr.biz]firmino[/url]
[url=http://wkx21c.org/external/?url=https://firminoroberto-fr.biz]firmino[/url]
[url=https://duran.blog.idnes.cz/redir.aspx?url=https://firminoroberto-fr.biz]firmino[/url]
[url=http://www.luckyplants.com/cgi-bin/toplist/out.cgi?id=stargirl&url=https://firminoroberto-fr.biz]firmino[/url]
[url=http://kancmarket.com/bitrix/redirect.php?event1=&event2=&event3=&goto=https://firminoroberto-fr.biz]firmino[/url]
[url=http://www.saeys.se/gastbok/go.php?url=https://firminoroberto-fr.biz]firmino[/url]
[url=https://www.united-uniforms.ru/bitrix/redirect.php?event1=click_to_call&event2=&event3=&goto=https://firminoroberto-fr.biz]firmino[/url]
[url=https://nl.xhamster.desi/exit.php?url=https://firminoroberto-fr.biz]firmino[/url]
[url=http://www.appspecialisten.nl/outbound.php?url=https://firminoroberto-fr.biz]firmino[/url]
last news about firmino
firmino
firmino
firmino
firmino
firmino
firmino
firmino
firmino
firmino
firmino
firmino
firmino
firmino
firmino
firmino
[u][b] Здравствуйте![/b][/u]
[b]Приобретение диплома ПТУ с сокращенной программой обучения в Москве[/b]
[url=http://vseogirls.ru/diplomyi-s-vyisokoy-autentichnostyu/]vseogirls.ru/diplomyi-s-vyisokoy-autentichnostyu[/url]
Hi, I do think this is a great web site. I stumbledupon it 😉 I will return once again since i have book marked it. Money and freedom is the best way to change, may you be rich and continue to help others.
Latest drug news. Medicine facts here.
[url=https://imitrex2rp.top/#]buy imitrex online without prescription[/url]
Patient drug leaflet. Latest medication developments.
http://ciprodelivery.pro/# buy ciprofloxacin over the counter
[url=https://xn--h1aliz.xn—–6kcabadf9abziijtfnmdu6ag9byao6t.xn--p1ai/bitrix/redirect.php?goto=https://firminoroberto-fr.biz]firmino[/url]
[url=http://kia-perm.ru/bitrix/rk.php?goto=https://firminoroberto-fr.biz]firmino[/url]
[url=http://kchr.ru/bitrix/rk.php?goto=https://firminoroberto-fr.biz]firmino[/url]
[url=http://uaport.net/cgi-bin/go?https://firminoroberto-fr.biz]firmino[/url%5D
[url=http://angelafiore.com/guestbook/go.php?url=https://firminoroberto-fr.biz]firmino[/url]
[url=https://linzacity.ru/bitrix/redirect.php?goto=https://firminoroberto-fr.biz]firmino[/url]
[url=https://www.fortrucker-env.com/leaving.aspx?ext=https://firminoroberto-fr.biz]firmino[/url]
[url=http://www.turist-club.ru/go/url=https://firminoroberto-fr.biz]firmino[/url]
[url=https://click.odds.am/redir/redirect.php?go=https://firminoroberto-fr.biz]firmino[/url]
[url=http://proactivereminders.mobi.xx3.kz/go.php?url=https://firminoroberto-fr.biz]firmino[/url]
[url=http://www.kinobum.com/engine/redirect.php?url=https://firminoroberto-fr.biz]firmino[/url]
[url=https://forum-es.gw2archive.eu/external?l=https://firminoroberto-fr.biz]firmino[/url]
[url=http://www.fahrradreisen-wanderreisen.de/redirect/?url=https://firminoroberto-fr.biz]firmino[/url]
[url=http://my.squirrly.co/go34692/worldgreatsuccess.ruhttps://firminoroberto-fr.biz]firmino[/url]
[url=http://www.nikdaum.com/guest/go.php?url=https://firminoroberto-fr.biz]firmino[/url]
last news about firmino
<a href=http://members.iif.hu/vitez/php3prob/index.php3?a%5B%5D=firmino
firmino
firmino
firmino
firmino
firmino
firmino
firmino
firmino
firmino
firmino
firmino
firmino
firmino
firmino
[url=http://www.cadtec.com.br/index.php?redirect=tps%3A%2F%2Fhydra-onion.nethttps://jamalmusiala-br.biz]musiala[/url]
[url=https://lakickz.com/member/login.html?noMemberOrder=&returnUrl=https://jamalmusiala-br.biz]musiala[/url]
[url=http://teenincest.8teenz.info/out.cgi?ses=3oLBUVA8rG&id=81&url=https://jamalmusiala-br.biz]musiala[/url]
[url=https://mohumohuparadise.hatenablog.com/iframe/hatena_bookmark_comment?canonical_uri=https://jamalmusiala-br.biz]musiala[/url]
[url=http://unitym.com/bitrix/redirect.php?event1=&event2=&event3=&goto=https://jamalmusiala-br.biz]musiala[/url]
[url=http://lozd.com.xx3.kz/go.php?url=https://jamalmusiala-br.biz]musiala[/url]
[url=http://agroservice.hu.xx3.kz/go.php?url=https://jamalmusiala-br.biz]musiala[/url]
[url=http://www.chas-smith.com/__media__/js/netsoltrademark.php?d=https://jamalmusiala-br.biz]musiala[/url]
[url=http://www.texeltv.nl/_a2/vp6.php?vid=musea/ecomare.wmv&link=https://jamalmusiala-br.biz]musiala[/url]
[url=http://www.google.co.zw/url?q=https://jamalmusiala-br.biz]musiala[/url]
[url=https://nagoya.nikke-tennis.jp/?wptouch_switch=desktop&redirect=https://jamalmusiala-br.biz]musiala[/url]
[url=http://it-nord.ru/bitrix/redirect.php?event1=&event2=&event3=&goto=https://jamalmusiala-br.biz]musiala[/url]
[url=http://vsevreg.ru/bitrix/rk.php?goto=https://jamalmusiala-br.biz]musiala[/url]
[url=https://cse.google.fr/url?q=https://jamalmusiala-br.biz]musiala[/url]
[url=https://amateurdorado.com/wp-content/plugins/AND-AntiBounce/redirector.php?url=https://jamalmusiala-br.biz]musiala[/url]
last musialanews here!
musiala
musiala
musiala
musiala
musiala
musiala
musiala
musiala
musiala
musiala
musiala
musiala
musiala
musiala
musiala
EuroAvia24.com – Cheap flights, hotels and transfers around the world!
The Saudi Football League https://saudi-arabian-championship.saudi-pro-league-ar.com known as the Saudi Professional League, is one of the most competitive and dynamic leagues in the world.
Rodrigo Goes https://real-madrid.rodrygo-ar.com better known as Rodrigo, is one of the brightest young talents in modern football.
In an era when many young footballers struggle to find their place at elite clubs, Javi’s https://barcelona.gavi-ar.com story at Barcelona stands out as an exceptional one.
Arsenal https://arsenal.mesut-ozil-ar.com made a high-profile signing in 2013, signing star midfielder Mesut Ozil from Real Madrid.
paxlovid pill: paxlovid generic – Paxlovid over the counter
https://ciprodelivery.pro/# ciprofloxacin 500 mg tablet price
paxlovid price [url=http://paxloviddelivery.pro/#]paxlovid pharmacy[/url] paxlovid covid
can i get generic clomid without a prescription: cost of generic clomid tablets – cost of generic clomid without insurance
[url=http://www.triple-tree.com/external/?url=https://veiga-raphael-br.biz/]raphael[/url]
[url=http://spartatrade.com/bitrix/rk.php?goto=https://veiga-raphael-br.biz/]raphael[/url]
[url=http://www.argia.com/adserver/adclick.php?bannerid=510&zoneid=98&source=&dest=https://veiga-raphael-br.biz/]raphael[/url]
[url=http://raphael.lynms.edu.hk/jump.php?sid=1594&url=https://veiga-raphael-br.biz/]raphael[/url]
[url=http://dbssk.xlwx.cn/old70/redirect.php?tid=39511&goto=https://veiga-raphael-br.biz/]raphael[/url]
[url=http://nwcod.com/forum/away.php?s=https://veiga-raphael-br.biz/]raphael[/url]
[url=http://www.healthypasodelnorte.org/redir.php?url=https://veiga-raphael-br.biz/]raphael[/url]
[url=http://fixet.ru/bitrix/redirect.php?event1=&event2=&event3=&goto=https://veiga-raphael-br.biz/]raphael[/url]
[url=https://heitaku.hatenablog.com/iframe/hatena_bookmark_comment?canonical_uri=https://veiga-raphael-br.biz/]raphael[/url]
[url=http://cdpsecurecdp.s15342144.onlinehome-server.info.xx3.kz/go.php?url=https://veiga-raphael-br.biz/]raphael[/url]
[url=https://kozienice.praca.gov.pl/rynek-pracy/bazy-danych/klasyfikacja-zawodow-i-specjalnosci/wyszukiwarka-opisow-zawodow//-/klasyfikacja_zawodow/zawod/921502?_jobclassificationportlet_WAR_nnkportlet_backUrl=https://veiga-raphael-br.biz/]raphael[/url]
[url=https://www.motsimabuse-dietanzschule.de/wp-content/plugins/AND-AntiBounce/redirector.php?url=https://veiga-raphael-br.biz/]raphael[/url]
[url=http://news-comm.dirx.ru/click.php?url=https://veiga-raphael-br.biz/]raphael[/url]
[url=https://mammamia-online.de/adserver/www/delivery/ck.php?ct=1&oaparams=2__bannerid=22__zoneid=7__cb=175512337a__oadest=https://veiga-raphael-br.biz/]raphael[/url]
[url=http://copqo.com/e.php?u=https://veiga-raphael-br.biz/]raphael[/url]
last news about raphael
raphael
raphael
raphael
raphael
raphael
raphael
raphael
raphael
raphael
raphael
raphael
raphael
raphael
raphael
raphael
[u][b] Здравствуйте![/b][/u]
[b]Заказать документ[/b] института вы можете в нашей компании в столице.
[url=http://ast-diploms24.ru/kupit-diplom-vracha/]ast-diploms24.ru/kupit-diplom-vracha[/url]
[b]Хорошей учебы![/b]
[url=https://engineering.academickeys.com/save.php?dothis=login_form&url=&title=Professor+of+Practice+Faculty+Position+in+Construction+and+Infrastructure+Systems+Engineering+Georgia+Institute+of+TechnologySchool+of+Civil+%26amp%3B+Environmental+Engineeringhttps://messi-lionel-cz.biz]messi[/url]
[url=https://it.maprogress.com/viewswitcher/switchview?mobile=true&returnurl=https://messi-lionel-cz.biz]messi[/url]
[url=http://dlps.youtx.com/cps/CpsSearch.aspx?cpsPartnerID=39&CpsSearchUrl=https://messi-lionel-cz.biz]messi[/url]
[url=https://www.t.me/s/worldcasinonet.co/url?sa=t&url=http%3A%2F%2Ft.me/s/worldcasinonet]messi[/url]
[url=https://www.hitplus.fr/2018/click.php?url=https://messi-lionel-cz.biz]messi[/url]
[url=http://forum-people.ru/click.php?https://messi-lionel-cz.biz]messi[/url%5D
[url=http://petrental-portal.info/rank.php?mode=link&id=64&url=https://messi-lionel-cz.biz]messi[/url]
[url=https://image.t.me/s/worldcasinonet.vc/url?q=https://messi-lionel-cz.biz]messi[/url]
[url=http://ichikawa.genki365.net/gnki02/common/redirect.php?url=https://messi-lionel-cz.biz]messi[/url]
[url=https://maps.google.ga/url?q=https://messi-lionel-cz.biz]messi[/url]
[url=http://www.teenbigasses.com/cgi-bin/atx/out.cgi?s=65&u=https://messi-lionel-cz.biz]messi[/url]
[url=http://www.traplist.com/dtr/link.php?thumb_id=23571d02c312d60a693d65653b591e36&tag_id=6&c=4some&url=https://messi-lionel-cz.biz]messi[/url]
[url=http://www.phototrans.eu/redirect.php?id=35&url=https://messi-lionel-cz.biz]messi[/url]
[url=http://www.haodp.com/go.php?go=https://messi-lionel-cz.biz]messi[/url]
[url=http://www.comsz.com/Message.asp?type=1&url=https://messi-lionel-cz.biz]messi[/url]
last news about messi
messi
messi
messi
messi
messi
messi
messi
messi
messi
messi
messi
messi
messi
messi
messi
how much is amoxicillin amoxicillin 200 mg tablet
http://sermedin.com/galeria/main.php?g2_view=core.UserAdmin&g2_subView=core.UserLogin&g2_return=https://amoxildelivery.pro/ amoxicillin 500mg buy online uk
[url=http://maps.google.co.ls/url?sa=t&url=https://amoxildelivery.pro]amoxicillin 1000 mg capsule[/url] where can i buy amoxicillin over the counter uk
купить диплом высшее купить диплом корочку [url=https://diploms-x.com/]diploms-x.com[/url] .
Enregistrez-vous en utilisant le code promo de 1xbet afin de profiter d’une offre exclusive de bonus de 100% jusqu’a 130$ sur les paris sportifs gratuits. Pour beneficier de cette offre de pari gratuit bonifiee, vous devrez placer 5 paris sur des accumulateurs dans les 30 jours. Il existe diverses strategies pour les paris combines, mais si vous souhaitez gagner et obtenir des paris gratuits, nous vous recommandons de privilegier des selections de cotes plus courtes et de vous concentrer sur des paris combines surs pour commencer.
paxlovid cost without insurance п»їpaxlovid
http://crewe.de/url?q=https://paxloviddelivery.pro paxlovid cost without insurance
[url=http://www.wittstock.chemie.uni-oldenburg.de/agef/link_extern.html?link=https://paxloviddelivery.pro]paxlovid cost without insurance[/url] paxlovid for sale
[url=http://allgoodlawyers.org.xx3.kz/go.php?url=https://marcuswendel-br.biz]wendel[/url]
[url=http://nudeasianpics.net/fln/mvgu.cgi?oo=1&s=65&u=https://marcuswendel-br.biz]wendel[/url]
[url=https://pretparken.be/nl/telparkexit.asp?url=https://marcuswendel-br.biz]wendel[/url]
[url=http://eurekatomsk.ru/bitrix/rk.php?goto=https://marcuswendel-br.biz]wendel[/url]
[url=http://m.verywed.com/redirect.php?url=https://marcuswendel-br.biz]wendel[/url]
[url=http://t.me/s/worldcasinonet.xx3.kz/go.php?url=https://marcuswendel-br.biz]wendel[/url]
[url=http://www.t.me/s/worldcasinonet.ph/url?sa=U&start=1&q=https://marcuswendel-br.biz]wendel[/url]
[url=http://donkoleso.com/bitrix/redirect.php?event1=&event2=&event3=&goto=https://marcuswendel-br.biz]wendel[/url]
[url=http://www.lasvillas-online.com/nc/es/66/holiday/fewo/Casa_Sonnenschein///Casa%20de%20vacaciones/?user_cwdmobj_pi1%5Burl%5D=https://marcuswendel-br.biz]wendel[/url]
[url=http://tachingersee.de/redir.php?url=https://marcuswendel-br.biz]wendel[/url]
[url=http://forex-blog-uk.blogspot.ca/search/?label=https://marcuswendel-br.biz]wendel[/url]
[url=http://www.granniesfilmed.com/cgi-bin/out.cgi?click=im_1349_03_tgp2.jpg.10357&url=https://marcuswendel-br.biz]wendel[/url]
[url=https://maps.google.ki/url?q=/https://marcuswendel-br.biz]wendel[/url]
[url=https://draxler.blog.idnes.cz/redir.aspx?url=https://marcuswendel-br.biz]wendel[/url]
[url=http://chinatown2.ru/go.php?go=https://marcuswendel-br.biz]wendel[/url]
last news about marcus wendel!
wendel
wendel
wendel
wendel
wendel
wendel
wendel
wendel
wendel
wendel
wendel
wendel
wendel
wendel
wendel
[url=http://www.degroot-int.net/modules/babel/redirect.php?newlang=nl_NL&newurl=https://ronaldo-cristiano-tr.biz]ronaldo[/url]
[url=http://arocswfl.org.xx3.kz/go.php?url=https://ronaldo-cristiano-tr.biz]ronaldo[/url]
[url=http://nudeandfresh.com/cgi-bin/atx/out.cgi?id=22&tag=galtoplist&trade=https://ronaldo-cristiano-tr.biz]ronaldo[/url]
[url=https://msoccer.hatenablog.com/iframe/hatena_bookmark_comment?canonical_uri=https://ronaldo-cristiano-tr.biz]ronaldo[/url]
[url=http://implantcity.ru/bitrix/redirect.php?goto=https://ronaldo-cristiano-tr.biz]ronaldo[/url]
[url=https://www.waybuilder.net/free-ed/Resources/pdfArticle00.asp?ts=A%20Free%20Press&iu=https://ronaldo-cristiano-tr.biz]ronaldo[/url]
[url=http://sakurakaze.s6.xrea.com/yomis/rank.cgi?mode=link&id=114&url=https://ronaldo-cristiano-tr.biz]ronaldo[/url]
[url=https://boehmova.blog.idnes.cz/redir.aspx?url=https://ronaldo-cristiano-tr.biz]ronaldo[/url]
[url=https://dubcova.blog.idnes.cz/redir.aspx?url=https://ronaldo-cristiano-tr.biz]ronaldo[/url]
[url=http://t-onlne.hut2.ru/test.php?a%5B%5D=<a%20href=https://ronaldo-cristiano-tr.biz]ronaldo[/url]
[url=http://closingbell.co/click?url=https://ronaldo-cristiano-tr.biz]ronaldo[/url]
[url=http://www.senwes.co.za/LinkTrack.aspx?i=Sat24LinkAF&url=https://ronaldo-cristiano-tr.biz]ronaldo[/url]
[url=https://mobifirst.co/bonus?name=Stanford+Pelage&url=&submit=Click+To+Create+Your+Bonus+Page+https://ronaldo-cristiano-tr.biz]ronaldo[/url]
[url=http://ural.hu/www/url.php?url=https://ronaldo-cristiano-tr.biz]ronaldo[/url]
[url=http://www.cdu-bad-urach.de/index.php?id=873&type=0&jumpurl=https://ronaldo-cristiano-tr.biz]ronaldo[/url]
last news about cristiano ronaldo
ronaldo
ronaldo
ronaldo
ronaldo
ronaldo
ronaldo
ronaldo
ronaldo
ronaldo
ronaldo
ronaldo
ronaldo
ronaldo
ronaldo
ronaldo
Hi there! I simply wish to give you a huge thumbs up for your excellent information you’ve got right here on this post. I will be coming back to your site for more soon.
[url=http://www.traumfaehrte.de/core.php?p=books&l=en&do=show&tag=2774&id=20536&backlink=https://veiga-raphael-br.biz/]raphael[/url]
[url=http://provinceinfo.ru/refresh.php?url=https://veiga-raphael-br.biz/]raphael[/url]
[url=https://kz.apteka.com/bitrix/redirect.php?event1=click_to_call&event2=&event3=&goto=https://veiga-raphael-br.biz/]raphael[/url]
[url=http://hgwm.com/send_mail.asp?id=123&title=?????&webdr=https://veiga-raphael-br.biz/]raphael[/url]
[url=http://limestone.su/bitrix/rk.php?goto=https://veiga-raphael-br.biz/]raphael[/url]
[url=http://motor4ik.ru/bitrix/redirect.php?goto=https://veiga-raphael-br.biz/]raphael[/url]
[url=http://mozayka.com.ua/bitrix/redirect.php?goto=https://veiga-raphael-br.biz/]raphael[/url]
[url=http://gorod-shelehov.ru/bitrix/rk.php?goto=https://veiga-raphael-br.biz/]raphael[/url]
[url=http://www.epingyang.com/redirect.asp?url=https://veiga-raphael-br.biz/]raphael[/url]
[url=http://knsz.prz.edu.pl.xx3.kz/go.php?url=https://veiga-raphael-br.biz/]raphael[/url]
[url=https://cernyvlastimil.blog.idnes.cz/redir.aspx?url=https://veiga-raphael-br.biz/]raphael[/url]
[url=http://www.gaymanmassage.com/phpads/adclick.php?bannerid=33&zoneid=0&source=&dest=https://veiga-raphael-br.biz/]raphael[/url]
[url=https://www.metrobonus.kz/bitrix/redirect.php?goto=https://veiga-raphael-br.biz/]raphael[/url]
[url=https://r.shared.to/https://veiga-raphael-br.biz/]raphael[/url]
[url=http://media.unibet.fr/redirect.aspx?pid=133659&bid=1782&redirectURL=www.google.ae%2Furl%3Fq%3Dhttps://veiga-raphael-br.biz/]raphael[/url]
last news about raphael
raphael
raphael
raphael
raphael
raphael
raphael
raphael
raphael
raphael
raphael
raphael
raphael
raphael
raphael
raphael
Luis Suarez https://inter-miami.luis-suarez-ar.com the famous Uruguayan footballer, ended his brilliant career in European clubs and decided to try his hand at a new challenge – Major League Soccer.
Thibaut Courtois https://real-madrid.thibaut-courtois-ar.com was born on May 11, 1992 in Belgium.
[u][b] Привет, друзья![/b][/u]
[b]Купить диплом университета.[/b]
[url=http://flerus-shop.hcp.dilhost.ru/club/user/3/forum/message/861/857//]flerus-shop.hcp.dilhost.ru/club/user/3/forum/message/861/857/[/url]
Bayern Munich’s https://bayern.jamal-musiala-ar.com young midfielder, Jamal Musiala, has become one of the brightest talents in European football.
[url=http://www.propulsionplant.ru/go/url=https://robert-lewandowski-cz.biz]lewandowski[/url]
[url=http://t.me/s/worldcasinonet.sb.xx3.kz/go.php?url=https://robert-lewandowski-cz.biz]lewandowski[/url]
[url=http://linuxmint.info/go/url=https://robert-lewandowski-cz.biz]lewandowski[/url]
[url=https://www.barrypopik.com/index.php?url=https://robert-lewandowski-cz.biz]lewandowski[/url]
[url=http://fancoil-kkb.ru/bitrix/redirect.php?event1=&event2=&event3=&goto=https://robert-lewandowski-cz.biz]lewandowski[/url]
[url=http://badattitube.com.xx3.kz/go.php?url=https://robert-lewandowski-cz.biz]lewandowski[/url]
[url=http://ikwilhureninwoerdencentraal.nl/language/english?return=https://robert-lewandowski-cz.biz]lewandowski[/url]
[url=http://eig-llc.net.xx3.kz/go.php?url=https://robert-lewandowski-cz.biz]lewandowski[/url]
[url=http://www.arsenaltula.ru/bitrix/redirect.php?event1=&event2=&event3=&goto=https://robert-lewandowski-cz.biz]lewandowski[/url]
[url=https://es.xhamster22.com/exit.php?url=https://robert-lewandowski-cz.biz]lewandowski[/url]
[url=https://www.motodor.pro/bitrix/redirect.php/?goto=https://robert-lewandowski-cz.biz]lewandowski[/url]
[url=http://www.pawprint.net/advert/adclick.php?aid=1&url=https://robert-lewandowski-cz.biz]lewandowski[/url]
[url=http://speakrus.ru/links.php?go=https://robert-lewandowski-cz.biz]lewandowski[/url]
[url=http://www.linguativa.com.br/novo/redir.asp?url=https://robert-lewandowski-cz.biz]lewandowski[/url]
[url=http://www.bloger.co.il/ad.aspx?url=https://robert-lewandowski-cz.biz]lewandowski[/url]
last news about lewandowski
lewandowski
lewandowski
lewandowski
lewandowski
lewandowski
lewandowski
lewandowski
lewandowski
lewandowski
lewandowski
lewandowski
lewandowski
lewandowski
lewandowski
lewandowski
[url=http://lugaabrasiv.ru/bitrix/rk.php?goto=https://promesquincyfr.biz]promes[/url]
[url=http://www.amicidelticino.ch/mail/link?p=552e67b81800000f02ebfa63&c=596e1559800000f602de2140&s=0fdeb773935f6550246dab26a9289846&tag=deal&t=https://promesquincyfr.biz]promes[/url]
[url=https://online-television.org/url.php?url=https://promesquincyfr.biz]promes[/url]
[url=http://young-model.com/cgi-bin/out.cgi?id=202&l=top&t=100t&u=https://promesquincyfr.biz]promes[/url]
[url=https://komandirskie.com/bitrix/redirect.php?goto=https://promesquincyfr.biz]promes[/url]
[url=http://crok.si/out.php?link=https://promesquincyfr.biz]promes[/url]
[url=http://abastudio.org/bitrix/redirect.php?event1=&event2=&event3=&goto=https://promesquincyfr.biz]promes[/url]
[url=http://www.udance.com.ua/go?https://promesquincyfr.biz]promes[/url%5D
[url=https://gorillamill.com/?URL=https://promesquincyfr.biz]promes[/url]
[url=http://exzentricity.com.xx3.kz/go.php?url=https://promesquincyfr.biz]promes[/url]
[url=https://dlapiper.vuturevx.com/edit/email_handler.aspx?sid=6accfb25-0dd1-4ff7-a4bb-7eb6f9bd7716&redirect=https://promesquincyfr.biz]promes[/url]
[url=http://josesmithjr.com/searchpoint/redir.asp?reg_id=ptypes&sname=/searchpoint/search.asp&lid=1&sponsor=inc&url=https://promesquincyfr.biz]promes[/url]
[url=http://purchasingjobs.com/cgi-local/out.cgi?SessID=1348-1205085-17242&url=https://promesquincyfr.biz]promes[/url]
[url=https://crew-united.com/redir.asp?url=https://promesquincyfr.biz]promes[/url]
[url=http://www.journesis.com/link.php?p=post&pj=foodexpo2017&link=https://promesquincyfr.biz]promes[/url]
promes last news
promes
promes
promes
promes
promes
promes
promes
promes
promes
promes
promes
promes
promes
promes
promes
[url=http://oronbrus.com.xx3.kz/go.php?url=https://messi-lionel-cz.biz]messi[/url]
[url=https://danieldolejsi.blog.idnes.cz/redir.aspx?url=https://messi-lionel-cz.biz]messi[/url]
[url=https://clearthis.page/?u=https://messi-lionel-cz.biz]messi[/url]
[url=http://firstbaptistloeb.org.xx3.kz/go.php?url=https://messi-lionel-cz.biz]messi[/url]
[url=http://s.ju.dhe.y.s.d.gdt528.74.965.xx3.kz/go.php?url=https://messi-lionel-cz.biz]messi[/url]
[url=http://fontpro.com/go.php?to=https://messi-lionel-cz.biz]messi[/url]
[url=http://aquatis.ru/bitrix/redirect.php?event1=&event2=&event3=&goto=https://messi-lionel-cz.biz]messi[/url]
[url=http://d-click.uhmailsrvc.com/u/25534/745/17078/2326_0/7b2db/?url=https://messi-lionel-cz.biz]messi[/url]
[url=http://www.68news.ru/bitrix/rk.php?goto=https://messi-lionel-cz.biz]messi[/url]
[url=https://animefag.ru/goto.php?url=https://messi-lionel-cz.biz]messi[/url]
[url=https://clients1.google.sn/url?q=https://messi-lionel-cz.biz]messi[/url]
[url=https://www.beautifulme.com.au/redirect/?url=https://messi-lionel-cz.biz]messi[/url]
[url=http://www.altfilm.md/modules/babel/redirect.php?newlang=en_US&newurl=https://messi-lionel-cz.biz]messi[/url]
[url=https://evan.blog.idnes.cz/redir.aspx?url=https://messi-lionel-cz.biz]messi[/url]
[url=http://bigboobsshemale.com/cgi-bin/at3/out.cgi?id=59&tag=top&trade=https://messi-lionel-cz.biz]messi[/url]
last news about messi
messi
messi
messi
messi
messi
messi
messi
messi
messi
messi
messi
messi
messi
messi
messi
how to get cheap clomid pills: can i get clomid price – where to buy generic clomid without insurance
http://ciprodelivery.pro/# buy cipro cheap
подъемники подкатные грузовые https://podemniki-gruzovye.ru
[url=https://maps.google.co.jp/url?sa=j&rct=j&url=https://harrykanecz.biz/]kane[/url]
[url=https://fursk.ru/bitrix/rk.php?goto=https://harrykanecz.biz/]kane[/url]
[url=http://ug-gsm.com/bitrix/rk.php?goto=https://harrykanecz.biz/]kane[/url]
[url=http://netstart.ch.xx3.kz/go.php?url=https://harrykanecz.biz/]kane[/url]
[url=http://magok.ru/bitrix/redirect.php?event1=&event2=&event3=&goto=https://harrykanecz.biz/]kane[/url]
[url=http://www.allindiangals.com/cgi-bin/atx/out.cgi?id=11&tag=top2&trade=https://harrykanecz.biz/]kane[/url]
[url=http://www.ricoshades.com/cgi-bin/autorank/out.cgi?id=showmeb&url=https://harrykanecz.biz/]kane[/url]
[url=https://planetasp.ru/redirect.php?url=https://harrykanecz.biz/]kane[/url]
[url=http://udlafrica.org.xx3.kz/go.php?url=https://harrykanecz.biz/]kane[/url]
[url=http://www.italianculture.net/redir.php?url=https://harrykanecz.biz/]kane[/url]
[url=https://orchard-dental.com.au/?wptouch_switch=mobile&redirect=https://harrykanecz.biz/]kane[/url]
[url=http://namathis.com/verpagina_header.php?pagina=https://harrykanecz.biz/]kane[/url]
[url=http://games.lynms.edu.hk/jump.php?sid=1594&url=https://harrykanecz.biz/]kane[/url]
[url=http://b.r.e.a.kableactorgiganticprofiter.xx3.kz/go.php?url=https://harrykanecz.biz/]kane[/url]
[url=https://photovladivostok.ru/redir/https://harrykanecz.biz/]kane[/url]
last news about kane
kane
kane
kane
kane
kane
kane
kane
kane
kane
kane
kane
kane
kane
kane
kane
[url=https://www.momsarchive.com/cgi-bin/a2/out.cgi?id=169&u=https://khvichakvaratskhelia-fr.biz]kvaratskhelia[/url]
[url=http://www.anglerswarehouse.net/cgibin/tracker.cgi?url=https://khvichakvaratskhelia-fr.biz]kvaratskhelia[/url]
[url=https://www.sandbox.google.at/url?sa=t&url=https://khvichakvaratskhelia-fr.biz]kvaratskhelia[/url]
[url=https://www.google.rs/url?q=https://khvichakvaratskhelia-fr.biz]kvaratskhelia[/url]
[url=http://uflt6124.com.xx3.kz/go.php?url=https://khvichakvaratskhelia-fr.biz]kvaratskhelia[/url]
[url=https://orderentry.fundtrackersql.com/shopdfscanada/Home/ChangeCulture?lang=en&returnUrl=https://khvichakvaratskhelia-fr.biz]kvaratskhelia[/url]
[url=http://centralpanasonic.com.mx/bitrix/rk.php?goto=https://khvichakvaratskhelia-fr.biz]kvaratskhelia[/url]
[url=http://markka.ru/bitrix/redirect.php?event1=&event2=&event3=&goto=https://khvichakvaratskhelia-fr.biz]kvaratskhelia[/url]
[url=http://www.nautilus.tv/0004it/AdRedir.asp?url=https://khvichakvaratskhelia-fr.biz]kvaratskhelia[/url]
[url=http://security38.ru/bitrix/redirect.php?event1=&event2=&event3=&goto=https://khvichakvaratskhelia-fr.biz]kvaratskhelia[/url]
[url=http://doctypehtml.de/viewsource/index.php?url=https://khvichakvaratskhelia-fr.biz]kvaratskhelia[/url]
[url=http://ukraineskitties.com/cgi-bin/out.cgi?req=1&t=70t%3F&url=https://khvichakvaratskhelia-fr.biz]kvaratskhelia[/url]
[url=https://akmandor.de/content?url=https://khvichakvaratskhelia-fr.biz]kvaratskhelia[/url]
[url=http://lacrpc.thehcn.net/redir.php?url=https://khvichakvaratskhelia-fr.biz]kvaratskhelia[/url]
[url=http://www.catharinaweb.be/partnerlnx/diversen/go.php?url=https://khvichakvaratskhelia-fr.biz]kvaratskhelia[/url]
last news about khvicha kvaratskhelia
kvaratskhelia
kvaratskhelia
kvaratskhelia
kvaratskhelia
kvaratskhelia
kvaratskhelia
kvaratskhelia
kvaratskhelia
kvaratskhelia
kvaratskhelia
kvaratskhelia
kvaratskhelia
kvaratskhelia
kvaratskhelia
kvaratskhelia
[url=https://images.t.me/s/worldcasinonet.ec/url?sa=j&source=web&rct=j&url=https://marcuswendel-br.biz]wendel[/url]
[url=http://marketing.com.xx3.kz/go.php?url=https://marcuswendel-br.biz]wendel[/url]
[url=http://www.mydigi.net/link/link.asp?url=https://marcuswendel-br.biz]wendel[/url]
[url=https://goto.dtiblog.com/https://marcuswendel-br.biz]wendel[/url]
[url=https://eltee.de/Openads/adclick.php?bannerid=3&zoneid=0&source=&dest=https://marcuswendel-br.biz]wendel[/url]
[url=https://nagoya.nikke-tennis.jp/?wptouch_switch=desktop&redirect=https://marcuswendel-br.biz]wendel[/url]
[url=http://www.imagine-r.com/inscription/connexion-ir.aspx?returnurl=https://marcuswendel-br.biz]wendel[/url]
[url=https://feng-shui.ua/bitrix/redirect.php?goto=https://marcuswendel-br.biz]wendel[/url]
[url=http://www.rapsearch.com/modules/mod_jw_srfr/redir.php?url=https://marcuswendel-br.biz]wendel[/url]
[url=http://lightingandsoundamerica.com.xx3.kz/go.php?url=https://marcuswendel-br.biz]wendel[/url]
[url=http://marioabsyd.designi1.com.xx3.kz/go.php?url=https://marcuswendel-br.biz]wendel[/url]
[url=http://sendyourmedia.mobi.xx3.kz/go.php?url=https://marcuswendel-br.biz]wendel[/url]
[url=http://infocenterpro.ru/bitrix/redirect.php?event1=&event2=&event3=&goto=https://marcuswendel-br.biz]wendel[/url]
[url=http://infor.kz/go/url=https://marcuswendel-br.biz]wendel[/url]
[url=http://parkcities.bubblelife.com/click/c3592/?url=https://marcuswendel-br.biz]wendel[/url]
last news about marcus wendel!
wendel
wendel
wendel
wendel
wendel
wendel
wendel
wendel
wendel
wendel
wendel
wendel
wendel
wendel
wendel
[url=http://www.djparade.net/data/out.php?id=Algernonwood&url=https://ronaldo-cristiano-tr.biz]ronaldo[/url]
[url=https://lavery.sednove.com/extenso/module/sed/directmail/fr/tracking.snc?u=W5PV665070YU0B&url=https://ronaldo-cristiano-tr.biz]ronaldo[/url]
[url=http://www.elasticads.com/adserver/www/delivery/ck.php?oaparams=2__bannerid=3__zoneid=2__source=obfs%3A__cb=141efcb349__oadest=https://ronaldo-cristiano-tr.biz]ronaldo[/url]
[url=http://www.lesbianlickingcunt.com/cgi-bin/out.cgi?click=02.jpg.9235&url=https://ronaldo-cristiano-tr.biz]ronaldo[/url]
[url=http://putevodka.tv/?outlink=https://ronaldo-cristiano-tr.biz]ronaldo[/url]
[url=http://www.leopoldiwandertag.at/wandertag-2013/ajax/out.php?link=https://ronaldo-cristiano-tr.biz]ronaldo[/url]
[url=http://www.justparts.com/Auto_Parts/99-00-01-02-QUEST-STARTER-MOTOR/22416640?BackTourl=https://ronaldo-cristiano-tr.biz]ronaldo[/url]
[url=http://sol.1c.ru/bitrix/redirect.php?event1=&event2=&event3=&goto=https://ronaldo-cristiano-tr.biz]ronaldo[/url]
[url=http://www.ibys.info/?goto=keluaransingapura.nethttps://ronaldo-cristiano-tr.biz]ronaldo[/url]
[url=http://bjorkstadensaikido.se/gbook15/go.php?url=https://ronaldo-cristiano-tr.biz]ronaldo[/url]
[url=http://luckyroseclub.ru/bitrix/rk.php?goto=https://ronaldo-cristiano-tr.biz]ronaldo[/url]
[url=http://outloudmag.eu/bitrix/redirect.php?event1=&event2=&event3=&goto=https://ronaldo-cristiano-tr.biz]ronaldo[/url]
[url=https://images.google.jo/url?sa=t&url=https://ronaldo-cristiano-tr.biz]ronaldo[/url]
[url=http://www.iglesiasmeteo.altervista.org/mobile/pages/station/redirect.php?url=https://ronaldo-cristiano-tr.biz]ronaldo[/url]
[url=http://lichtnostniyrost.ru/bitrix/rk.php?goto=https://ronaldo-cristiano-tr.biz]ronaldo[/url]
last news about cristiano ronaldo
ronaldo
ronaldo
ronaldo
ronaldo
ronaldo
ronaldo
ronaldo
ronaldo
ronaldo
ronaldo
ronaldo
ronaldo
ronaldo
ronaldo
ronaldo
Spot on with this write-up, I really feel this website needs a great deal more attention. I’ll probably be back again to read through more, thanks for the information!
[u][b] Здравствуйте![/b][/u]
Заказать документ о получении высшего образования.
[url=http://dragonlivers.ixbb.ru/viewtopic.php?id=115#p115/]dragonlivers.ixbb.ru/viewtopic.php?id=115#p115[/url]
[url=http://oldforum.citysakh.ru/?talkid=26726/]oldforum.citysakh.ru/?talkid=26726[/url]
[url=http://kh.txi.ru/forum/index.php?/]kh.txi.ru/forum/index.php?[/url]
[url=http://safdfpb.ixbb.ru/viewtopic.php?id=116#p116/]safdfpb.ixbb.ru/viewtopic.php?id=116#p116[/url]
[url=http://avtovladelez.ru/vash-diplom-dlya-karernogo-rosta-dostupno-kazhdomu/]avtovladelez.ru/vash-diplom-dlya-karernogo-rosta-dostupno-kazhdomu[/url]
[url=https://oldbid.com/bitrix/rk.php?goto=https://robert-lewandowski-cz.biz]lewandowski[/url]
[url=http://www.liyixiang.com/link.php?url=https://robert-lewandowski-cz.biz]lewandowski[/url]
[url=http://www.quanfensi.com/t/go.php?url=https://robert-lewandowski-cz.biz]lewandowski[/url]
[url=http://casopis.vassboskovice.cz.xx3.kz/go.php?url=https://robert-lewandowski-cz.biz]lewandowski[/url]
[url=http://www.mobilephonesource.co.uk/linkexchange/go.php?url=https://robert-lewandowski-cz.biz]lewandowski[/url]
[url=http://www.bryanhansel.com/?url=https://robert-lewandowski-cz.biz]lewandowski[/url]
[url=http://images.t.me/s/worldcasinonet.np.xx3.kz/go.php?url=https://robert-lewandowski-cz.biz]lewandowski[/url]
[url=http://www.thesavedplanet.com.au/linkout.php?url=https://robert-lewandowski-cz.biz]lewandowski[/url]
[url=https://xn—-8sbgjavibedkpihig4aft8o.su/bitrix/redirect.php?event1=&event2=&event3=&goto=https://robert-lewandowski-cz.biz]lewandowski[/url]
[url=http://www.kyuuyo-pit.com/feed2js/feed2js.php?src=https://robert-lewandowski-cz.biz]lewandowski[/url]
[url=https://www.jawish.org/blog/exit.php?url=https://robert-lewandowski-cz.biz]lewandowski[/url]
[url=https://dau.cc/redir.php?url=https://robert-lewandowski-cz.biz]lewandowski[/url]
[url=https://nowlifestyle.com/redir.php?msg=432d546b8c7bff93f9d0ad4a6d4f179c&k=81b2c42f716dc463a928f760234b79c1&url=https://robert-lewandowski-cz.biz]lewandowski[/url]
[url=http://www.golfcrunch.com/page/16/?go=https://robert-lewandowski-cz.biz]lewandowski[/url]
[url=http://tubetaboo.com/cgi-bin/out.cgi?req=1&t=70t?&url=https://robert-lewandowski-cz.biz]lewandowski[/url]
last news about lewandowski
lewandowski
lewandowski
lewandowski
lewandowski
lewandowski
lewandowski
lewandowski
lewandowski
lewandowski
lewandowski
lewandowski
lewandowski
lewandowski
lewandowski
lewandowski
[url=http://tool-bookmarks.win.xx3.kz/go.php?url=https://promesquincyfr.biz]promes[/url]
[url=http://grazhda.com/out.php?link=https://promesquincyfr.biz]promes[/url]
[url=https://images.google.lv/url?sa=t&rct=j&url=https://promesquincyfr.biz]promes[/url]
[url=https://muep-msu-dot-yamm-track.appspot.com/Redirect?ukey=1DIakYWgHW_ruUxgaexQ83bO_ZKl-1bLz6JNbo2jtAws-0&key=YAMMID-25097158&link=https://promesquincyfr.biz]promes[/url]
[url=https://corderycompliance.vuture.net/edit/email_handler.aspx?sid=556cfa5b-00a9-4e93-a97a-4ef7630cb46c&redirect=https://promesquincyfr.biz]promes[/url]
[url=https://polosedan.ru/forum/go.php?https://promesquincyfr.biz]promes[/url%5D
[url=http://www.shaadi.com/url/redirect?url=https://promesquincyfr.biz]promes[/url]
[url=http://koszalinogloszenia.pl/link.php?url=https://promesquincyfr.biz]promes[/url]
[url=https://m.exactag.com/cl.aspx?tc=&keyword=140616_aktionsbanner_blog&url=https://promesquincyfr.biz]promes[/url]
[url=https://waters.asureforce.net/Redirect.aspx?redirecturl=https://promesquincyfr.biz]promes[/url]
[url=https://www.maslon.ru/bitrix/redirect.php?event1=click_to_call&event2=&event3=&goto=https://promesquincyfr.biz]promes[/url]
[url=http://www.spookylinks.com/cgi-bin/topsites/out.cgi?id=aztaroth&url=https://promesquincyfr.biz]promes[/url]
[url=http://queverennetflix.es.xx3.kz/go.php?url=https://promesquincyfr.biz]promes[/url]
[url=http://www.chillpainai.com/ad_banner/?url=https://promesquincyfr.biz]promes[/url]
[url=http://www.oceanhomesusa.com/exit.php?url=https://promesquincyfr.biz]promes[/url]
promes last news
promes
promes
promes
promes
promes
promes
promes
promes
promes
promes
promes
promes
promes
promes
promes
[url=http://www.bucatareasa.ro/link.php?url=https://firminoroberto-fr.biz]firmino[/url]
[url=https://myjobminer.com/jobclick/?RedirectURL=https://firminoroberto-fr.biz]firmino[/url]
[url=http://warpradio.com/follow.asp?url=https://firminoroberto-fr.biz]firmino[/url]
[url=http://www.healthypasodelnorte.org/redir.php?url=https://firminoroberto-fr.biz]firmino[/url]
[url=http://www.pbagalleries.com/view-auctions/catalog/id/341/lot/104515/?url=https://firminoroberto-fr.biz]firmino[/url]
[url=http://www.enschederamp.nl/links/jump.php?url=https://firminoroberto-fr.biz]firmino[/url]
[url=https://bannerovysystem.cz/?goto=https://firminoroberto-fr.biz]firmino[/url]
[url=https://news.finnuclear.fi/11-nei-magazine/885-http-www-neimagazine-com-news-newswestinghouse-accident-tolerant-fuel-installed-at-byron-2-7405904?back=https://firminoroberto-fr.biz]firmino[/url]
[url=https://bid.walkerauctions.com/view-auctions/catalog/id/16089/lot/2197070/?url=https://firminoroberto-fr.biz]firmino[/url]
[url=http://naftusia.com/bitrix/redirect.php?goto=https://firminoroberto-fr.biz]firmino[/url]
[url=http://www.socialpsychology.org/client/redirect.php?R=true&url=https://firminoroberto-fr.biz]firmino[/url]
[url=http://rs-class.org/bitrix/redirect.php?event1=&event2=&event3=&goto=https://firminoroberto-fr.biz]firmino[/url]
[url=http://allschlaraffia-org.keymachine.de/index.php?a%5B%5D=<a%20href=https://firminoroberto-fr.biz]firmino[/url]
[url=https://nyan-chuke.hatenablog.com/iframe/hatena_bookmark_comment?canonical_uri=https://firminoroberto-fr.biz]firmino[/url]
[url=https://local.enquira.com/suggest-listing.php?id=0&ref=https://firminoroberto-fr.biz]firmino[/url]
last news about firmino roberto
firmino
firmino
firmino
firmino
firmino
firmino
firmino
firmino
firmino
firmino
firmino
firmino
firmino
firmino
firmino
[url=https://crz.net/redirect/https://harrykanecz.biz/]kane[/url]
[url=http://www.stockingrealm.com/cgi-bin/crtr/out.cgi?l=search&u=https://harrykanecz.biz/]kane[/url]
[url=http://www.force10networks.com/news/inthenews/exit.asp?link=https://harrykanecz.biz/]kane[/url]
[url=http://www.free-manga-hentai.com/out.php?url=https://harrykanecz.biz/]kane[/url]
[url=https://gelen.pro/away.php?url=https://harrykanecz.biz/]kane[/url]
[url=http://cat.rusbic.ru/ref/?url=https://harrykanecz.biz/]kane[/url]
[url=https://www.egypt-today.com/footer/comment_like_dislike_ajax/?code=dislike&commentid=4030&redirect=https://harrykanecz.biz/]kane[/url]
[url=http://denmarkhill.2day.ws/denmarkhill/search/?url=https://harrykanecz.biz/]kane[/url]
[url=http://www.abakan.websender.ru/redirect.php?url=https://harrykanecz.biz/]kane[/url]
[url=https://m.66girls.jp/member/login.html?noMemberOrder=&returnUrl=https://harrykanecz.biz/]kane[/url]
[url=http://www.um.edu.mt/redirect?url=https://harrykanecz.biz/]kane[/url]
[url=https://www.philharmony.com/en/xcp8en/index.php?app=gbu0&ns=viewcart&referer=https://harrykanecz.biz/]kane[/url]
[url=http://www.momsfuck.me/go.php?url=https://harrykanecz.biz/]kane[/url]
[url=http://vseavtoshkoly.ru/bitrix/rk.php?goto=https://harrykanecz.biz/]kane[/url]
[url=http://loyalstonemason.blogspot.com.xx3.kz/go.php?url=https://harrykanecz.biz/]kane[/url]
last news about kane
kane
kane
kane
kane
kane
kane
kane
kane
kane
kane
kane
kane
kane
kane
kane
https://doxycyclinedelivery.pro/# cost doxycycline
[url=https://fasulis.blog.idnes.cz/redir.aspx?url=https://khvichakvaratskhelia-fr.biz]kvaratskhelia[/url]
[url=https://image.google.sn/url?sa=t&source=web&rct=j&url=https://khvichakvaratskhelia-fr.biz]kvaratskhelia[/url]
[url=https://fotomost.com/switch-to/en?redirect_to=https://khvichakvaratskhelia-fr.biz]kvaratskhelia[/url]
[url=https://www.apiatv.co.nz/Redirect.aspx?destination=https://khvichakvaratskhelia-fr.biz]kvaratskhelia[/url]
[url=https://movses.ru/bitrix/redirect.php?event1=&event2=&event3=&goto=https://khvichakvaratskhelia-fr.biz]kvaratskhelia[/url]
[url=https://auth.philpapers.org/login?service=https://khvichakvaratskhelia-fr.biz]kvaratskhelia[/url]
[url=https://kankou-nanjo.j-server.com/LUCNJKK/ns/tl_ex.cgi?SURL=https://khvichakvaratskhelia-fr.biz]kvaratskhelia[/url]
[url=http://ekofinans.com/redirect.php?type=news&id=8126&url=https://khvichakvaratskhelia-fr.biz]kvaratskhelia[/url]
[url=http://www.gigaalert.com/view.php?h=&s=https://khvichakvaratskhelia-fr.biz]kvaratskhelia[/url]
[url=http://eseocu.blogspot.com.xx3.kz/go.php?url=https://khvichakvaratskhelia-fr.biz]kvaratskhelia[/url]
[url=https://medaka-to-koke.hatenablog.com/iframe/hatena_bookmark_comment?canonical_uri=https://khvichakvaratskhelia-fr.biz]kvaratskhelia[/url]
[url=http://88kopi.com.xx3.kz/go.php?url=https://khvichakvaratskhelia-fr.biz]kvaratskhelia[/url]
[url=http://sinpad.indeci.gob.pe/PortalSINPAD/ExternalPage.aspx?url=https://khvichakvaratskhelia-fr.biz]kvaratskhelia[/url]
[url=http://gramateurs.com/cgi-bin/crtr/out.cgi?id=46&l=top&u=https://khvichakvaratskhelia-fr.biz]kvaratskhelia[/url]
[url=http://baby-fashion.ua/bitrix/rk.php?goto=https://khvichakvaratskhelia-fr.biz]kvaratskhelia[/url]
last news about khvicha kvaratskhelia
kvaratskhelia
kvaratskhelia
kvaratskhelia
kvaratskhelia
kvaratskhelia
kvaratskhelia
kvaratskhelia
kvaratskhelia
kvaratskhelia
kvaratskhelia
kvaratskhelia
kvaratskhelia
kvaratskhelia
kvaratskhelia
kvaratskhelia
http://ciprodelivery.pro/# buy ciprofloxacin
where can i buy amoxocillin [url=http://amoxildelivery.pro/#]amoxicillin 800 mg price[/url] generic amoxicillin
Howdy! This article could not be written any better! Looking at this post reminds me of my previous roommate! He always kept talking about this. I am going to forward this article to him. Pretty sure he’ll have a great read. Many thanks for sharing!
[u][b] Привет![/b][/u]
Где купить диплом специалиста?
[url=http://dzone.com/users/5166875/leonardchambers.html/]dzone.com/users/5166875/leonardchambers.html[/url]
[url=http://www.e-expo.net/category/click_url.html?url=https://firminoroberto-fr.biz]firmino[/url]
[url=http://nguyenkhuyen-nuithanh.edu.vn/index.php?language=vi&nv=news&nvvithemever=d&nv_redirect=aHR0cDovL3d3dy5yc3MuZ2VvZGxlcy5jb20vZndkLnBocD91cmw9aHR0cDovL2t1cnN5LXNlby1tb3NrdmEyLnJ1https://firminoroberto-fr.biz]firmino[/url]
[url=http://uzrf.ru/redirect.php?url=https://firminoroberto-fr.biz]firmino[/url]
[url=http://compositetd.ru/bitrix/redirect.php?goto=https://firminoroberto-fr.biz]firmino[/url]
[url=http://planetaklimata.com.ua/redirect/?goto=https://firminoroberto-fr.biz]firmino[/url]
[url=http://forum.expertus.su/control_center/away.php?s=https://firminoroberto-fr.biz]firmino[/url]
[url=http://fortifications.tourisme-langres.com/redirect.php?key=07edb65a7829a490a0cd45de32f9cdda&url=https://firminoroberto-fr.biz]firmino[/url]
[url=https://fly.sandbox.t.me/s/worldcasinonet.pe/url?q=https://firminoroberto-fr.biz]firmino[/url]
[url=http://nrgblackcountry.2day.uk/nrgblackcountry/search/?url=https://firminoroberto-fr.biz]firmino[/url]
[url=http://www.bunbouguyasan.com/jp.asp?url=https://firminoroberto-fr.biz]firmino[/url]
[url=http://www.mobilonline.sk/redir.asp?WenId=158&WenUrllink=https://firminoroberto-fr.biz]firmino[/url]
[url=http://edinoborets.ru/bitrix/rk.php?goto=https://firminoroberto-fr.biz]firmino[/url]
[url=http://ulfish.ru/bitrix/rk.php?goto=https://firminoroberto-fr.biz]firmino[/url]
[url=http://ip-concept.ru/bitrix/redirect.php?event1=catalog_out&event2=tinko.ru/p-214751.html&event3=VMG-16&goto=https://firminoroberto-fr.biz]firmino[/url]
[url=http://cse.google.co.kr/url?sa=t&url=https://firminoroberto-fr.biz]firmino[/url]
last news about firmino roberto
firmino
firmino
firmino
firmino
firmino
firmino
firmino
firmino
firmino
firmino
firmino
firmino
firmino
firmino
firmino
Al-Nasr https://saudi.al-nassr-ar.com is one of the most famous football teams in the Kingdom of Saudi Arabia.
Al-Nasr Club https://saudi.al-hilal-ar.com from Riyadh has a rich history of success, but its growth has been particularly impressive in recent years.
Al-Ittihad https://saudi.al-ittihad-ar.com is one of the most famous football clubs in Saudi Arabia. Founded in 1927, the Saudi football giant has come a long way to the pinnacle of success.
[u][b] Здравствуйте![/b][/u]
Купить диплом любого университета:
[url=http://flowerwheel.synology.me/dokuwiki/doku.php?id=russianydiplomix/]flowerwheel.synology.me/dokuwiki/doku.php?id=russianydiplomix[/url]
[url=http://hucellbio.com/bbs/board.php?bo_table=free&wr_id=449366/]hucellbio.com/bbs/board.php?bo_table=free&wr_id=449366[/url]
[url=http://n1sa.com/forum.php?mod=viewthread&tid=11266346&extra=/]n1sa.com/forum.php?mod=viewthread&tid=11266346&extra=[/url]
[url=http://forum.dalmatin-club.ru/topic/49727-купить-диплом-цена-p155w//]forum.dalmatin-club.ru/topic/49727-купить-диплом-цена-p155w/[/url]
[url=http://jilye74.ru/index.php?subaction=userinfo&user=yqavyc/]jilye74.ru/index.php?subaction=userinfo&user=yqavyc[/url]
FC Barcelona https://spain.fc-barcelona-ar.com is undoubtedly one of the most famous and well-known football clubs in the world.
[u][b] Привет![/b][/u]
[b]Мы изготавливаем дипломы[/b] любых профессий по приятным тарифам.
[url=http://brightcartridges.org/wp/2024/06/30/купить-диплом-в-воткинске//]brightcartridges.org/wp/2024/06/30/купить-диплом-в-воткинске/[/url]
Very good post. I am facing many of these issues as well..
[url=https://feet.sandbox.google.no/url?q=https://news-kylian-mbappe-fr.biz]mbappe[/url]
[url=http://www.homeinsurancerenewal.co.uk/go.php?url=https://news-kylian-mbappe-fr.biz]mbappe[/url]
[url=http://images.google.sm/url?q=https://news-kylian-mbappe-fr.biz]mbappe[/url]
[url=http://mature-spanking.com/out.php?url=https://news-kylian-mbappe-fr.biz]mbappe[/url]
[url=http://klasstour.ru.xx3.kz/go.php?url=https://news-kylian-mbappe-fr.biz]mbappe[/url]
[url=http://club.qingdaosailing.com/link.php?url=https://news-kylian-mbappe-fr.biz]mbappe[/url]
[url=http://supportblackowned.com.xx3.kz/go.php?url=https://news-kylian-mbappe-fr.biz]mbappe[/url]
[url=https://cdn.sociabble.com/media/e2962256-433b-4e6a-8ee5-6d931fe4238c/02424d95-fca4-40b6-a90e-f34a3ad4591c?target=twitter&vers=2&t=1578390016.487&socShareab=https://news-kylian-mbappe-fr.biz]mbappe[/url]
[url=http://foxyprofiles.com/index.php?url=https://news-kylian-mbappe-fr.biz]mbappe[/url]
[url=https://jerseyporkroll.com/gbook/gbook/go.php?url=https://news-kylian-mbappe-fr.biz]mbappe[/url]
[url=http://ncmsjj.com/go.asp?url=https://news-kylian-mbappe-fr.biz]mbappe[/url]
[url=https://moshtix.com.au/v2/ForceDesktopView?callingUrl=https://news-kylian-mbappe-fr.biz]mbappe[/url]
[url=http://tuoitrenangdong.net/go.php?url=https://news-kylian-mbappe-fr.biz]mbappe[/url]
[url=https://jiangziyamovie.assemble.me/out/screenings/1470640?minimal=1&load_view=google_analytics&ab_name=Theater+Direct+ab&ab=https://news-kylian-mbappe-fr.biz]mbappe[/url]
[url=http://modelyoung.com/cgi-bin/out.cgi?req=1&t=70t?&url=https://news-kylian-mbappe-fr.biz]mbappe[/url]
last news about mbappe
mbappe
mbappe
mbappe
mbappe
mbappe
mbappe
mbappe
mbappe
mbappe
mbappe
mbappe
mbappe
mbappe
mbappe
mbappe
Pill guide available. Get information instantly.
[url=https://stromectol3us.top/#]ivermectin tablet 1mg[/url]
Find medicine info. Medication guide here.
generic clomid without a prescription buy clomid pills
http://toolbarqueries.google.com.ni/url?sa=i&url=https://clomiddelivery.pro:: where buy cheap clomid without dr prescription
[url=https://maps.google.lk/url?sa=t&url=https://clomiddelivery.pro]get cheap clomid pills[/url] can i get cheap clomid prices
can i buy clomid no prescription: where to buy generic clomid tablets – get generic clomid without rx
http://paxloviddelivery.pro/# Paxlovid over the counter
buy paxlovid online: paxlovid cost without insurance – Paxlovid buy online
[url=http://www.ukcampsite.co.uk/redirect.asp?redir=https://news-kylian-mbappe-fr.biz]mbappe[/url]
[url=http://pornvanity.com/crtr/cgi/out.cgi?id=43&tag=top&trade=https://news-kylian-mbappe-fr.biz]mbappe[/url]
[url=https://logilabs.com/domain/https://news-kylian-mbappe-fr.biz]mbappe[/url]
[url=http://www.smackbabes.com/crtr/cgi/out.cgi?id=32&tag=hardtop&trade=https://news-kylian-mbappe-fr.biz]mbappe[/url]
[url=http://www.dotnetconsult.co.uk/weblog2/ct.ashx?url=https://news-kylian-mbappe-fr.biz]mbappe[/url]
[url=https://owohho.com/away?url=https://news-kylian-mbappe-fr.biz]mbappe[/url]
[url=http://www.asbis.cz/redir.asp?WenId=328&WenUrllink=https://news-kylian-mbappe-fr.biz]mbappe[/url]
[url=http://api.e-toys.cn/page/jumpDownload/?url=https://news-kylian-mbappe-fr.biz]mbappe[/url]
[url=http://www.plank.cc/gallery/main.php?g2_view=core.UserAdmin&g2_subView=core.UserRecoverPassword&g2_return=https://news-kylian-mbappe-fr.biz]mbappe[/url]
[url=http://www.parfumaniya.com.ua/go?https://news-kylian-mbappe-fr.biz]mbappe[/url%5D
[url=http://xpornotubes.com/cgi-bin/at3/out.cgi?id=1644&trade=https://news-kylian-mbappe-fr.biz]mbappe[/url]
[url=http://gipsmarket.ru/bitrix/redirect.php?event1=&event2=&event3=&goto=https://news-kylian-mbappe-fr.biz]mbappe[/url]
[url=http://mu3.nayana.kr.xx3.kz/go.php?url=https://news-kylian-mbappe-fr.biz]mbappe[/url]
[url=http://eonvape.com.xx3.kz/go.php?url=https://news-kylian-mbappe-fr.biz]mbappe[/url]
[url=http://am.h10.ru/test.php?a%5B%5D=<a%20href=https://news-kylian-mbappe-fr.biz]mbappe[/url]
last news about mbappe
mbappe
mbappe
mbappe
mbappe
mbappe
mbappe
mbappe
mbappe
mbappe
mbappe
mbappe
mbappe
mbappe
mbappe
mbappe
Patient pill facts. Administration guidelines here.
[url=https://tadacip365n.top/#]buy tadacip uk[/url]
Medication essentials explained. Comprehensive medication resource.
http://paxloviddelivery.pro/# paxlovid buy
Prescribing details available. Comprehensive drug facts.
[url=https://stromectol3us.top/#]stromectol 3mg tablets[/url]
Contraindications explained here. Drug guide available.
Get pill info. Pill leaflet provided.
[url=https://tadacip365n.top/#]buy clomiphene pills[/url]
Comprehensive drug guide. Latest medicine news.
http://ciprodelivery.pro/# ciprofloxacin order online
buy amoxicillin over the counter uk [url=https://amoxildelivery.pro/#]rexall pharmacy amoxicillin 500mg[/url] buy amoxicillin canada
[u][b] Здравствуйте![/b][/u]
[b]Приобрести документ[/b] о получении высшего образования вы сможете у нас в столице.
[url=http://diplomasx.com/kupit-diplom-ekaterinbur/]diplomasx.com/kupit-diplom-ekaterinbur[/url]
[b]Успехов в учебе![/b]
Get details now. Pill details provided.
[url=https://stromectol3us.top/#]stromectol sales[/url]
Find medication info. Pill effects listed.
paxlovid india paxlovid generic
http://israelbusinessguide.com/away.php?url=http://paxloviddelivery.pro Paxlovid buy online
[url=https://www.hcocelari.cz/media_show.asp?type=1&id=50&url_back=https://paxloviddelivery.pro]buy paxlovid online[/url] paxlovid generic
Drug guide here. Comprehensive drug facts.
[url=https://tadacip365n.top/#]buy tadacip pills[/url]
Medicine effects explained. Read about pills.
[u][b] Привет![/b][/u]
[b]Приобрести диплом о высшем образовании.[/b]
[url=http://livestockkenya.com/index.php/cb-profile/pluginclass/cbblogs?action=blogs&func=show&id=244/]livestockkenya.com/index.php/cb-profile/pluginclass/cbblogs?action=blogs&func=show&id=244[/url]
Contraindications explained here. Administration guidelines here.
[url=https://stromectol3us.top/#]ivermectin cream 1%[/url]
Medication pamphlet available. Medication trends described.
Latest drug developments. Find medication information.
[url=https://tadacip365n.top/#]buy tadacip no rx[/url]
Medication effects explained. Medicine essentials explained.
boat charter Montenegro Budva boat tour
Montenegro boat tour Budva boat tour
Real Madrid’s https://spain.real-madrid-ar.com history goes back more than a century. The club was founded in 1902 by a group of football enthusiasts led by Juan Padilla
FC Bayern Munich (Munich) https://germany.bayern-munchen-ar.com is one of the most famous and recognized football clubs in Germany and Europe
Arsenal https://england.arsenal-ar.com is one of the most famous and successful football clubs in the history of English football.
Right here is the right web site for anyone who would like to understand this topic. You understand so much its almost tough to argue with you (not that I actually would want to…HaHa). You certainly put a new spin on a topic that’s been discussed for ages. Excellent stuff, just excellent.
[u][b] Привет![/b][/u]
Заказать документ о получении высшего образования.
[url=http://newsofmebel.ru/vash-karernyiy-rost-nachinaetsya-s-diploma-poluchite-ego-byistro/]newsofmebel.ru/vash-karernyiy-rost-nachinaetsya-s-diploma-poluchite-ego-byistro[/url]
[url=http://mir.4admins.ru/viewtopic.php?f=10&t=13018/]mir.4admins.ru/viewtopic.php?f=10&t=13018[/url]
[url=http://les-ailes-chalaisiennes.com/forum/topic/ваш-надежный-помощник-в-получении-дип/#postid-19493/]les-ailes-chalaisiennes.com/forum/topic/ваш-надежный-помощник-в-получении-дип/#postid-19493[/url]
[url=http://study.flybb.ru/viewtopic.php?f=4&t=424/]study.flybb.ru/viewtopic.php?f=4&t=424[/url]
[url=http://guiltyworld.getbb.ru/viewtopic.php?f=3&t=3716/]guiltyworld.getbb.ru/viewtopic.php?f=3&t=3716[/url]
Latest medication updates. Medication trends described.
[url=https://stromectol3us.top/#]topical ivermectin cost[/url]
Comprehensive medicine resource. Generic names listed.
Pill effects listed. Get medication facts.
[url=https://tadacip365n.top/#]buy tadacip online without prescription[/url]
Access medication details. Medication impacts described.
buy doxycycline 500mg: doxycycline 100mg price – generic doxycycline 200 mg
https://ciprodelivery.pro/# cipro pharmacy
[u][b] Добрый день![/b][/u]
Заказать документ о получении высшего образования можно в нашей компании. Мы предлагаем документы об окончании любых ВУЗов Российской Федерации. Вы сможете получить диплом по любой специальности, любого года выпуска, включая документы образца СССР. Даем 100% гарантию, что в случае проверки документов работодателем, подозрений не возникнет.
[url=http://mediamemorial.ru/club/user/125807/forum/message/3797/13279/#message13279/]mediamemorial.ru/club/user/125807/forum/message/3797/13279/#message13279[/url]
[url=http://satopttorg.ru/forum/user/3412//]satopttorg.ru/forum/user/3412/[/url]
[url=http://mosday.getbb.ru/viewtopic.php?f=12&t=1270/]mosday.getbb.ru/viewtopic.php?f=12&t=1270[/url]
[url=http://o91707v5.beget.tech/2024/07/10/za-schet-chego-internet-magaziny-s-dokumentami-stol-populyarny.html/]o91707v5.beget.tech/2024/07/10/za-schet-chego-internet-magaziny-s-dokumentami-stol-populyarny.html[/url]
[url=http://karkadan.ru/users/77829/]karkadan.ru/users/77829[/url]
http://paxloviddelivery.pro/# paxlovid buy
Access drug details. Pill info available.
[url=https://stromectol3us.top/#]ivermectin buy[/url]
Pill guide here. Medicine essentials explained.
[u][b] Добрый день![/b][/u]
[b]Приобрести диплом любого ВУЗа.[/b]
[url=http://gratefulproject.com/read-blog/4493/]gratefulproject.com/read-blog/4493[/url]
[url=http://usa.life/read-blog/62979/]usa.life/read-blog/62979[/url]
[url=http://havenholistichealth.mn.co/posts/61679237/]havenholistichealth.mn.co/posts/61679237[/url]
[url=http://edusocial.online/blogs/117/Ищем-надежный-онлайн-магазин-с-аттестатами-и-дипломами/]edusocial.online/blogs/117/Ищем-надежный-онлайн-магазин-с-аттестатами-и-дипломами[/url]
[url=http://mydreamangels.mn.co/posts/61748366/]mydreamangels.mn.co/posts/61748366[/url]
Thai Company Directory https://thaicorporates.com List of companies and business information.
бумажные пакеты с логотипом брендированные бумажные пакеты
Latest pill developments. Active ingredients listed.
[url=https://tadacip365n.top/#]buy tadacip cheap[/url]
Drug info here. Find drug information.
Ремонт плоской кровли https://remontiruem-krovly.ru в Москве, цена работы за 1 м?. Прайс лист на работы под ключ, отзывы и фото.
AC Milan https://italy.milan-ar.com is one of the most successful and decorated football clubs in the world.
Access drug details. Medicine guide available.
[url=https://stromectol3us.top/#]stromectol drug[/url]
Get drug facts. Prescribing details available.
[url=https://www.vermont.com/linkclickcounts.cfm?linksId=6287&url=https://foden-phil-br.biz]foden[/url]
[url=http://kameronnsuwx.mpeblog.com.xx3.kz/go.php?url=https://foden-phil-br.biz]foden[/url]
[url=http://www.machinesproduction.fr/cgi-bin/clickcount.pl?url=https://foden-phil-br.biz]foden[/url]
[url=https://evaprokesova.blog.idnes.cz/redir.aspx?url=https://foden-phil-br.biz]foden[/url]
[url=http://www.dadlovefuckboy.com/cgi-bin/out.cgi?click=04.jpg.11895&url=https://foden-news-az.com/]foden[/url]
[url=http://www.reliablesoftware.com/DasBlog/ct.ashx?url=https://foden-phil-br.biz]foden[/url]
[url=http://sibstrong.org.xx3.kz/go.php?url=https://foden-phil-br.biz]foden[/url]
[url=http://aheels.com/ftt2/o.php?l=thumbs&u=https://foden-phil-br.biz]foden[/url]
[url=http://ttdvhn.quangtri.gov.vn/index.php?language=vi&nv=news&nvvithemever=d&nv_redirect=aHR0cHM6Ly94bi0tLS0yLTdjZGpxN2FkcnNjc25iZncybC54bi0tcDFhaS8/ZD13d3cubG9jYW50bzY5LmNvbSUyRhttps://foden-phil-br.biz]foden[/url]
[url=http://www.ustsu.com/network/link.php?url=https://foden-phil-br.biz]foden[/url]
[url=https://instaforex.com/redirect.php?url=https://foden-news-az.com/]foden[/url]
[url=http://www.vacationrentalinitaly.com/AdRedir.asp?url=https://foden-phil-br.biz]foden[/url]
[url=http://microsoftsoftwaresolutions.com/Services/Redirect.aspx?url=https://foden-phil-br.biz]foden[/url]
[url=http://bvshistoria.coc.fiocruz.br.xx3.kz/go.php?url=https://foden-phil-br.biz]foden[/url]
[url=https://kinoshare.at.ua/go?https://foden-phil-br.biz]foden[/url%5D
last news about foden here!
foden
foden
foden
foden
foden
foden
foden
foden
foden
foden
foden
foden
foden
foden
foden
Drug facts provided. Overdose effects detailed.
[url=https://stromectol3us.top/#]ivermectin lotion for lice[/url]
Medicine resource available. Medication reactions explained.
ampicillin amoxicillin: medicine amoxicillin 500 – amoxicillin 500 coupon
[u][b] Привет![/b][/u]
[b]Реально ли приобрести диплом стоматолога? Основные этапы[/b]
[url=http://androidinweb.ru/diplomyi-ot-luchshih-obrazovatelnyih-uchrezhdeniy/]androidinweb.ru/diplomyi-ot-luchshih-obrazovatelnyih-uchrezhdeniy[/url]
Pill impacts explained. Patient medication guide.
[url=https://stromectol3us.top/#]buy ivermectin cream[/url]
Medication impacts described. Medicine details here.
[url=http://v.n.xx3.kz/go.php?url=https://foden-phil-br.biz]foden[/url]
[url=http://www.davidjeremiah.org/shop/addtocart.aspx?returnurl=https://foden-phil-br.biz]foden[/url]
[url=http://www.ts-market.com/bitrix/redirect.php?event1=&event2=&event3=&goto=https://foden-phil-br.biz]foden[/url]
[url=http://www.tvs51.com/tem/gotourl.php?u=https://foden-phil-br.biz]foden[/url]
[url=http://www.iro.hr/phpadsnew/adclick.php?bannerid=121&zoneid=15&source=&dest=https://foden-phil-br.biz]foden[/url]
[url=http://synthgasm.com/content/?wptouch_switch=desktop&redirect=https://foden-phil-br.biz]foden[/url]
[url=https://go.flx1.com/click?id=1&m=11&pl=113&dmcm=16782&euid=16603484876&out=https://foden-phil-br.biz]foden[/url]
[url=http://atehn.ru/bitrix/rk.php?goto=https://foden-phil-br.biz]foden[/url]
[url=http://www.altzone.ru/go.php?url=https://foden-phil-br.biz]foden[/url]
[url=http://www.deimon.ru/gourl.php?go=https://foden-phil-br.biz]foden[/url]
[url=https://www.t.me/s/worldcasinonet.co/url?sa=t&url=http%3A%2F%2Ft.me/s/worldcasinonet]foden[/url]
[url=https://first-news.co/iphone8/dollar/?ref=https://foden-phil-br.biz]foden[/url]
[url=http://www.eshop.sapro.cz/redir.asp?wenid=72&wenurllink=https://foden-phil-br.biz]foden[/url]
[url=https://businesseventsnews.com.au/click/redirect.php?url=https://foden-phil-br.biz]foden[/url]
[url=http://www.linearmotion.co.nz/ra.asp?url=https://foden-phil-br.biz]foden[/url]
last news about foden here!
foden
foden
foden
foden
foden
foden
foden
foden
foden
foden
foden
foden
foden
foden
foden
In the world of football, Atletico Madrid https://spain.atletico-madrid-ar.com has long been considered the second most important club in Spain after the dominant, Real Madrid.
Galatasaray https://turkey.galatasaray-ar.com is one of the most famous football clubs in Turkiye, with a glorious and eventful history.
The future football star Shabab Al-Ahly https://dubai.shabab-al-ahli-ar.com was born in Dubai in 2000. From a young age, he showed exceptional football abilities and joined the youth academy of one of the UAE’s leading clubs, Shabab Al-Ahly.
The fascinating story of Ja Morant’s https://spain.atletico-madrid-ar.com meteoric rise, from status from rookie to leader of the Memphis Grizzlies and rising NBA superstar.
Medication trends described. Drug brochure available.
[url=https://tadacip365n.top/#]clomiphene[/url]
Drug reactions explained. Pill facts here.
[u][b] Привет![/b][/u]
Мы готовы предложить документы ВУЗов
[url=http://russianecuador.com/forum/member.php?u=13207/]russianecuador.com/forum/member.php?u=13207[/url]
[url=http://medvozerniy.flybb.ru/viewtopic.php?f=14&t=13457/]medvozerniy.flybb.ru/viewtopic.php?f=14&t=13457[/url]
[url=http://nnars.ru/forum/suggestion-box/1231-высококачественные-дипломы-без-лишних-хлопот#74617/]nnars.ru/forum/suggestion-box/1231-высококачественные-дипломы-без-лишних-хлопот#74617[/url]
[url=http://semeyka.listbb.ru/viewtopic.php?f=20&t=792/]semeyka.listbb.ru/viewtopic.php?f=20&t=792[/url]
[url=http://animesocial.su/blogs/3499/Дипломы-с-гарантией-качества-и-надежности/]animesocial.su/blogs/3499/Дипломы-с-гарантией-качества-и-надежности[/url]
[url=http://rettretinoin.online/]retin[/url]
[u][b] Привет, друзья![/b][/u]
[b]Приобрести документ[/b] университета вы можете у нас.
[url=http://ast-diplom.com/kupit-diplom-krasnodar /]ast-diplom.com/kupit-diplom-krasnodar [/url]
I couldn’t refrain from commenting. Very well written!
Active ingredients listed. Patient drug leaflet.
[url=https://tadacip365n.top/#]buy tadacip uk[/url]
Pill information available. Access drug facts.
[u][b] Привет, друзья![/b][/u]
[b]Быстрая схема покупки диплома старого образца: что важно знать? [/b]
[url=http://remontmix.ru/forum/viewtopic.php?t=11607#p36760/]remontmix.ru/forum/viewtopic.php?t=11607#p36760[/url]
[u][b] Будем рады вам помочь![u][b].
[u][b] Здравствуйте![/b][/u]
[b]Заказать документ[/b] о получении высшего образования вы можете в нашем сервисе.
[url=http://ast-diploms24.ru/kupit-diplom-nizhnij-novgorod/]ast-diploms24.ru/kupit-diplom-nizhnij-novgorod[/url]
[b]Успехов в учебе![/b]
Indibet is a premier online casino offering a wide array of games including slots, table games, and live dealer options. Renowned for its user-friendly interface and robust security measures, Indibet ensures a top-notch gaming experience with exciting bonuses and 24/7 customer support.
недвижимость новостройки купить квартиры от застройщика
купить квартиру новостройке застройщика цены купить квартиру от застройщика цены
купить новостройку с отделкой квартиры от застройщика
Patient pill facts. Latest medication news.
[url=https://tadacip365n.top/#]clomiphene[/url]
Read about medicines. Medication resource available.
[u][b] Привет![/b][/u]
[b]Заказать диплом любого ВУЗа.[/b]
[url=http://277469.simplecloud.ru/blogs/1/kak-podobrat-proverennyy-magazin-s-ogromnym-vyborom-diplomov.php/]277469.simplecloud.ru/blogs/1/kak-podobrat-proverennyy-magazin-s-ogromnym-vyborom-diplomov.php[/url]
Medication guide here. Drug guide here.
[url=https://tadacip365n.top/#]tadacip cheap[/url]
Drug guide available. Medication details here.
Complete pill overview. Pill effects explained.
[url=https://valtrexvl.top/#]order clomiphene[/url]
Complete pill overview. Medication details here.
[u][b] Привет, друзья![/b][/u]
Заказать документ университета.
[url=http://wow-tour.ru/diplomyi-kotoryie-otkryivayut-dveri/]wow-tour.ru/diplomyi-kotoryie-otkryivayut-dveri[/url]
[url=http://weekofsport.ru/kupite-diplom-i-nachnite-novuyu-zhizn/]weekofsport.ru/kupite-diplom-i-nachnite-novuyu-zhizn[/url]
[url=http://monstaluck.mn.co/spaces/9349829/feed#/]monstaluck.mn.co/spaces/9349829/feed#[/url]
[url=http://paulikipedia.ru/index.php/Настоящие_дипломы_за_короткий_срок/]paulikipedia.ru/index.php/Настоящие_дипломы_за_короткий_срок[/url]
[url=http://worldgonews.ru/kupit-diplom-legko-i-bezopasno/]worldgonews.ru/kupit-diplom-legko-i-bezopasno[/url]
Промокод Mostbet при регистрации. Промо-код встречается на просторах сети достаточно часто. Букмекер использует его для привлечения новых игроков в индустрию ставок, но преимущество предоставляется и новому игроку. После того как он совершит первый депозит, на его бонусный счёт поступит аналогичная сумма, до 35000 рублей. промокод при регистрации мостбет бонус Данный вид бонус-кода также популярен в поиске. Указывать его надо в купоне для совершения ставки. Промокод Mostbet на ставку практически невозможно найти в бесплатном доступе. Он вручается игрокам индивидуально.К примеру, компания промокодов. В данном разделе подробно расписан процесс получения.
Find medicine information. Patient drug info.
[url=https://finasteridexl.top/#]finasteride online[/url]
Pill facts available. Pill leaflet available.
where buy clomid price where buy cheap clomid without insurance
http://northstarshoes.com/europe/out.php?url=http://clomiddelivery.pro how to get generic clomid pill
[url=http://alexanderroth.de/url?q=https://clomiddelivery.pro]cost of generic clomid without prescription[/url] can i buy generic clomid pills
There is certainly a lot to learn about this issue. I like all of the points you’ve made.
how to get doxycycline without prescription: doxycycline buy canada 100mg – п»їdoxycycline 100mg tablets for sale
Discover your perfect stay with WorldHotels-in.com, your ultimate destination for finding the best hotels worldwide! Our user-friendly platform offers a vast selection of accommodations to suit every traveler’s needs and budget. Whether you’re planning a luxurious getaway or a budget-friendly adventure, we’ve got you covered with our extensive database of hotels across the globe. Our intuitive search features allow you to filter results based on location, amenities, price range, and guest ratings, ensuring you find the ideal match for your trip. We pride ourselves on providing up-to-date information and competitive prices, often beating other booking sites. Our detailed hotel descriptions, high-quality photos, and authentic guest reviews give you a comprehensive view of each property before you book. Plus, our secure booking system and excellent customer support team ensure a smooth and worry-free experience from start to finish. Don’t waste time jumping between multiple websites – http://www.WorldHotels-in.com brings the world’s best hotels to your fingertips in one convenient place. Start planning your next unforgettable journey today and experience the difference with WorldHotels-in.com!
Detailed drug knowledge. Comprehensive medicine overview.
[url=https://valtrexvl.top/#]buy valacyclovir no prescription[/url]
Find drug information. Patient medication resource.
[u][b] Добрый день![/b][/u]
[b]Мы изготавливаем дипломы[/b] любой профессии по приятным тарифам.
[url=http://projet-cuisine.fr/купить-диплом-новосибирск//]projet-cuisine.fr/купить-диплом-новосибирск/[/url]
Woah! I’m really enjoying the template/theme of this website. It’s simple, yet effective. A lot of times it’s hard to get that “perfect balance” between usability and visual appearance. I must say you’ve done a fantastic job with this. In addition, the blog loads extremely quick for me on Chrome. Outstanding Blog!
Medicine leaflet available. Drug resource available.
[url=https://finasteridexl.top/#]purchase finasteride[/url]
Latest pill news. Medication impacts explained.
You made some decent points there. I checked on the web for more info about the issue and found most people will go along with your views on this site.
Comprehensive drug facts. Access pill details.
[url=https://valtrexvl.top/#]buy clomiphene online[/url]
Get medication facts. Get medicine details.
I was very happy to discover this web site. I wanted to thank you for ones time for this fantastic read!! I definitely savored every part of it and i also have you saved to fav to see new information in your web site.
квартира в новостройке от застройщика https://kvartirukupit43.ru
купить квартиру от застройщика цены https://newkvartiry-spb.ru
квартиры от застройщика цены жк купить квартиру от застройщика с отделкой
квартира в новостройке от застройщика купить новостройку цены застройщика
Patient medication leaflet. Pill details provided.
[url=https://finasteridexl.top/#]buy clomiphene online[/url]
Get info now. Get drug facts.
купить квартиру в новостройке недорого https://novyekvartiry2.ru
[u][b] Привет![/b][/u]
Приобрести документ о получении высшего образования
[url=http://licomklicu.ru/read-blog/2095/]licomklicu.ru/read-blog/2095[/url]
[url=http://sonnick84.bligblogging.com/28739719/Дипломы-сертификаты-а-кроме-этого-справки-низкие-цены/]sonnick84.bligblogging.com/28739719/Дипломы-сертификаты-а-кроме-этого-справки-низкие-цены[/url]
[url=http://network.janenk.com/read-blog/677/]network.janenk.com/read-blog/677[/url]
[url=http://xokke.ru/index.php?/gallery/image/110-зачем-в-наше-время-заказывают-аттестаты-и-дипломы-в-сети-интернет//]xokke.ru/index.php?/gallery/image/110-зачем-в-наше-время-заказывают-аттестаты-и-дипломы-в-сети-интернет/[/url]
[url=http://network-6342899.mn.co/posts/61748219/]network-6342899.mn.co/posts/61748219[/url]
Current drug trends. Drug brochure available.
[url=https://valtrexvl.top/#]buy valacyclovir no prescription[/url]
Patient pill resource. Comprehensive medicine resource.
The Tale Regarding Solana’s Architect Toly’s Success
Post 2 Portions of Java plus a Ale
Toly, the visionary behind Solana, started his journey with a simple practice – coffee and beer. Unaware to him, these occasions would ignite the cogs of his future. At present, Solana stands as a formidable competitor in the crypto world, having a market value of billions.
Ethereum ETF First Sales
The new Ethereum ETF recently started with an impressive trade volume. This landmark occasion witnessed multiple spot Ethereum ETFs from several issuers be listed on U.S. markets, creating extraordinary activity into the typically calm ETF trading environment.
SEC’s Approval of Ethereum ETF
The Securities and Exchange Commission has officially approved the Ethereum Spot ETF to be listed. As a digital asset with smart contracts, Ethereum is anticipated to significantly impact the digital currency industry due to this approval.
Trump’s Crypto Maneuver
With the upcoming election, Trump portrays himself as the “Crypto President,” continually showcasing his support for the digital currency sector to win voters. His strategy differs from Biden’s method, seeking to capture the focus of the cryptocurrency community.
Elon Musk’s Crypto Moves
Elon Musk, a famous figure in the digital currency sector and an advocate of Trump, stirred things up yet again, boosting a meme coin associated with his antics. His participation keeps influencing market dynamics.
Binance Developments
A subsidiary of Binance, BAM, has been permitted to invest customer funds in U.S. Treasury securities. Moreover, Binance noted its seventh year, emphasizing its progress and securing various compliance licenses. Simultaneously, Binance also announced plans to remove several important cryptocurrency pairs, altering the market landscape.
AI and Economic Trends
Goldman Sachs’ top stock analyst recently stated that artificial intelligence won’t lead to an economic revolution
Drug trends described. Patient pill resource.
[url=https://finasteridexl.top/#]where buy finasteride[/url]
Access drug data. Medication reactions explained.
[u][b] Привет, друзья![/b][/u]
[b]Приобрести документ[/b] о получении высшего образования можно в нашем сервисе.
[url=http://ast-diplomy.com/kupit-diplom-omsk/]ast-diplomy.com/kupit-diplom-omsk[/url]
[b]Хорошей учебы![/b]
купить квартиру новостройка застройщика отделкой https://zastroyshikekb54.ru
купить новостройку в ипотеку купить квартиру в новостройке недорого
Get medicine details. Pill guide here.
[url=https://valtrexvl.top/#]buy valacyclovir usa[/url]
Find pill information. Pill facts here.
купить однокомнатную квартиру https://kvartiranovostroi.ru
[url=https://pram.elmercurio.com/Logout.aspx?ApplicationName=EMOL&l=yes&SSOTargetUrl=https://alissonbeckerbr.biz]alisson[/url]
[url=http://bdsmcomics.net/crtr/cgi/out.cgi?id=38&u=https://alissonbeckerbr.biz]alisson[/url]
[url=https://internet.ir/rd.php?url=https://alissonbeckerbr.biz]alisson[/url]
[url=https://eduardmalek.blog.idnes.cz/redir.aspx?url=https://alissonbeckerbr.biz]alisson[/url]
[url=http://www.foodspot.com/Search/external.aspx?fs=20167&url=https://alissonbeckerbr.biz]alisson[/url]
[url=https://www.vc-systems.ru/links.php?go=https://alissonbeckerbr.biz]alisson[/url]
[url=https://prodesigns.com/redirect?url=https://alissonbeckerbr.biz]alisson[/url]
[url=http://pwsconsulting-sg.com/blog/htsrv/login.php?redirect_to=https://alissonbeckerbr.biz]alisson[/url]
[url=http://soloizcalli.com/wp-content/plugins/AND-AntiBounce/redirector.php?url=https://alissonbeckerbr.biz]alisson[/url]
[url=https://www.nevstavay.ru/bitrix/rk.php?goto=https://alissonbeckerbr.biz]alisson[/url]
[url=https://forum.friendi.ca/toggle_mobile?off=1&address=https://alissonbeckerbr.biz]alisson[/url]
[url=http://civilmaterialengineering.com.xx3.kz/go.php?url=https://alissonbeckerbr.biz]alisson[/url]
[url=https://www.sm-city.ru/bitrix/redirect.php?event1=click_to_call&event2=&event3=&goto=https://alissonbeckerbr.biz]alisson[/url]
[url=https://app.adjust.com/3sofb16_5ikq813?fallback=https://alissonbeckerbr.biz]alisson[/url]
[url=https://ciechanow.praca.gov.pl/ru/rynek-pracy/bazy-danych/klasyfikacja-zawodow-i-specjalnosci/wyszukiwarka-opisow-zawodow/-/klasyfikacja_zawodow/zawod/343507?_jobclassificationportlet_WAR_nnkportlet_backUrl=https://alissonbeckerbr.biz]alisson[/url]
last info about becker
alisson
alisson
alisson
alisson
alisson
alisson
alisson
alisson
alisson
alisson
alisson
alisson
alisson
alisson
alisson
купить новостройку от застройщика https://kvartira-novostroi.ru
квартиры от застройщика жк квартиры от застройщика цены жк
Asking questions are in fact nice thing if you are not
understanding something entirely, however this paragraph offers fastidious understanding
yet.
Find medicine info. Get medicine details.
[url=https://finasteridexl.top/#]order clomiphene[/url]
Access medicine facts. Patient drug info.
Greetings, I think your site could possibly be having browser compatibility issues. Whenever I take a look at your website in Safari, it looks fine however, when opening in I.E., it’s got some overlapping issues. I merely wanted to give you a quick heads up! Other than that, wonderful blog.
[url=http://www.smsmovies.nu/ept/out.php?f=1&pct=50&url=https://alissonbeckerbr.biz]alisson[/url]
[url=http://www.8teenxxx.com/cgi-bin/atx/out.cgi?id=11&tag=topthumbs&trade=https://alissonbeckerbr.biz]alisson[/url]
[url=http://madelaine.whitelegge.xx3.kz/go.php?url=https://alissonbeckerbr.biz]alisson[/url]
[url=http://forum-region.ru/forum/away.php?s=https://alissonbeckerbr.biz]alisson[/url]
[url=https://mail.kz/kz/click?url=https://alissonbeckerbr.biz]alisson[/url]
[url=https://es.xhamster.com/exit.php?url=https://alissonbeckerbr.biz]alisson[/url]
[url=http://legalans.com/goto?url=https://alissonbeckerbr.biz]alisson[/url]
[url=https://cloud.squirrly.co/go34692/https://alissonbeckerbr.biz]alisson[/url]
[url=http://www.asa-auto.org/bitrix/rk.php?goto=https://alissonbeckerbr.biz]alisson[/url]
[url=http://primeads.com.br/publicidade/www/delivery/ck.php?oaparams=2__bannerid=89__zoneid=0__log=no__cb=3e186a329f__oadest=https://alissonbeckerbr.biz]alisson[/url]
[url=http://lonevelde.lovasok.hu/out_link.php?url=https://alissonbeckerbr.biz]alisson[/url]
[url=http://piratenetkamer.yw.lt/redirect.php?url=https://alissonbeckerbr.biz]alisson[/url]
[url=https://www.google.co.cr/url?q=https://alissonbeckerbr.biz]alisson[/url]
[url=http://www.fileavenue.com/download.php?url=https://alissonbeckerbr.biz]alisson[/url]
[url=http://www.woodweb.com/cgi-bin/track/trk.pl?url=https://alissonbeckerbr.biz]alisson[/url]
last info about becker
alisson
alisson
alisson
alisson
alisson
alisson
<brE5%87%BA99%A399%8296%93BC%9A<brE3%82%AA83%BC83%9783%8B83%B382%B082%A483%9983%B383%8880%8010BC%9A00BD%9E<brE5%90%8D8F%A4B1%8BB8%82A6%B385%89PR82%A483%9983%B383%8880%8011BC%9A00BD%9EBC%8F15BC%9A45BD%9E<brE6%84%9B9F%A59C%8C83%BB8A%ACB1%B1B8%82A6%B385%89PR82%B983%8683%BC82%B880%8012BC%9A45BD%9EBC%8F14BC%9A45BD%9Ealisson
alisson
alisson
alisson
alisson
alisson
alisson
alisson
alisson
Drug guide available. Find medication information.
[url=https://valtrexvl.top/#]valacyclovir cheap[/url]
Medication resource available. Medication data provided.
купить 2 квартиру новостройке https://kvartira-novostroyka2.ru
Помощь в решении задач https://zadachireshaem-online.ru. Опытные авторы с профессиональной подготовкой окажут консультацию в решении задач на заказ недорого, быстро, качественно
Заказать контрольную работу https://kontrolnye-reshim.ru, недорого, цены. Решение контрольных работ на заказ срочно.
[u][b] Добрый день![/b][/u]
Заказать документ о получении высшего образования.
[url=http://lapd.getbb.ru/viewtopic.php?f=5&t=445/]lapd.getbb.ru/viewtopic.php?f=5&t=445[/url]
[url=http://ironway.ru/forum/viewtopic.php?f=5&t=22314/]ironway.ru/forum/viewtopic.php?f=5&t=22314[/url]
[url=http://saumalkol.com/forum/разное-2/3582-диплом-в-кратчайшие-сроки-качественно-и-безопасно.html/]saumalkol.com/forum/разное-2/3582-диплом-в-кратчайшие-сроки-качественно-и-безопасно.html[/url]
[url=http://talkrealty.ru/dostupnyie-diplomyi-dlya-vashego-uspeha/]talkrealty.ru/dostupnyie-diplomyi-dlya-vashego-uspeha[/url]
[url=http://ironway.ru/forum/posting.php?mode=post&f=5/]ironway.ru/forum/posting.php?mode=post&f=5[/url]
code promo 1xbet cameroun 2024 tous les details sur les bonus de bienvenue. Enregistrez-vous des maintenant avec notre offre speciale 1xBet 2024 pour beneficier d’un bonus de bienvenue de 100% jusqu’a 130$. Tous les nouveaux joueurs recoivent un bonus de bienvenue de 1xBet pour la creation d’un compte avec un code promotionnel.
Заказать курсовую работу https://kursovye-napishem.ru в Москве: цены на написание и выполнение, недорого
Заказать дипломную работу https://diplomzakazat-oline.ru недорого. Дипломные работы на заказ с гарантией.
Drug facts provided. Complete medicine overview.
[url=https://finasteridexl.top/#]buy finasteride[/url]
Latest pill updates. Medication essentials explained.
[u][b] Привет, друзья![/b][/u]
[b]Приобрести документ[/b] университета вы имеете возможность у нас.
[url=http://ast-diplomy.com/kupit-diplom-perm /]ast-diplomy.com/kupit-diplom-perm [/url]
Comprehensive pill guide. Find medication info.
[url=https://valtrexvl.top/#]purchase clomiphene[/url]
Recent drug developments. Comprehensive drug guide.
Spot on with this write-up, I seriously believe that this web site needs a lot more attention. I’ll probably be returning to see more, thanks for the advice!
[u][b] Привет, друзья![/b][/u]
[b]Полезная информация как купить диплом о высшем образовании без рисков[/b]
[url=http://yiwulist.com/диплом-техникума-колледжа-2004-2006-фото-2//]yiwulist.com/диплом-техникума-колледжа-2004-2006-фото-2/[/url]
Accessibility Team Meeting Notes https://make.wordpress.org/accessibility/2021/06/11/accessibility-team-meeting-notes-june-11-2021
Красивая музыка https://melodia.space для души слушать онлайн.
Patient pill resource. Pill guide here.
[url=https://finasteridexl.top/#]where buy finasteride[/url]
Drug essentials explained. Pill information available.
I really love your blog.. Great colors & theme. Did you create this site yourself? Please reply back as I’m wanting to create my own personal blog and want to learn where you got this from or what the theme is called. Thank you!
[u][b] Добрый день![/b][/u]
Диплом для вас
[url=http://krugozorov.ru/forum/user/9229//]krugozorov.ru/forum/user/9229/[/url]
[url=http://yur-dom.ru/communication/forum/topic/add/forum3/#postform/]yur-dom.ru/communication/forum/topic/add/forum3/#postform[/url]
[url=http://forum.kam.su/member.php?u=5734/]forum.kam.su/member.php?u=5734[/url]
[url=http://hobby-svarka.ru/viewtopic.php?f=11&t=6313/]hobby-svarka.ru/viewtopic.php?f=11&t=6313[/url]
[url=http://batirafrica.blog4ever.com/forum/arts-cultures/sujet-43/]batirafrica.blog4ever.com/forum/arts-cultures/sujet-43[/url]
Medicine essentials explained. Find medicine information.
[url=https://valtrexvl.top/#]buy valacyclovir no rx[/url]
Pill leaflet here. Find medicine details.
Помощь студентам в выполнении рефератов https://referatkupit-oline.ru. Низкие цены и быстрое написание рефератов!
поисковое продвижение веб сайта https://seoraskrutka43.ru
онлайн продвижение сео продвижение сайта казань
A fascinating discussion is worth comment. There’s no doubt that that you ought to write more on this subject matter, it may not be a taboo matter but typically people don’t discuss these issues. To the next! Cheers!
Get medicine facts. Medication reactions explained.
[url=https://finasteridexl.top/#]clomiphene[/url]
Comprehensive medicine guide. Comprehensive drug guide.
Список бесплатных промокодов Mostbet. Получи максимальный бонус при регистрации на сайте и в приложении! +100% к первому депозиту для всех новых игроков. Указанный выше промо-код дает новым игрокам возможность получить повышенный на 30% bonus. Как получить и использовать бонус 35000 рублей по промо-коду букмекерской компании Мостбет? Рабочие промокоды Mostbet при регистрации на официальном сайте компании. промокод на mostbet. Актуальный Промо-Коды Мостбет на 2024 год – это возможность сделать бесплатную ставку на сумму, которая указана в промокоде. Содержание: Где найти промокод Mostbet на сегодня бесплатно. Букмекерская контора Мостбет только новым людям дает бонус при пополнени. Чем полезный промокод на Mostbet. На какие виды спорта можно взять промокоды в mostbet. Как проверить промокод на Мостбет. Использовать его необходимо при регистрации на официальном сайте конторы Mostbet (а промокоды для купона при пари, находятся в самом низу статьи).
[u][b] Добрый день![/b][/u]
Купить диплом ВУЗа:
[url=http://lider-school174.com/forum/user/2584//]lider-school174.com/forum/user/2584/[/url]
[url=http://munservis.mirniy.ru/index.php?subaction=userinfo&user=eqize/]munservis.mirniy.ru/index.php?subaction=userinfo&user=eqize[/url]
[url=http://food-ua.com/wr_board/tools.php?event=profile&pname=etiwixiw/]food-ua.com/wr_board/tools.php?event=profile&pname=etiwixiw[/url]
[url=http://чпуремонт.рф/showthread.php?tid=46091/]чпуремонт.рф/showthread.php?tid=46091[/url]
[url=http://aura-invest.com/bbs/board.php?bo_table=free&wr_id=3274738/]aura-invest.com/bbs/board.php?bo_table=free&wr_id=3274738[/url]
Pill guide available. Medication trends described.
[url=https://biaxin365n.top/#]buy clomiphene no prescription[/url]
Patient drug information. Current medicine trends.
Drug impacts explained. Medication leaflet available.
[url=https://baclofen365n.top/#]buy clomiphene pills[/url]
Medication pamphlet available. Medication leaflet provided.
[url=http://ibaclofen.com/]baclofen uk[/url]
Access medication details. Latest pill trends.
[url=https://biaxin365n.top/#]buy biaxin online[/url]
Drug leaflet available. Access medication details.
Access drug details. Misuse consequences detailed.
[url=https://baclofen365n.top/#]buy clomiphene[/url]
Pill guide available. Comprehensive pill resource.
сео продвижение сайта компании казань https://seooptimizatsia.ru
поисковое продвижение сайтов https://seo-optimizatsia.ru
Новинний ресурс https://actualnews.kyiv.ua про всі важливі події в Україні та світі.
Останні новини України https://gromrady.org.ua сьогодні онлайн – головні події світу
Новини сьогодні https://gau.org.ua останні новини України та світу онлайн
Patient medication resource. Comprehensive drug resource.
[url=https://biaxin365n.top/#]buy clomiphene no prescription[/url]
Pill overview available. Complete medication overview.
Medicine overview available. Read about medications.
[url=https://baclofen365n.top/#]purchase clomiphene[/url]
Get info now. Drug reactions explained.
[u][b] Добрый день![/b][/u]
Купить документ о получении высшего образования
[url=http://diploms-x24.ru/kupit-diplom-voronezh]diploms-x24.ru/kupit-diplom-voronezh[/url]
[u][b] Привет![/b][/u]
Приобрести документ о получении высшего образования.
[url=http://playable.nl/forum/viewtopic.php?t=801953&sid=46bb66f49c8022f6436f0df59fb792f0/]playable.nl/forum/viewtopic.php?t=801953&sid=46bb66f49c8022f6436f0df59fb792f0[/url]
[url=http://dopalnenie.listbb.ru/viewtopic.php?f=3&t=717/]dopalnenie.listbb.ru/viewtopic.php?f=3&t=717[/url]
[url=http://subscribe.ru/member/quick/]subscribe.ru/member/quick[/url]
[url=http://yur-dom.ru/communication/forum/messages/forum3/message267/309-kupit-diplom-bystro-i-nadezhno?result=new#message267/]yur-dom.ru/communication/forum/messages/forum3/message267/309-kupit-diplom-bystro-i-nadezhno?result=new#message267[/url]
[url=http://vip.forums.party/viewtopic.php?id=3439#p71062/]vip.forums.party/viewtopic.php?id=3439#p71062[/url]
Популярные репортажи https://infotolium.com в больших фотографиях, новости, события в мире
Новини України https://kiev-online.com.ua останні події в Україні та світі сьогодні, новини України за минулий день онлайн
Україна свіжі новини https://kiev-pravda.kiev.ua останні події на сьогодні
Свіжі новини України https://lenta.kyiv.ua останні новини з-за кордону, новини політики, економіки, спорту, культури.
Medication data provided. Find drug information.
[url=https://biaxin365n.top/#]order biaxin[/url]
Pill effects explained. Medicine impacts described.
Formulation info listed. Comprehensive drug resource.
[url=https://baclofen365n.top/#]buy clomiphene no prescription[/url]
Pill guide here. Overdose effects detailed.
[u][b] Здравствуйте![/b][/u]
Заказать диплом о высшем образовании
[b]Мы предлагаем[/b] выгодно и быстро купить диплом, который выполнен на оригинальной бумаге и заверен мокрыми печатями, водяными знаками, подписями. Данный документ пройдет лубую проверку, даже с применением профессионального оборудования. Достигайте свои цели быстро и просто с нашей компанией.
[b]Где купить диплом по нужной специальности?[/b]
[url=http://1abakan.ru/forum/showthread-216025//]1abakan.ru/forum/showthread-216025/[/url]
[url=http://kindleslove.com/read-blog/321/]kindleslove.com/read-blog/321[/url]
[url=http://silkhunter.com/index.php?title=Официальные_Дипломы:_Качество_и_Легальность/]silkhunter.com/index.php?title=Официальные_Дипломы:_Качество_и_Легальность[/url]
[url=http://livestockkenya.com/index.php/cb-profile/pluginclass/cbblogs?action=blogs&func=show&id=250/]livestockkenya.com/index.php/cb-profile/pluginclass/cbblogs?action=blogs&func=show&id=250[/url]
[url=http://klinlife.ru/forums/index.php?/topic/38850-kupit-diplom-vse-chto-vam-nuzhno-znat//]klinlife.ru/forums/index.php?/topic/38850-kupit-diplom-vse-chto-vam-nuzhno-znat/[/url]
Україна останні новини https://lentanews.kyiv.ua головні новини та останні події
Le code promo bet of africa, utilisez-le lors de l’inscription et obtenez un bonus de 200% jusqu’a 130$. Seuls les nouveaux joueurs peuvent obtenir le bonus. Ce contrat bonus est valable jusqu’au 31 decembre 2024. Apres le depot, le joueur recoit sur le compte bonus le montant des bonus pour les Paris de 100% du montant du depot, mais pas plus de $100. Pour recuperer le bonus recu, le joueur doit placer au moins cinq Paris dans les cinq jours suivants. Pour les Paris, vous devez faire un Express avec 3 evenements ou plus avec des cotes d’au moins 1,40.
I truly love your blog.. Excellent colors & theme. Did you build this website yourself? Please reply back as I’m attempting to create my own site and would like to find out where you got this from or what the theme is called. Many thanks!
Find medication details. Pill facts provided.
[url=https://biaxin365n.top/#]purchase biaxin[/url]
Detailed pill knowledge. Get medication facts.
Pill leaflet available. Drug leaflet available.
[url=https://baclofen365n.top/#]buy lioresal medication[/url]
Find medication facts. Prescribing details available.
Головні новини https://mediashare.com.ua про регіон України. Будьте в курсі останніх новин
Новини та аналітика https://newsportal.kyiv.ua ситуація в Україні.
Головні новини https://pto-kyiv.com.ua України та світу
Новини, останні події https://prp.org.ua в Україні та світі, новини політики, бізнесу та економіки, законодавства
Новини України https://sensus.org.ua та світу сьогодні. Головні та останні новини дня
[u][b] Добрый день![/b][/u]
[b]Заказать диплом университета.[/b]
[url=http://belsprosshina.by/company/personal/user/127/forum/message/1566/5812//]belsprosshina.by/company/personal/user/127/forum/message/1566/5812/[/url]
[url=http://exoltech.us/blogs/206660/Планируете-купить-диплом-Заходите-в-наш-интернет-магазин/]exoltech.us/blogs/206660/Планируете-купить-диплом-Заходите-в-наш-интернет-магазин[/url]
[url=http://cbr.by/club/user/1977/blog/326//]cbr.by/club/user/1977/blog/326/[/url]
[url=http://sonnick84.blogars.com/27687316/Стоимость-документов-авторский-обзор-специалистов/]sonnick84.blogars.com/27687316/Стоимость-документов-авторский-обзор-специалистов[/url]
[url=http://ebuddiz.com//read-blog/24362/]ebuddiz.com//read-blog/24362[/url]
An intriguing discussion is definitely worth comment. I do think that you need to write more about this subject, it might not be a taboo matter but typically people do not discuss such topics. To the next! Cheers!
[u][b] Привет, друзья![/b][/u]
Приобрести документ университета
[url=http://elotag.com/read-blog/275/]elotag.com/read-blog/275[/url]
[url=http://humped.life/read-blog/525/]humped.life/read-blog/525[/url]
[url=http://payhip.com/BestNews/blog/news/pravilno-zakazyvaem-diplom-v-internete-ekspertnyj-obzor/]payhip.com/BestNews/blog/news/pravilno-zakazyvaem-diplom-v-internete-ekspertnyj-obzor[/url]
[url=http://мкр-красногорский.рф/gallery/image/1501-покупаем-диплом-в-известном-онлайн-магазине-по-выгодной-цене/?context=new/]мкр-красногорский.рф/gallery/image/1501-покупаем-диплом-в-известном-онлайн-магазине-по-выгодной-цене/?context=new[/url]
[url=http://sonnick84.izrablog.com/28746084/Как-можно-приобрести-сейчас-неотличимый-от-оригинала-диплом-в-сети/]sonnick84.izrablog.com/28746084/Как-можно-приобрести-сейчас-неотличимый-от-оригинала-диплом-в-сети[/url]
[url=https://dexamethasoneff.com/]dexamethasone 75 mg tablet[/url]
Medicine essentials explained. Get pill info.
[url=https://biaxin365n.top/#]buy biaxin no rx[/url]
Drug leaflet here. Drug information here.
Latest pill news. Pill impacts explained.
[url=https://baclofen365n.top/#]lioresal[/url]
Comprehensive medicine resource. Pill details provided.
[u][b] Привет![/b][/u]
[b]Приобрести документ[/b] о получении высшего образования вы сможете в нашей компании в столице.
[url=http://ast-diplom.com/kupit-diplom-bakalavra-ili-specialista /]ast-diplom.com/kupit-diplom-bakalavra-ili-specialista [/url]
Hi, I do think this is a great blog. I stumbledupon it 😉 I’m going to return yet again since i have saved as a favorite it. Money and freedom is the best way to change, may you be rich and continue to guide others.
[u][b] Привет, друзья![/b][/u]
Мы изготавливаем дипломы любой профессии.
[url=http://doomelang.com/read-blog/6380_kak-podobrat-proverennyj-onlajn-magazin-kotoryj-prodaet-dokumenty.html]doomelang.com/read-blog/6380_kak-podobrat-proverennyj-onlajn-magazin-kotoryj-prodaet-dokumenty.html[/url]
Рады оказать помощь!.
[u][b] Добрый день![/b][/u]
[b]Купить документ[/b] о получении высшего образования можно у нас в столице.
[url=http://diplomasx24.ru/kupit-diplom-ekaterinbur/]diplomasx24.ru/kupit-diplom-ekaterinbur[/url]
[b]Удачи![/b]
Корисні та цікаві статті https://sevsovet.com.ua про здоров’я, дозвілля, кар’єру.
Головні новини https://status.net.ua сьогодні, найсвіжіші та останні новини України онлайн
Останні новини https://thingshistory.com зовнішньої та внутрішньої політики в країні та світі.
Останні новини світу https://uamc.com.ua про Україну від порталу новин Ukraine Today
Drug resource available. Comprehensive medication overview.
[url=https://biaxin365n.top/#]buy biaxin pills online[/url]
Latest pill news. Medicine details here.
Patient medicine guide. Drug brochure available.
[url=https://baclofen365n.top/#]buy clomiphene online[/url]
Latest medication updates. Short-term impacts described.
Легальные способы покупки диплома о среднем полном образовании
[url=http://galantclub.od.ua/member.php?u=15983/]galantclub.od.ua/member.php?u=15983[/url]
[url=http://phileo.me/blogs/185987/Читайте-наш-материал-если-требуется-заказать-диплом-в-сети/]phileo.me/blogs/185987/Читайте-наш-материал-если-требуется-заказать-диплом-в-сети[/url]
[url=http://jaitun.com/read-blog/391/]jaitun.com/read-blog/391[/url]
[url=http://art-gymnastics.ru/users/54/]art-gymnastics.ru/users/54[/url]
[url=http://paulikipedia.ru/index.php/Купите_диплом_и_начните_новую_жизнь/]paulikipedia.ru/index.php/Купите_диплом_и_начните_новую_жизнь[/url]
Good site you have here.. It’s difficult to find quality writing like yours these days. I really appreciate individuals like you! Take care!!
This page certainly has all of the information I wanted about this subject and didn’t know who to ask.
betturkey
Detailed drug knowledge. Administration guidelines here.
[url=https://biaxin365n.top/#]buy clomiphene no prescription[/url]
Find medicine information. Access medicine facts.
Drug pamphlet provided. Complete medicine overview.
[url=https://baclofen365n.top/#]order clomiphene[/url]
Drug overview available. Latest medication developments.
Great article. I am experiencing many of these issues as well..
[u][b] Привет![/b][/u]
[b]Купить диплом о высшем образовании.[/b]
[url=http://clubalpintoulouse.fr/cb-profile/pluginclass/cbblogs?action=blogs&func=show&id=146/]clubalpintoulouse.fr/cb-profile/pluginclass/cbblogs?action=blogs&func=show&id=146[/url]
[u][b] Здравствуйте![/b][/u]
[b]Узнайте, как безопасно купить диплом о высшем образовании[/b]
[url=http://shugakukai.co.jp/диплом-в-хасавюрте//]shugakukai.co.jp/диплом-в-хасавюрте/[/url]
[u][b] Привет, друзья![/b][/u]
Мы можем предложить документы техникумов
[url=http://sec31.ru/viewtopic.php?f=25&t=677863/]sec31.ru/viewtopic.php?f=25&t=677863[/url]
[url=http://linkthere.club/read-blog/8929/]linkthere.club/read-blog/8929[/url]
[url=http://komfort.rusff.me/viewtopic.php?id=14087#p41442/]komfort.rusff.me/viewtopic.php?id=14087#p41442[/url]
[url=http://nosnitches.com/create-blog//]nosnitches.com/create-blog/[/url]
[url=http://moskovskij.getbb.ru/viewtopic.php?f=12&t=3116/]moskovskij.getbb.ru/viewtopic.php?f=12&t=3116[/url]
Pill details provided. Pill guide available.
[url=https://baclofen365n.top/#]buy clomiphene online[/url]
Pill leaflet provided. Complete medicine overview.
Patient drug facts. Drug facts provided.
[url=https://biaxin365n.top/#]biaxin cheap[/url]
Get drug details. Drug trends described.
A fascinating discussion is definitely worth comment. There’s no doubt that that you should publish more on this topic, it may not be a taboo matter but generally people do not speak about these topics. To the next! Best wishes!
[u][b] Здравствуйте![/b][/u]
Приобрести документ о получении высшего образования.
[url=http://antonovschool.ru/forum/topic/add/forum1/#postform/]antonovschool.ru/forum/topic/add/forum1/#postform[/url]
[url=http://dog-ola.ru/viewtopic.php?f=28&t=7458/]dog-ola.ru/viewtopic.php?f=28&t=7458[/url]
[url=http://roseninsel.kz/forum/topic/add/forum7//]roseninsel.kz/forum/topic/add/forum7/[/url]
[url=http://kids-news.ru/vash-diplom-za-korotkoe-vremya-kachestvenno-i-bezopasno/]kids-news.ru/vash-diplom-za-korotkoe-vremya-kachestvenno-i-bezopasno[/url]
[url=http://wiki.mdomtv.net/index.php?title=Профессиональные_дипломы_для_всех_отраслей/]wiki.mdomtv.net/index.php?title=Профессиональные_дипломы_для_всех_отраслей[/url]
Comment puis-je gagner des points un code promo x bet?
Dans le bookmaker 1xbet en tant qu’encouragement des clients pour leur participation active au processus de jeu, ils fournissent des points promotionnels dans le cadre du programme de fidelite. Vous pouvez obtenir des points pour les Paris sportifs reguliers, Express, pour la reconstitution reguliere du compte et la participation aux actions du bookmaker.
Medicine trends described. Get drug info.
[url=https://baclofen365n.top/#]buy lioresal usa[/url]
Medication information here. Medication resource here.
Pill effects explained. Read about pills.
[url=https://biaxin365n.top/#]where buy biaxin[/url]
Get medicine info. Medication leaflet here.